Похожие презентации:
Механизм действия ферментов
1. 2 Механизм действия ферментов
Гомельский государственныймедицинский университет
Кафедра биохимии
Доцент кафедры, к. б. н. А. Н. Коваль
2. Содержание
8/20/2017Свойства ферментов (термолабильность, специфичность и др.).
Механизм действия ферментов. Этапы взаимодействия фермента и
субстрата.
Гипотезы Э. Фишера, Д. Кошланда и современные взгляды.
Теория промежуточных соединений. Основы термодинамики
катализа. Энергия активации. Энергетический барьер.
Кинетика ферментативных реакций (факторы, влияющие на
скорость ферментативных реакций: природа фермента и субстрата,
их концентрация, pH, температура, лекарственные препараты и др.).
Km – определение, физиологическое значение.
Регуляция активности ферментов. Роль гормонов, цАМФ,
активаторов, ингибиторов. Регуляция активности путем химической
модификации ферментов (ограниченный протеолиз,
фосфорилирование, метилирование и др.). Аллостерическая
регуляция и свойства аллостерических ферментов.
Виды ингибирования.
Коваль А. Н., 2006 (C)
2
3. Свойства ферментов
Термолабильность – скоростьферментативных реакций зависит от
температуры.
Каждый фермент имеет свой pH-оптимум.
Активность фермента зависит от
концентрации субстратов.
Специфичность: абсолютная и
относительная (групповая).
8/20/2017
Коваль А. Н., 2006 (C)
3
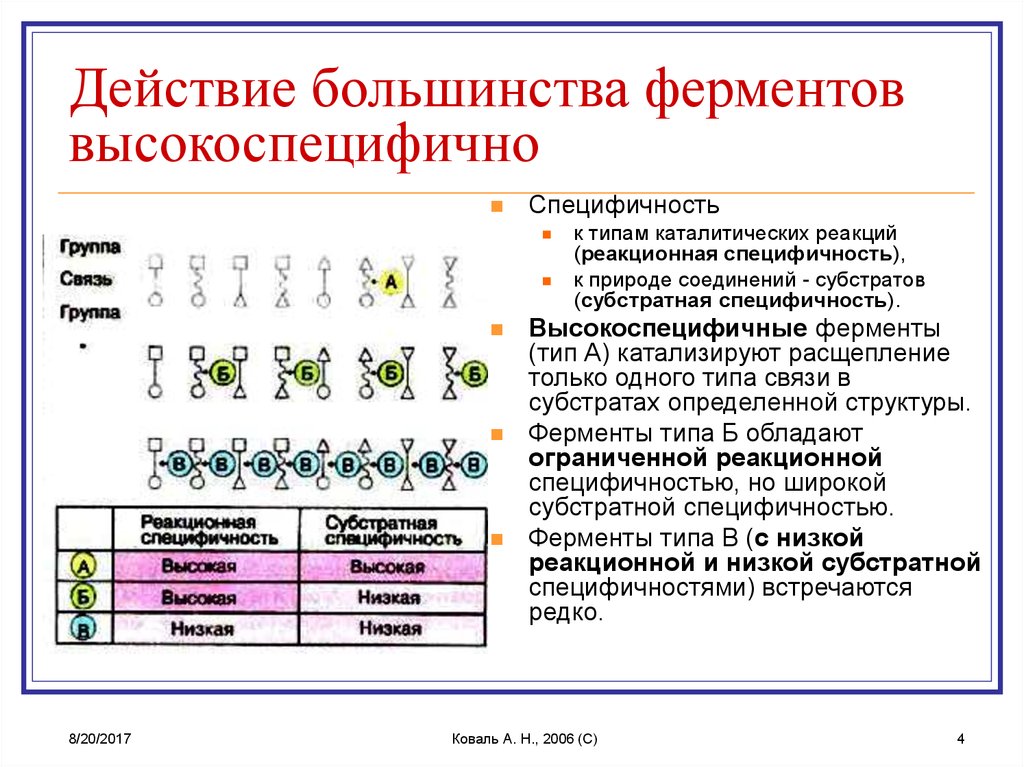
4. Действие большинства ферментов высокоспецифично
Специфичность8/20/2017
к типам каталитических реакций
(реакционная специфичность),
к природе соединений - субстратов
(субстратная специфичность).
Высокоспецифичные ферменты
(тип А) катализируют расщепление
только одного типа связи в
субстратах определенной структуры.
Ферменты типа Б обладают
ограниченной реакционной
специфичностью, но широкой
субстратной специфичностью.
Ферменты типа В (с низкой
реакционной и низкой субстратной
специфичностями) встречаются
редко.
Коваль А. Н., 2006 (C)
4
5. Механизм действия ферментов. Теории «ключ-замок», «рука-перчатка»
Механизм действия ферментов.Теории «ключ-замок», «рукаперчатка»
Э. Фишер предложил предложил для объяснения
специфичности взаимодействия фермента и субстрата
модель «ключа и замка».
Эта модель предполагала существование такого центра
как особой структуры и без связи с субстратом.
Д. Кошленд в 1959 г. предложил теорию
индуцированного соответствия («рука-перчатка»): т.
е. что субстрат навязывает активному центру свою
форму, а активный центр в свою очередь подгоняет
форму субстрата под свою собственную.
8/20/2017
была подтверждена при помощи метода
рентгеноструктурного анализа, позволившего построить
пространственную модель фермента.
Коваль А. Н., 2006 (C)
5
6. Механизм действия ферментов. Концепции «дыбы» и «лилипутов»
В 1954 году была предложена гипотеза связывающаямеханизм ферментативного каталитического акта с
деформацией и напряжением молекулы субстрата при ее
сорбции в активном центра фермента.
Эта гипотеза вошла в науку под названием концепции
«дыбы» или «лилипутов».
8/20/2017
Первое подчеркивало принудительный характер
механической деформации гибкого субстрата жестким
ферментом.
Второе название указывает на то, что слабые
нековалентные взаимодействия субстрата и активного
центра обеспечивают дестабилизацию субстрата и перевод
его в высокоэнергетическое переходное состояние.
Коваль А. Н., 2006 (C)
6
7. Механизм действия ферментов. Современные взгляды
Современные концепции на механизмферментативного катализа
объединяются в теорию
топохимического соответствия и
объединяют все вышеперечисленные
взгляды.
8/20/2017
Коваль А. Н., 2006 (C)
7
8. Теория промежуточных соединений
Выдвинутая в 1913 году Л. Михаэлисом и М. Ментенобщая теория ферментативного катализа постулировала,
что фермент Е сначала обратимо и относительно быстро
связывается с со своим субстратом S в реакции:
E + S = ES
Образовавшийся при этом фермент-субстратный
комплекс ES, не имеющий аналогий в органической
химии и химическом катализе, затем распадается в
второй более медленной (лимитирующей) стадии
реакции:
ES = Е + Р
8/20/2017
Коваль А. Н., 2006 (C)
8
9. Теория промежуточных соединений. Этапы взаимодействия фермента и субстрата
1 этап: происходит сближение и ориентациясубстрата относительно субстратного центра
фермента и его постепенное «причаливание» к
«якорной» площадке.
2 этап: напряжение и деформация:
индуцированное соответствие - происходит
присоединение субстрата, которое вызывает
конформационные изменения в молекуле
фермента приводящие к напряжению структуры
активного центра и деформации связанного
субстрата.
3 этап: непосредственный катализ.
8/20/2017
Коваль А. Н., 2006 (C)
9
10. Теория промежуточных соединений.
Имеется реакция:S→P+Q
Представим эту реакцию в виде отдельных новых
стадий:
S + E = ES = E + P
подстадии:
1.
2.
3.
4.
5.
6.
E + S = ES
ES = ES*
ES* = ES**
ES** = ES***
ES*** = EP
EP = E + P
8/20/2017
S*, S**, S*** - новые модификации
субстрата, обусловленные изменением
энергетической плотности, заряда и т. д.
Коваль А. Н., 2006 (C)
10
11. Основы термодинамики катализа
Из недостаточности чисто статическихвзаимоотношений в духе «замка и
ключа» для объяснения
многостадийного каталитического
процесса, Д. Кошланд предположил, что
с термодинамической точки зрения
ферменты ускоряют химические реакции
за счет снижения энергии активации.
8/20/2017
Коваль А. Н., 2006 (C)
11
12. Энергия активации.
Энергия активации - энергия, необходимаядля перевода всех молекул моля вещества в
активное состояние при данной температуре,
т. е. это та энергия, которая необходима
молекуле, чтобы преодолеть энергетический
барьер.
8/20/2017
Фермент снижает энергию активации путем
увеличения числа активированных молекул, которые
становятся реакционно-способными на более низком
энергетическом уровне, т. е. снижается и
энергетический барьер.
Коваль А. Н., 2006 (C)
12
13. Термодинамика ферментативных реакций
GЭнергия активации
ферментативной реакции
GA1
Энергия активации
неферментативной
реакции
GA2
Энергетический
барьер
G1
DG = G2 – G1
G2
t
8/20/2017
Коваль А. Н., 2006 (C)
14
14. Термодинамика ферментативных реакций
Кинетика ферментативных реакций.Концентрация фермента.
V
Чем выше
концентрация E,
тем выше скорость
реакции.
[E]
8/20/2017
Коваль А. Н., 2006 (C)
15
15. Кинетика ферментативных реакций. Концентрация фермента.
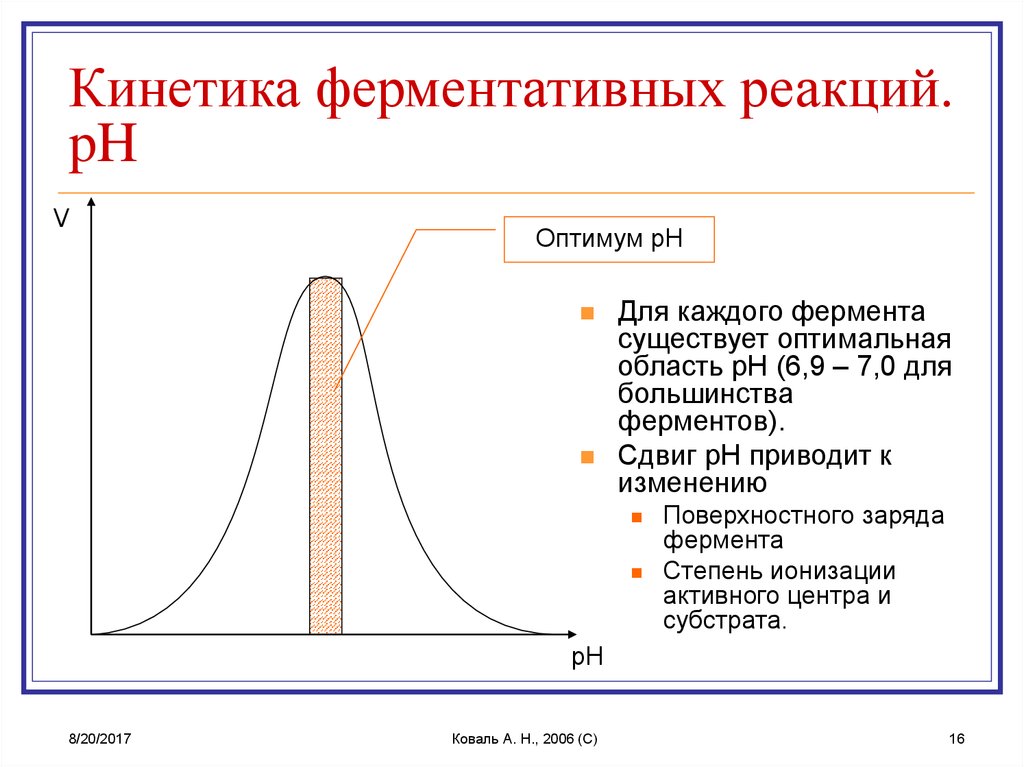
Кинетика ферментативных реакций.pH
V
Оптимум pH
Для каждого фермента
существует оптимальная
область pH (6,9 – 7,0 для
большинства
ферментов).
Сдвиг pH приводит к
изменению
Поверхностного заряда
фермента
Степень ионизации
активного центра и
субстрата.
pH
8/20/2017
Коваль А. Н., 2006 (C)
16
16. Кинетика ферментативных реакций. pH
Кинетика ферментативных реакций.Температура
V
60-70° C
8/20/2017
С увеличением
температуры на 10°C
скорость реакции
возрастает в 2 раза
(правило Вант-Гоффа).
После 60-70° C
происходит денатурация
фермента с потерей его
каталитической
активности.
t°
Коваль А. Н., 2006 (C)
17
17. Кинетика ферментативных реакций. Температура
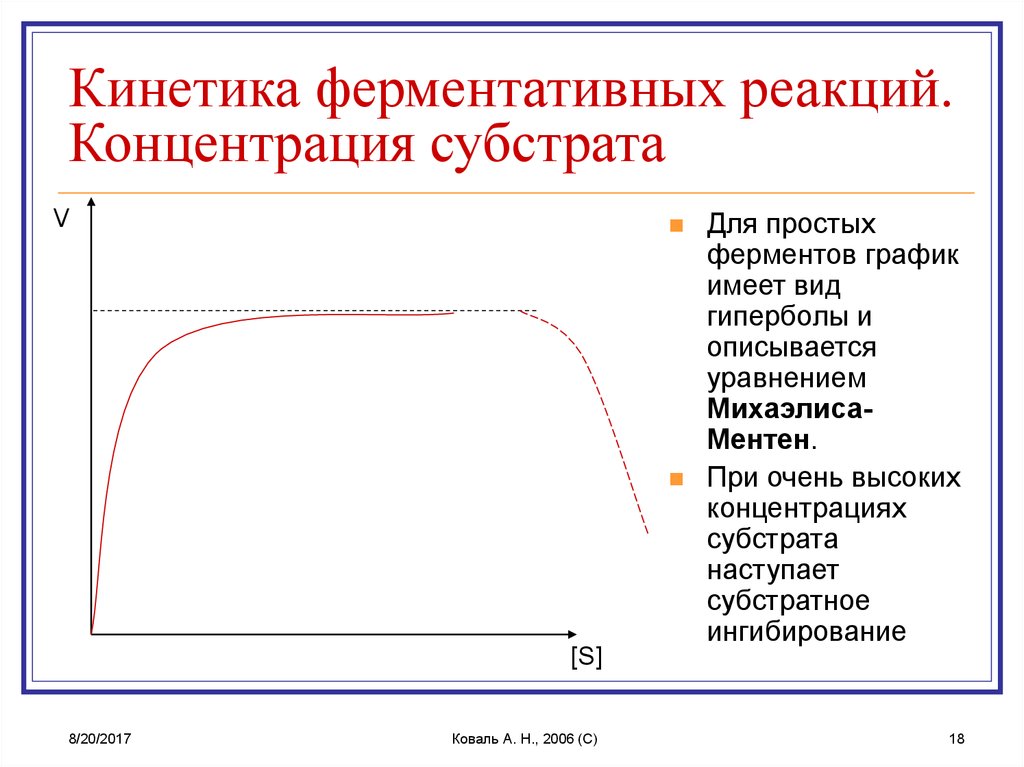
Кинетика ферментативных реакций.Концентрация субстрата
V
[S]
8/20/2017
Коваль А. Н., 2006 (C)
Для простых
ферментов график
имеет вид
гиперболы и
описывается
уравнением
МихаэлисаМентен.
При очень высоких
концентрациях
субстрата
наступает
субстратное
ингибирование
18
18. Кинетика ферментативных реакций. Концентрация субстрата
Кинетика ферментативных реакцийИсследование зависимости скорости
ферментативных реакций от концентрации
реагирующих веществ стало одним из главных
путей изучения механизма действия
ферментов.
В 1905 году французский исследователь Генри
впервые высказал ряд предположений,
которые были экспериментально
подтверждены в 1913 году Леонором
Михаэлисом и Мод Ментен (США, Канада).
8/20/2017
Коваль А. Н., 2006 (C)
19
19. Кинетика ферментативных реакций
8/20/2017Коваль А. Н., 2006 (C)
20
20.
8/20/2017Коваль А. Н., 2006 (C)
21
21.
8/20/2017Коваль А. Н., 2006 (C)
22
22.
8/20/2017Коваль А. Н., 2006 (C)
23
23.
8/20/2017Коваль А. Н., 2006 (C)
24
24.
8/20/2017Коваль А. Н., 2006 (C)
25
25.
8/20/2017Коваль А. Н., 2006 (C)
26
26.
8/20/2017Коваль А. Н., 2006 (C)
27
27.
8/20/2017Коваль А. Н., 2006 (C)
28
28.
8/20/2017Коваль А. Н., 2006 (C)
29
29.
8/20/2017Коваль А. Н., 2006 (C)
30
30.
8/20/2017Коваль А. Н., 2006 (C)
31
31.
8/20/2017Коваль А. Н., 2006 (C)
32
32.
8/20/2017Коваль А. Н., 2006 (C)
33
33.
8/20/2017Коваль А. Н., 2006 (C)
34
34.
8/20/2017Коваль А. Н., 2006 (C)
35
35.
8/20/2017Коваль А. Н., 2006 (C)
36
36.
8/20/2017Коваль А. Н., 2006 (C)
37
37.
8/20/2017Коваль А. Н., 2006 (C)
38


































 Биология
Биология








