Похожие презентации:
Строение и механизм действия ферментов
1. Ферменты: строение, механизм действия
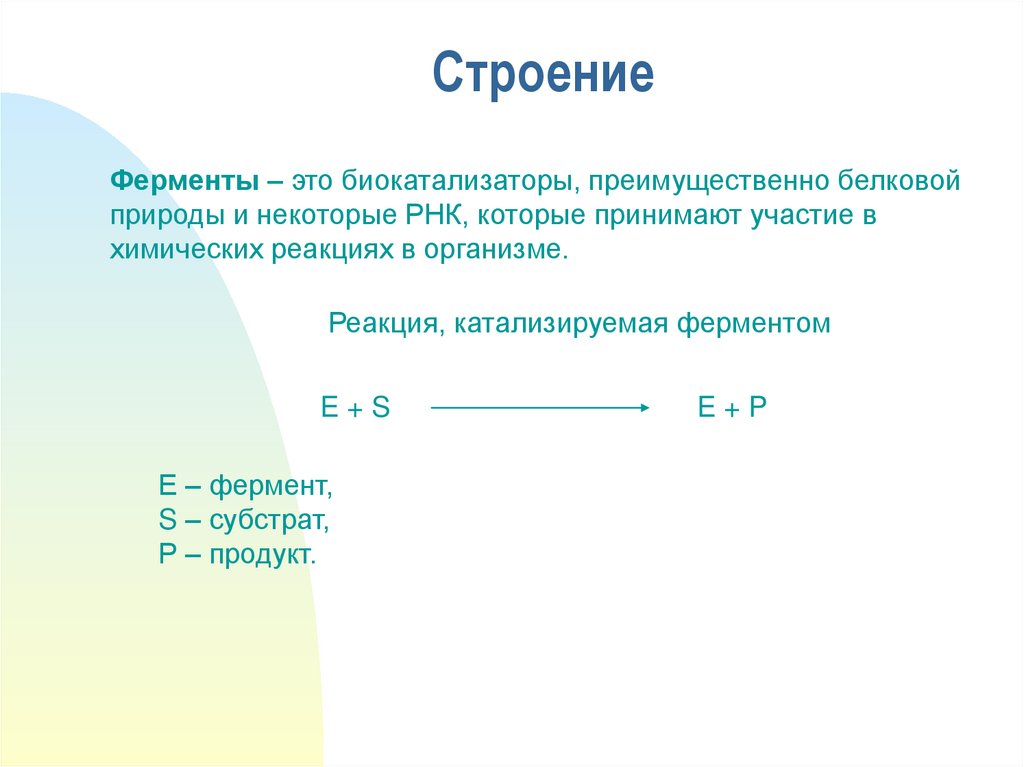
2. Строение
Ферменты – это биокатализаторы, преимущественно белковойприроды и некоторые РНК, которые принимают участие в
химических реакциях в организме.
Реакция, катализируемая ферментом
E+S
Е – фермент,
S – субстрат,
Р – продукт.
E+P
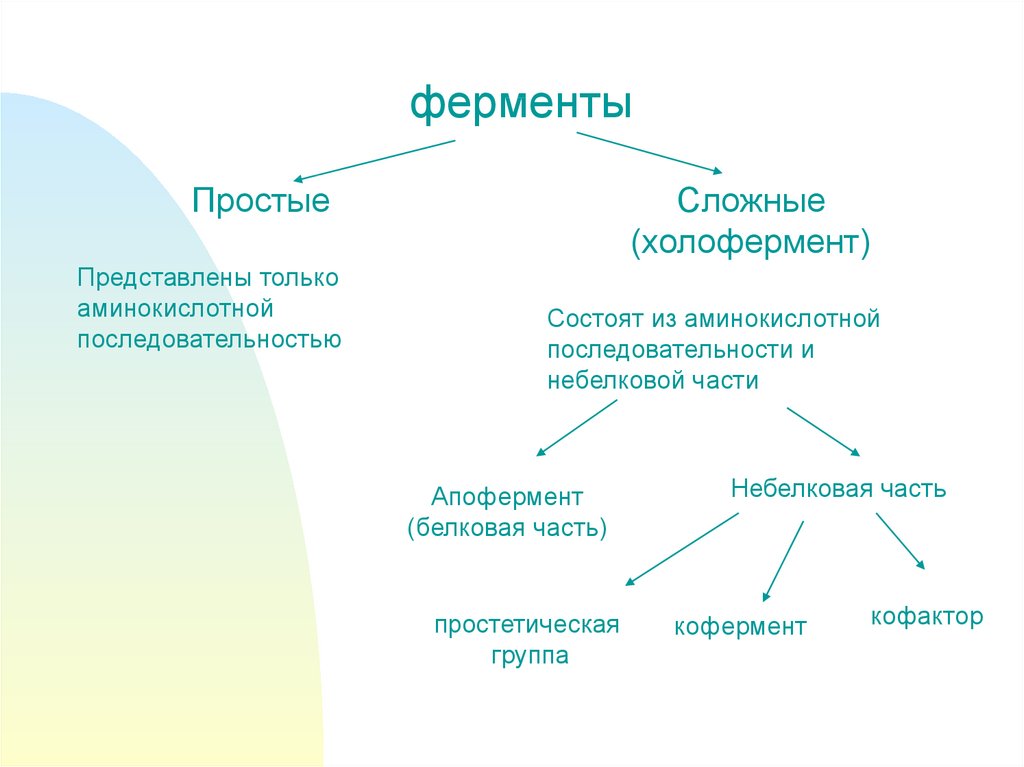
3.
ферментыПростые
Представлены только
аминокислотной
последовательностью
Сложные
(холофермент)
Состоят из аминокислотной
последовательности и
небелковой части
Апофермент
(белковая часть)
простетическая
группа
Небелковая часть
кофермент
кофактор
4.
Небелковая частьКофактор
Кофермент
Неорганическое
вещество, как
правило Mg2+, Mn2+,
Ca2+, Co2+ и др. В
состав фермента не
входит,
взаимодействует
или с регуляторным
центром или с
субстратом.
Непосредственного
участия в реакции не
принимает.
Органическое
вещество, как
правило
производное
витамина (НАД,
тиамин и др.).
Входит в состав
фермента, связан с
ним слабой
ковалентной связью.
Принимает
непосредственное
участие в реакции.
Простетическая
группа
Органическое
вещество,
производное
флавина (ФАД).
Входит в состав
фермента,
ковалентно с ним
связано. За пределы
фермента не
выходит. Принимает
непосредственное
участие в реакции.
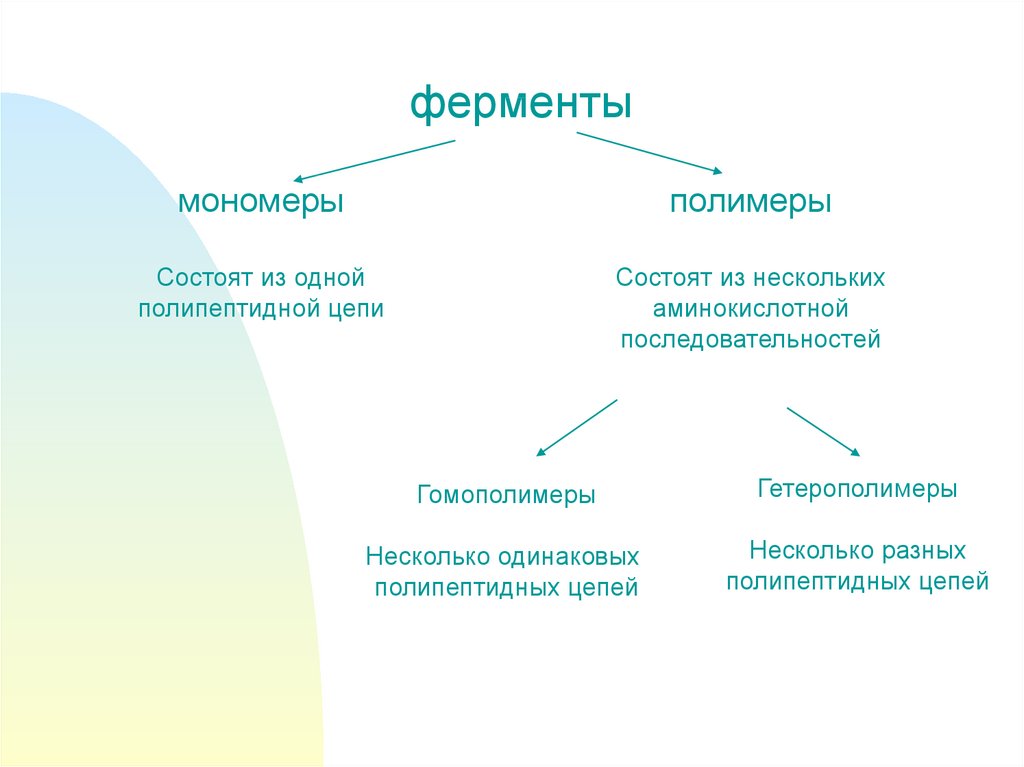
5.
ферментымономеры
полимеры
Состоят из одной
полипептидной цепи
Состоят из нескольких
аминокислотной
последовательностей
Гомополимеры
Гетерополимеры
Несколько одинаковых
полипептидных цепей
Несколько разных
полипептидных цепей
6. Структурно-функциональная организация
ферментПростой
Аллостерический
В составе имеется только
активный центр
в составе имеется активный
цент и аллостерической
(регуляторный) центр
7.
Строение простого ферментаАктивный центр – комбинация аминокислот, связывающаяся с субстратом
и осуществляющая катализ. В состав активного центра входят 12-16
аминокислот в разном сочетании.
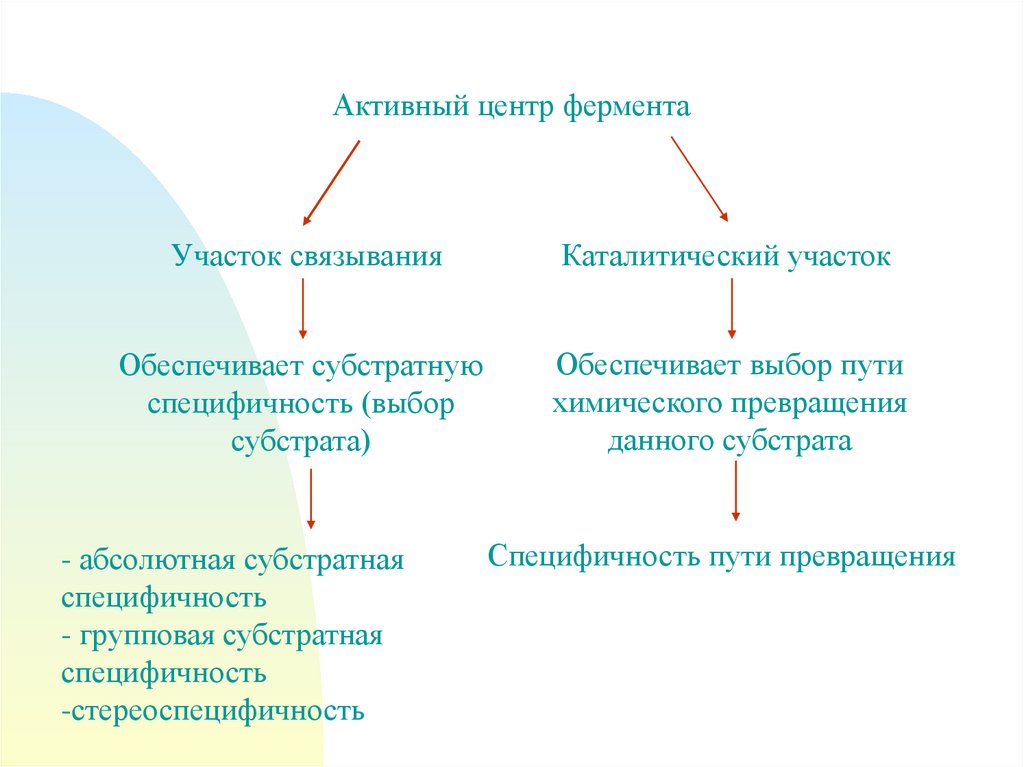
8.
Активный центр ферментаУчасток связывания
Каталитический участок
Обеспечивает субстратную
специфичность (выбор
субстрата)
Обеспечивает выбор пути
химического превращения
данного субстрата
- абсолютная субстратная
специфичность
- групповая субстратная
специфичность
-стереоспецифичность
Специфичность пути превращения
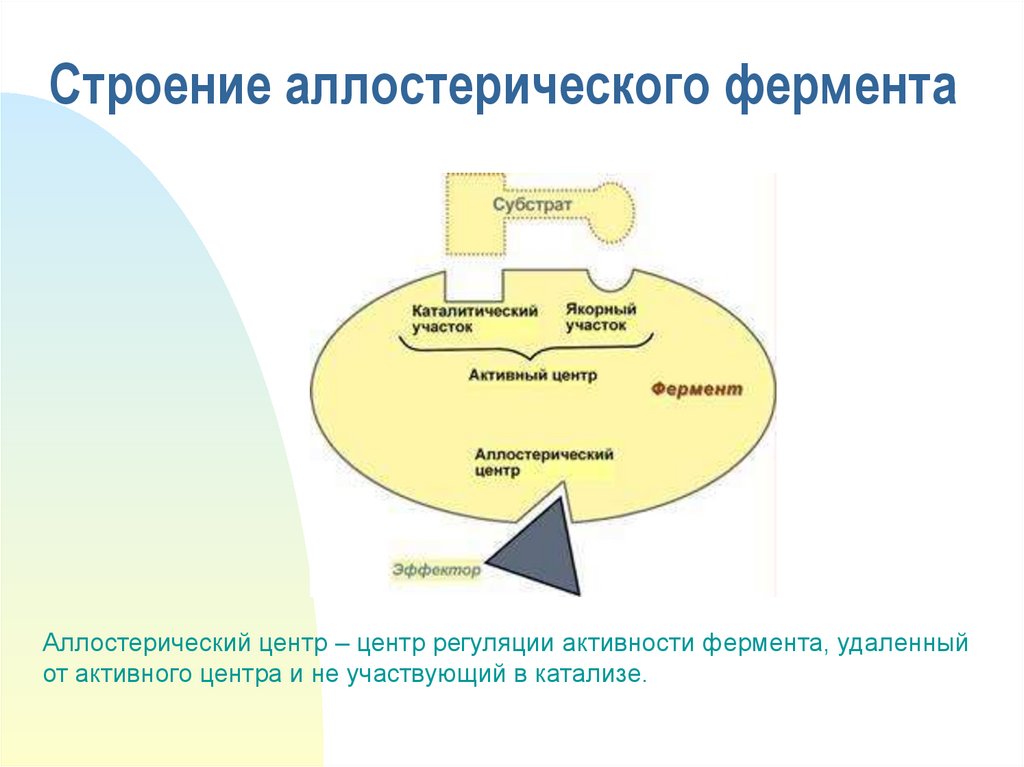
9. Строение аллостерического фермента
Аллостерический центр – центр регуляции активности фермента, удаленныйот активного центра и не участвующий в катализе.
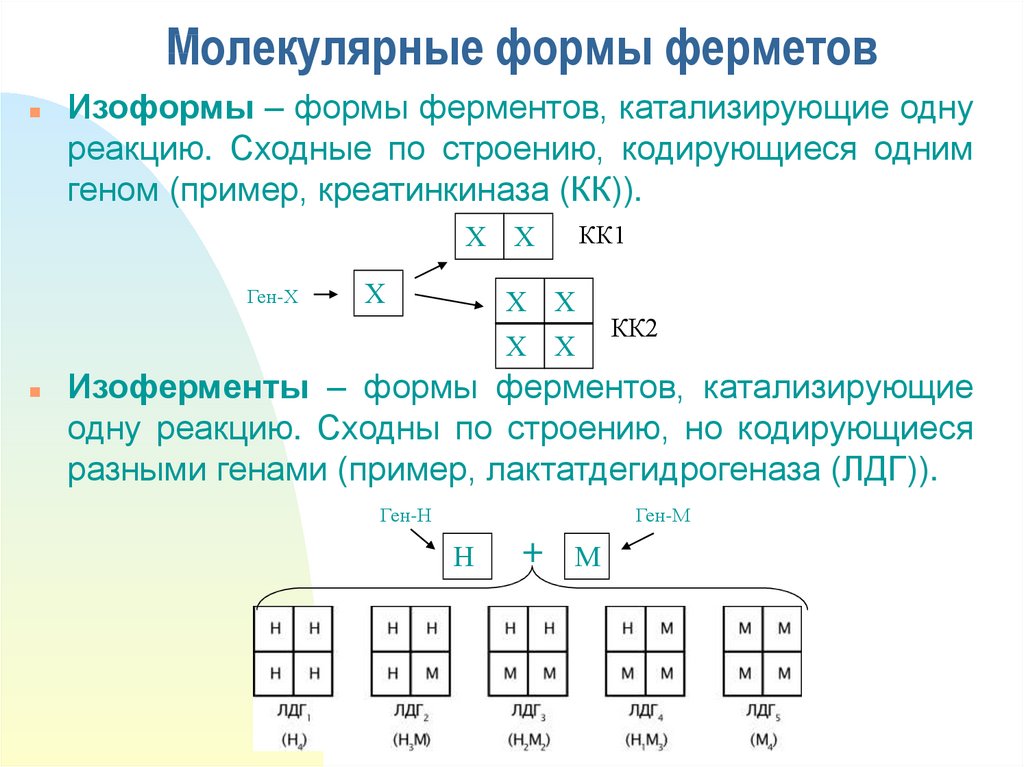
10. Молекулярные формы ферметов
Изоформы – формы ферментов, катализирующие однуреакцию. Сходные по строению, кодирующиеся одним
геном (пример, креатинкиназа (КК)).
КК1
Х Х
Ген-Х
Х
Х Х
Х Х
КК2
Изоферменты – формы ферментов, катализирующие
одну реакцию. Сходны по строению, но кодирующиеся
разными генами (пример, лактатдегидрогеназа (ЛДГ)).
Ген-Н
Ген-М
Н
+
М
11.
Мультиферментный комплексВ состав входит несколько отдельных ферментов последовательно
катализирующих превращение субстрата в продукт. Расположение
ферментов в комплексе строго регламентировано, поскольку продукт
катализа одного фермента является субстратом для другого фермента.
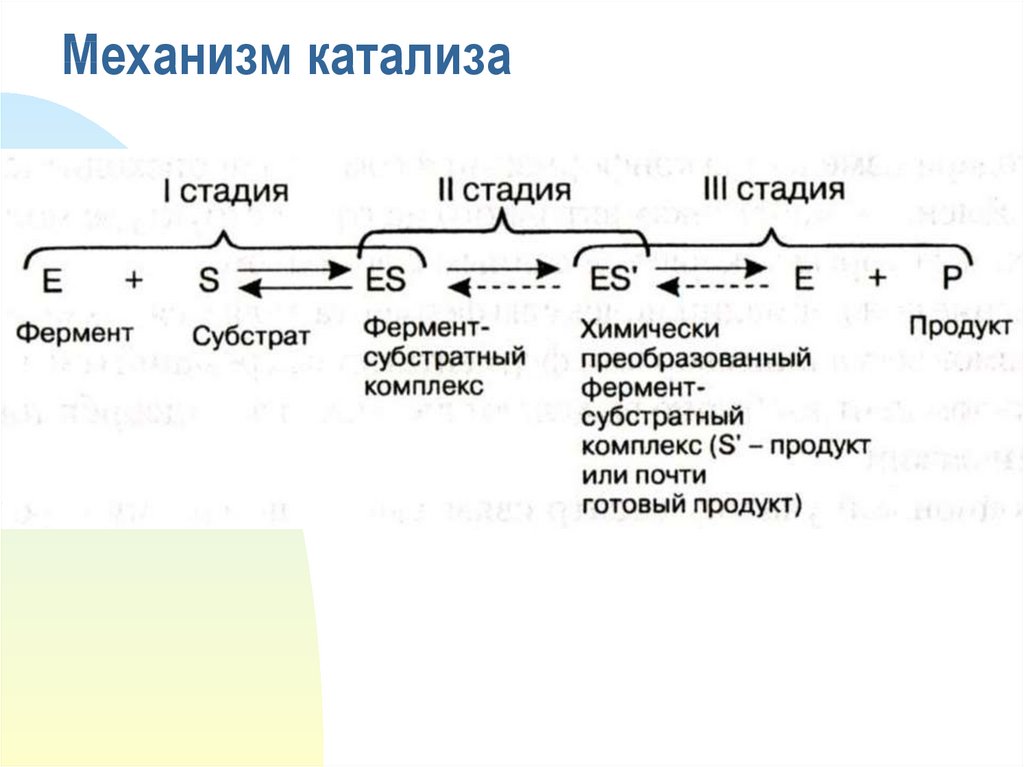
12. Механизм катализа
13. Механизм катализа
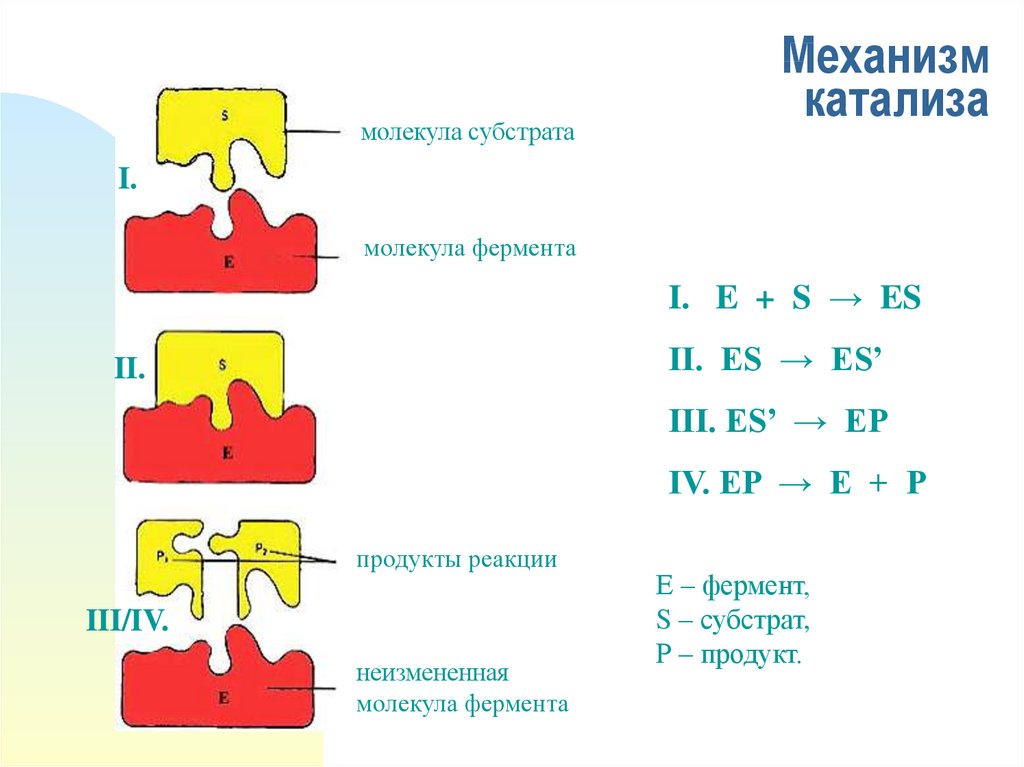
молекула субстратаМеханизм
катализа
I.
молекула фермента
I. E + S → ES
II. ES → ES’
II.
III. ES’ → EP
IV. EP → E + P
продукты реакции
III/IV.
неизмененная
молекула фермента
Е – фермент,
S – субстрат,
Р – продукт.
14. Механизм катализа (по типу взаимодействия)
Кислотно-основныйВ активном центре фермента
находятся специфические
аминокислоты, являющиеся
донорами или акцепторами
электронов.
доноры:
-СООН
-NH3+
-SH
акцепторы:
-СОО-NH2
-S-
Ковалентный
Фермента и субстрат образуют
ковалентные связи с
нестабильными продуктами,
приводящие к
внутримолекулярным
перестройкам. Образуются
слабые ковалентные связи –
дисульфидные мостики (-S-S-)
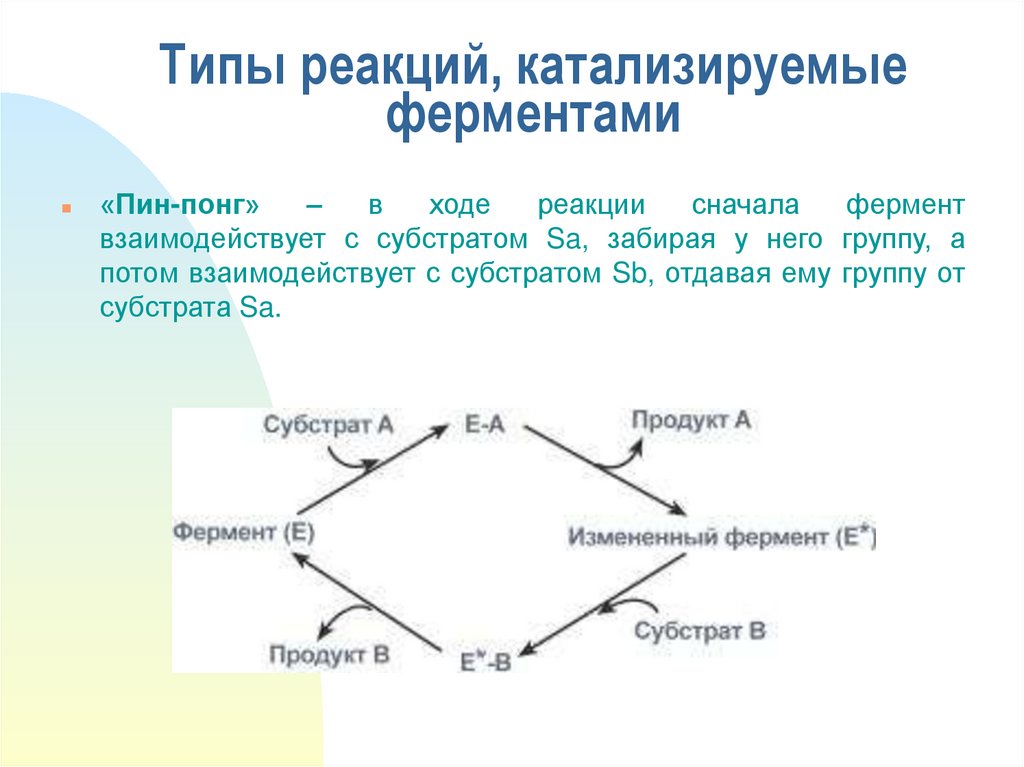
15. Типы реакций, катализируемые ферментами
«Пин-понг»–
в
ходе
реакции
сначала
фермент
взаимодействует с субстратом Sa, забирая у него группу, а
потом взаимодействует с субстратом Sb, отдавая ему группу от
субстрата Sa.
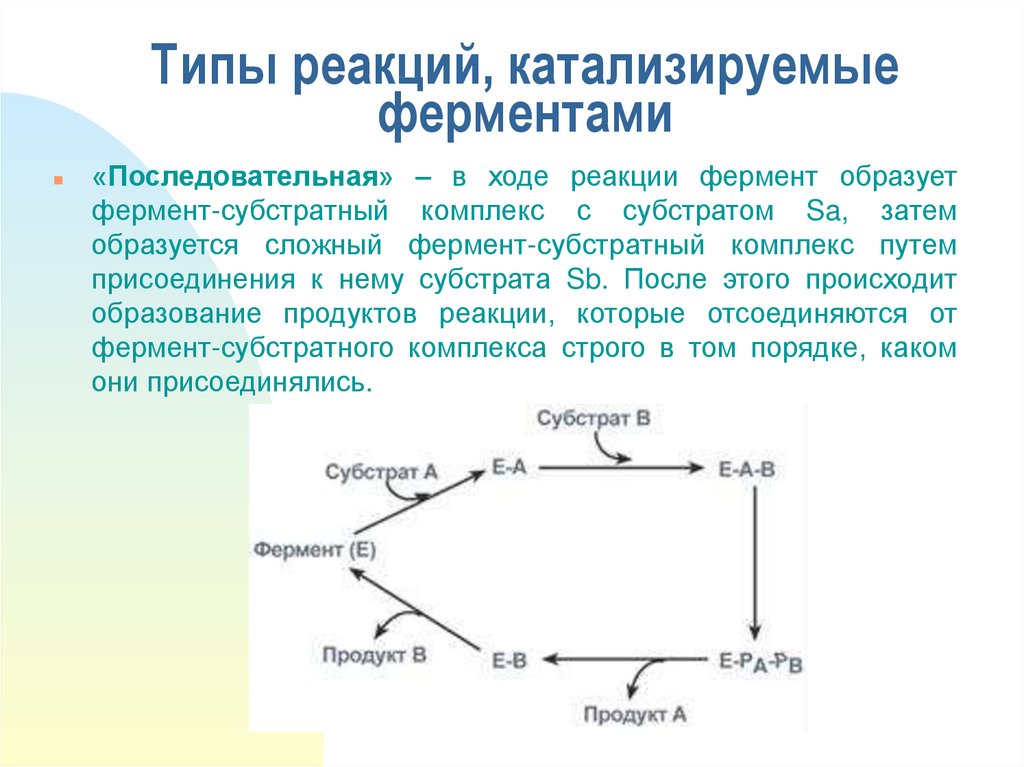
16. Типы реакций, катализируемые ферментами
«Последовательная» – в ходе реакции фермент образуетфермент-субстратный комплекс с субстратом Sa, затем
образуется сложный фермент-субстратный комплекс путем
присоединения к нему субстрата Sb. После этого происходит
образование продуктов реакции, которые отсоединяются от
фермент-субстратного комплекса строго в том порядке, каком
они присоединялись.
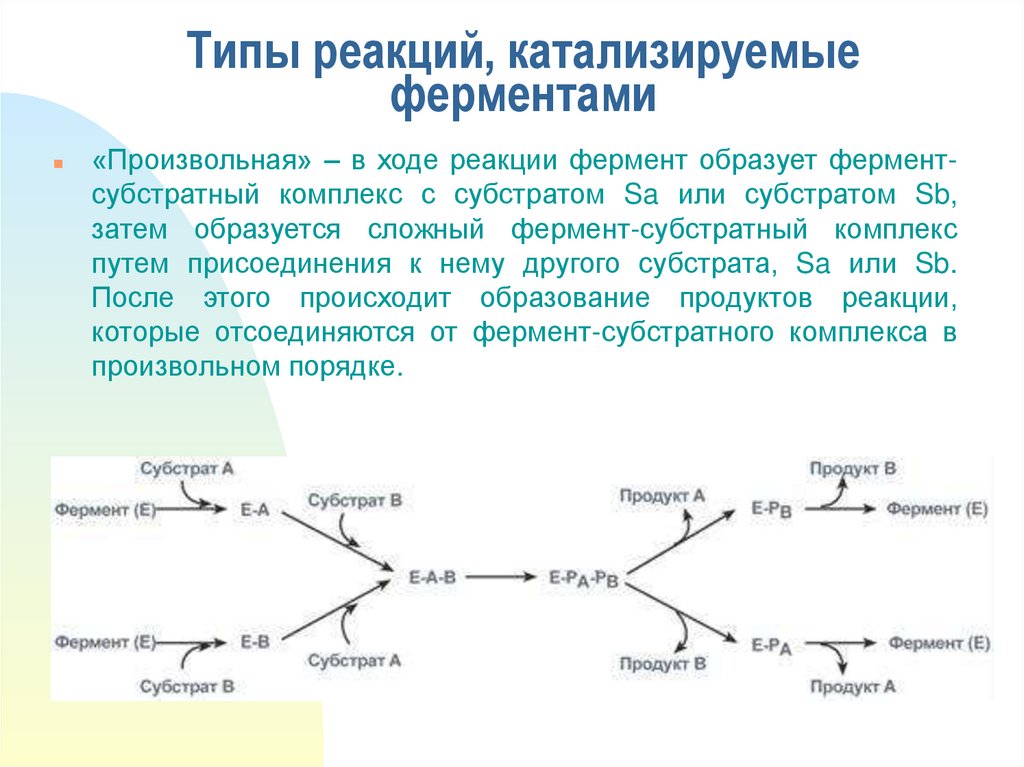
17. Типы реакций, катализируемые ферментами
«Произвольная» – в ходе реакции фермент образует ферментсубстратный комплекс с субстратом Sa или субстратом Sb,затем образуется сложный фермент-субстратный комплекс
путем присоединения к нему другого субстрата, Sa или Sb.
После этого происходит образование продуктов реакции,
которые отсоединяются от фермент-субстратного комплекса в
произвольном порядке.
18.
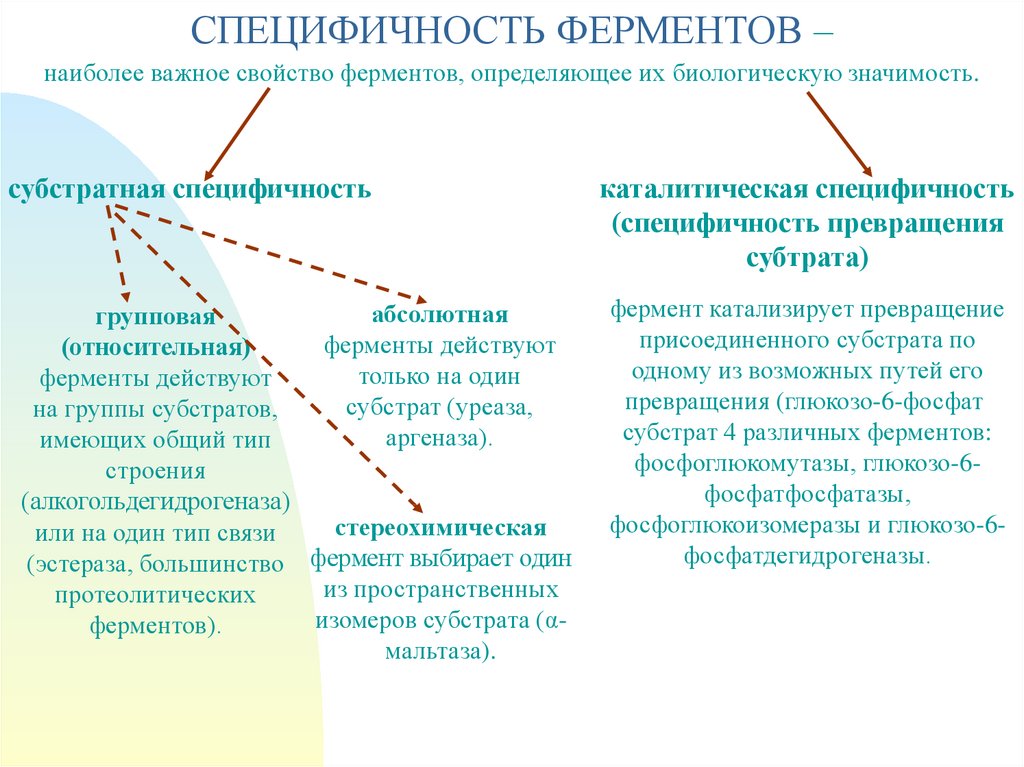
СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ –наиболее важное свойство ферментов, определяющее их биологическую значимость.
субстратная специфичность
абсолютная
групповая
ферменты действуют
(относительная)
только на один
ферменты действуют
субстрат (уреаза,
на группы субстратов,
аргеназа).
имеющих общий тип
строения
(алкогольдегидрогеназа)
стереохимическая
или на один тип связи
(эстераза, большинство фермент выбирает один
из пространственных
протеолитических
изомеров субстрата (αферментов).
мальтаза).
каталитическая специфичность
(специфичность превращения
субтрата)
фермент катализирует превращение
присоединенного субстрата по
одному из возможных путей его
превращения (глюкозо-6-фосфат
субстрат 4 различных ферментов:
фосфоглюкомутазы, глюкозо-6фосфатфосфатазы,
фосфоглюкоизомеразы и глюкозо-6фосфатдегидрогеназы.
–
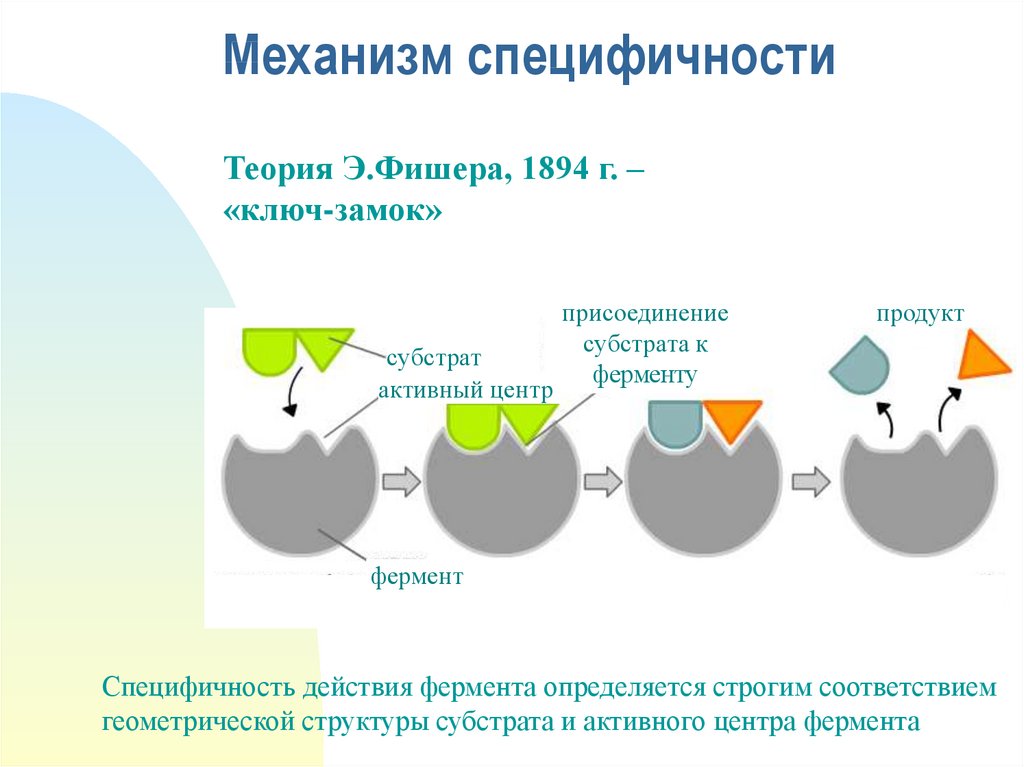
19. Механизм специфичности
Теория Э.Фишера, 1894 г. –«ключ-замок»
субстрат
активный центр
присоединение
субстрата к
ферменту
продукт
фермент
Специфичность действия фермента определяется строгим соответствием
геометрической структуры субстрата и активного центра фермента
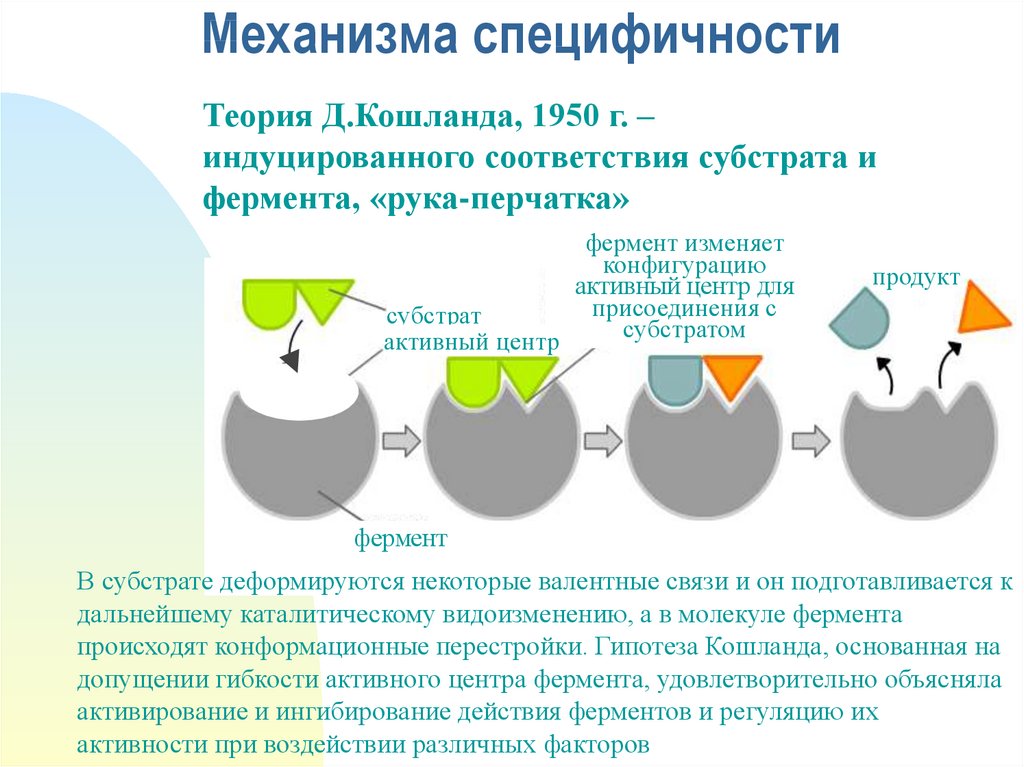
20. Механизма специфичности
Теория Д.Кошланда, 1950 г. –индуцированного соответствия субстрата и
фермента, «рука-перчатка»
фермент изменяет
конфигурацию
активный центр для
присоединения с
субстрат
субстратом
активный центр
продукт
фермент
В субстрате деформируются некоторые валентные связи и он подготавливается к
дальнейшему каталитическому видоизменению, а в молекуле фермента
происходят конформационные перестройки. Гипотеза Кошланда, основанная на
допущении гибкости активного центра фермента, удовлетворительно объясняла
активирование и ингибирование действия ферментов и регуляцию их
активности при воздействии различных факторов
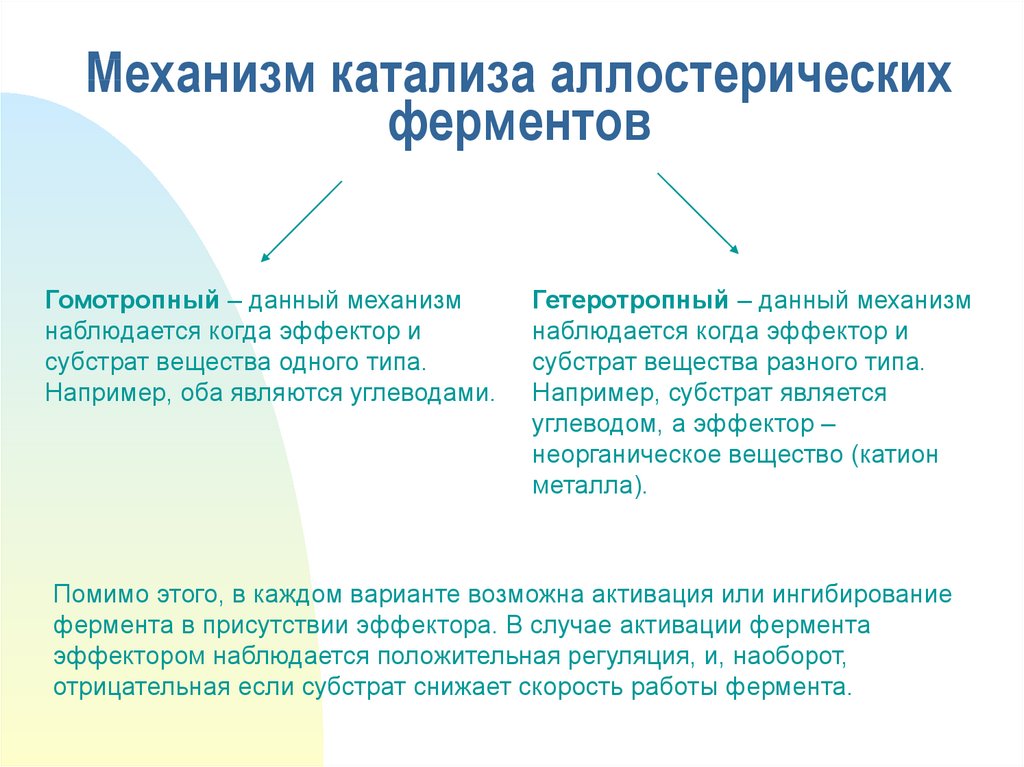
21. Механизм катализа аллостерических ферментов
Гомотропный – данный механизмнаблюдается когда эффектор и
субстрат вещества одного типа.
Например, оба являются углеводами.
Гетеротропный – данный механизм
наблюдается когда эффектор и
субстрат вещества разного типа.
Например, субстрат является
углеводом, а эффектор –
неорганическое вещество (катион
металла).
Помимо этого, в каждом варианте возможна активация или ингибирование
фермента в присутствии эффектора. В случае активации фермента
эффектором наблюдается положительная регуляция, и, наоборот,
отрицательная если субстрат снижает скорость работы фермента.
22.
Энергетикаферментативных реакций
Ферменты снижают энергию активации
Скорость химической реакции зависит от
концентрации реагирующих веществ
В комплексе с ферментами субстраты превращаются
в более устойчивые промежуточные соединения, за
счет чего их концентрация резко повышается, что
способствует ускорению реакции
23.
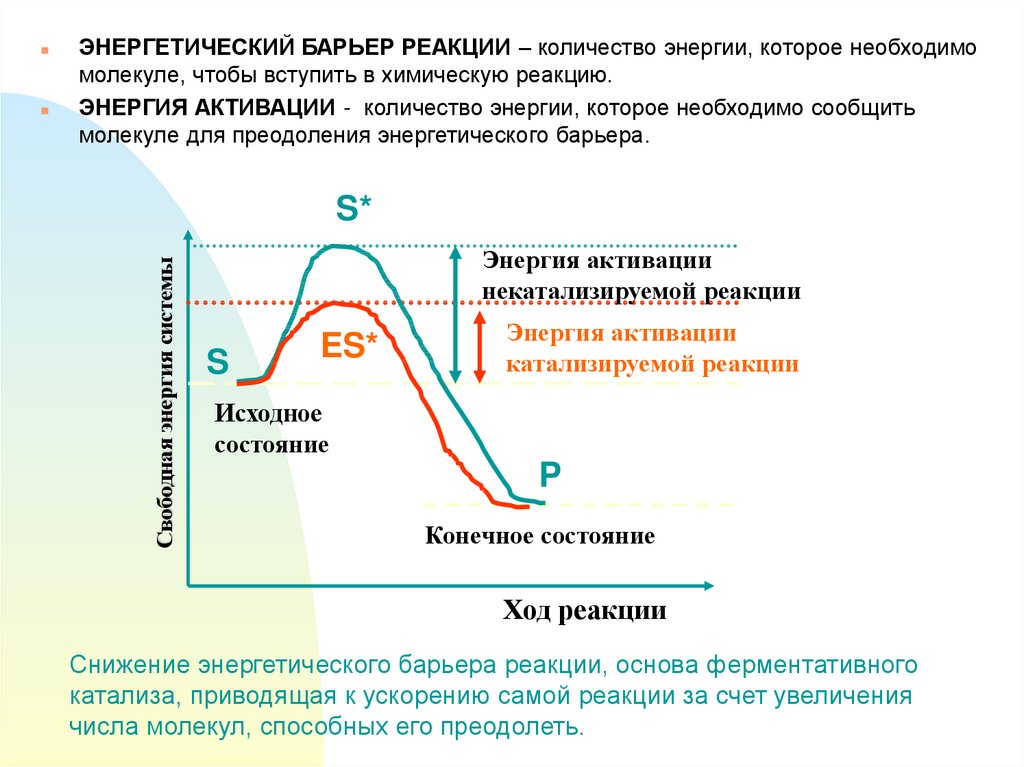
ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР РЕАКЦИИ – количество энергии, которое необходимомолекуле, чтобы вступить в химическую реакцию.
ЭНЕРГИЯ АКТИВАЦИИ - количество энергии, которое необходимо сообщить
молекуле для преодоления энергетического барьера.
S*
Свободная энергия системы
Энергия активации
некатализируемой реакции
S
ES*
Энергия активации
катализируемой реакции
Исходное
состояние
P
Конечное состояние
Ход реакции
Снижение энергетического барьера реакции, основа ферментативного
катализа, приводящая к ускорению самой реакции за счет увеличения
числа молекул, способных его преодолеть.
24. Активность ферментов
Активность фермента – это процесс преобразованиясубстрата в продукт, но при том необходимо
учитывать такие факторы как время, количество
фермента и субстрат.
Количество S или P (моль)
Активность фермента =
Время (мин) Масса (кг) или Объем пробы (литр)
25. Выражение активности фермента
Ферментативная единица (ФЕ или Е) – этоколичество фермента, которое превращает 1 мкмоль
субстрата в 1 минуту при стандартных условиях
(37оС, оптимальное значение рН, атмосферное
давление 750 мм ртутного столба).
Катал – количество фермента, которое превращает 1
моль субстрата в 1 секунду при стандартных
условиях (см. выше).
Число оборотов – количество молекул субстрата
превращенное в продукт за 1 минуту 1 молем
фермента при избытке субстрата в стандартных
условиях (см. выше).









 Биология
Биология








