Похожие презентации:
Механизм действия ферментов
1.
II. Трансферазы.а) п/кл фосфотрансферазы.
Все трансферазы переносят функционольные группы.
Фосфотрансферазы катализируют перенос фосфатной группы.
Коферментом является АТФ. В этой молекуле остатки
фосфорной кислоты связаны между собой макроэргической
связью. Кроме АТФ могут учавствовать молекулы ЦТФ, ГТФ,
УТФ.
б) п/кл аминотрансферазы.
Ферменты отвечают за перенос аминогрупп.
Коферментом является передоксильфосфат, является
производным пиридоксина витамина В6.
в) п/кл ацилтрансферазы.
Переносят остатки органических кислот. Коферментом
является кофермент А, производное пантотеновой кислоты.
г) п/кл переносящие одноуглеродные группы(СН, СН3).
Коферментом является тетрагидрофолиевая кислота,
производная витамина фолиевая кислота.
2.
III. Гидролазы.Ферменты, катализирующие расщепление веществ с
участием воды. Они не нуждаются в коферментах.
IV. Лиазы.
Ферменты, катализирующие присоединение веществ по
двойным связям.
V. Изомеразы.
Катализируют внутримолекулярные перегруппировки.
Имеют окончание –изомераза или –мутаза. Могут
осуществлять рацимизацию, транс-,цисизомеризацию,
внутримолекулярный перенос функциональных групп.
Коферментом является цианкобаламин производное
витамина В12.
VI. Лигазы = синтетазы.
Ферменты, осуществляющие энергозависимый синтез.
Поставщиком обычно является внутриклеточный
пирофосфат(АТФ, АДФ).
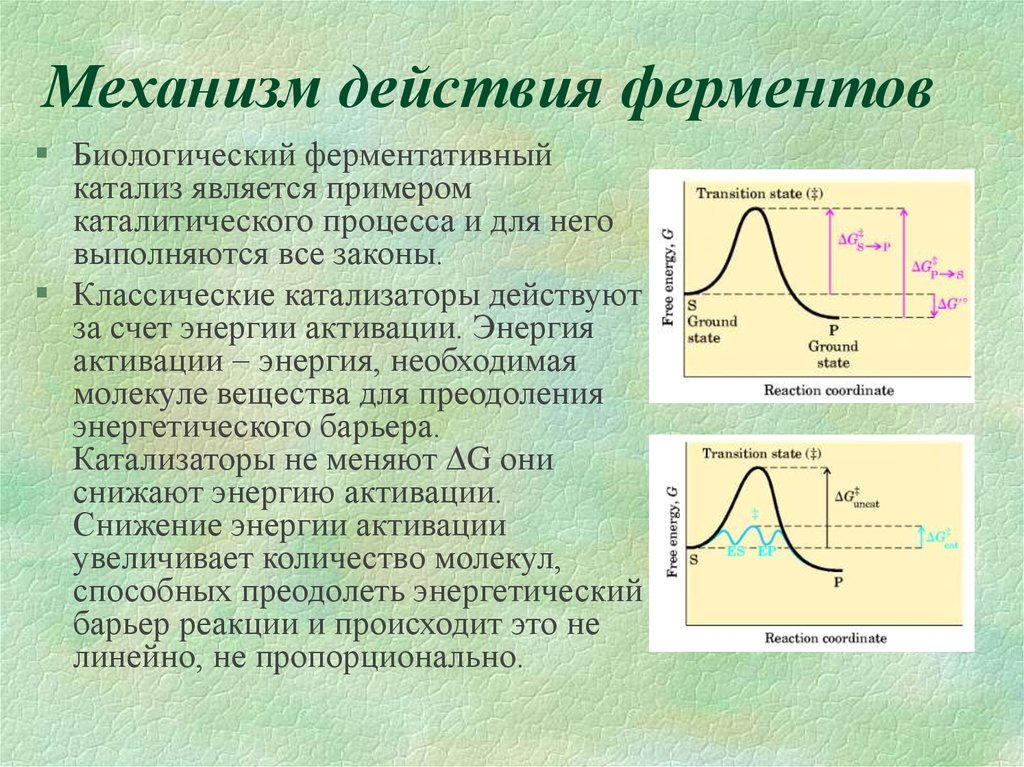
3. Механизм действия ферментов
Биологический ферментативныйкатализ является примером
каталитического процесса и для него
выполняются все законы.
Классические катализаторы действуют
за счет энергии активации. Энергия
активации энергия, необходимая
молекуле вещества для преодоления
энергетического барьера.
Катализаторы не меняют G они
снижают энергию активации.
Снижение энергии активации
увеличивает количество молекул,
способных преодолеть энергетический
барьер реакции и происходит это не
линейно, не пропорционально.
4. Снижение энергии активации достигается за счет:
1. ориентации субстратов.2. Теория стерического
взаимодействия (взаимодействие
ключ-замок). Фишер
предположил, что активный
центр фермента пространственно
соответствует молекуле
субстрата. За счет своей
пространственной
специфичности фермент и
субстрат ориентируются
специфично.
5.
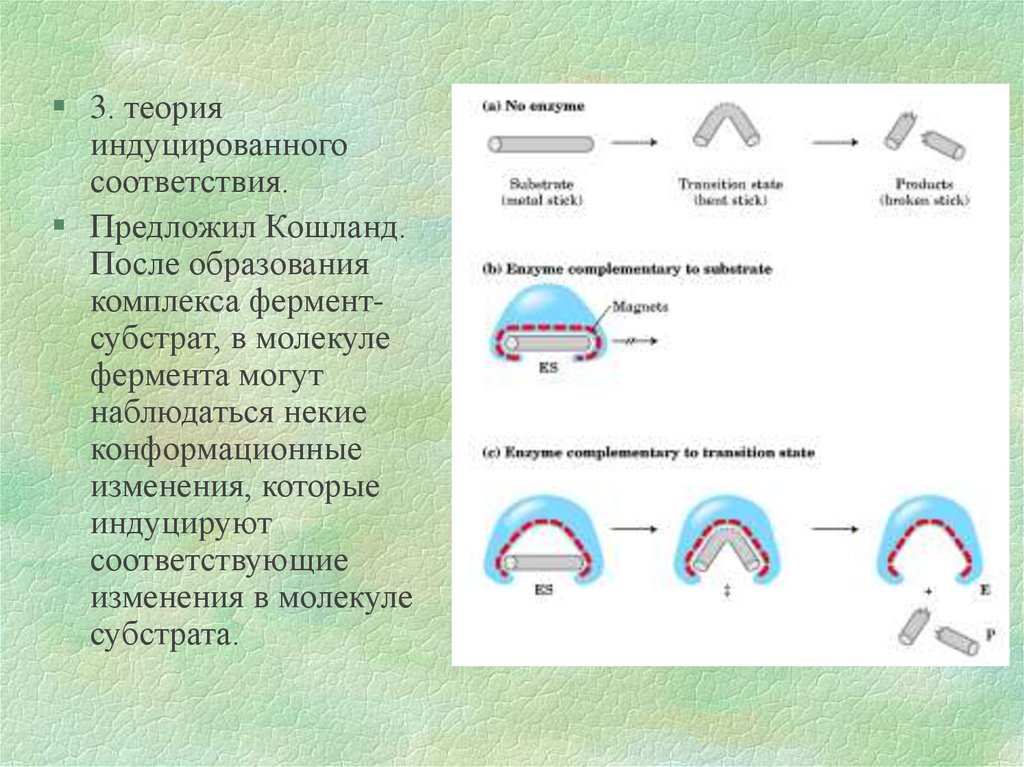
3. теорияиндуцированного
соответствия.
Предложил Кошланд.
После образования
комплекса ферментсубстрат, в молекуле
фермента могут
наблюдаться некие
конформационные
изменения, которые
индуцируют
соответствующие
изменения в молекуле
субстрата.
6.
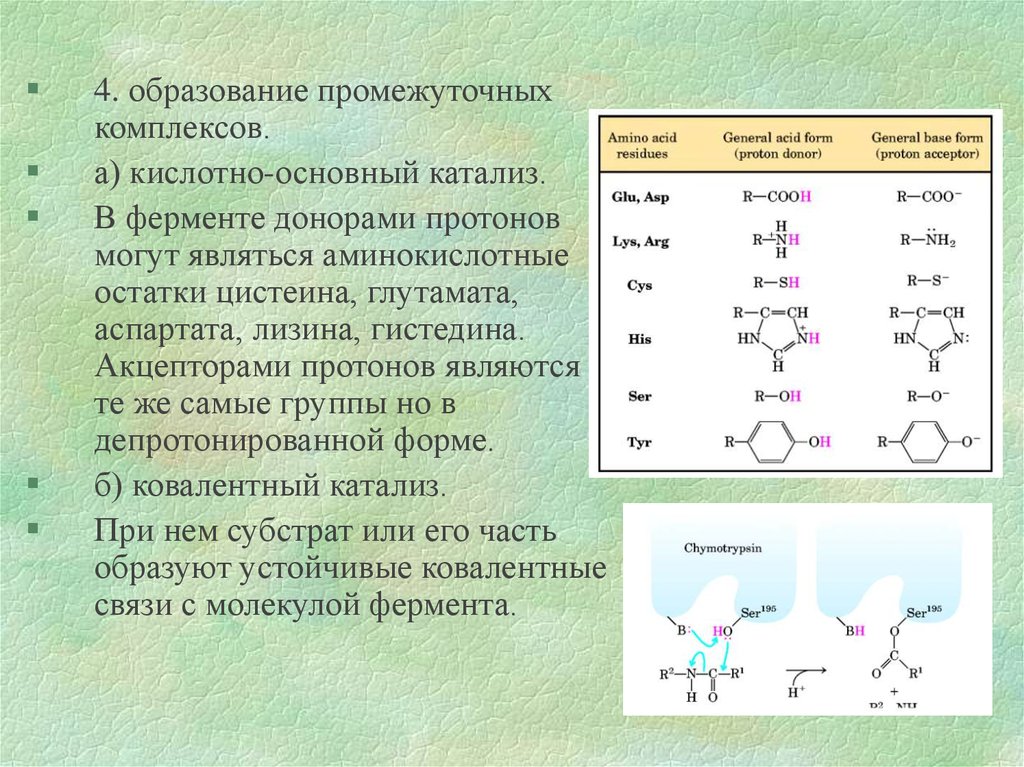
4. образование промежуточныхкомплексов.
а) кислотно-основный катализ.
В ферменте донорами протонов
могут являться аминокислотные
остатки цистеина, глутамата,
аспартата, лизина, гистедина.
Акцепторами протонов являются
те же самые группы но в
депротонированной форме.
б) ковалентный катализ.
При нем субстрат или его часть
образуют устойчивые ковалентные
связи с молекулой фермента.
7.
в) нуклеофильнаяэлектрофильнаяатака
8. Факторы, влияющие на активность фермента
Концентрация субстрата.В 1913г. Михаэлис и Ментен проедложили
уравнение
= max[S]/Km+[S]
9.
Km - константа Михаэлиса.Лимитирующим фактором
протекания реакции,
является образование
фермент-субстратного
комплекса.
Km= концентрации
субстрата при которой
скорость реакции равна ½
скорости максимальной.
Т.к. это концентрация, то она
выражается моль/литр и тп.
Уравнение МихаэлисаМентен описявает
односубстратные не
аллостерические ферменты.









 Биология
Биология








