Похожие презентации:
Органическая химия
1. Все, чему мне случилось быть здесь свидетелем, не было мне совершенно незнакомым, о подоб-ных случаях я где-то что-то читал и теперь вспомнил
Все, чему мне случилось быть здесь свидетелем,не было мне совершенно незнакомым, о подобных случаях я где-то что-то читал и теперь
вспомнил…
Стругацкие А. и Б.
Понедельник начинается в субботу.
На капителях колонн и лабиринтах исполинской
люстры, свисающей с почерневшего потолка, шуршали
нетопыри и летучие собаки. С ними Модест Матвеевич
боролся. Он поливал их скипидаром и креозотом, опылял дустом, опрыскивал гексахлораном, они гибли тысячами, но возрождались десятками тысяч.
Стругацкие А. и Б.
Понедельник начинается в субботу.
2. Органическая химия – это химия соединений углерода
Органическая химия – это химияуглеводородов и их производных
3. Производные углеводородов
Содержат кромеO
N
Hal
С
и
Н
и др.
4. Галогенпроизводные углеводородов
производные углеводовородов,в которых один или несколько
атомов водорода замещены на
атомы галогенов
5. Этапы изучения
КлассификацияСтроение
Номенклатура
Изомерия
Физические свойства
Химические свойства
Получение
Применение
6. Классификация 1
По характеру галогенаФторХлорБромИодпроизводные
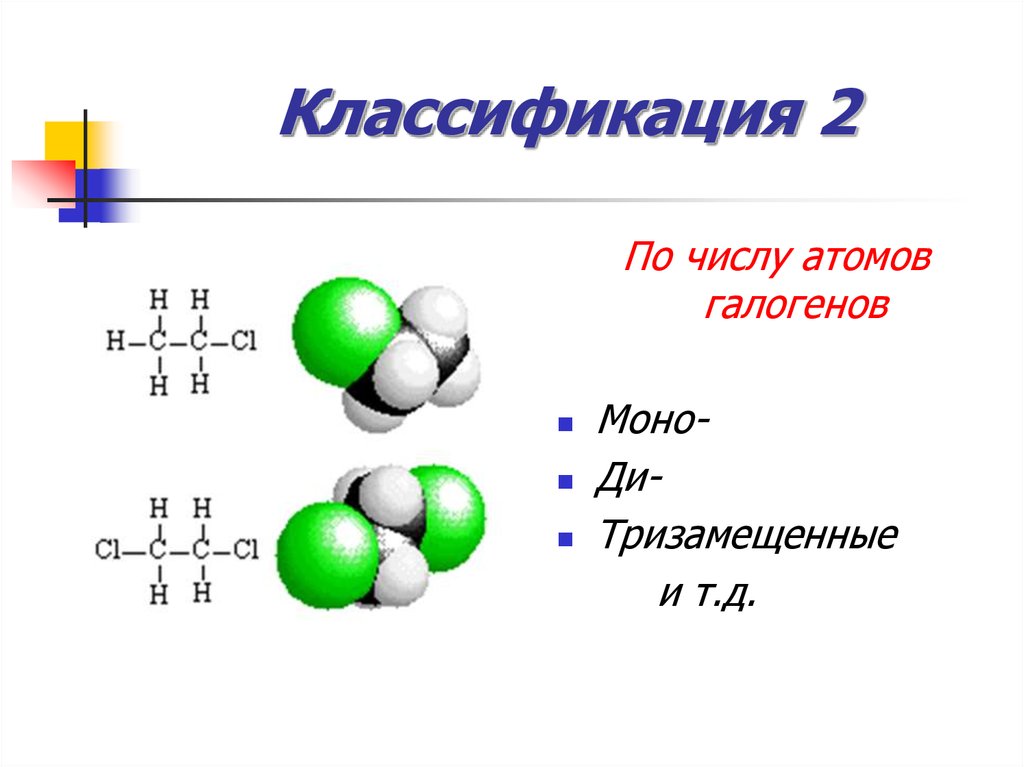
7. Классификация 2
По числу атомовгалогенов
МоноДиТризамещенные
и т.д.
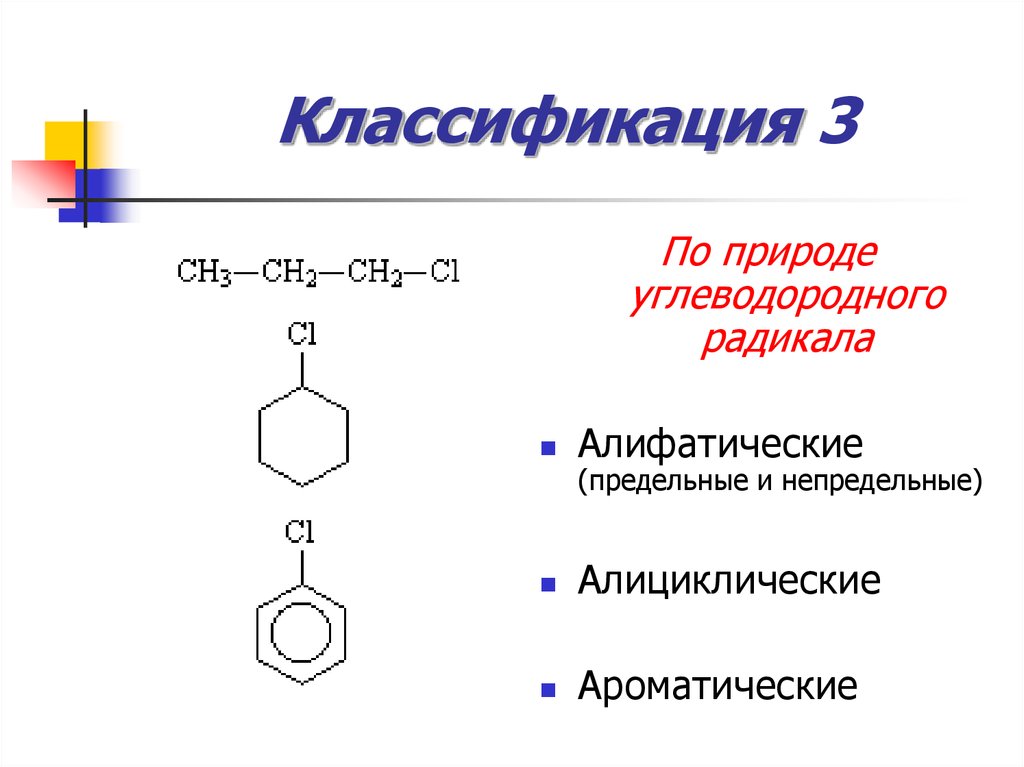
8. Классификация 3
По природеуглеводородного
радикала
Алифатические
Алициклические
Ароматические
(предельные и непредельные)
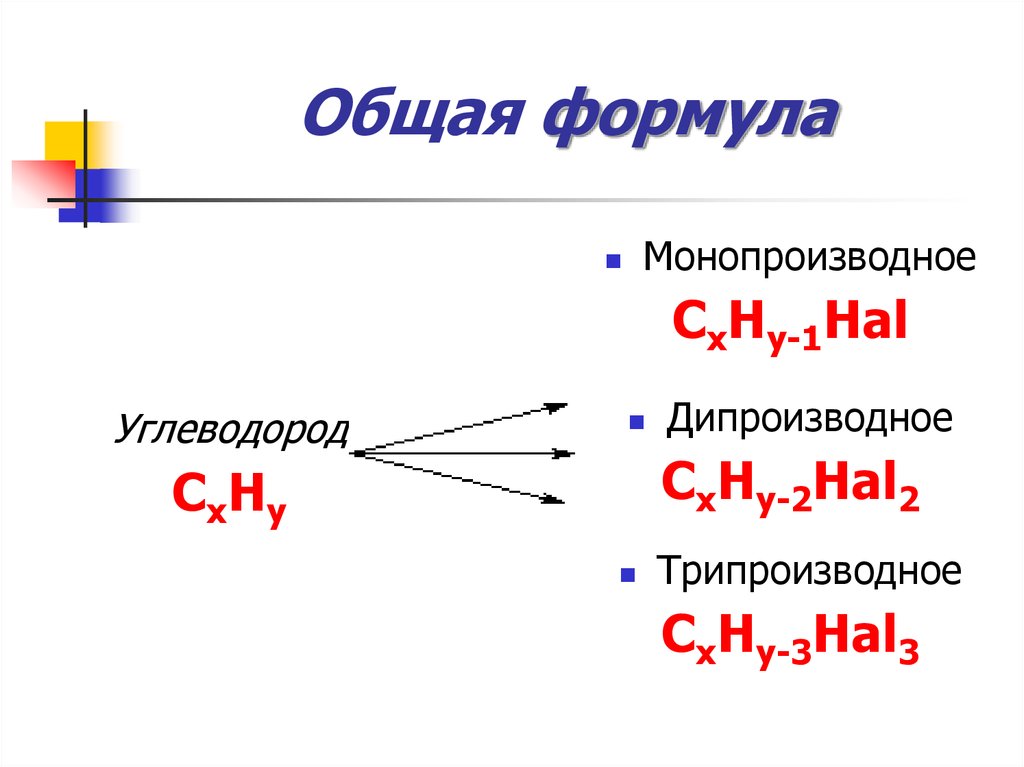
9. Общая формула
МонопроизводноеСxHy-1Hal
Углеводород
Дипроизводное
СxHy-2Hal2
СxHy
Трипроизводное
СxHy-3Hal3
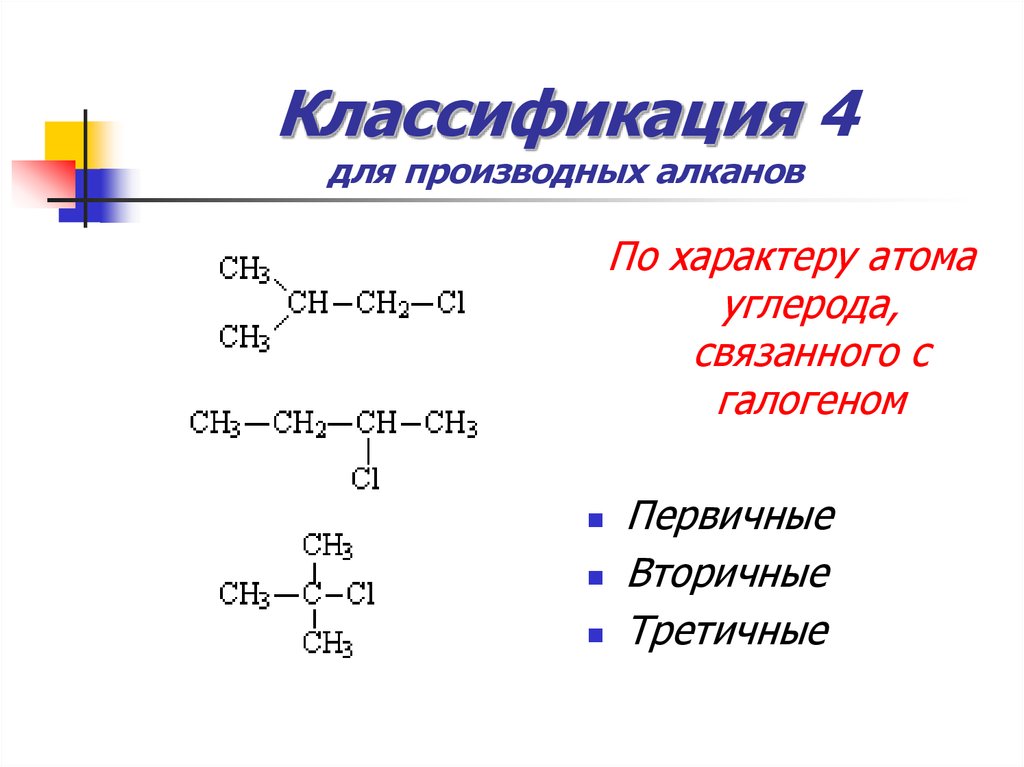
10. Классификация 4 для производных алканов
По характеру атомауглерода,
связанного с
галогеном
Первичные
Вторичные
Третичные
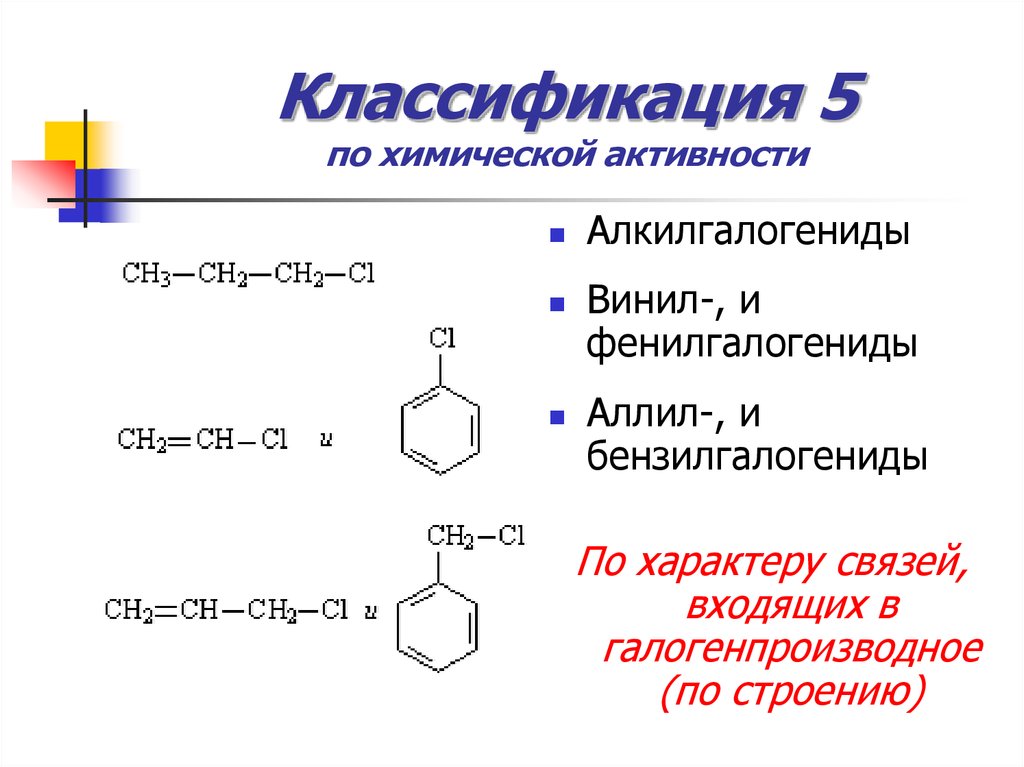
11. Классификация 5 по химической активности
АлкилгалогенидыВинил-, и
фенилгалогениды
Аллил-, и
бензилгалогениды
По характеру связей,
входящих в
галогенпроизводное
(по строению)
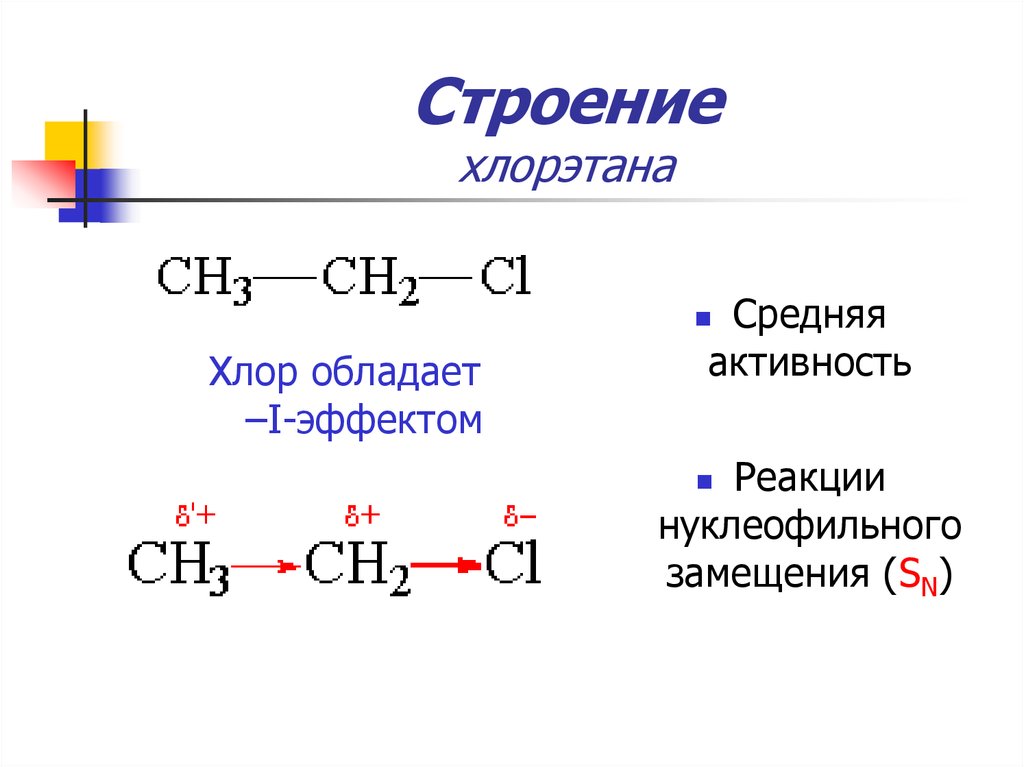
12. Строение хлорэтана
13. Строение хлорэтана
Средняяактивность
Хлор обладает
–I-эффектом
Реакции
нуклеофильного
замещения (SN)
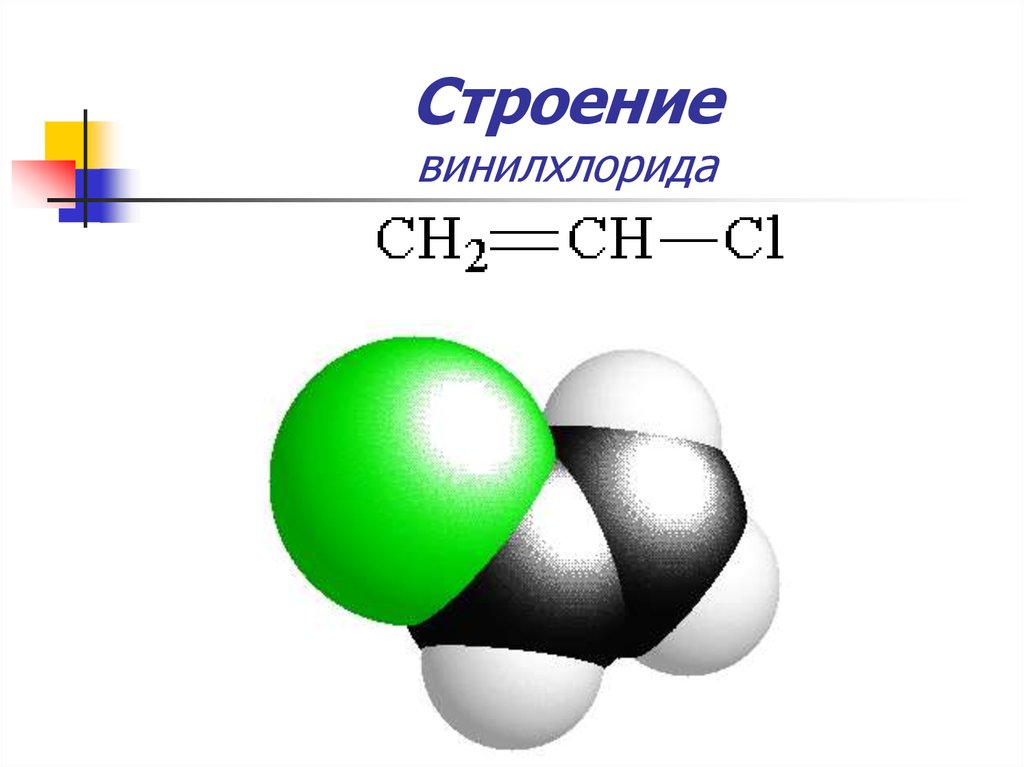
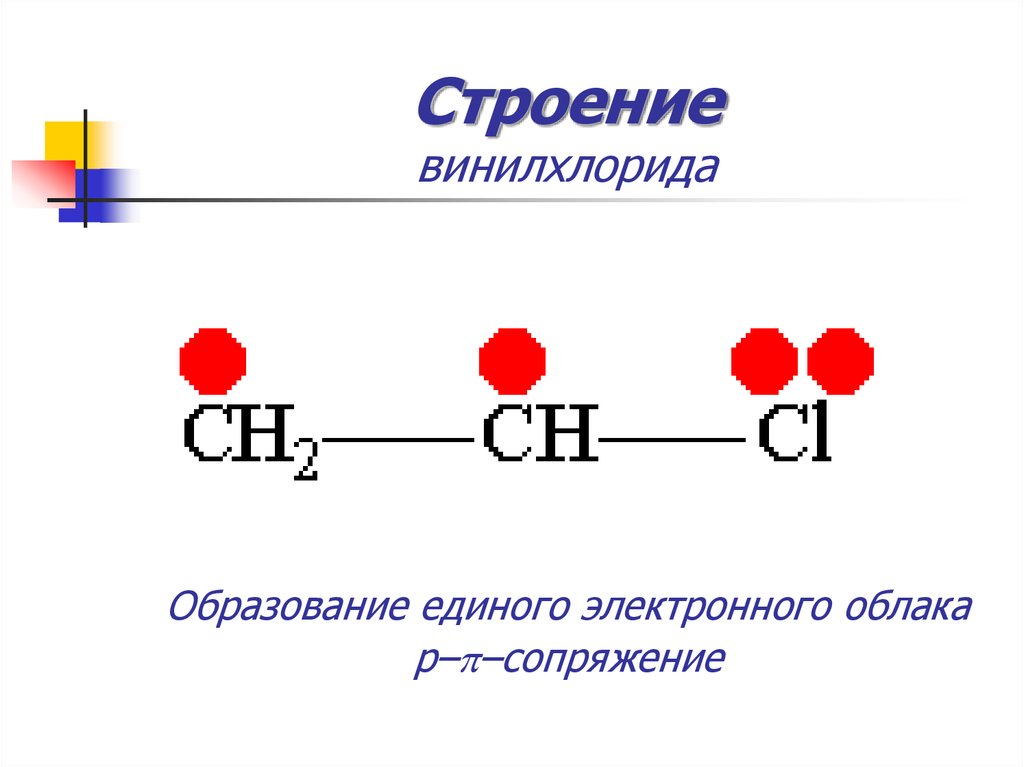
14. Строение винилхлорида
15. Строение винилхлорида
Хлор обладает-I и +М-эффектами
–I>+M
Более прочная
связь С — Cl
Низкая активность
в реакциях
нуклеофильного
замещения (SN)
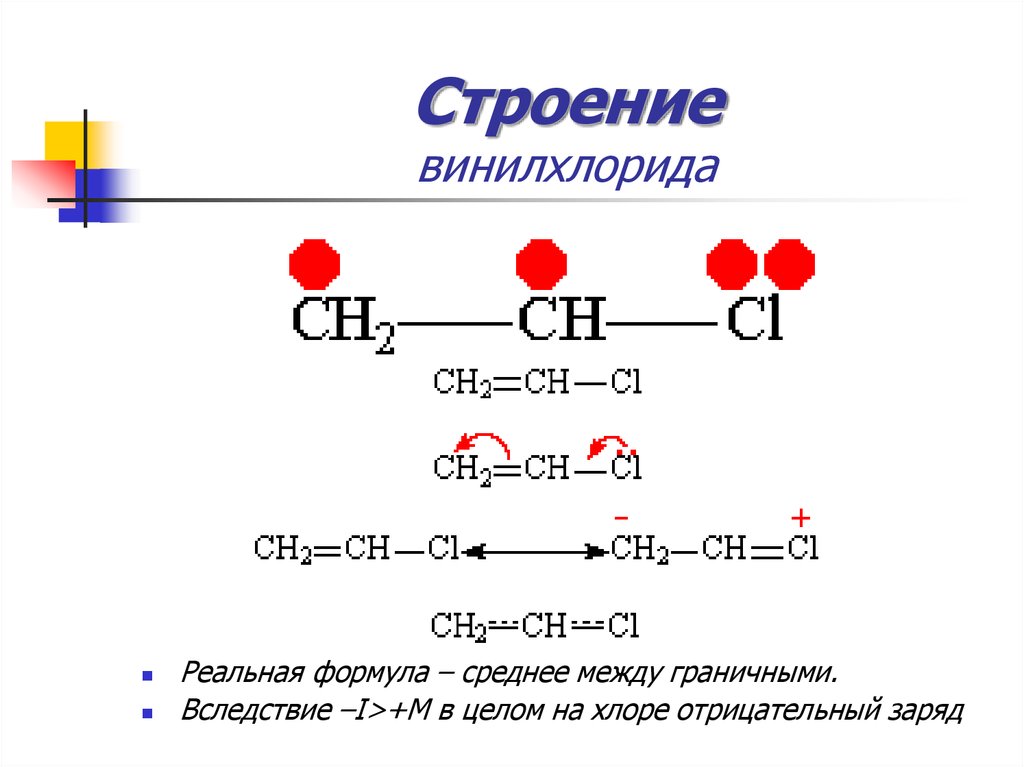
16. Строение винилхлорида
Образование единого электронного облакаp–p–сопряжение
17. Строение винилхлорида
Реальная формула – среднее между граничными.Вследствие –I>+M в целом на хлоре отрицательный заряд
18. Строение аллилхлорида
19. Строение аллилхлорида
В чем причина высокой активности?В устойчивости образующегося
промежуточного карбкатиона!
20. Строение аллил-катиона
Образование единого электронного облакаp–p–сопряжение
21. Строение аллил-катиона
Реальная формула – среднее между граничными – устойчива,легко образуется.
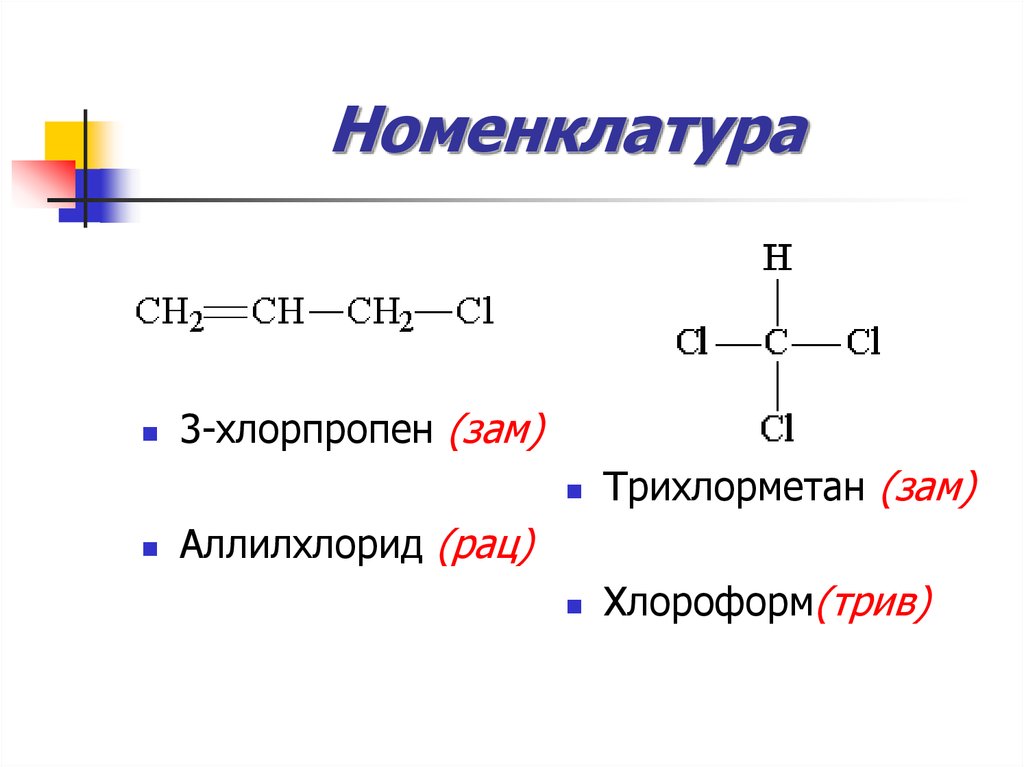
22. Номенклатура
Систематическая (заместительная)Локант (№) + галоген + углеводород
Рациональная
радикал + галогенид
Тривиальная (исторически сложившаяся)
23. Номенклатура
3-хлорпропен (зам)Трихлорметан (зам)
Хлороформ(трив)
Аллилхлорид (рац)
24. Номенклатура
Задание: Назовите вещество посистематической номенклатуре
1-хлор-2-этилпропен-2
2-хлорметилбутен-1
2-этил-3-хлорпропен-1
неправильно
3-хлор-2-этилпропен-1 – правильно
25. Номенклатура
Задание : Назовите вещества26. Изомерия
СтруктурнаяА) характерная для
углеводородов
+
Б) положения
заместителя
Пространственная
Если характерна для
углеводородов, от
которого образовано
галогенпроизводное
27. Изомерия
ЗаданиеСоставьте формулы всех возможных
изомеров состава С4Н9Вr.
Укажите виды изомерии, характерные
для этих соединений.
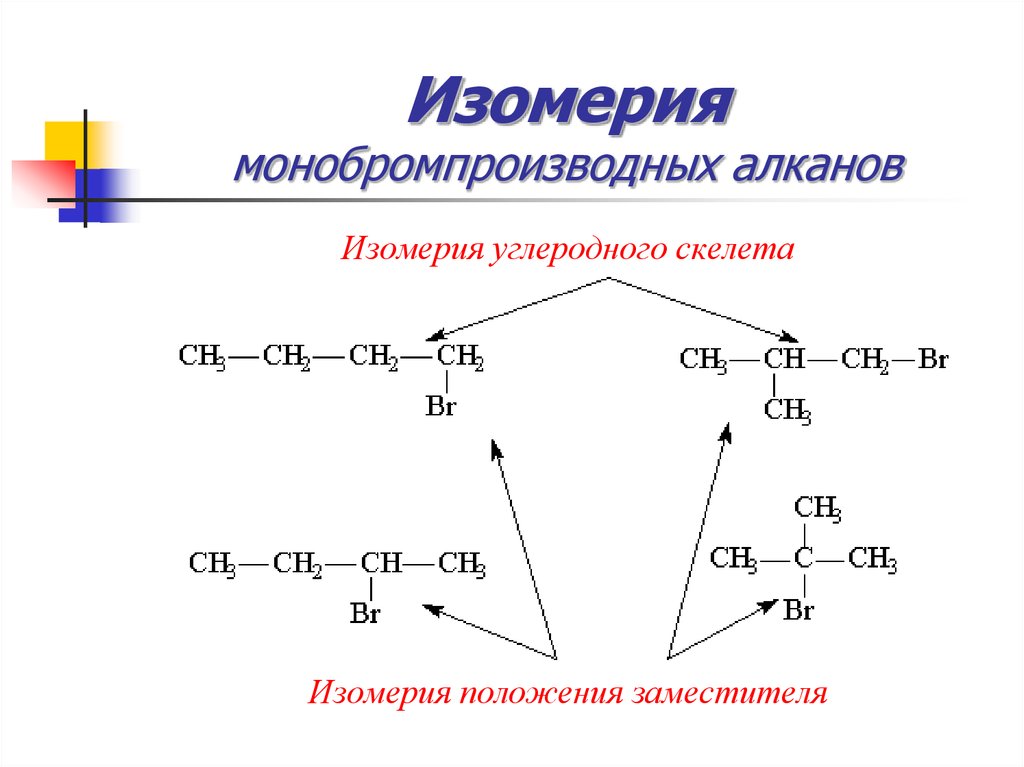
28. Изомерия монобромпроизводных алканов
Изомерия углеродного скелетаИзомерия положения заместителя
29. Изомерия пространственная
Какие классы галогенпроизводных могутсуществовать в виде цис-транс-изомеров?
Существует ли винилхлорид в виде
цис-транс-изомеров?
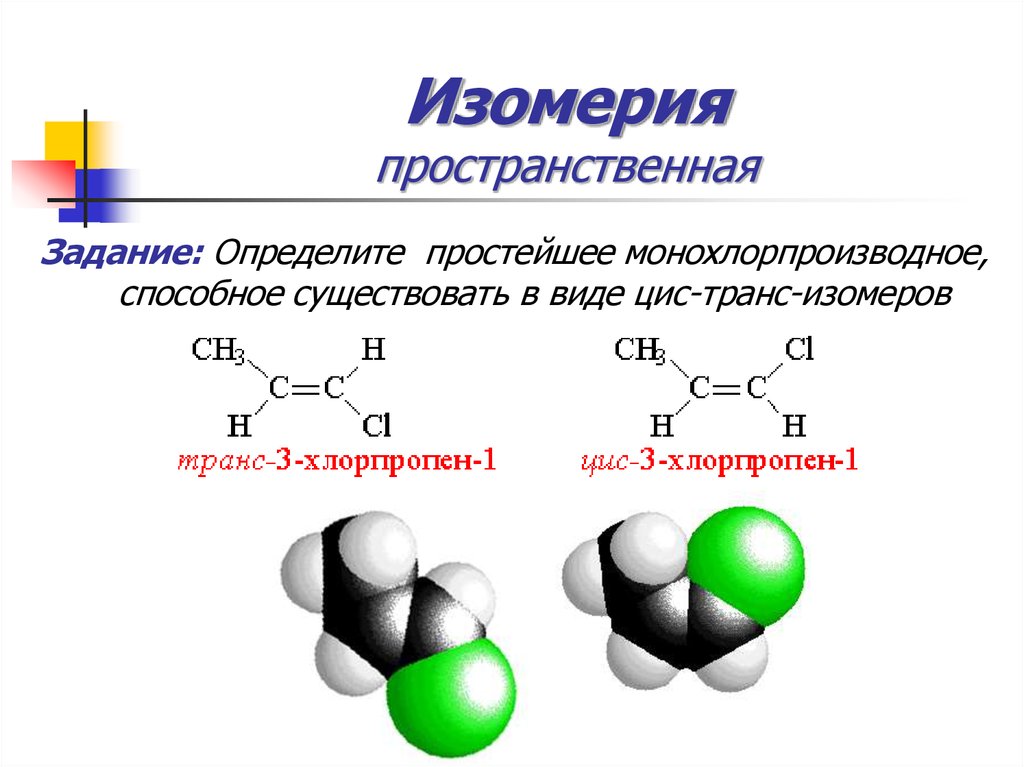
30. Изомерия пространственная
Задание: Определите простейшее монохлорпроизводное,способное существовать в виде цис-транс-изомеров
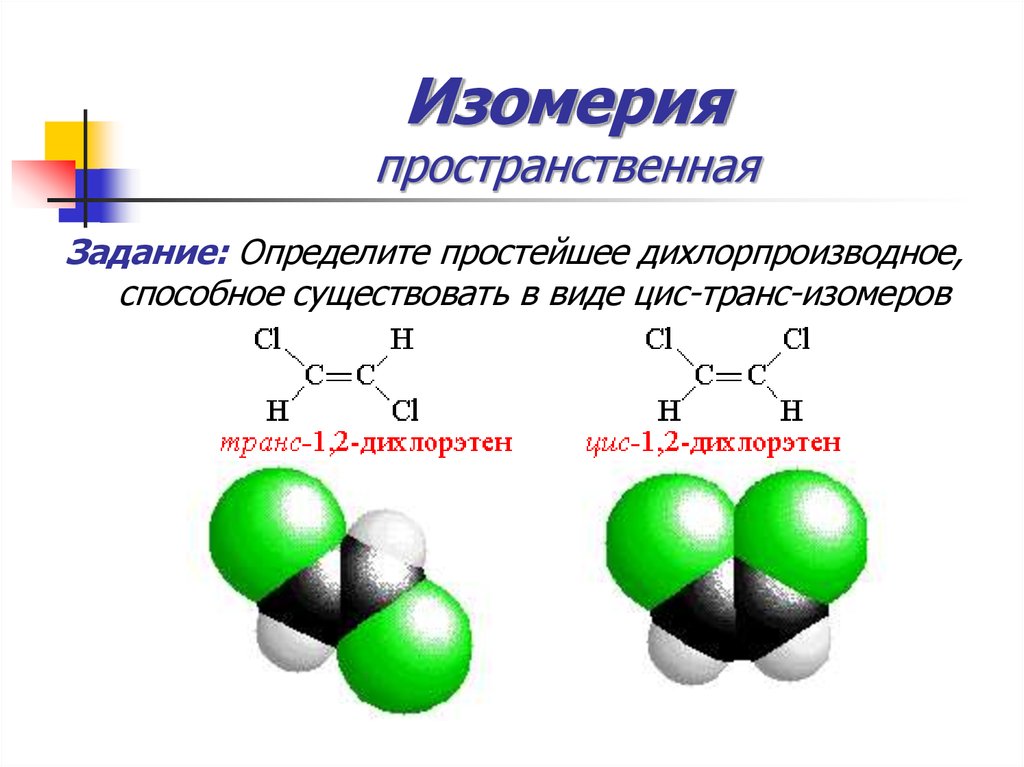
31. Изомерия пространственная
Задание: Определите простейшее дихлорпроизводное,способное существовать в виде цис-транс-изомеров
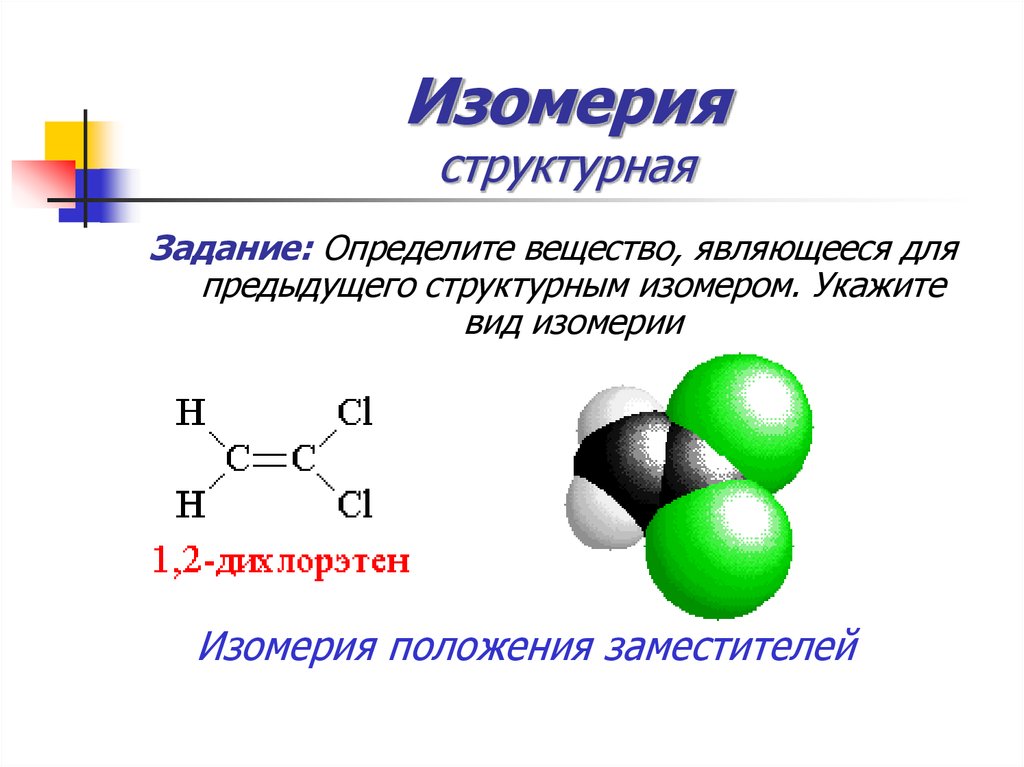
32. Изомерия структурная
Задание: Определите вещество, являющееся дляпредыдущего структурным изомером. Укажите
вид изомерии
Изомерия положения заместителей
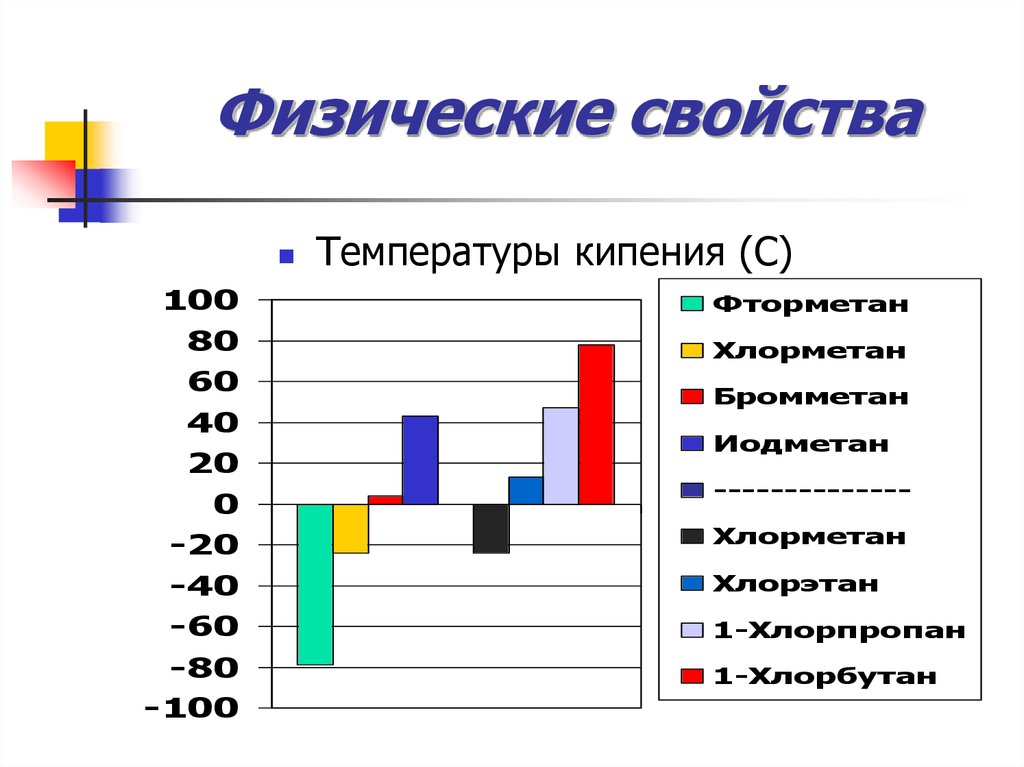
33. Физические свойства
Температуры кипения (С)100
Фторметан
80
60
Хлорметан
40
20
Иодметан
Бромметан
0
-20
--------------
-40
-60
Хлорэтан
-80
-100
Хлорметан
1-Хлорпропан
1-Хлорбутан
34. Физические свойства
Температуры кипения (С)140
Хлорметан
120
Дихлорметан
100
80
60
Хлороформ
Тетрахлорметан
40
------------------
20
Винилхлорид
0
-20
-40
Хлорбензол
1,2-Дихлорэтан
35. Физические свойства
Температуры кипения увеличиваются:А) с увеличением порядкового номера галогена
Б) с увеличением углеводородного радикала
В) с увеличением числа атомов галогенов
Простейшие – газы, далее б/ц жидкости с
характерным запахом, нерастворимы в
воде, растворимы в орг. растворителях
Плотность увеличивается
Б) с увеличением числа атомов галогенов
А) с увеличением порядкового номера галогена
36. Физиологическое действие
Почти все токсичны (гексахлоран,ДДТ - ядохимикаты), кроме
фторпроизводных (тефлон, фреоны)
Многие обладают наркотическим
воздействием (хлороформ и др.)
Слезоточивое действие – лакриматор
(бензилхлорид и др.)
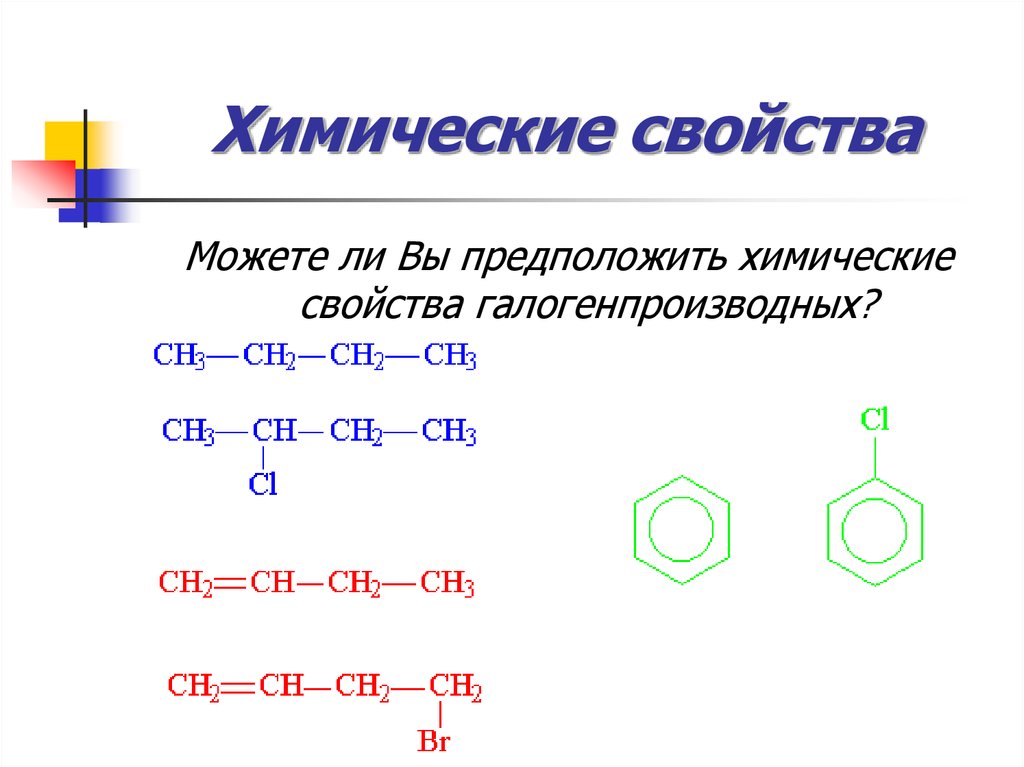
37. Химические свойства
Можете ли Вы предположить химическиесвойства галогенпроизводных?
38. Химические свойства
А) реакции углеводородных радикаловТе же что и у соответствующих у/в
предельные – замещение (SR)
непредельные – присоединие (АЕ)
ароматические – замещение (SЕ)
Б) реакции с участием галогенов
замещение (SN)
отщепления (элиминирования) (ЕN)
39. Химические свойства Реакции углеводородных радикалов
Задание:Укажите условия проведения реакций40. Химические свойства
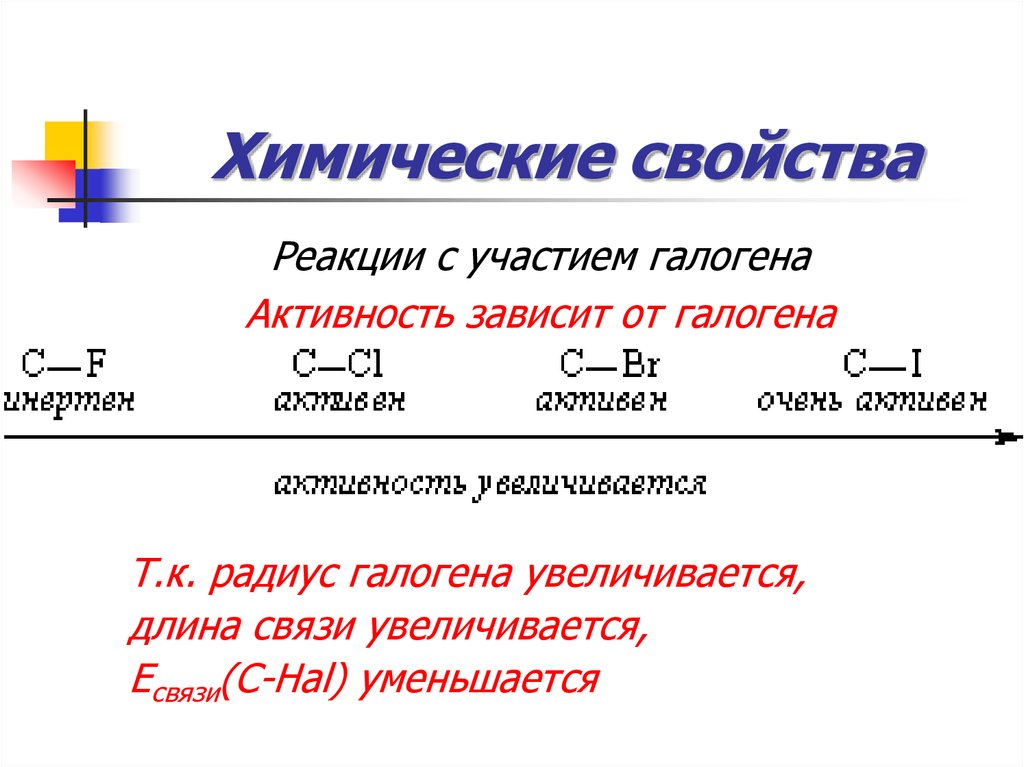
Реакции с участием галогенаАктивность зависит от галогена
Т.к. радиус галогена увеличивается,
длина связи увеличивается,
Есвязи(С-Hal) уменьшается
41. Химические свойства
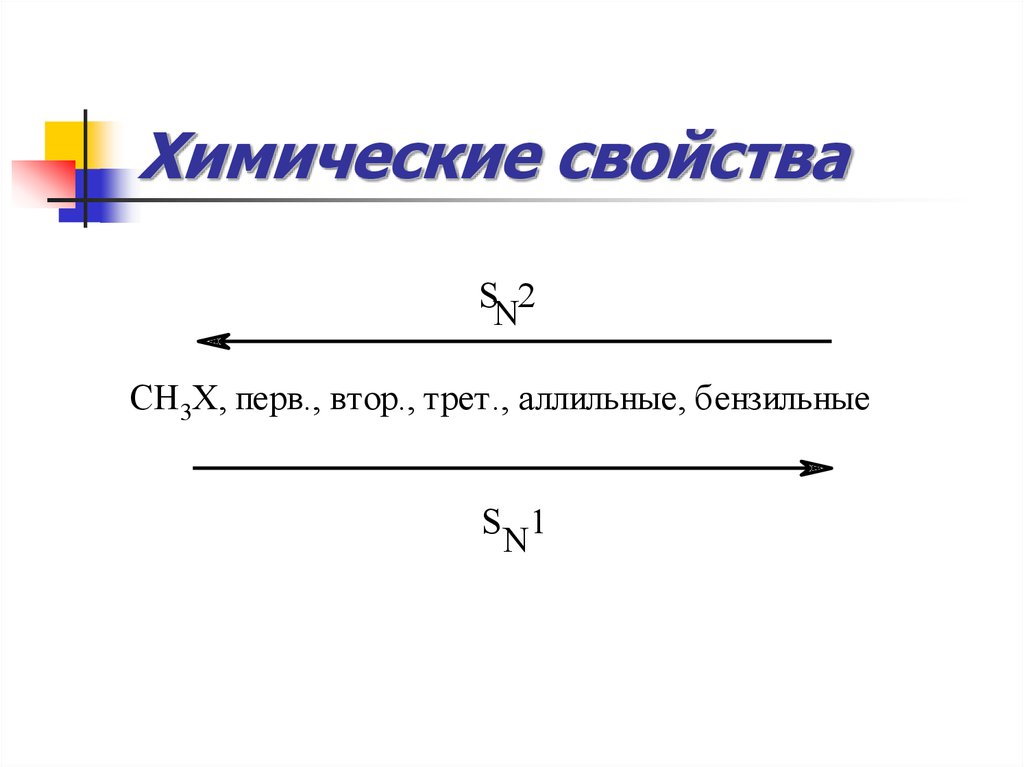
Механизм р-ции нуклеофильного замещения (SN)42. Химические свойства
SN2СH3X, перв., втор., трет., аллильные, бензильные
S 1
N
43. Химические свойства
SN2:1) атака нуклеофилом с тыла•одностадийный процесс (пентакоординационное переходное
состояние)
•вальденовское обращение конфигурации
OH
H3C
+
R
H3C
H
C
HO
Br
H
H
C
Br
R
(R)
CH3
C
HO
+ Br -
R
(S)
пентакоординационное переходное
состоя ние
Особые условия: отсутствие стерических препятствий в переходном состоянии!
V=k[RX][Nu]
44. Химические свойства
SN1: 1) двухстадийный процесс и рацемизация впроцессе реакции.
Особые условия: образование стабильного карбкатиона
V=k[RX]
CH3
CH3
медленно
+
+ Cl
1) H3C C Cl
H3C C
CH3
2) H3C
CH3
CH3
быстро
+ + OH
H3C
C
CH3
CH3
CH3
C
OH
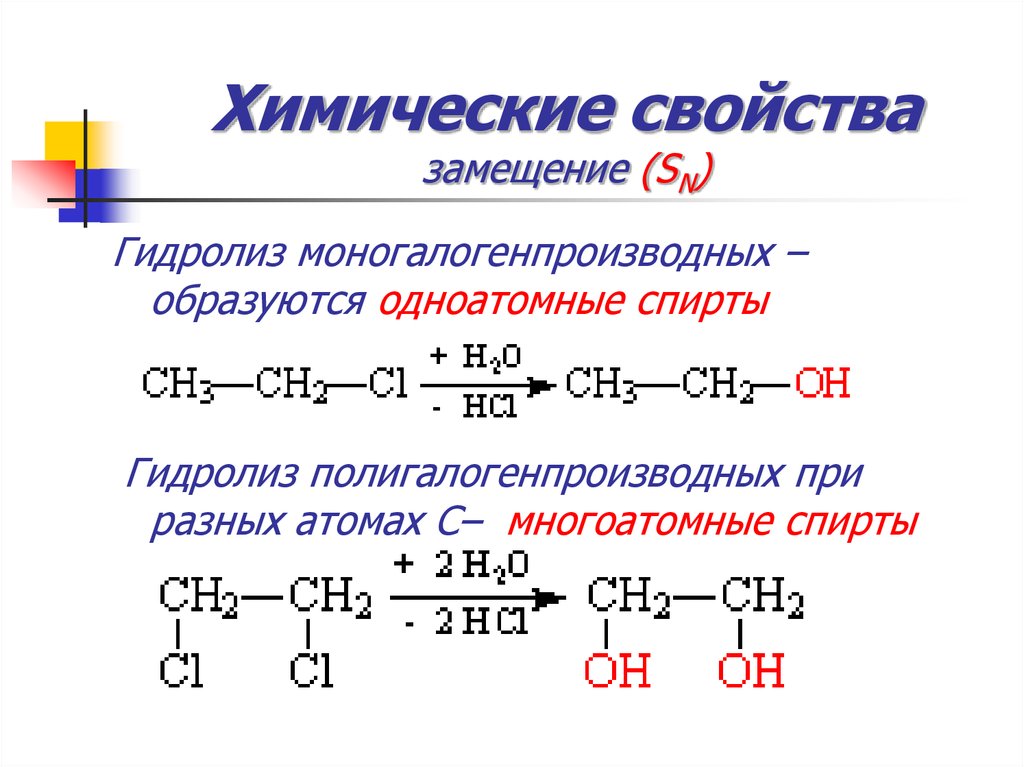
45. Химические свойства замещение (SN)
ГидролизА) алкилгалогенидов – средняя активность
(в присутствии щелочей)
46. Химические свойства замещение (SN)
ГидролизБ) винилгалогенидов и арилгалогенилов
не происходит
В) Аллилгалогенидов и бензилгалогенидов
происходит очень легко (без щелочи)
47. Химические свойства замещение (SN)
Гидролиз моногалогенпроизводных –образуются одноатомные спирты
Гидролиз полигалогенпроизводных при
разных атомах С– многоатомные спирты
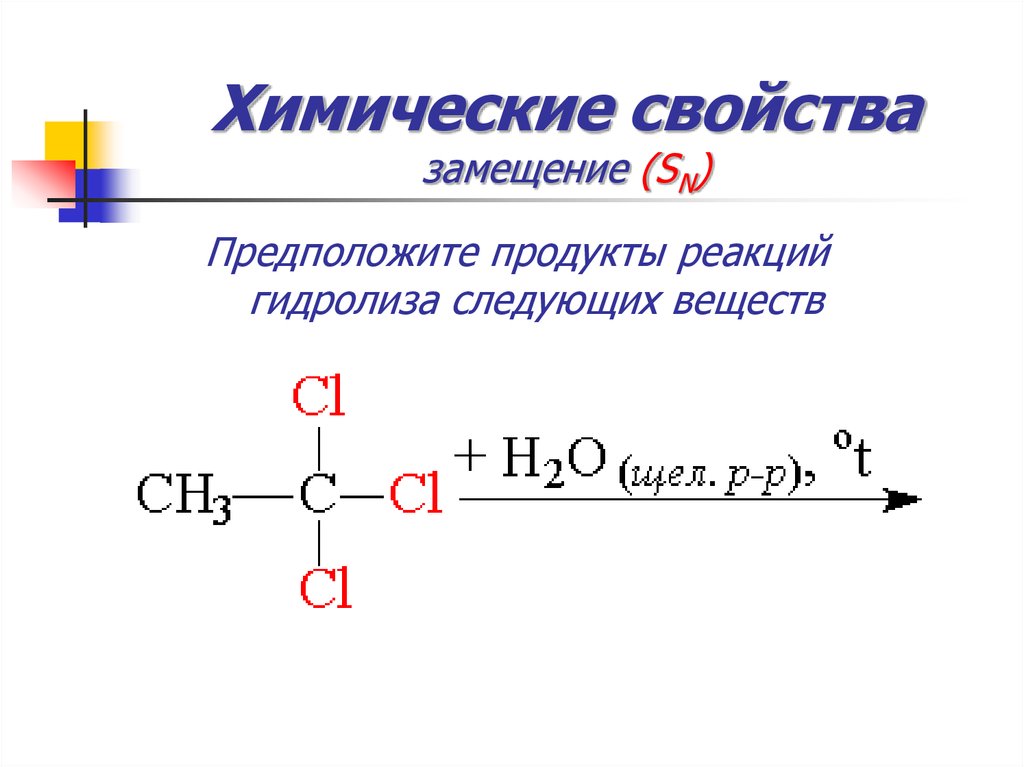
48. Химические свойства замещение (SN)
Предположите продукты реакцийгидролиза следующих веществ
49. Химические свойства
50. Химические свойства замещение (SN)
Гидролиз дигалогенпроизводных –образуются а)альдегиды и б) кетоны
51. Химические свойства замещение (SN)
Предположите продукты реакцийгидролиза следующих веществ
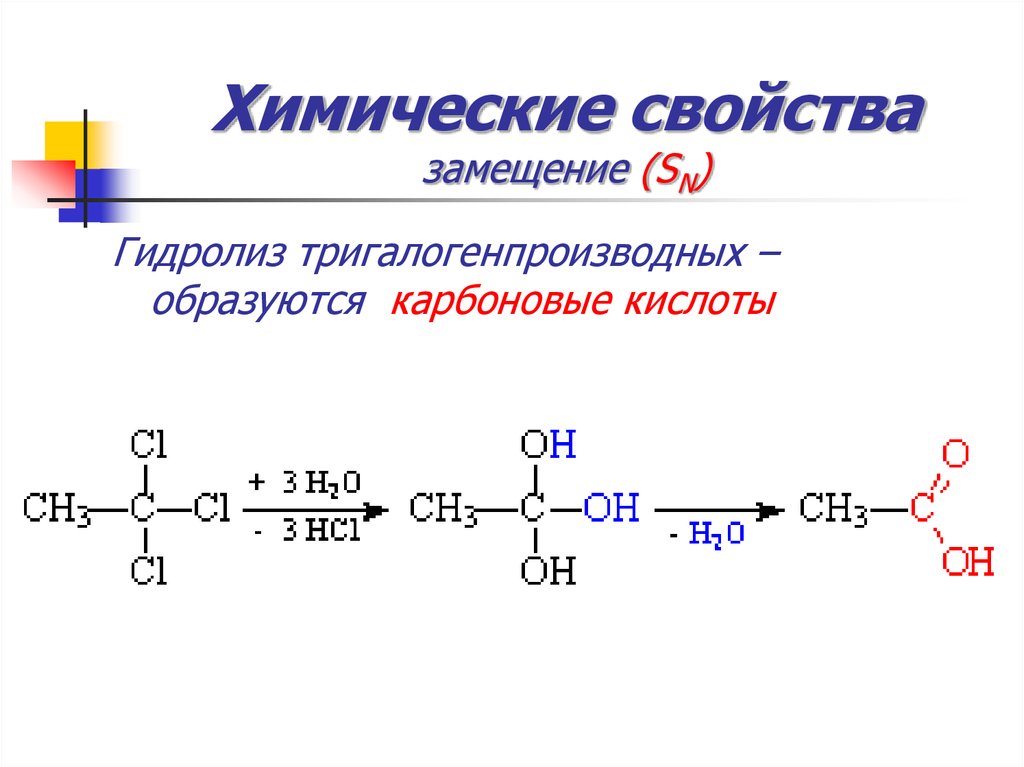
52. Химические свойства замещение (SN)
Гидролиз тригалогенпроизводных –образуются карбоновые кислоты
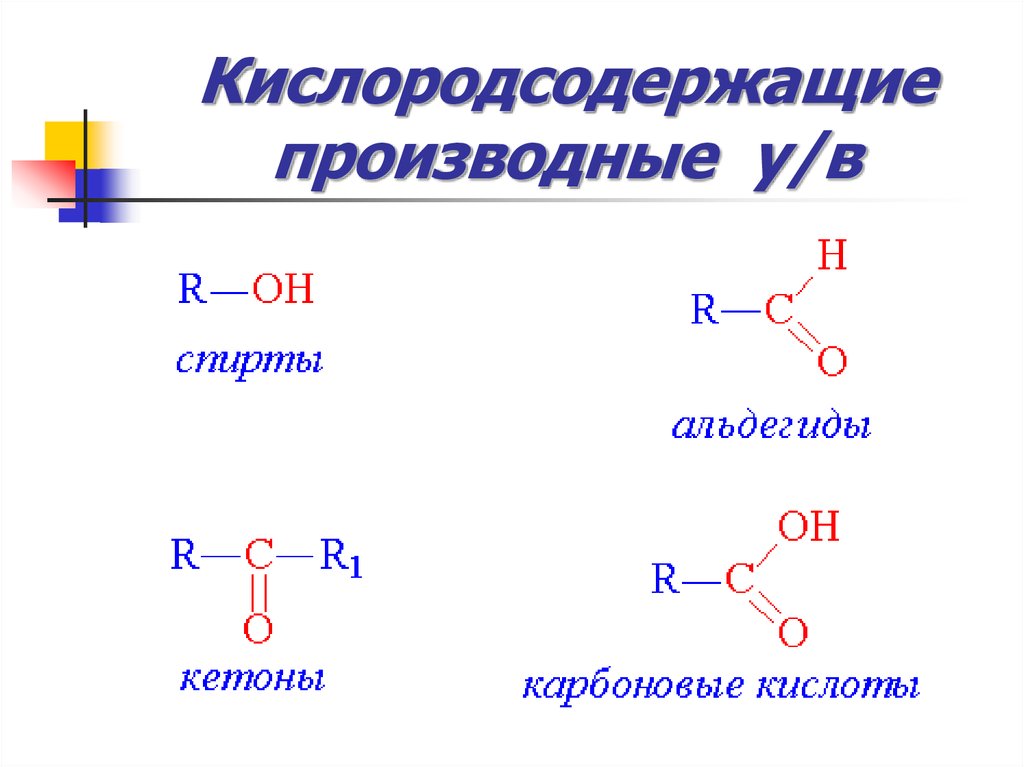
53. Кислородсодержащие производные у/в
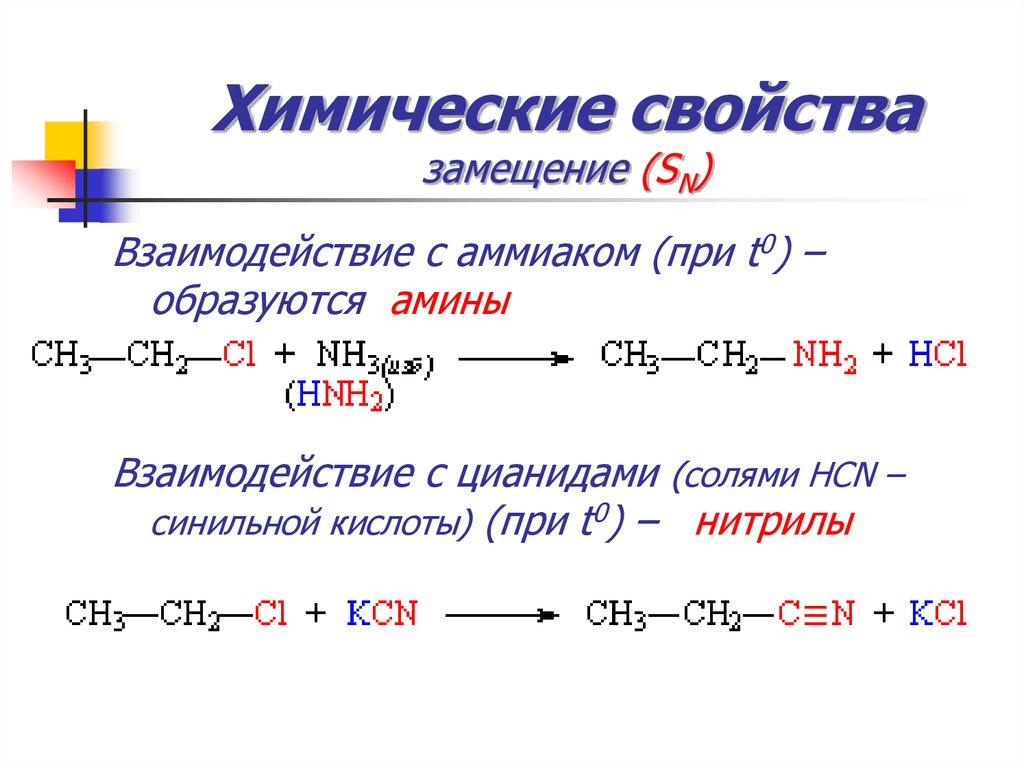
54. Химические свойства замещение (SN)
Взаимодействие с аммиаком (при t0) –образуются амины
Взаимодействие с цианидами (солями HCN –
синильной кислоты) (при t0) – нитрилы
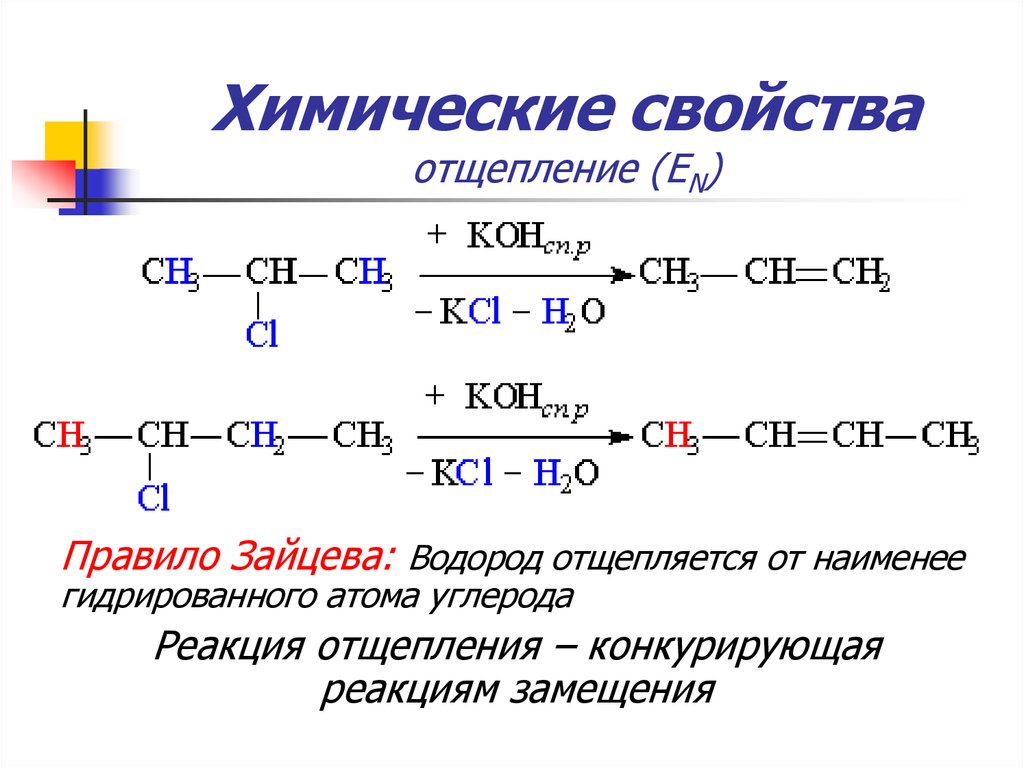
55. Химические свойства отщепление (ЕN)
Задание:Составьте уравнения реакций отщепления
хлороводорода при нагревании со
спиртовым раствором щелочи
А) 2-хлорпропана
Б) 2- хлорбутана
56. Химические свойства отщепление (ЕN)
Правило Зайцева: Водород отщепляется от наименеегидрированного атома углерода
Реакция отщепления – конкурирующая
реакциям замещения
57. Химические свойства окисление
Горят плохо,выделяя ядовитые соединения (!!!)
(например хлороводород HCl),
или не горят вовсе.
Качественная реакция на Сl, Br, I:
Окрашивание пламени в зеленый цвет
медной проволочкой, смоченной в
галогенпроизводном
58. Получение
Из алканов и циклоалкановИз алкенов и алкинов
Из аренов
Из спиртов
Из альдегидов и кетонов
59. Применение
Анестезия С2H5Cl и наркоз CF3CHClBr(ранее СНCl3) и др.
Растворители CCl4 , CH2ClCH2C и др.
Фреоны (хладагенты) CF2Cl2 и др.
Антисептик СНI3
Тушение пожаров CCl4 и др.
Полимеры из СН2=СН-Сl, СF2=СF2 и др.
Ядохимикаты: гексахлоран, ДДТ и др.
и др.
60. Получение
Задание: Составьте уравнения возможных реакцийобразования моно- и дихлорпроизводных из
Пропана
Пропилена
Ацетилена
Бензола
Циклогексана
Циклопропана
Толуола
Стирола




































 Химия
Химия