Похожие презентации:
Протолитическое равновесие в водных и неводных растворах
1.
ЛЕКЦИЯ:ПРОТОЛИТИЧЕСКОЕ
РАВНОВЕСИЕ В
ВОДНЫХ И
НЕВОДНЫХ
РАСТВОРАХ.
2.
В 1923г датский ученый Бренстед ианглийский ученый Лоури
разработали
протонную (протолитическую)
теорию кислот и оснований,
согласно которой кислота – это атом,
молекула или ион, способные
отдавать протон водорода (Н+), донор
протонов, а основание - это атом,
молекула или ион, способные
принимать протон водорода, акцептор
(Н+) протонов.
3.
Кислотные свойства соединенийпроявляются лишь в
присутствии оснований, а
основные свойства лишь в
присутствии кислот. От кислоты
к основанию переходит Н+ такие реакции называются
протолитическими, а
равновесия в системе с
переносом Н+ называются
протолитические равновесия.
4.
Кислота, отдавая Н+,превращается в основание,
которое называется
сопряженным.
+
Н
СН3СООН + Н2О ↔ СН3СОО- + Н3О+
кислота
основание
с.о
с.к
5.
Три типа кислот и оснований:Нейтральные: кислоты (HCl, H2SO4, H3PO4)
основания (NH3, H2O, C2H5OH)
Катионные:
кислоты (NH4+, H3O+,)
основания(-NH3+, NH2+)
Анионные:
кислоты (HSO4-, H2PO4-)
основания (Cl-, СН3СОО-, ОН-)
6.
Типы протолитических реакций:Автопротолиз, сольволиз (самоионизация)
Н2О + Н2О ↔ ОН- +
к
о
с.о.
Н 3 О+
с.к.
СН3СООН+СН3СООН↔СН3СОО-+СН3СООН2+
к
о
с.о
с.к
ацетат ион ион ацетония
7.
Реакции ионизацииНСN + Н2О ↔ Н3О+ + СNк
о
с.к
с.о
NH3 + Н2О ↔ NH4+ + ОНо
к
с.к
с.о
8.
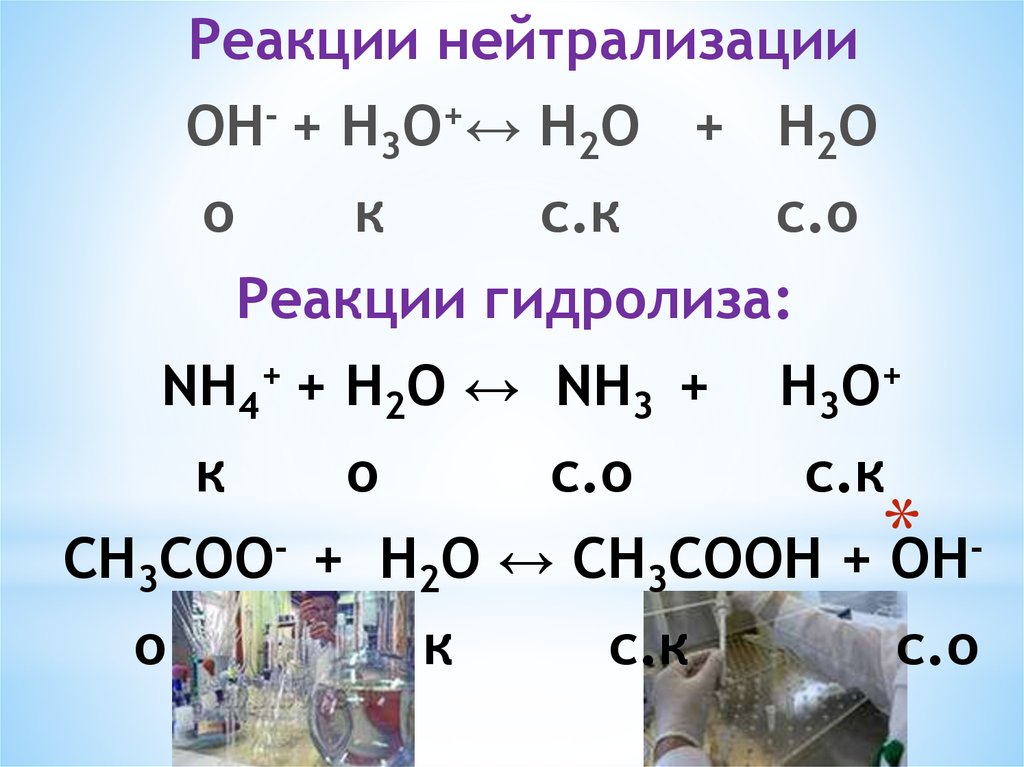
Реакции нейтрализацииОН- + Н3О+↔ Н2O + Н2O
о
к
с.к
с.о
Реакции гидролиза:
NH4+ + Н2O ↔ NH3 +
к
о
с.о
Н3О+
с.к
СН3СОО- + Н2O ↔ СН3СООН + *
ОН-
о
к
с.к
с.о
9.
Протолитические кислотно-основныеравновесия могут иметь место не только в
Н2O, но и в других растворителях, например
в жидком аммиаке:
СН3СООН + NH3 ↔ СН3СОО- + NH4+
к
о
с.о
с.к
в безводном НF:
С2Н5ОН +
НF ↔ С2Н5ОН2+ + Fо
к
с.к
с.о
Недостаток теории Брендстеда-Лоури:
не применима к веществам, не
содержащим Н+(галогенидам бора,
алюминия, кремния, олова).
10.
Поэтому более общей являетсяэлектронная теория кислот и оснований
Льюиса, согласно которой:
Кислота - вещество, принимающее
электронные пары - акцептор электронов;
Основание - вещество, поставляющее
электроны для образования химической
связи - донор электронов.
Взаимодействие между ними заключается в
образовании химической донорноакцепторной связи.
А↑↓ + В ↔ А↑↓В
основ
кисл
ОН-↑↓ + Н+ ↔ НО↑↓Н
11.
Н\Н\
Н - N: + НCI → Н - N : НCI
Н/
Н/
основ. кислота
Н3С \
Н3С - N : + BCI3 → (Н3С)3N: BCI3
Н3С /
основ.
кислота
Теория Льюиса рассматривает
разные химические процессы:
реакцию нейтрализации,
взаимодействия аминов с галогенами
бора, комплексообразование.
12.
К основанием Льюиса относятсяCI-; NH3; амины,
кислородсодержащие
органические соединения R2CO.
К кислотам Льюиса: галогениды
бора, алюминия, кремния, олова.
Рассмотренные теории ионизации
кислот и оснований не
противоречат, а дополняют друг
друга и имеют глубокую
внутреннюю связь.
13.
Ионизация воды. Водородный игидроксильный показатели.
Константа автопротолиза.
Вода ведет себя как амфолит, согласно теории
Бренстера-Лоури
Н2O+Н2O↔Н3О++ОН- + 56,5КДж/моль
Кравн= [Н3О+] [ОН-] / [Н2O]2 = 1,8 10-16 моль/л
Н2O-слабый электролит, поэтому [Н2O] = const
Кравн[Н2O]= [Н3О+] [ОН-] – закон действующих масс
Ионное произведение:
К(Н2O) = Кw= [Н3О+] [ОН-]
где К(Н2O) - const (константа автопротолиза)
К(Н2O) = 1·10-14
14.
Возьмем 1кг (л) воды[Н2O]=1000г/18г/моль=55,5моль/л
К(Н2O) = 1,86 10-16 55,5=1·10-14
В чистой воде [Н3О+] = [ОН-] = 1·10-7
- раствор нейтральный
В присутствии посторонних электролитов
это равенство не соблюдается, а
[Н3О+] и [ОН-] можно рассчитать:
[Н3О+] = К(Н2O)/[ОН-];
[ОН-] = К(Н2O) /[Н3О+]
Если [Н3О+] > [ОН-], то реакция среды в
растворе кислая [Н3О+] >1 10-7, а для
случая, когда[Н3О+] < [ОН-]
щелочная [Н3О+] < 1 10-7
15.
Для удобства расчетов используют значение:рН = - lg[Н3О+] - водородный показатель
рОН= - lg[ОН-]-гидроксильный показатель
т.к. К(Н2O) = 1∙10-14
Прологарифмируем и умножим на -1:
- lg К(Н2O) = - lg[Н3О+] – lg[ОН-]
- lg 1 10-14 = - lg[Н3О+] - lg[ОН-]
14 = pH + pOH
рН определяют с помощью индикаторов,
более точное определение с помощью
потенциометров.
рН < 7 (среда кислая),
рН > 7 (среда щелочная),
рН = 7 (среда нейтральная)
16.
Расчет рН сильных электролитов.В растворах сильных электролитов рН
кислот и оснований зависит от
концентрации кислоты и основания:
[Н+] = C(1/z кислоты)
[ОН-] = C(1/z основания)
Например, рассчитать рН 0,1 моль/л р-ра
НСl:
[Н+] = C(НСl) = 0,1 моль/л рН = - lg 0,1 = 1
рОН = 14 – рН = 14 – 1 = 13
Рассчитать рН 0,01 моль/л р-ра NаОН:
[ОН-] = C(NаОН) = 0,01 моль/л
рОН = - lg 0,01 = 2
рН = 14 – рОН = 14 – 2 = 12
17.
В растворах слабых кислот:НА ↔ Н+ + А- или
НА + Н2О ↔ А- + Н3О+
-lg[Н3О+]= -1/2·lgК(НА)- 1/2·lgC(1/zНА)
рН = 1/2·рК(НА) - 1/2·lgC(НА)
Например, чему равен
водородный показатель 0,1моль/л
р-ра НСN?
рН = 1/2·рК(НСN) - 1/2·lgC(НСN)
рН = 1/2·9,3 - 1/2·lg 0,1 =
4,65 + 0,5 = 5,15
18.
Расчет рН слабых оснований:В + Н2О ↔ ВН+ + ОНрОН = 1/2рК(В)- 1/2lgC(1/z В)
рН = 14 - рОН
рН = 14 - 1/2рК(В) + 1/2lgC(1/z В)
Например, чему равен водородный
показатель 0,01моль/л р-ра
гидроксида аммония?
NН3 + Н2О ↔ NН4ОН + ОНрН = 14 - 1/2рК(NН3) + 1/2lg C(NН3)
рН = 14 - 1/2·4,76 + 1/2lg 0,01 =
14 – 2,38 – 1 = 10,62
19.
БУФЕРНЫЕ СИСТЕМЫБуферные системы - это равновесные
системы, способные сохранять постоянное
значение рН при добавлении к ним
небольших количеств сильных кислот и
оснований, а также при разбавлении.
Свойство растворов сохранять
определенное значение рН называется
буферным действием. К буферам 1 типа
относятся протолитические системы
растворов слабых кислот и их солей с
сильными основаниями или, смеси
растворов солей многоосновных кислот
различной степени замещения.
20.
Например, буферные смеси примолярном соотношении 1:1.
НСООН + НСООNa
формиатная, рН=3,8
СН3СООН + СН3СООNa
ацетатная, рН=4,7
Na2НРО4 + NaН2РО4
фосфатная, рН=6,6
Н2СО3 + NaНСО3
карбонатная, рН=6,4
21.
К буферам 2 типа относятсяпротолитические системы слабых
оснований и их солей с сильными
кислотами. Например,
NН4ОН + NН4Cl
аммиачная, рН=9,25 (при молярном
соотношении 1:1)
Буферным действием могут обладать
растворы, состоящие из анионов разных
слабых кислот, например, фосфатцитратный буфер
Na2НРО4 - С6Н8О7
22.
Способность буферных системподдерживать постоянство рН при
добавлении к ним небольших
количеств сильной кислоты или
сильного основания основана на том,
что одна составная часть буферной
системы может взаимодействовать с
ионами (Н3О+) добавляемой кислоты, а
другая с ионами (ОН-) прибавляемого
основания. Вследствие этого
буферная система способна
сохранить постоянство величины рН.
23.
МЕХАНИЗМ ДЕЙСТВИЯ БУФЕРНЫХ СИСТЕМНапример: если к ацетатной буферной
системе прилить сильную кислоту
(НCl;Н2SО4), то произойдет реакция между
ацетат ионами и ионом гидроксония
кислоты, что можно выразить уравнением:
СН3СООNa + НСl → СН3СООН + NaCl
СН3СОО- + Н3О+ → СН3СООН + Н2О
Сильная хлороводородная кислота
замещается слабой уксусной кислотой,
посылающей в раствор ничтожно малое
количество ионов гидроксония.
24.
При добавлении к ацетатнойбуферной смеси сильной щелочи
(NaОН; КОН) пойдет реакция
нейтрализации уксусной кислоты
сильным основанием:
СН3СООН+NaОН→СН3СООNa+Н2О
СН3СООН+ОН- → СН3СОО-+ Н2О
В аммиачной буферной системе
протекают следующие реакции:
NН4ОН + НСl → NН4Сl + Н2О
NН4Сl + KОН → NН4ОН + КCl
25.
РАСЧЕТ РН БУФЕРНЫХ СИСТЕМНа примере ацетатной буферной системы:
СН3СООН/СН3СООNa
СН3СООН+ Н2О → СН 3СОО- + Н3О+
В соответствии с законом действующих масс:
[ Н3О+]·[ СН3СОО−]
К(СН3СООН) =
[СН3СООН]
К(СН3СООН)·[СН3СООН]
+
Откуда, [Н3О ] =
[ СН3СОО−]
Уксусная кислота присутствует в буферном
растворе в смеси с ацетатом натрия в виде
недиссоциированных молекул, т.к. ацетат натрия
подавляет ее диссоциацию. Поэтому
концентрацию уксусной кислоты можно принять
равной общей молярной концентрации кислоты в
растворе, т.е. [СН3СООН] = С(СН3СООН)
26.
Концентрацию анионов уксусной кислотыможно принять равной концентрации соли,
т.к. [СН3СОО-] = С(СН3СООNa), т.к. ацетат
натрия сильный электролит,
диссоциирующий в растворе полностью.
Приняв эти обозначения получим:
[Н3О+]
К(СН3СООН)·С(СН3СООН)
=
С(СН3СООNa)
Логарифмируя полученное уравнение и
заменяя знаки логарифма на обратные,
запишем:
С(СН3СООН)
+
-lg[Н3О ]= −lgК(СН3СООН) − lg
С(СН3СООNa)
27.
-lg [Н3О+] = рН−lgК(СН3СООН) = рК (СН3СООН)
С(СН3СООН)
рН = рК(СН3СООН) − lg
С(СН3СООNa)
Для буферных систем 1 типа:
С(кислоты)
рН = рК(кислоты) − lg
С(соли)
Изменяя отношения концентрации
кислоты и соли можно получить серию
буферных систем с различной
величиной рН.
28.
Расчет рН буферной системы 2 типа.Для примера возьмем аммиачную буферную
систему, представляющую собой смесь
гидроксида аммония и хлорида аммония.
Запишем уравнение константы основности
для гидроксида аммония в аммиачной
буферной системе:
NН4ОН/NН4Сl
NН3 + Н2О → NН4+ + ОН[NН4+]·[ОН−]
К(NН4ОН) =
[NН3]
[NН3] = С(NН4ОН)
[NН4+] = С(NН4Сl)
29.
С(NН4Сl)·[ОН−]К(NН4ОН) =
С(NН4ОН)
К(NН4ОН)·С(NН4ОН)
[ОН ] =
С(NН4Сl)
Логарифмируем, умножаем на -1:
С(NН4ОН)
-lg[ОН ] = - lg К(NН4ОН) – lg
С(NН4Сl)
С(NН4ОН)
рОН = рК(NН4ОН) – lg
С(NН4Сl)
С(NН4ОН)
рН = 14 - рК(NН4ОН) + lg
С(NН4Сl)
30.
Расчет рН для буферных систем 2 типа:С(основания)
рН = 14 - рК(основания) + lg
С(соли)
Буферный раствор поддерживает
рН только при условии, что количество
прибавляемых к раствору сильной кислоты,
сильного основания не превышает
определенной величины.
Предел, в котором проявляется буферное
действие, называется
БУФЕРНОЙ ЕМКОСТЬЮ.
31.
Буферную емкость выражают количествомэквивалента сильной кислоты или
сильного основания, которое следует
добавить к 1 литру буферного раствора,
чтобы сместить рН на единицу.
С(1/z х)·


































 Химия
Химия








