Похожие презентации:
Валентность и степень окисления
1. Тема лекции Валентность и степень окисления
2.
Формы существованияхимического элемента
Свободные
атомы
Простые
вещества
Сложные
вещества
3.
Из атомов мир создавалаПрирода.
Два атома лёгких взяла
водорода.
Прибавила атом один
кислорода.
И получилась частица …
4.
Н2 ОПочему такой состав
имеет молекула
воды?
5. Задачи урока:
1. выяснить, от чего зависитсостав сложных веществ;
2.что необходимо знать,
чтобы составить формулы
веществ.
6. Степень окисления
Степень окисления (с.о.)- этоусловный заряд, который мог
бы возникнуть на атоме при
условии, что все общие
электронные пары смещены к
более электроотрицательному
элементу.
7. Правила определения степеней окисления
У свободных атомов и у простых веществСТЕПЕНЬ ОКИСЛЕНИЯ равна 0
Металлы во всех соединениях имеют
ПОЛОЖИТЕЛЬНУЮ С.О.
В соединениях кислород имеет С.О.-2
(кроме Н2О2 , К2О2, ОF2 )
В соединениях с неметаллами у водорода
С.О.+1, а с металлами -1
В соединениях сумма всех С.О. равна 0
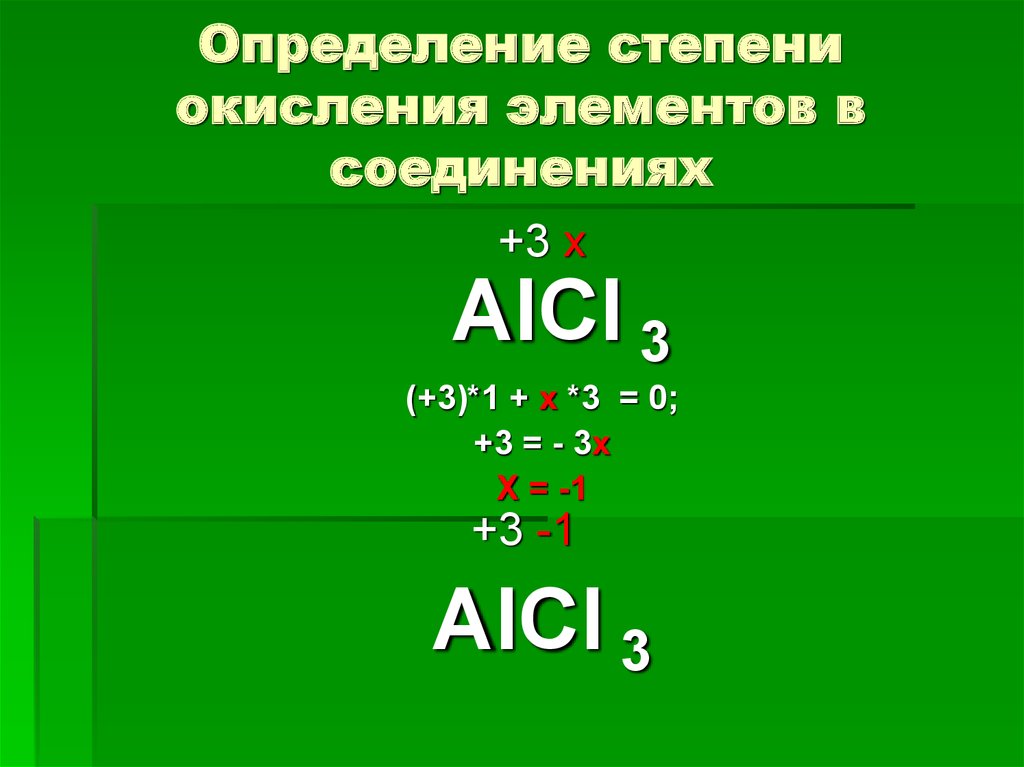
8. Определение степени окисления элементов в соединениях
+3 хАlСl 3
(+3)*1 + х *3 = 0;
+3 = - 3х
Х = -1
+3 -1
АlСl 3
9.
1. Определите валентность элементов поструктурной формуле.
2. Внесите значение валентности
элементов в таблицу.
Валентность
Степень окисления
Н
О
Са
Аl
С
10. Сравнение понятий валентность и степень окисления
ВалентностьН
О
Са
Аl
С
Степень окисления
I
II
II
III
II, IV
Н +1, -1
О -2
Са +2
Аl +3
С +2, +4, -4
CI I, III, V,VII
CI ? ? ? ? ?
11.
Как правило, в записи степени окисления знаки «+» и «-»ставятся перед цифрой, указывающей величину заряда.
Например, Ca+2O-2, Al+3I-13.
Ионы – положительно или отрицательно заряженные
частицы. Заряд иона в отличие от степени окисления
существует, например, в растворах. Если в воде
растворить всем нам известную соль — хлорид натрия,
то в результате произойдет его диссоциация, с
образованием ионов Na+ и Cl-. Единичный заряд иона
обозначается только знаками «+» или «-», а при записи
многозарядного иона цифры стоят перед знаками (в
отличие от степени окисления). Например, Ba2+S2-.
Кроме этого, ионы могут состоять из группы атомов,
например, NO3-, CH3COO-.
Примеры: степени окисления атомов в серной кислоте
H2+1S+6O4-2, а заряды ионов H2+SO42-; степени окисления
атомов в карбонате кальция Ca+2C+4O3-2, а заряды ионов
Ca2+CO32-.










 Химия
Химия








