Похожие презентации:
Реакции ионного обмена
1. Реакции ионного обмена
Прокопенко Наталья Федоровнаучитель химии
МОУ СОШ №7 г. Колпашевa
2. Цели и задачи
Цель: развитие знаний обучающихся онеобратимых реакциях на примере
реакций ионного обмена (РИО) и условий
их протекания
Для достижения поставленной цели
требуется решить следующие задачи:
ознакомиться с РИО
изучить экспериментально условия протекания
РИО
закрепить полученные знания
3. Основные понятия
Реакция называется необратимой, еслиодин из продуктов реакции является
нерастворимым, газообразным или
малодиссоциирующим веществом
Реакция называется обратимой, если не
происходит связывания ионов в
нерастворимые, газообразные или
малодиссоциирующие вещества
4. Основные понятия
Реакциями ионного обмена называютсяреакции, протекающие между ионами в
растворах электролитов
Сущность РИО заключается в связывании
ионов электролитов в нерастворимые,
газообразные и малодиссоциирующие
вещества
Реакции ионного обмена являются
необратимыми
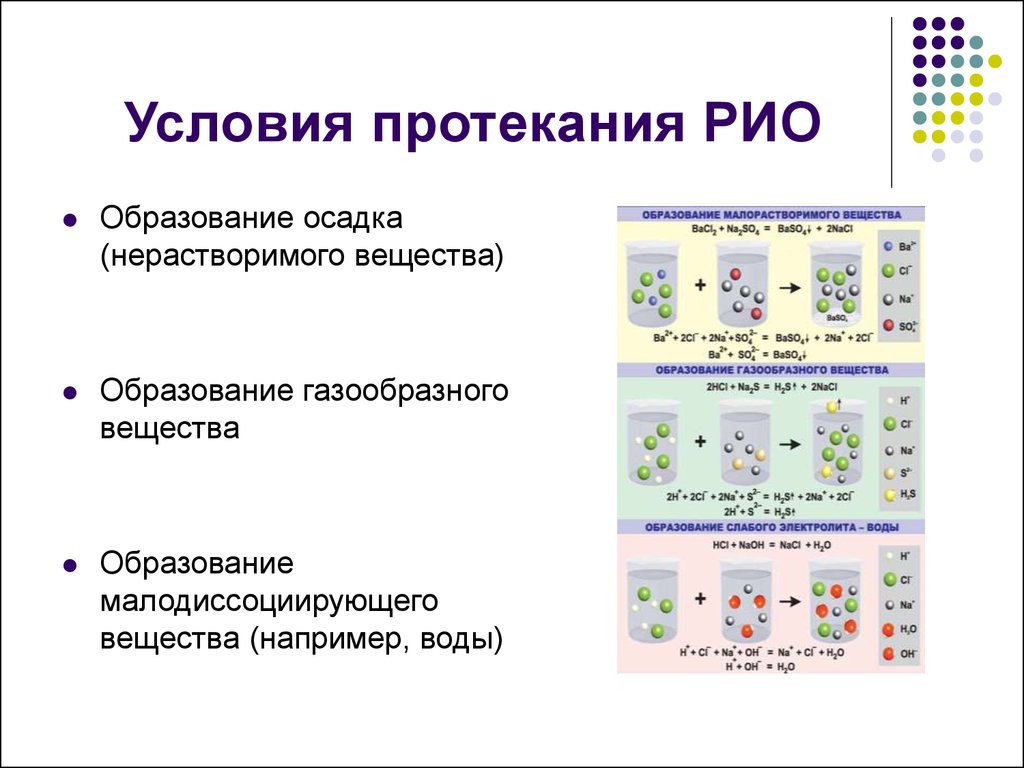
5. Условия протекания РИО
Образование осадка(нерастворимого вещества)
Образование газообразного
вещества
Образование
малодиссоциирующего
вещества (например, воды)
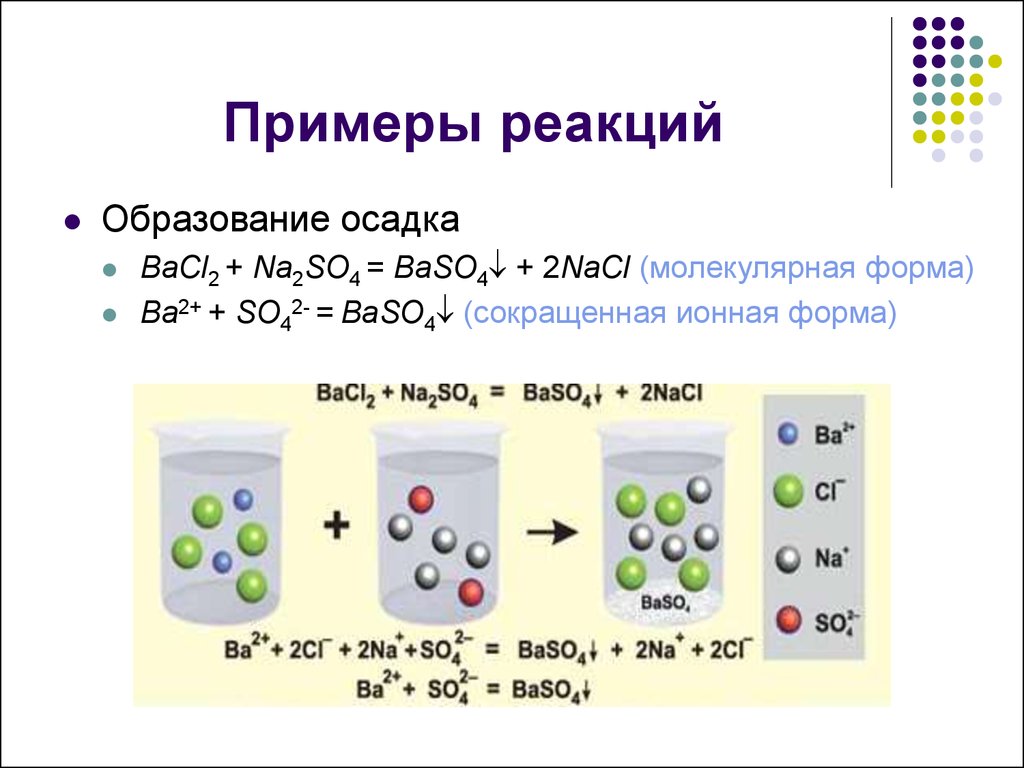
6. Примеры реакций
Образование осадкаBaCl2 + Na2SO4 = BaSO4 + 2NaCl (молекулярная форма)
Ba2+ + SO42- = BaSO4 (сокращенная ионная форма)
7.
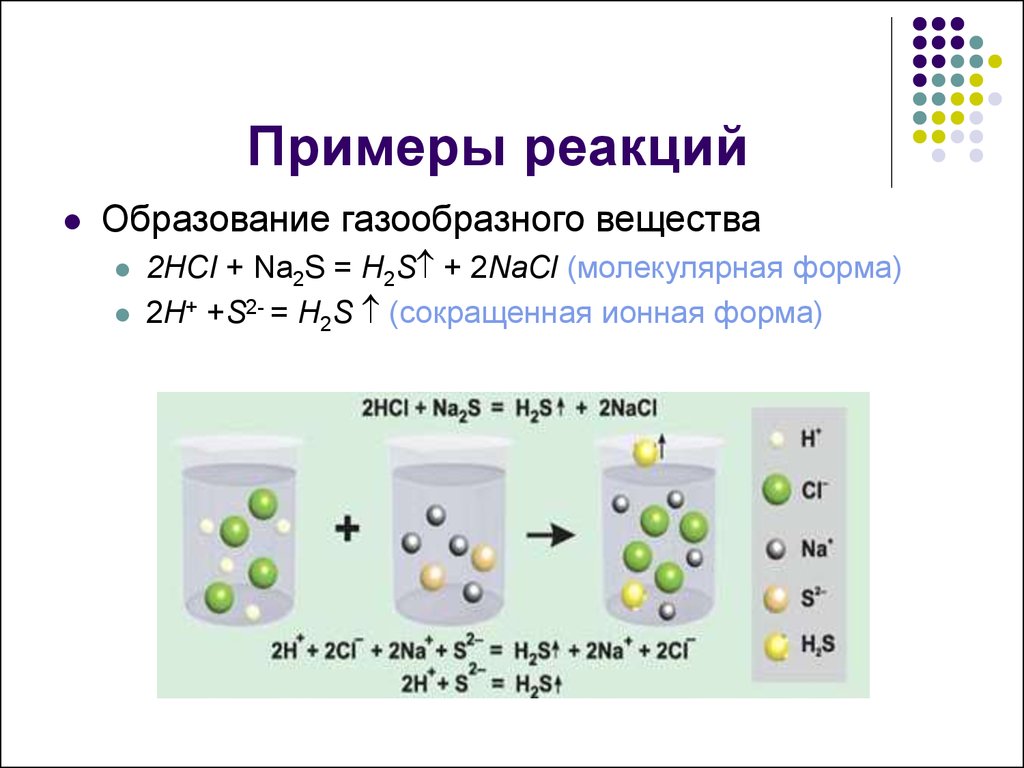
Примеры реакцийОбразование газообразного вещества
2HCI + Na2S = H2S + 2NaCl (молекулярная форма)
2H+ +S2- = H2S (сокращенная ионная форма)
8.
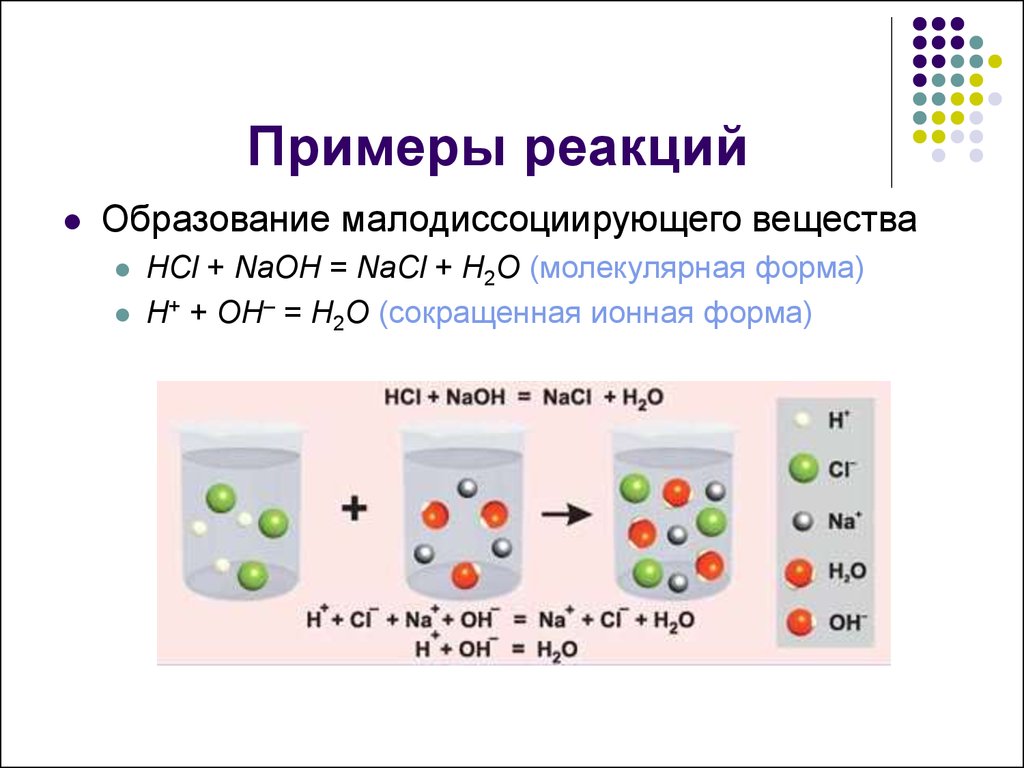
Примеры реакцийОбразование малодиссоциирующего вещества
HCl + NaOH = NaCl + H2O (молекулярная форма)
H+ + OH– = H2O (сокращенная ионная форма)
9. Примеры заданий для самостоятельной работы
Какие из перечисленных реакций относятсяк РИО? Ответ обоснуйте
AgNO3 + NaCl = AgCl + NaNO3
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Na2CO3 + 2HCl = 2NaCl + CO2 +H2O
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3
K2S + H2SO4 = K2SO4 + H2S
2KCl + Na2SO4 = 2NaCl + K2SO4
10. Примеры заданий для самостоятельной работы
По схемам сокращенных ионных уравненийсоставить молекулярные и полные ионные
уравнения
2H+ + 2OH- 2H2O
3Ca2+ + 2PO43- Ca3(PO4)2
Pb2+ + S2- PbS
SO32- + 2H+ SO2 + H2O
CO32- + 2H+ CO2 + H2O
Cu2+ +2OH- Cu(OH)2
11. Примерный перечень контрольных вопросов
Какие реакции называются необратимымии обратимыми?
Какие реакции называются реакциями
ионного обмена?
Являются ли реакции ионного обмена
обратимыми?
В чем заключается сущность реакций
ионного обмена?
12. Примерный перечень контрольных вопросов
Приведите примеры реакций ионногообмена в молекулярной и сокращенной
ионной формах
с образованием осадка
с образованием газообразного вещества
с образованием малодиссоциирующего
вещества
13. Рефлексия
С какими новыми понятиями выпознакомились на уроке?
Какие трудности усвоения материала по
данной теме у вас возникли?
Понимание каких реакций ионного обмена
вызвало у вас затруднение?
Что на данном занятии было вам
интересно?










 Химия
Химия








