Похожие презентации:
Тасымалдау құбылысы. Нақты газдар
1.
Қарағанды мемлекеттік техникалық университетіФизика кафедрасы
ФИЗИКА 1
ТАСЫМАЛДАУ ҚҰБЫЛЫСЫ.
НАҚТЫ ГАЗДАР
2.
Дәріс жоспарыЭффективтік диаметр
Тасымалдау құбылысы
Молекуллрдың өзара әсерлесуі
Ван-дер-Ваальс теңдеуі
Ван-дер-Ваальс изотермасы
Фазалық ауысу
Күй диаграммасы
3.
МОЛЕКУЛАНЫҢЭФФЕКТИВТІК ДИАМЕТРІ
Молекуланың
эффективтік диаметрі –
молекулалардың жақындай
алатын минимал
қашықтығы
d
d
- Эффективтік
диаметр
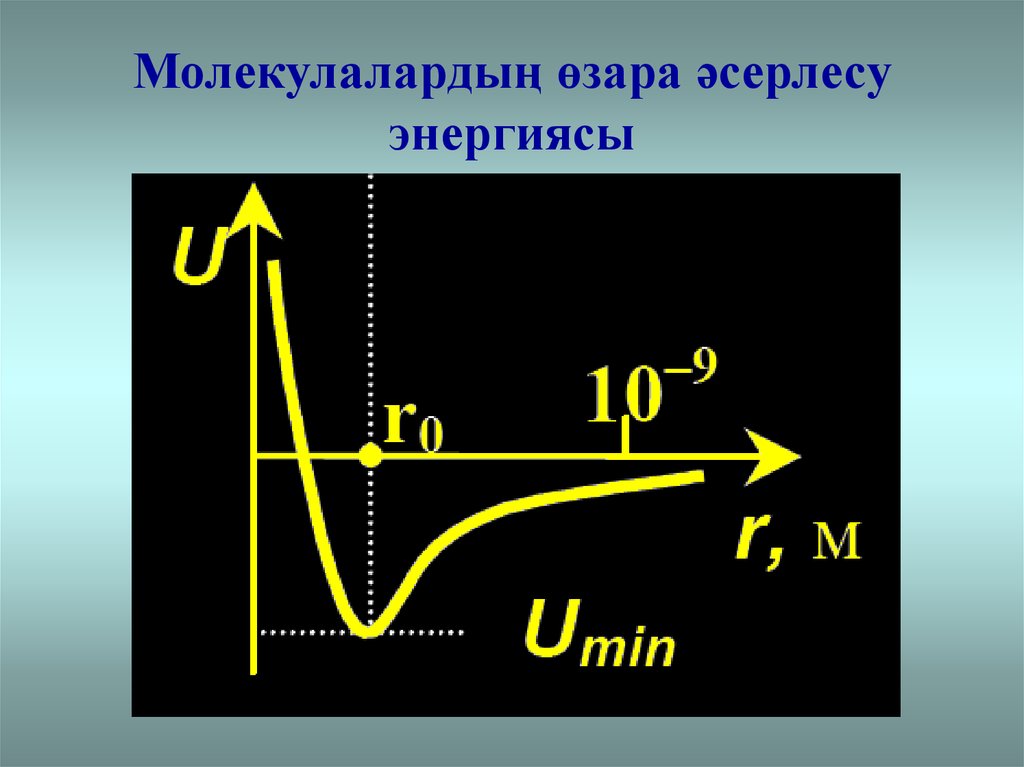
4. Молекулалардың өзара әсерлесу энергиясы
5.
d2
- молекуланың эффективті қимасы
Z
Z
z
- орташа еркін жол ұзындығы
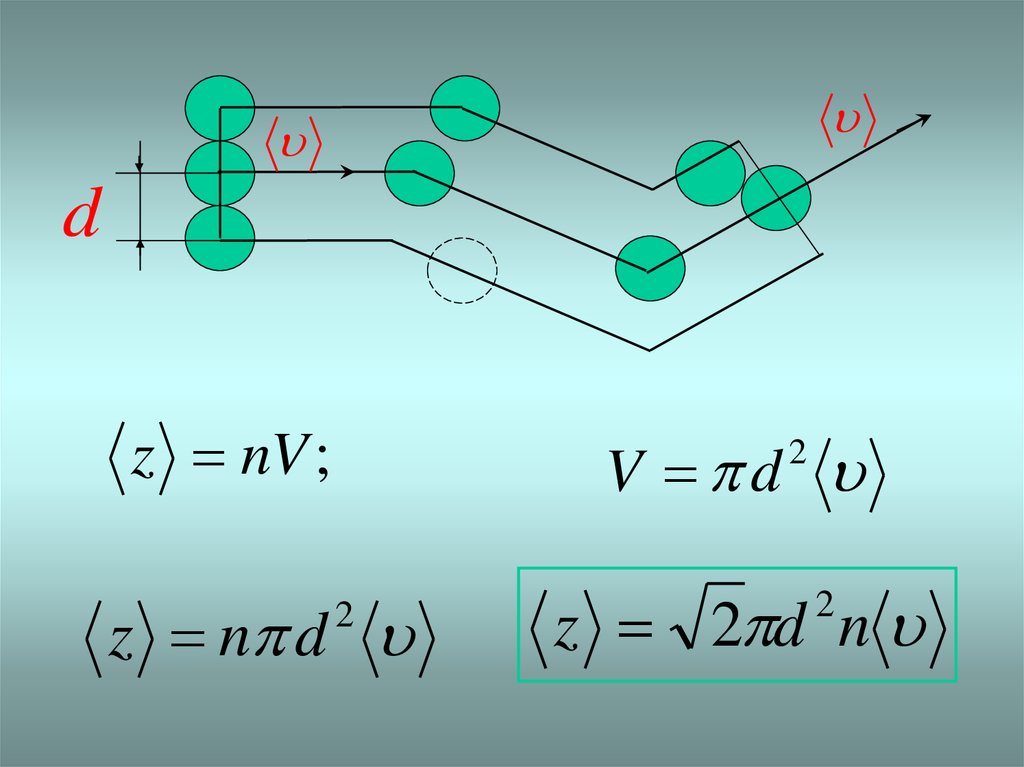
6.
dz nV ;
V d
2
z n d
2
z 2 d n
2
7.
ZZ
2 d n
2
1
2
2 d n
1
2 d n
2
8. Орташа еркін жол ұзындығы
12
2 d n
T const
1
~
n
1
n2 p2
2
n1 p1
1
~
P
9.
Тасымалдау құбылысыДиффузия
dni
dN i D
S ,
dz
d i
dM i D
S ,
dz
Фик заңы
10.
nm1
D
3
M кг / с
-диффузия коэффициенті
d
dx
1 2
D 1м / с
2
x
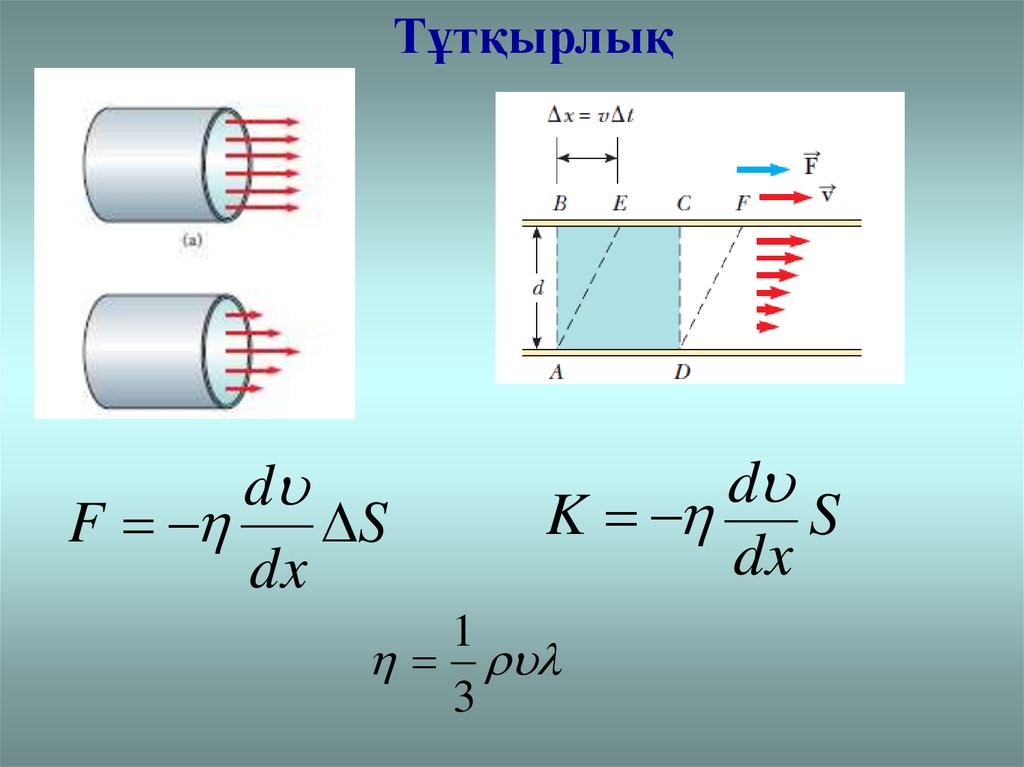
11.
Тұтқырлықd
F
S
dx
d
K
S
dx
1
3
12.
Жылу өткізгіштікT1 T2
dT
dT
q
dS
dx
q - Дж/c
1
cv
3
Вт/м К
13.
Dcv D cv
14.
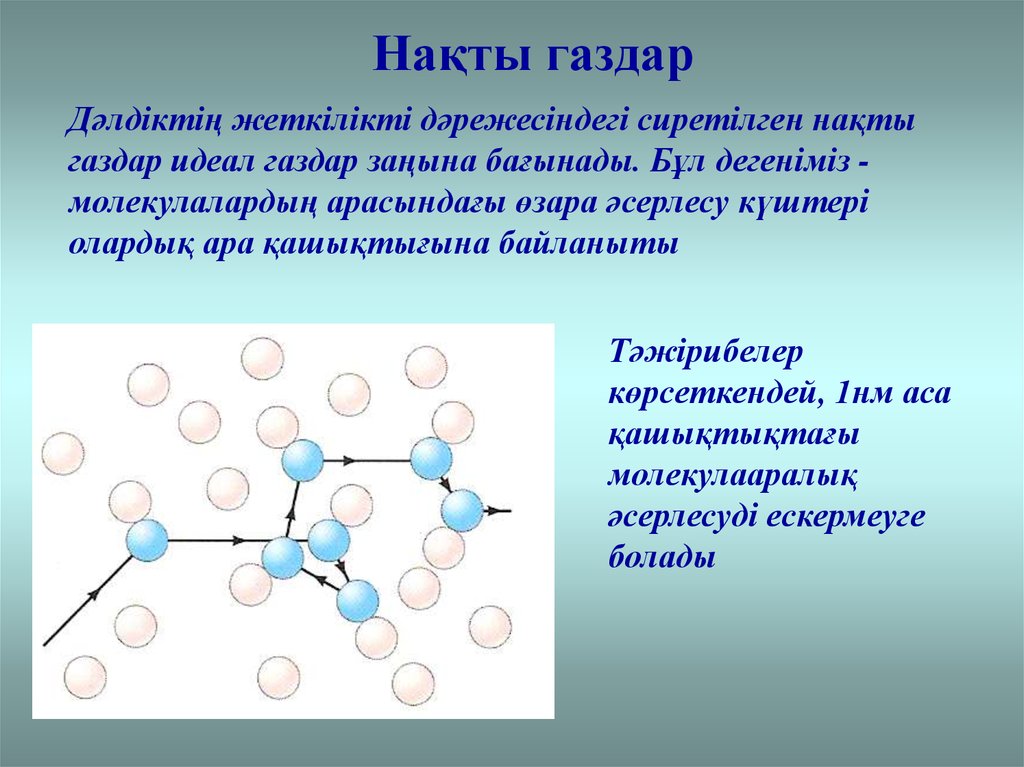
Нақты газдарДәлдіктің жеткілікті дәрежесіндегі сиретілген нақты
газдар идеал газдар заңына бағынады. Бұл дегеніміз молекулалардың арасындағы өзара әсерлесу күштері
олардық ара қашықтығына байланыты
Тәжірибелер
көрсеткендей, 1нм аса
қашықтықтағы
молекулааралық
әсерлесуді ескермеуге
болады
15.
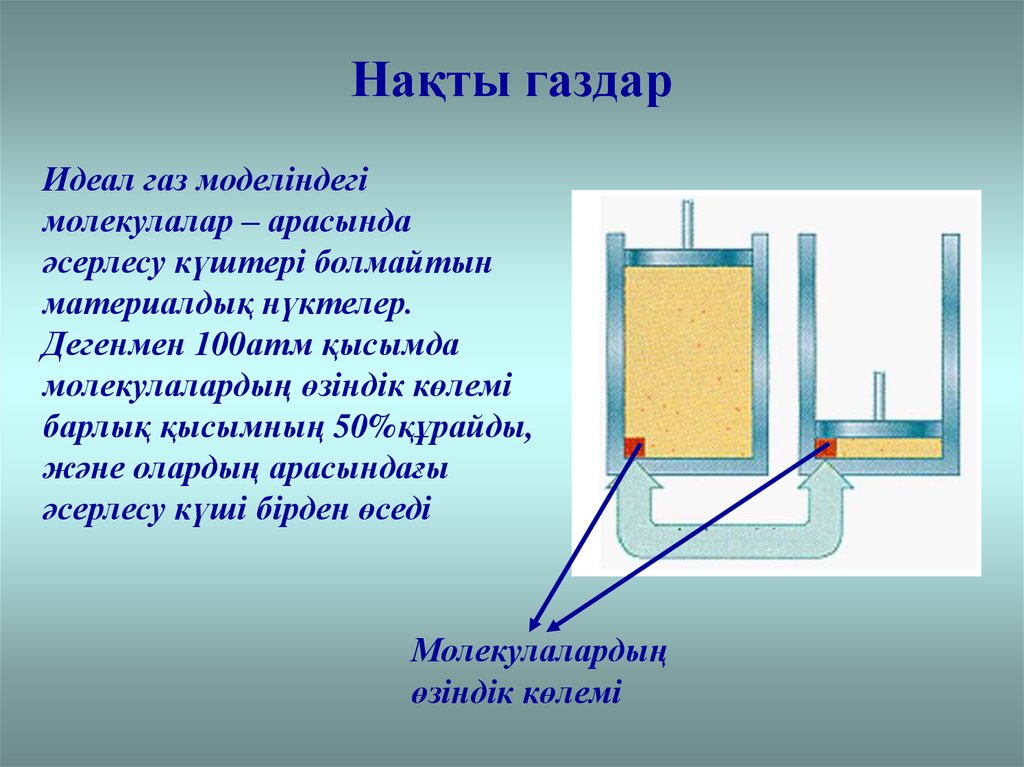
Нақты газдарИдеал газ моделіндегі
молекулалар – арасында
әсерлесу күштері болмайтын
материалдық нүктелер.
Дегенмен 100атм қысымда
молекулалардың өзіндік көлемі
барлық қысымның 50%құрайды,
және олардың арасындағы
әсерлесу күші бірден өседі
Молекулалардың
өзіндік көлемі
16.
Қысым ұлғайғанда сығылғын газ көлемімолекулалардың өздері алатын көлемге теңеседі
17.
Идеал газ күйінің теңдеуі төмен қысымда және жоғарытемпературадағы газдар әрекетін сипаттауға пайдалы.
Идеал газадың берілген күйден ауытқуы сығылу
коэффициентімен Z сипатталады
pV
Z
RT
Егер Z = 1 болса, идеал газ қасиетіне жақын болады
Сығылу коэффициенті Z 1-ден өзгеше болса,солғұрлым идеал
газадан ауытқуы күштірек болады
18.
Кейбір газдар үшін Z=PV/νRT P қысымға тәуелділікграфигі (200K)
Нақты газ
19.
Нақты газдарМолекулалар арасында тартылыс және тебіліс күштері
болады
Тебілу
Тартылу
20.
10 21 ДжU
Ar-Ar
3
Не-Не
2
1
0
1
2
3
4
-1
5
r
10 10 м
-2
Температура:
He үшін ~ 4 K
Ar үшін~ 87 K
21.
Молекулалардың потенциялдық және кинетикалықэнергиялары арасындағы арақатынас агрегаттық
күйлерге бөлу үшін сындық болып табылады
22.
Нақты газ күйінің теңдеуі –Ван-дер-Ваальс теңдеуіНақты газдарда келесі ескерілу керек:
Бөлшектерде өз көлемі болады
Молекулалар арасында тартылыс және тебіліс
күштері бар
pV RT
Идеал газ күйінің теңдеуі
молекулалардың өз көлемі мен олардың әсерлесуі
ескерілетіндей түрлендірілуі қажет
23.
ВАН-ДЕР-ВААЛЬС ТЕҢДЕУІГаздың 1 молі үшін
a
p 2 V b RT
V
Молекулалардың өзара
әсерлесуін ескеру
Молекуланың өз
көлеміне түзетілім
a
p 2 V b RT
V
2
Газдың туынды массасы үшін
24.
Bтұрақтысы молекула өлшеміне байланысты: үлкенмолекула үшін оның мәні де үлкен
a
молекулалар арасындағы тартылыс күшінің
шамасы
25.
ВАН-ДЕР-ВААЛЬСИЗОТЕРМАЛАРЫ
Сындық нүкте
Ван-дер-Ваальса теңдеуі –
3-дәрежеде V қатысты,
сондықтан 3 заттық
түбірі болуы мүмкін
db жеріндегі ұлғаю қысым
ұлғаюымен жүреді, оның
физикалық мағынасы жоқ,
сол себепті бірден ea
секірісі болады
26.
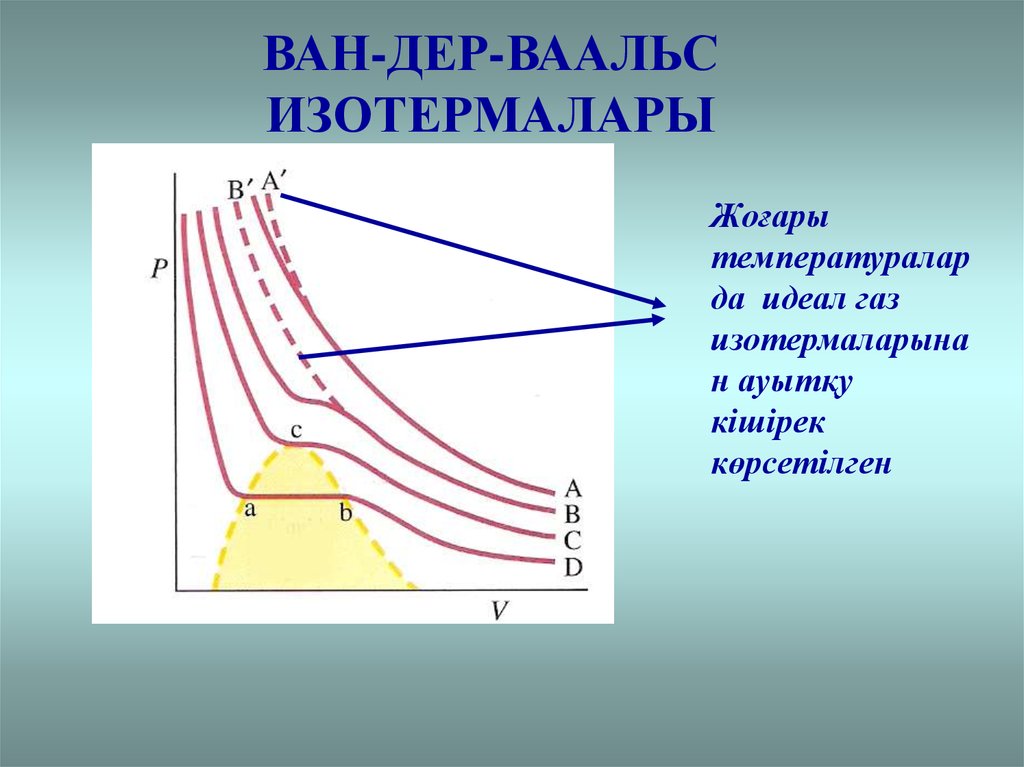
ВАН-ДЕР-ВААЛЬСИЗОТЕРМАЛАРЫ
Жоғары
температуралар
да идеал газ
изотермаларына
н ауытқу
кішірек
көрсетілген
27.
Нақты газдың ішкі энергиясыНақты газдың ішкі энергиясы молекулалардың
кинетикалық ,сондай –ақ потенциалдық
энергияларынан құралады
Газдың 1молі үшін:
a
U CV T
V
Молекулалардың
кинетикалық
энергиясының қосындысы
Молекулалардың
потенциалдық
энергиясының қосындысы
28.
Фазалық ауысуларФаза – химиялық құрамы бірдей және 1
термодинамикалық күйдегі
жүйенің барлық бөліктерінің байланысы
1 реттік фазалық ауысу мысалдары:
•балқу – қату
•булану – конденсация
•Сублимация
2 реттік фазалық ауысу мысалдары:
•ферромагнетиктің парамагнетикке ауысуы және
керісінше. Металдың жоғары өтімді күйге ауысуы
•Сұйық гелийдің аққыштығы жоғары күйге айналуы
29.
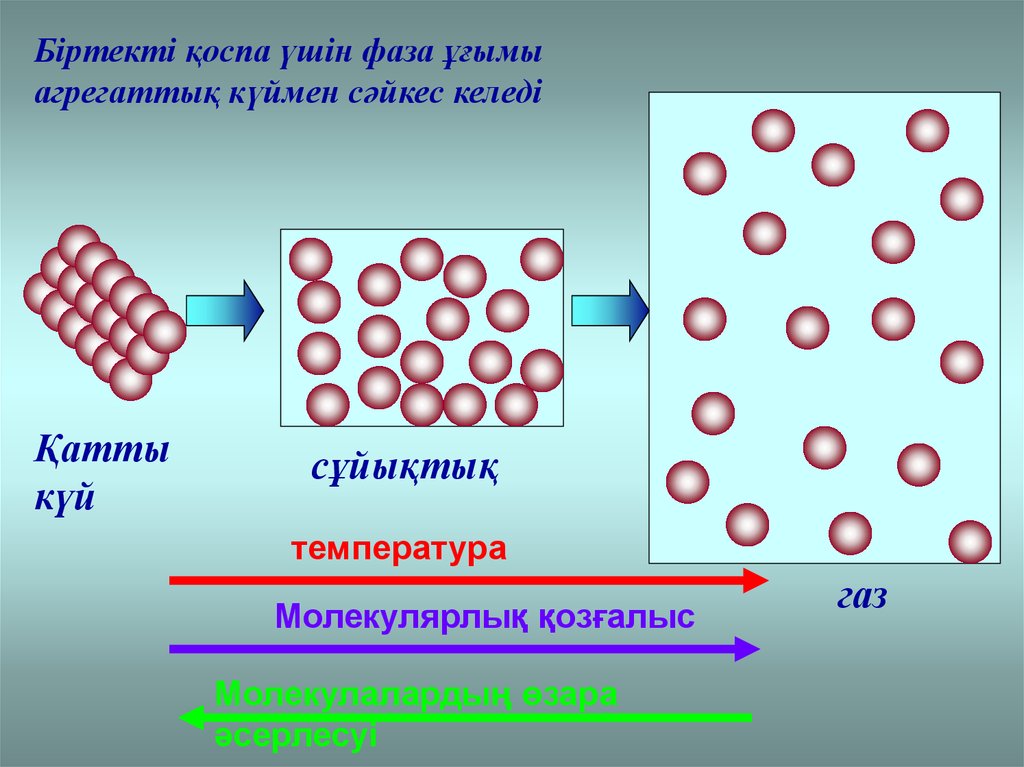
Біртекті қоспа үшін фаза ұғымыагрегаттық күймен сәйкес келеді
Қатты
күй
сұйықтық
температура
Молекулярлық қозғалыс
Молекулалардың өзара
әсерлесуі
газ
30.
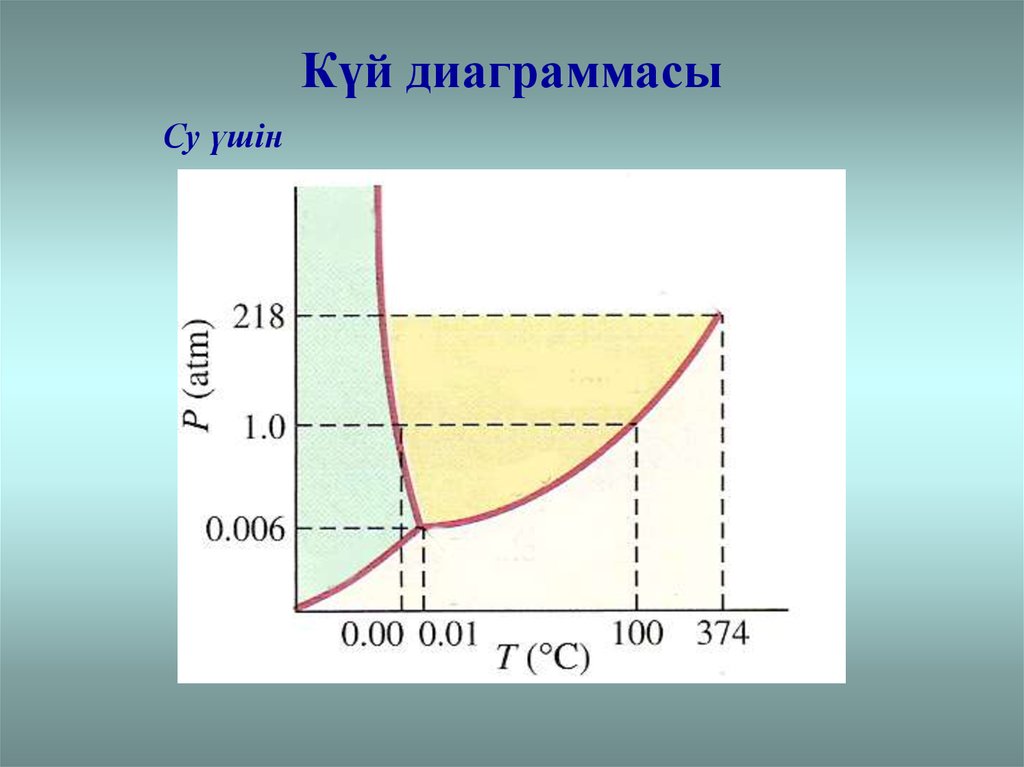
Күй диаграммасыЕгер жүйе біртекті болса, онда фаза ұғымы
агрегаттық күймен сәйкес келеді
Күй диаграммасы –
фазалық ауысудың
температурасы мен қысымы
арасындағы тәуелділік
диаграмманы 3ке бөлетін
қатты ,сұйық,газ шарттарына
сай булану,балқу,сублимация
қисықтары түріндегі графикте
бейнеленген
С
31.
Күй диаграммасыСу үшін
32.
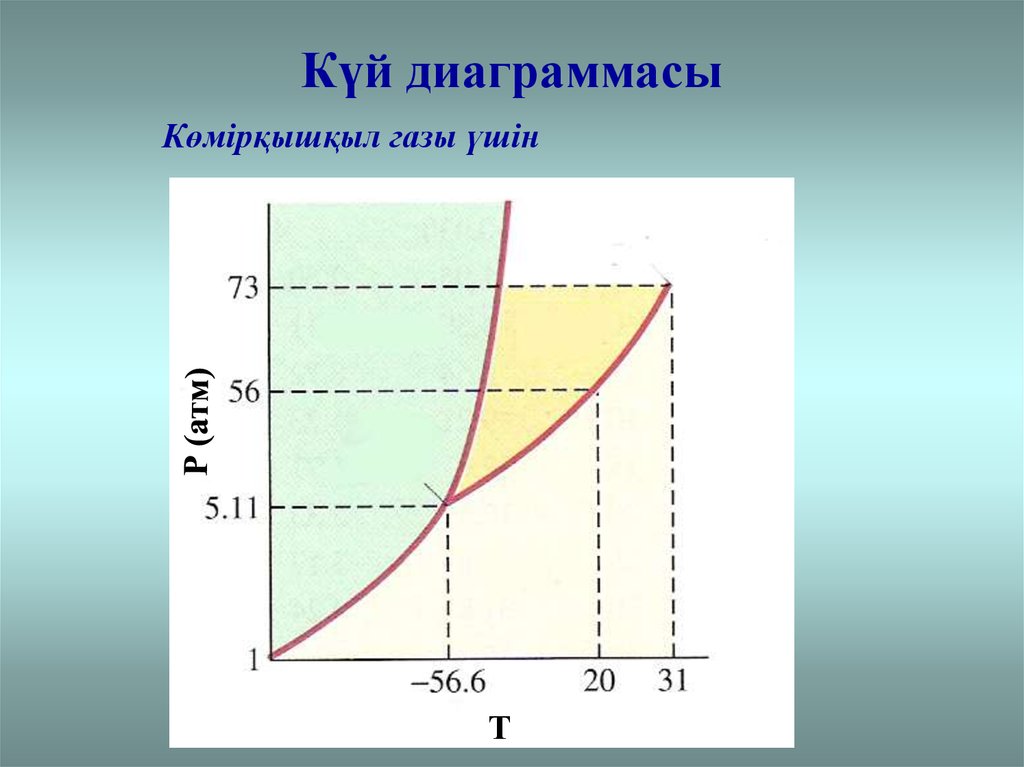
Күй диаграммасыКөмірқышқыл газы үшін
Т
33.
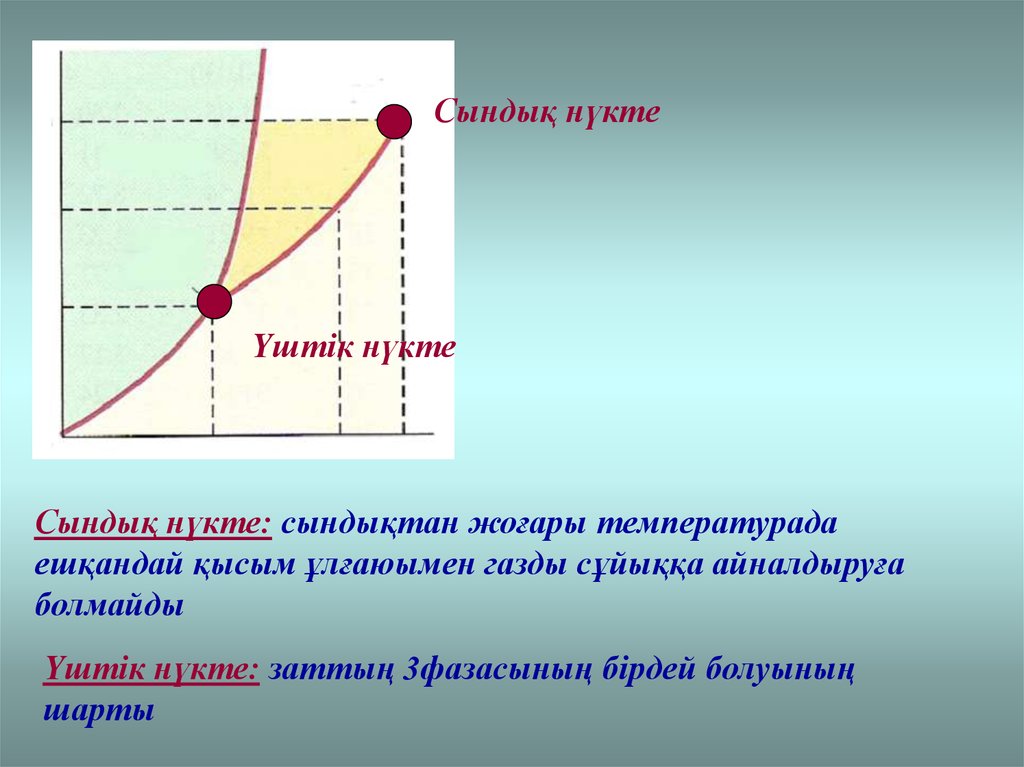
Сындық нүктеҮштік нүкте
Сындық нүкте: сындықтан жоғары температурада
ешқандай қысым ұлғаюымен газды сұйыққа айналдыруға
болмайды
Үштік нүкте: заттың 3фазасының бірдей болуының
шарты
34.
Ван-дер-Ваальс теңдеуіне бағынатын газ үшінкүйлердің сындық шамаларының мәндері
1 a
p
k
2
27 b
Vk 3b
8 a
Tk
27 bR
35.
Назараударғандарыңызға
рахмет!




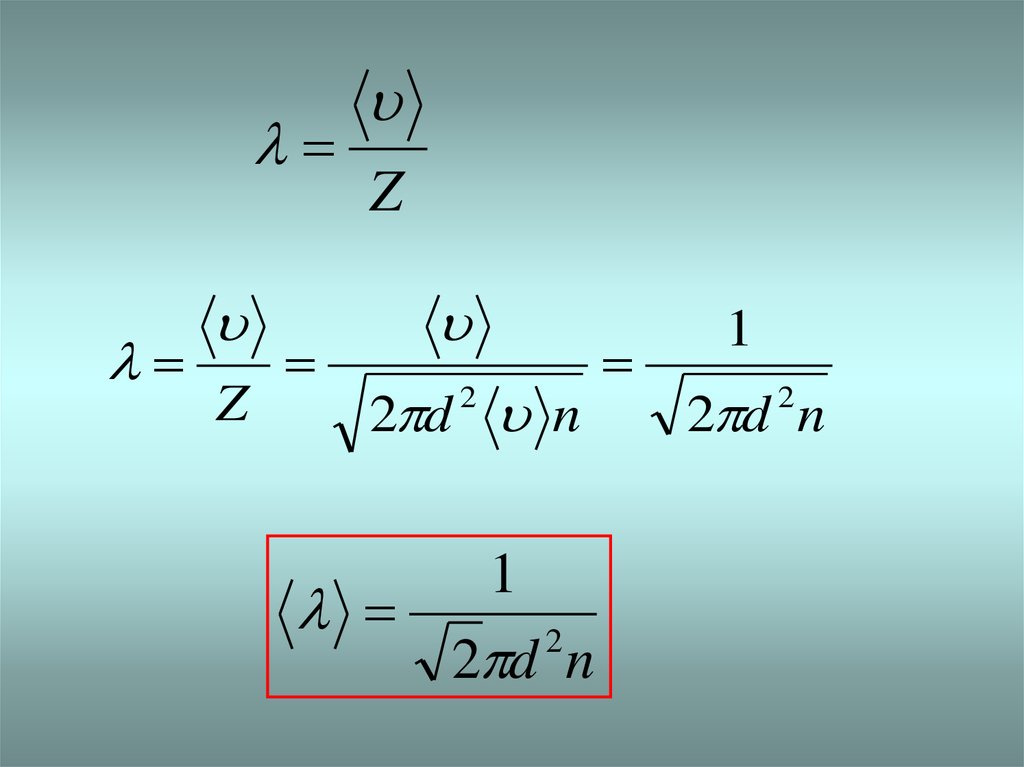




















 Физика
Физика








