Похожие презентации:
Термодинамика негіздері
1.
Қарағанды мемлекеттік техникалық университетіФизика кафедрасы
ТЕРМОДИНАМИКА
НЕГІЗДЕРІ
2.
Дәріс жоспары1. Идеал газдың ішкі энергиясы Газдың
ұлғаю жұмысы
2. Термодинамиканың бірінші заңы
3. Жылусыйымдылқ теориясы
4. Карно циклы және оның ПӘК
5. Энтропия. Энтропииның ықтималды
салыстырмалы күйімен байланысы
Термодинамиканың екінші заңы және
оның физикалық мәні
3.
Идеал газдың ішкі энергиясыИдеал газдың ішкі
энергиясы оның
молекулаларының
кинетикалық
энергиясынан тұрады
UM
i
RT
2
im
U
RT
2
4.
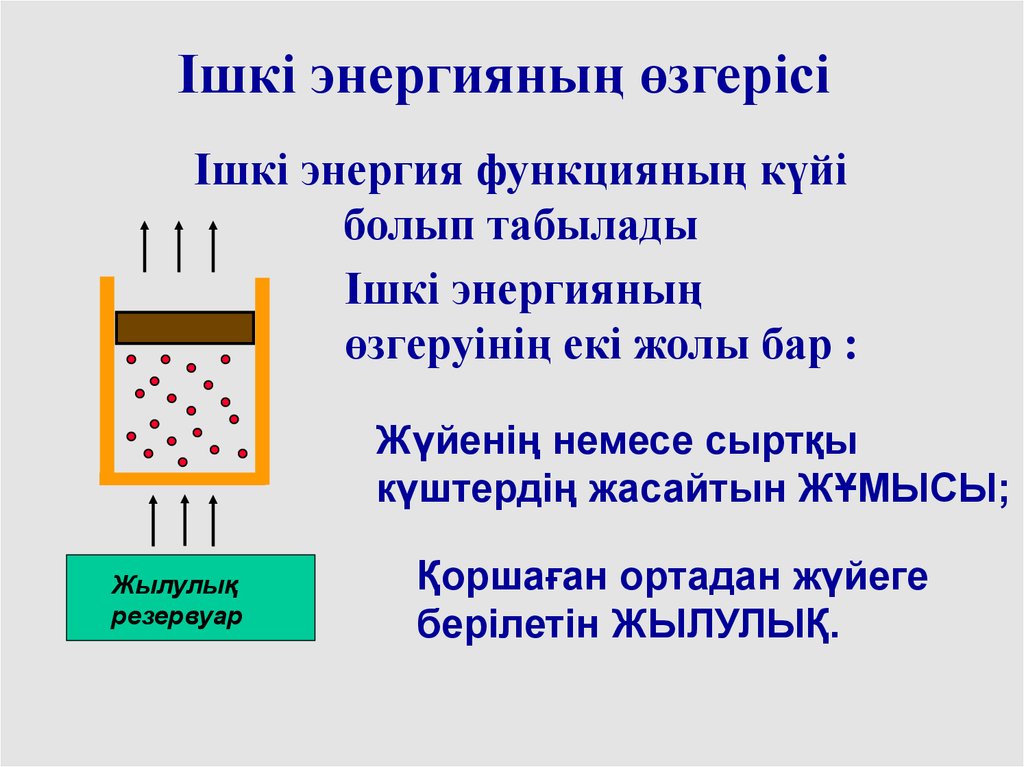
Ішкі энергияның өзгерісіІшкі энергия функцияның күйі
болып табылады
Ішкі энергияның
өзгеруінің екі жолы бар :
Жүйенің немесе сыртқы
күштердің жасайтын ЖҰМЫСЫ;
Жылулық
резервуар
Қоршаған ортадан жүйеге
берілетін ЖЫЛУЛЫҚ.
5.
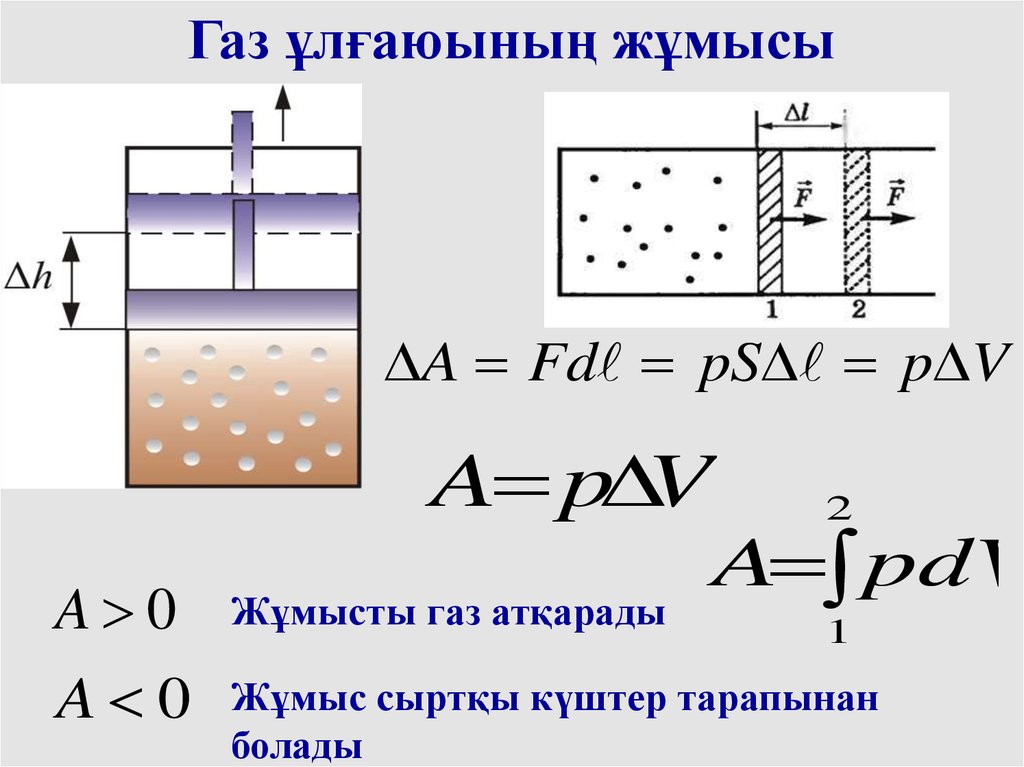
Газ ұлғаюының жұмысыA Fd pS p V
A p V
2
A pdV
A 0
Жұмысты газ атқарады
A 0
Жұмыс сыртқы күштер тарапынан
болады
1
6.
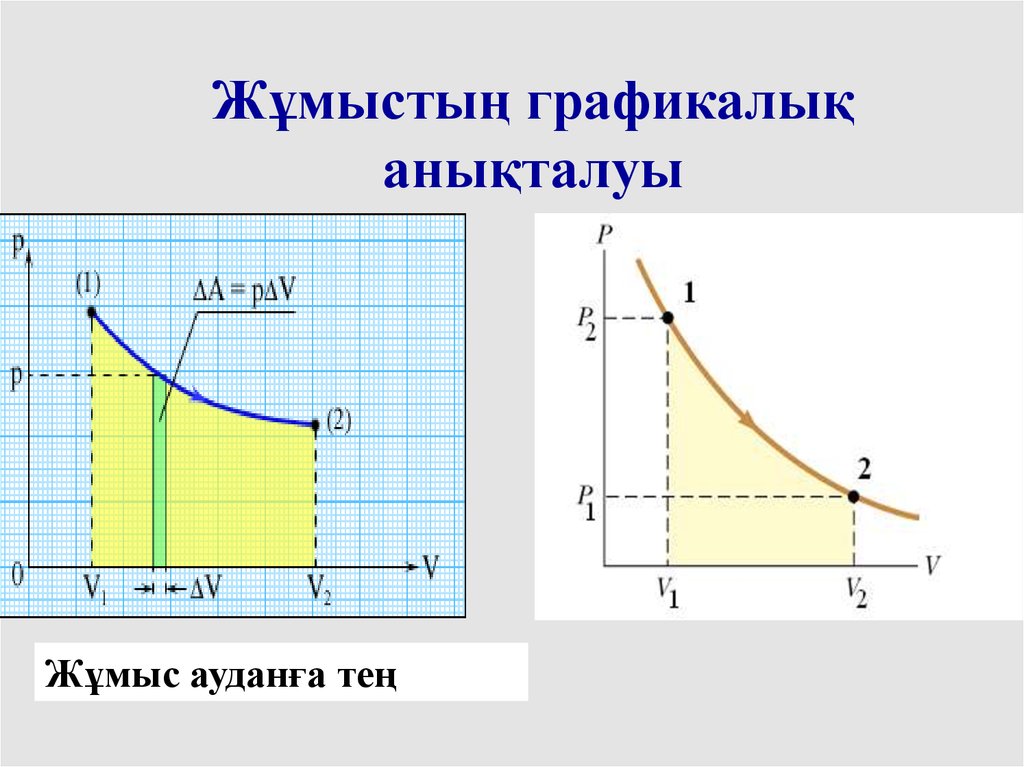
Жұмыстың графикалықанықталуы
Жұмыс ауданға тең
7.
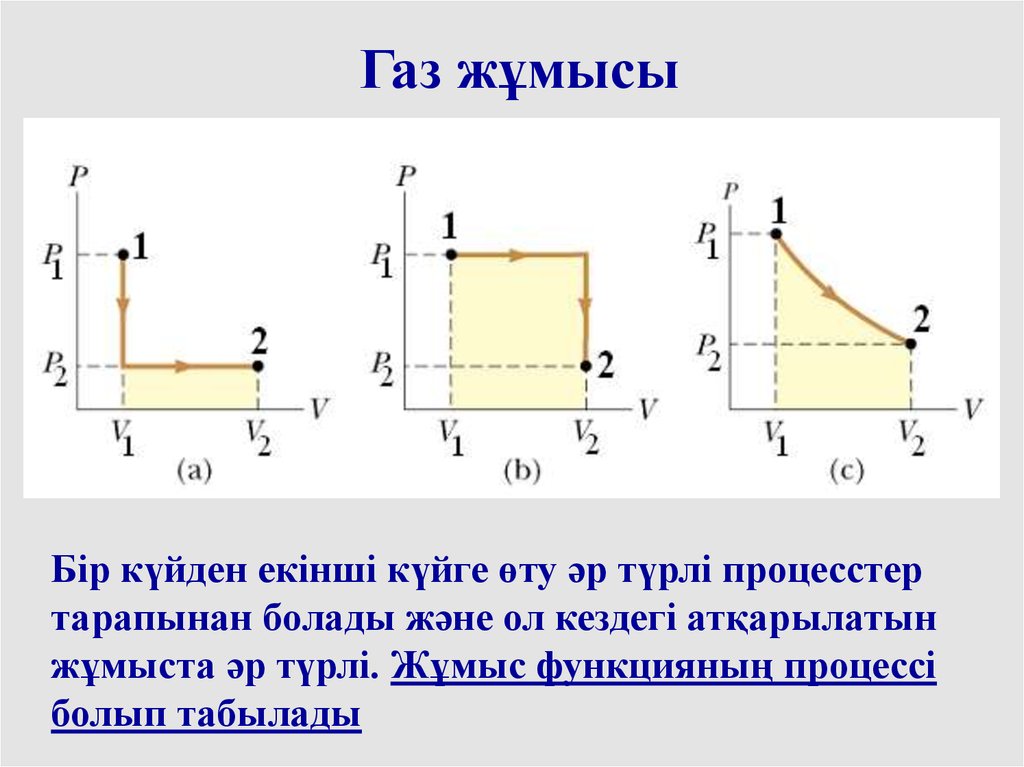
Газ жұмысыБір күйден екінші күйге өту әр түрлі процесстер
тарапынан болады және ол кездегі атқарылатын
жұмыста әр түрлі. Жұмыс функцияның процессі
болып табылады
8.
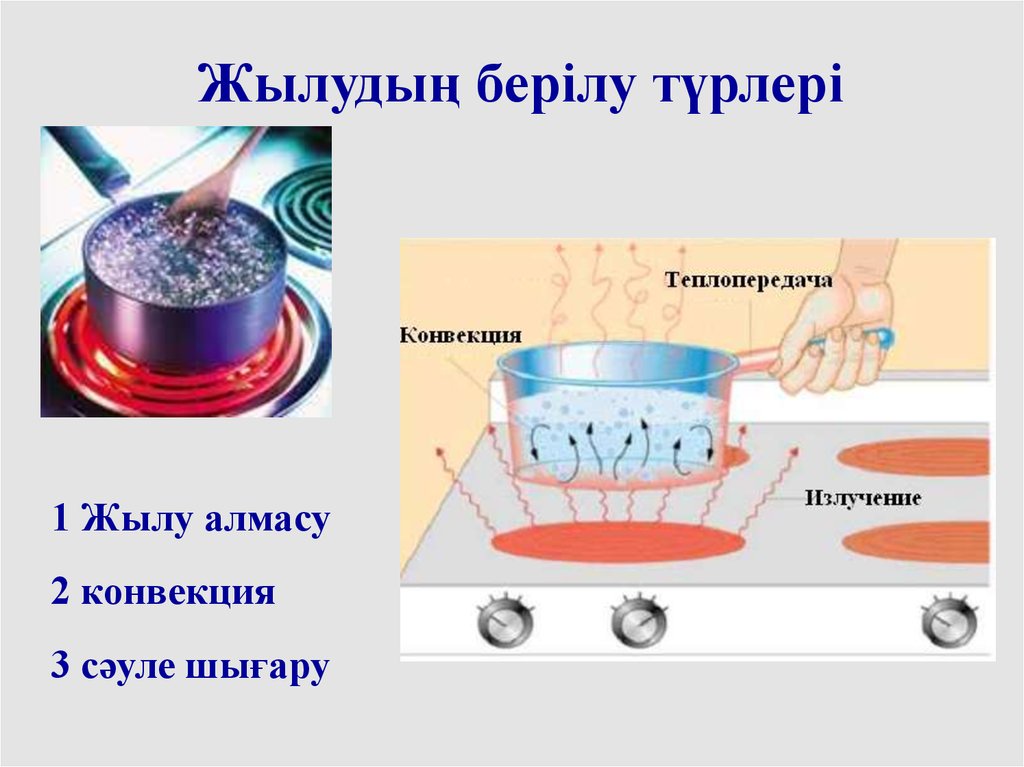
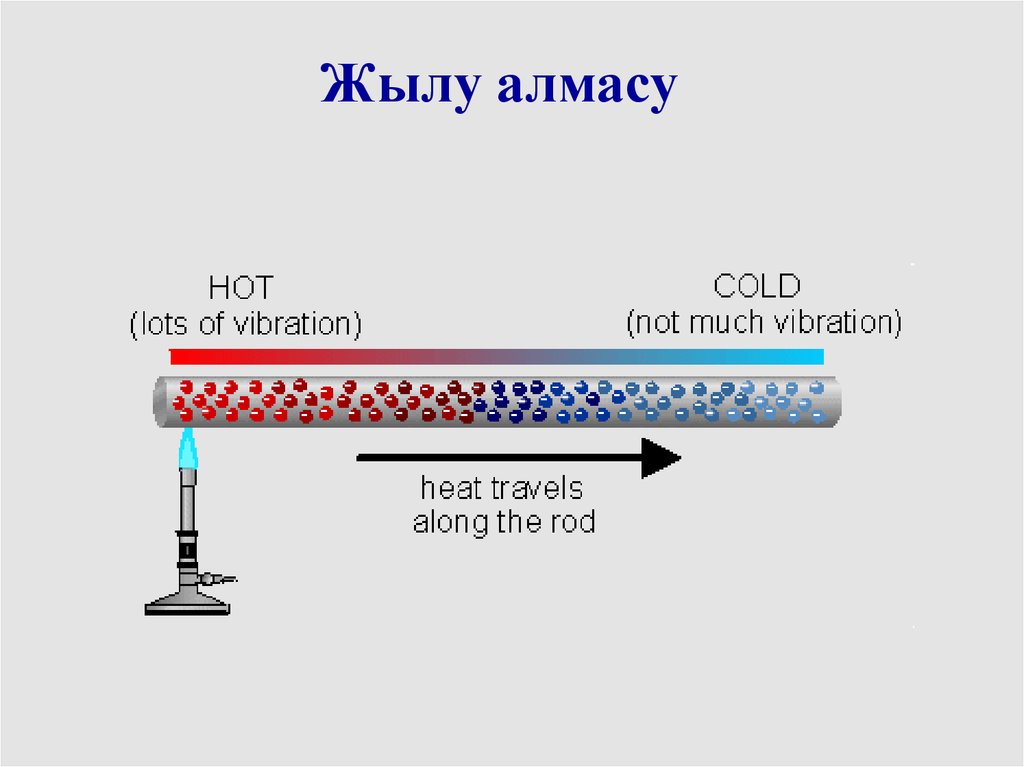
Жылудың берілу түрлері1 Жылу алмасу
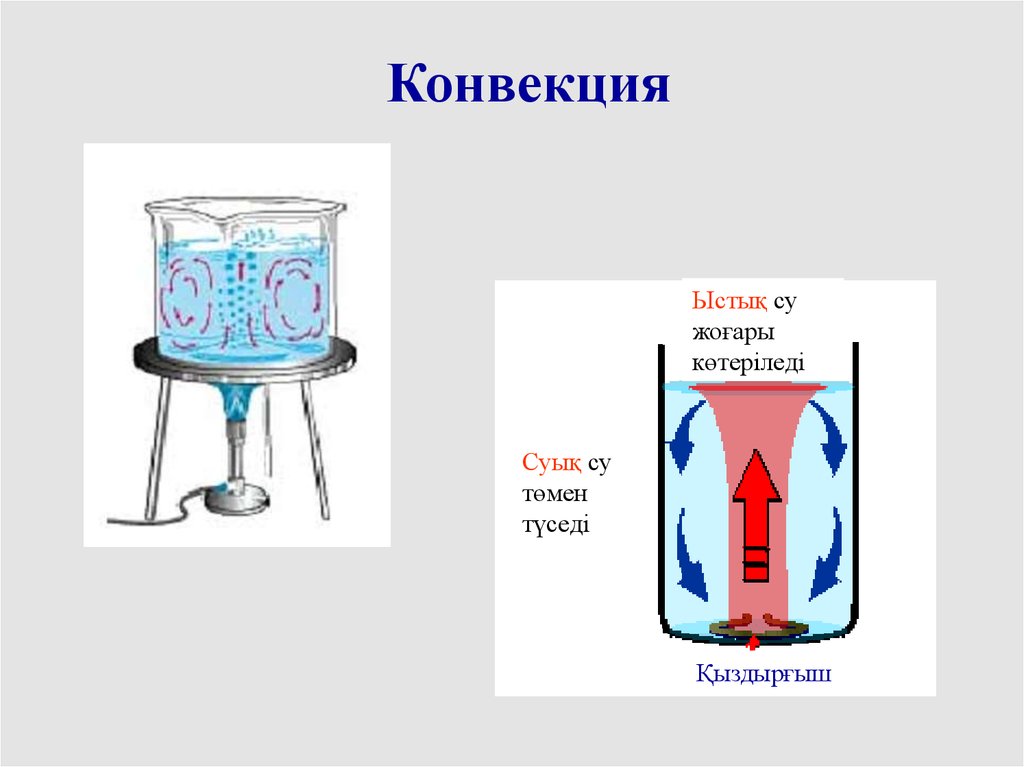
2 конвекция
3 сәуле шығару
9.
Жылу алмасу10.
КонвекцияЫстық су
жоғары
көтеріледі
Суық су
төмен
түседі
Қыздырғыш
11.
Сәуле шығару12.
13.
Термодинамиканың бірінші заңыQ
U A
U Q A
Q dU
A
2
dU U
1
2
U1
2
dA
A
12
1
2
dQ
Q
12
1
14.
ЖылусыйымдылықC
Меншікті
жылусыйымдылық
c
Q
mdT
Q
dT
Дж
C
К
Мольлық жылусыйымдылық
Q Q
С
dT mdT
V const
Cv
P const
CP
15.
V constA P V 0
QV dU
CV dT dU
dU M CV dT
m
U
CV T
M
dU M
CV
dT
iR
cv
2
16.
P constA PdVM
Q dU M PdVM
Q
dU M
dVM
P
dT
dT
dT
17.
PVM RTdU M
dVM
CP
P
dT
dT
CP CV R
i 2
cp
R
2
PVM
R
T
18.
Жылусыйымдылық процесстүріне байланысты
dUi
С
R
V
dT2
Тұрақты көлемдегі
мольдық
жылусыйымдылық
C
C
P
V R
C
i 2
P
C
i
V
dU
Ai
2
С
R
P
dT
dT
2
Тұрақты қысымдығы мольдық
жылусыйымдылық
Мольдық
жылусыйымдылық
арасындағы байланыс
(Майер теңдеуі)
Пуассона коэффициенті
(адиабата көрсеткіші)
19.
Изобаралық процессm
A
p
V
R
T
im m
U
R
T
C
T
V
2
m
Q
U
A
C
T
P
20.
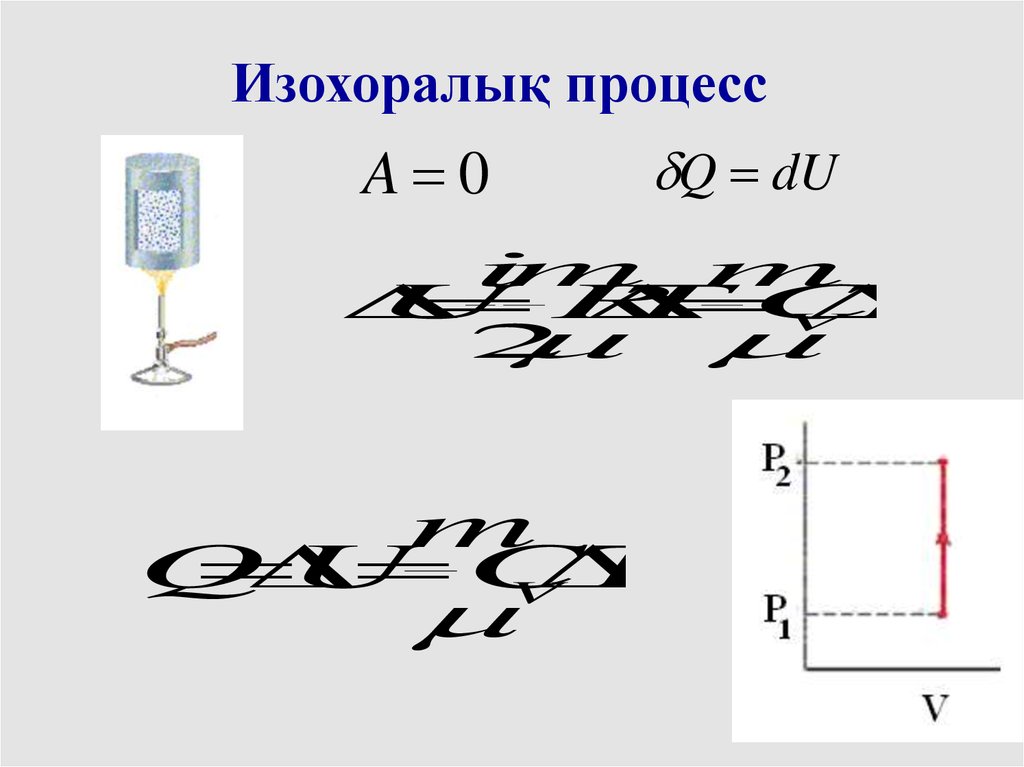
Изохоралық процессA 0
Q dU
im m
U
R
T
C
T
V
2
m
Q
U
C
T
V
21.
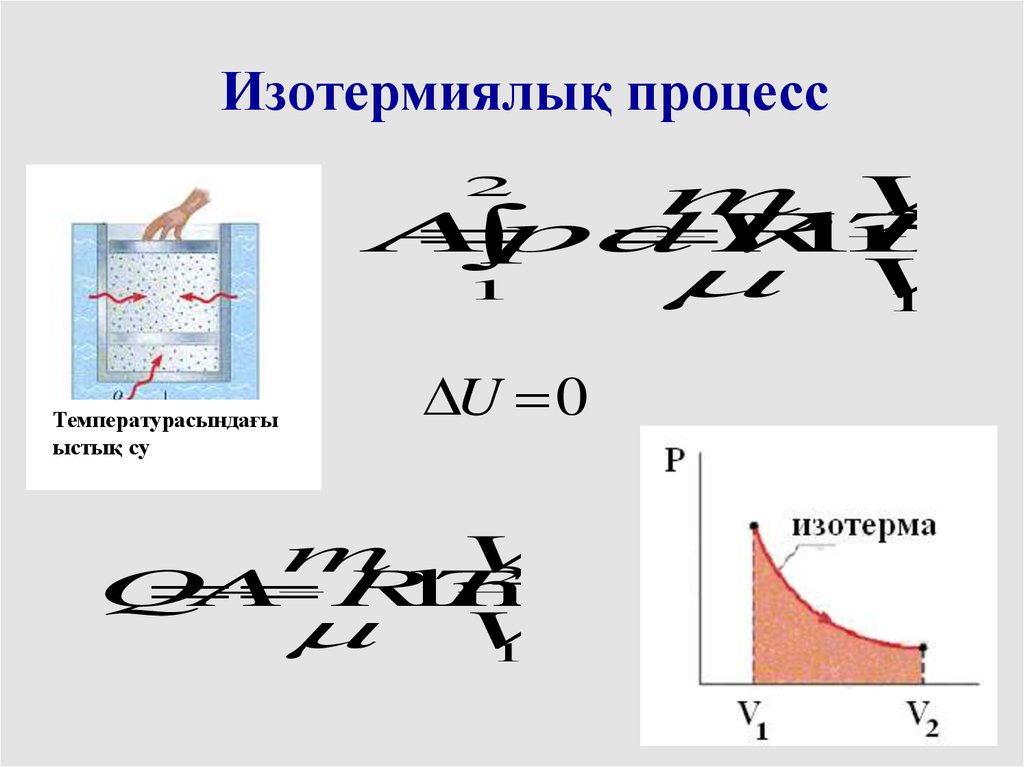
Изотермиялық процессm V
2
A
RT
ln
pdV
V
1
1
2
Температурасындағы
ыстық су
U 0
m V
2
Q
A
RT
ln
V
1
22.
Адиабаталық процессАдиабаталық процесс кезінде
қысымның ұлғаюы көлемнің
кішіреуі мен температураның
жоғарылауына тәуелді.
Процесстің теңдеуі:
pV const
Q 0
A dU
1
V
p
V
11
1
TV const A
1
1
V
1
2
1
T p
const
23.
ЭнтропияQ / T
Q
келтірілген жылу мөлшері
T 0
қайтымды процесс үшін
Клаузиус өлшем енгізді, оны энтропия деп атады:
dS
Q
T
24.
2S S 2 S1
Q
dU A
T
T
1
1
m
dU
CV dT
M
2
m
dV
A PdV RT
V
T2
V2
m
dT m
dV
S S 2 S1
Cv
R
M T1 T
M V1 V
m
S S 2 S1
M
T2
V2
Cv ln R ln
T1
V1
25.
ЭнтропияБольцман энтропияны термодинамикалық
ықтималдығымен байланыстырды :
S klnw
Энтропия жүйенің біркелкілік емес шамасы;
үлкен энтропия үлкен хаосқа соқтырады
26.
Термодинамиканың екіншібастамасы
Суық денеден ыстық денеге жылу берілу мүмкін емес
Бір рет қана берілген жылудың көмегімен сыртқы
ортаның қасиетін өзгертпей мәңгі қозғалтқыш алу
мүмкін емес
Оқшауланған жүйедегі энтропия ондағы барлық
процесстерде кеміді
S 0
S 0
Қайтымды
процесстер үшін
S 0
Кайтымсыз
процесстер үшін
27.
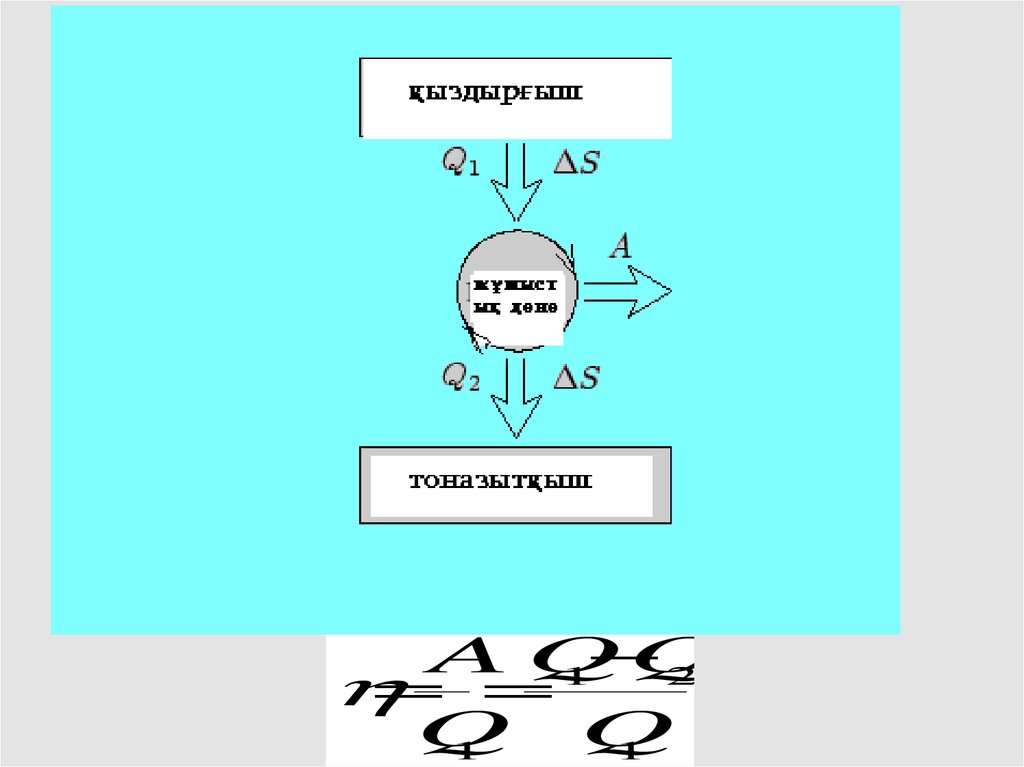
QAQ
1
2
Q
Q
1
1
28.
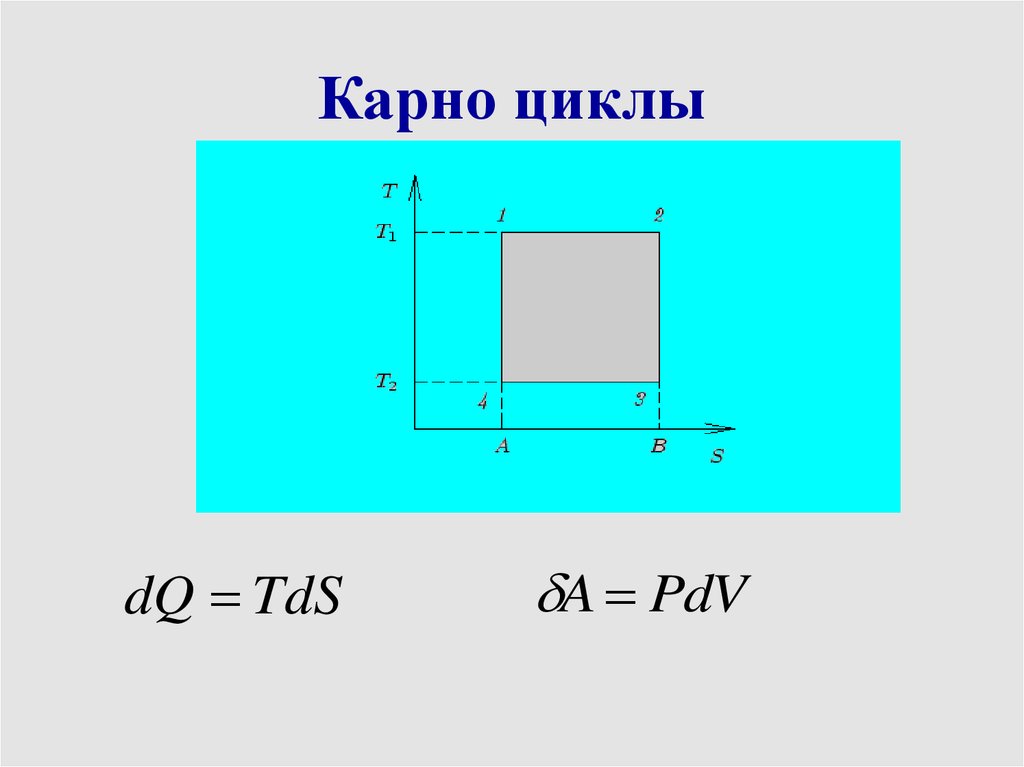
Карно циклы1-2 изотерма
2-3 адиабата
3-4 изотерма
4-1 адиабата
T
T
1
2
max
T
1
29.
Карно циклыdQ TdS
A PdV
30.
2Q12 TdS
T const
1
Q12 T (S 2 S1 )
dQ dU dA
TdS dU PdV
dU PdV
dS
T
31.
ТАСЫМАЛДАУ ҚҰБЫЛЫСЫ.НАҚТЫ ГАЗДАР
32.
Дәріс жоспарыЭффективтік диаметр
Тасымалдау құбылысы
Молекуллрдың өзара әсерлесуі
Ван-дер-Ваальс теңдеуі
Ван-дер-Ваальс изотермасы
Фазалық ауысу
Күй диаграммасы
33.
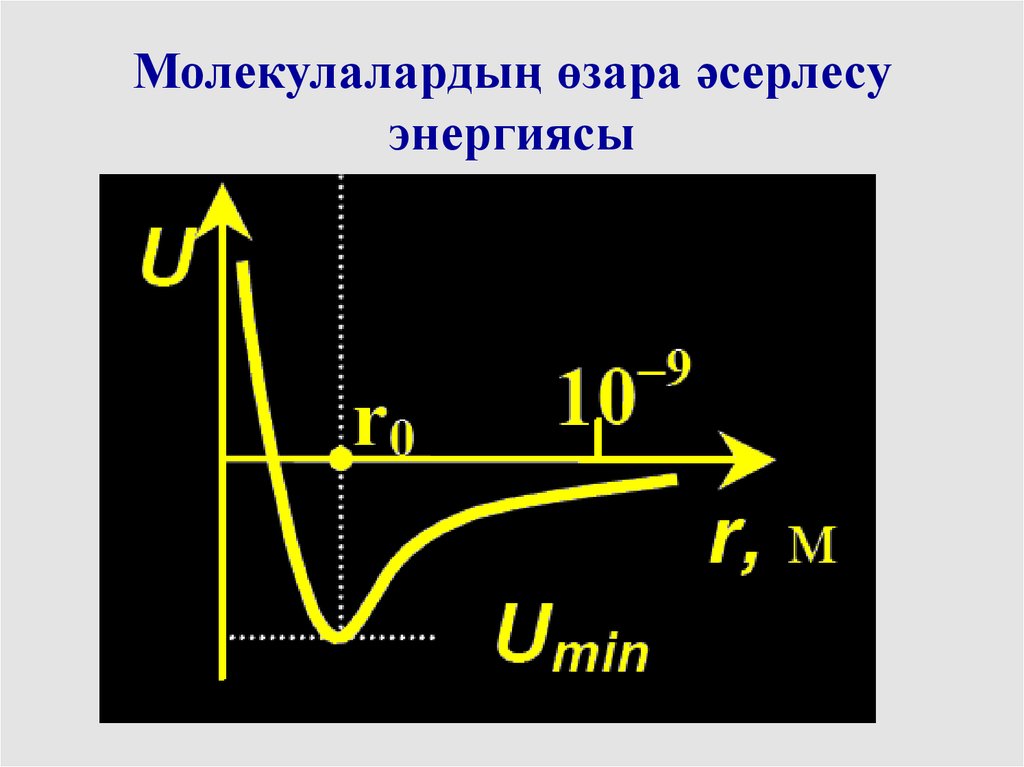
Молекулалардың өзара әсерлесуэнергиясы
34.
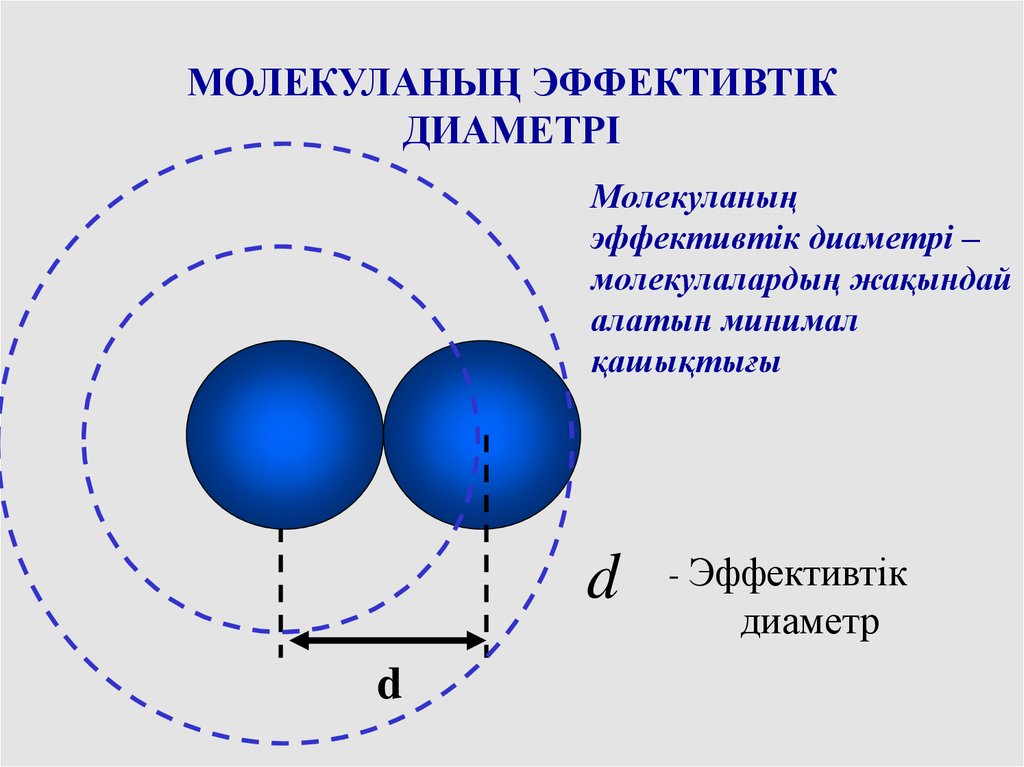
МОЛЕКУЛАНЫҢ ЭФФЕКТИВТІКДИАМЕТРІ
Молекуланың
эффективтік диаметрі –
молекулалардың жақындай
алатын минимал
қашықтығы
d
d
- Эффективтік
диаметр
35.
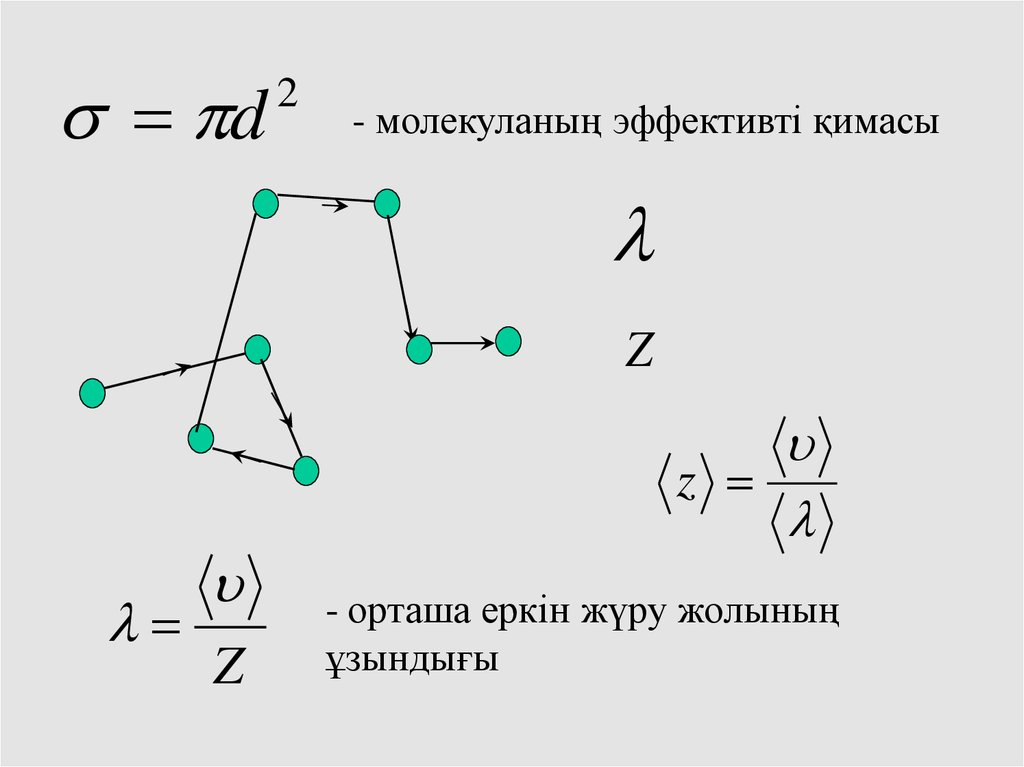
d2
- молекуланың эффективті қимасы
Z
Z
z
- орташа еркін жүру жолының
ұзындығы
36.
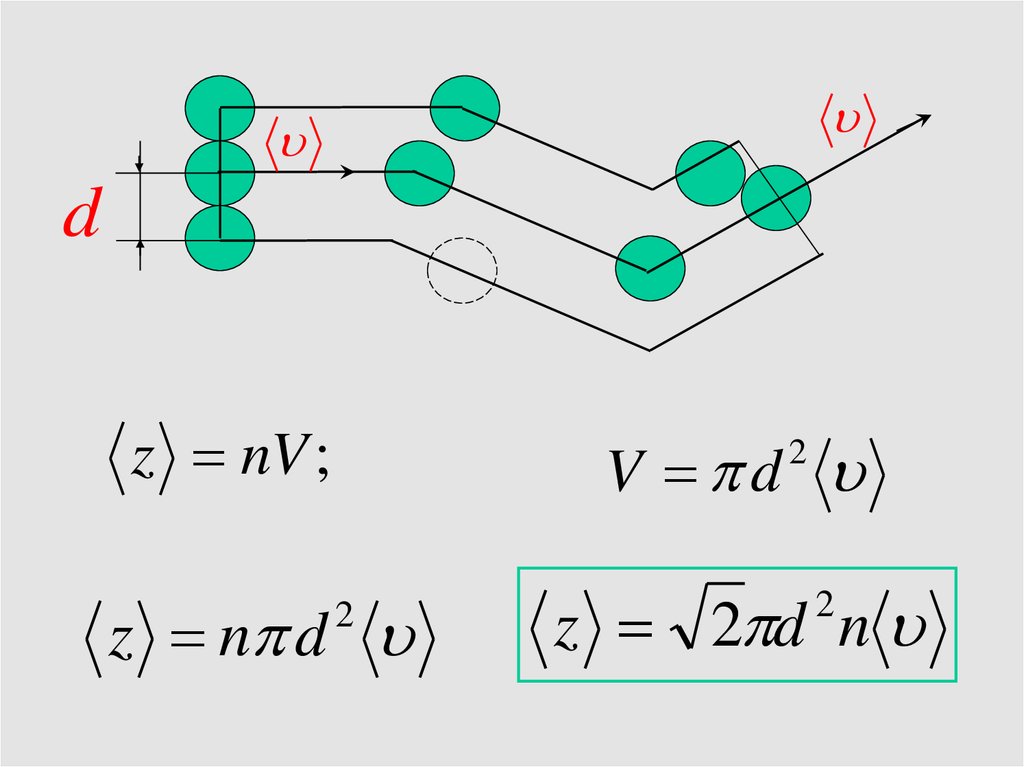
dz nV ;
V d
2
z n d
2
z 2 d n
2
37.
ZZ
2 d n
1
2
2 d n
2
1
2 d n
2
1
2 n
38.
Орташа еркін жол ұзындығы1
2
2 d n
T const
1
~
n
1
n2 p2
2
n1 p1
1
~
P
39.
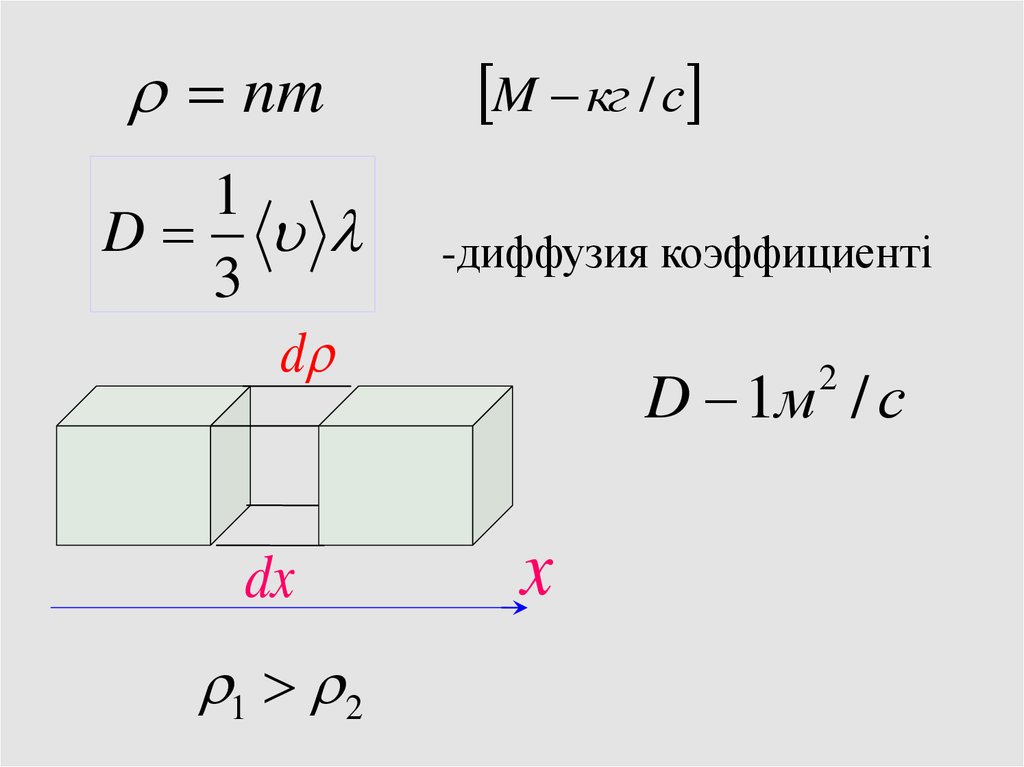
Тасымалдау құбылысыДиффузия
dni
dN i D
S ,
dz
d i
dM i D
S ,
dz
Фик заңы
40.
nm1
D
3
d
dx
1 2
M кг / с
-диффузия коэффициенті
D 1м / с
2
x
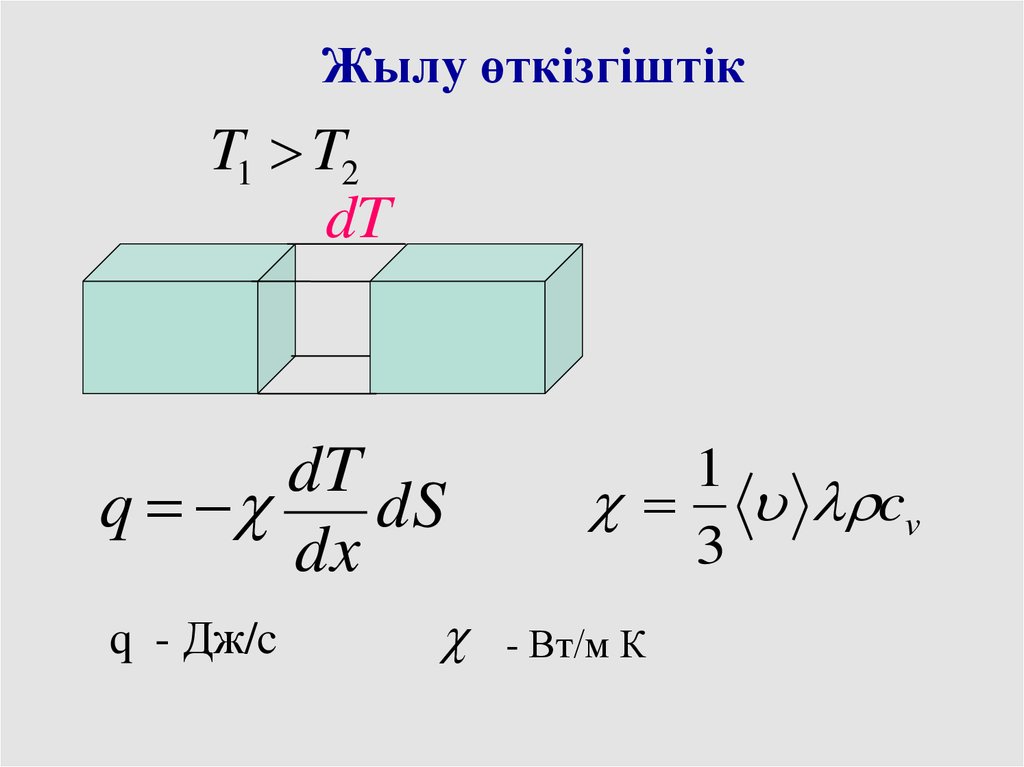
41.
Жылу өткізгіштікT1 T2
dT
dT
q
dS
dx
q - Дж/c
1
cv
3
- Вт/м К
42.
Тұтқырлықd
F
S
dx
d
K
S
dx
1
3
43.
Dcv D cv
44.
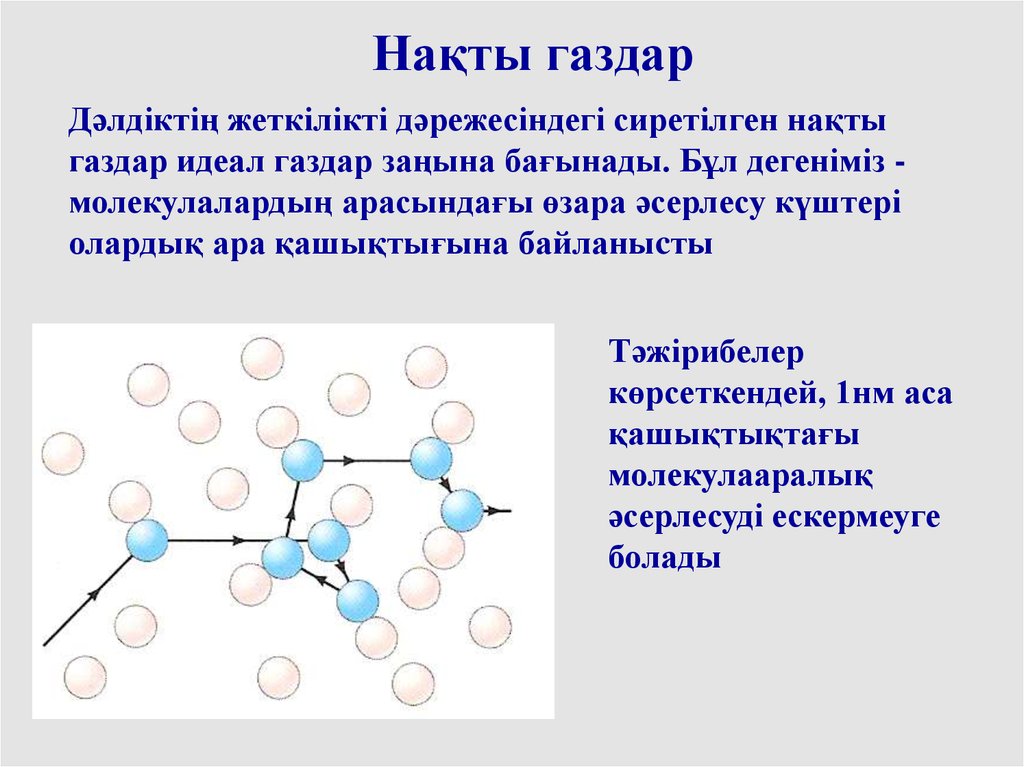
Нақты газдарДәлдіктің жеткілікті дәрежесіндегі сиретілген нақты
газдар идеал газдар заңына бағынады. Бұл дегеніміз молекулалардың арасындағы өзара әсерлесу күштері
олардық ара қашықтығына байланыcты
Тәжірибелер
көрсеткендей, 1нм аса
қашықтықтағы
молекулааралық
әсерлесуді ескермеуге
болады
45.
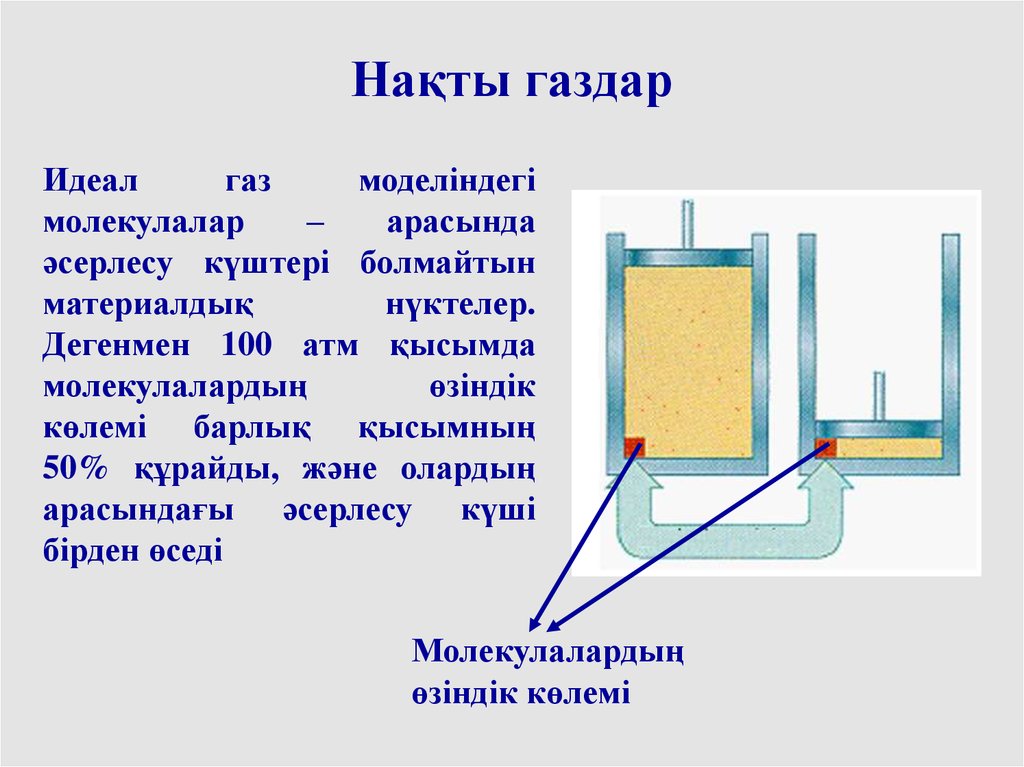
Нақты газдарИдеал
газ
моделіндегі
молекулалар
–
арасында
әсерлесу күштері болмайтын
материалдық
нүктелер.
Дегенмен 100 атм қысымда
молекулалардың
өзіндік
көлемі барлық қысымның
50% құрайды, және олардың
арасындағы әсерлесу күші
бірден өседі
Молекулалардың
өзіндік көлемі
46.
Қысым ұлғайғанда сығылғaн газ көлемімолекулалардың өздері алатын көлемге
теңеседі
47.
Идеал газ күйінің теңдеуі төмен қысымда жәнежоғары температурадағы газдар әрекетін сипаттауға
пайдалы.
Идеал газадың берілген күйден ауытқуы сығылу
коэффициентімен Z сипатталады
pV
Z
RT
Егер Z = 1 болса, идеал газ қасиетіне жақын болады
Сығылу коэффициенті Z 1-ден өзгеше
болса,солғұрлым идеал газадан ауытқуы күштірек
болады
48.
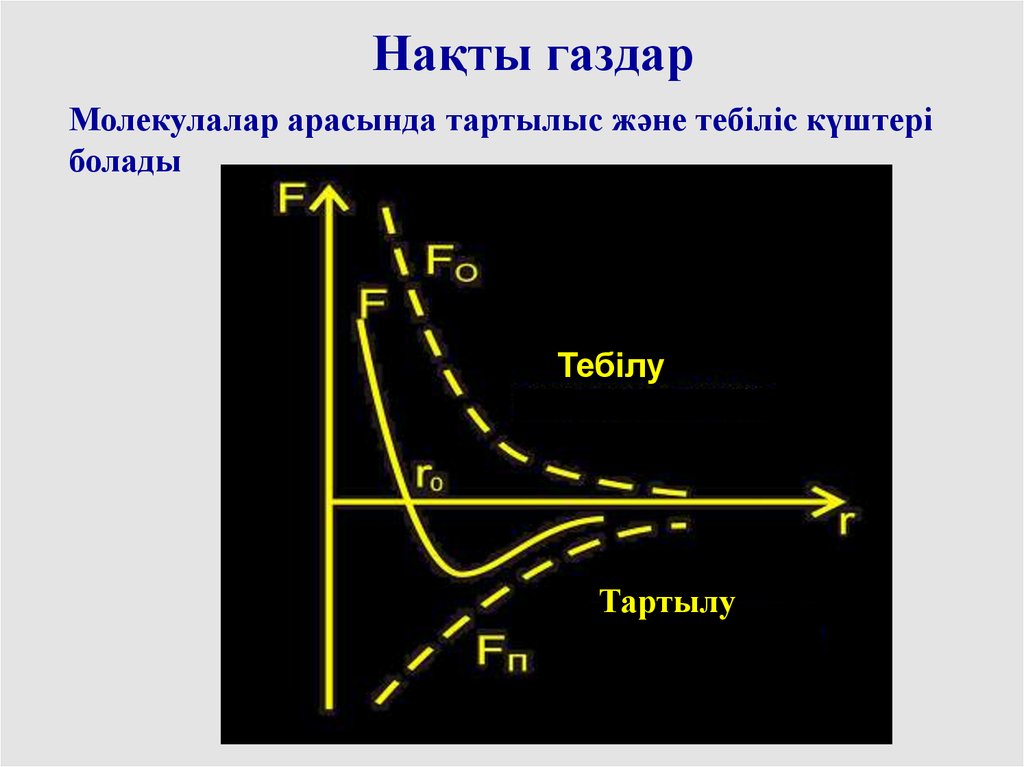
Нақты газдарМолекулалар арасында тартылыс және тебіліс күштері
болады
Тебілу
Тартылу
49.
Молекулалардың потенциялдық жәнекинетикалық энергиялары арасындағы
арақатынас агрегаттық күйлерге бөлу
үшін сындық болып табылады
50.
Нақты газ күйінің теңдеуі –Ван-дер-Ваальстеңдеуі
Нақты газдарда келесі ескерілу керек:
Бөлшектерде өз көлемі болады
Молекулалар арасында тартылыс және тебіліс
күштері бар
pV RT
Идеал газ күйінің теңдеуі
молекулалардың өз көлемі мен олардың
әсерлесуі ескерілетіндей түрлендірілуі қажет
51.
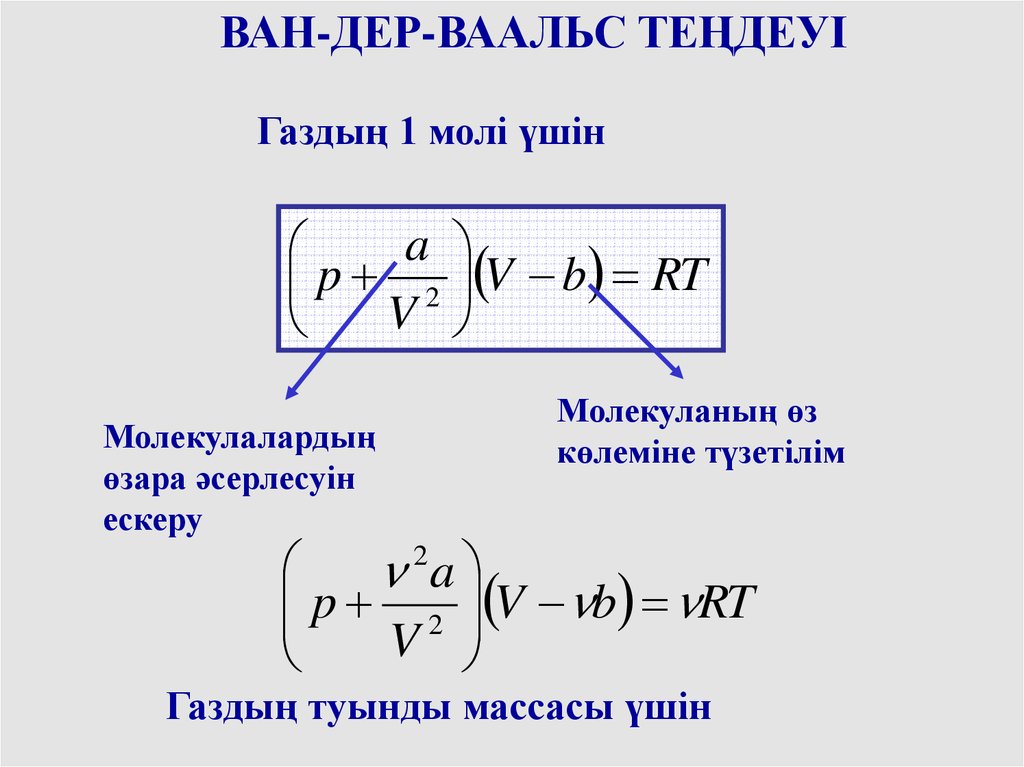
ВАН-ДЕР-ВААЛЬС ТЕҢДЕУІГаздың 1 молі үшін
a
p 2 V b RT
V
Молекулалардың
өзара әсерлесуін
ескеру
Молекуланың өз
көлеміне түзетілім
2
a
p 2 V b RT
V
Газдың туынды массасы үшін
52.
B-тұрақтысымолекула
өлшеміне
байланысты: үлкен молекула үшін оның
мәні де үлкен
a-молекулалар
арасындағы
күшінің шамасы
тартылыс
53.
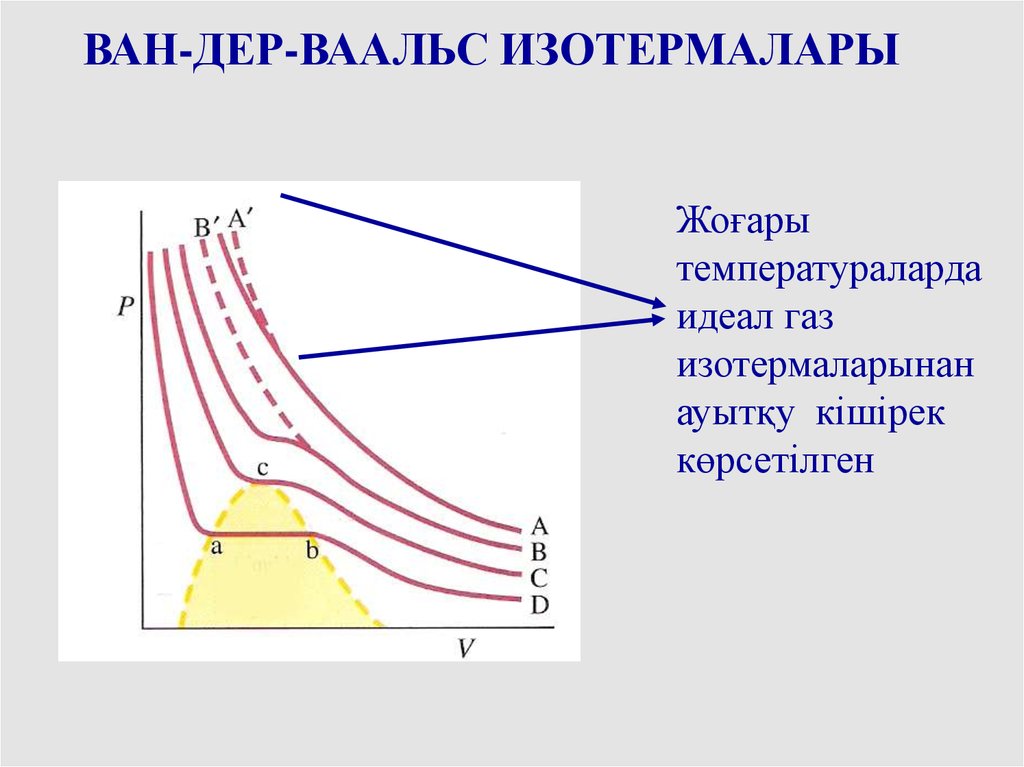
ВАН-ДЕР-ВААЛЬС ИЗОТЕРМАЛАРЫВан-дер-Ваальса теңдеуі
– 3-дәрежеде V қатысты,
сондықтан 3 заттық
түбірі болуы мүмкін
db жеріндегі ұлғаю
қысым ұлғаюымен
жүреді, оның физикалық
мағынасы жоқ, сол
себепті бірден ea
секірісі болады
54.
ВАН-ДЕР-ВААЛЬС ИЗОТЕРМАЛАРЫЖоғары
температураларда
идеал газ
изотермаларынан
ауытқу кішірек
көрсетілген
55.
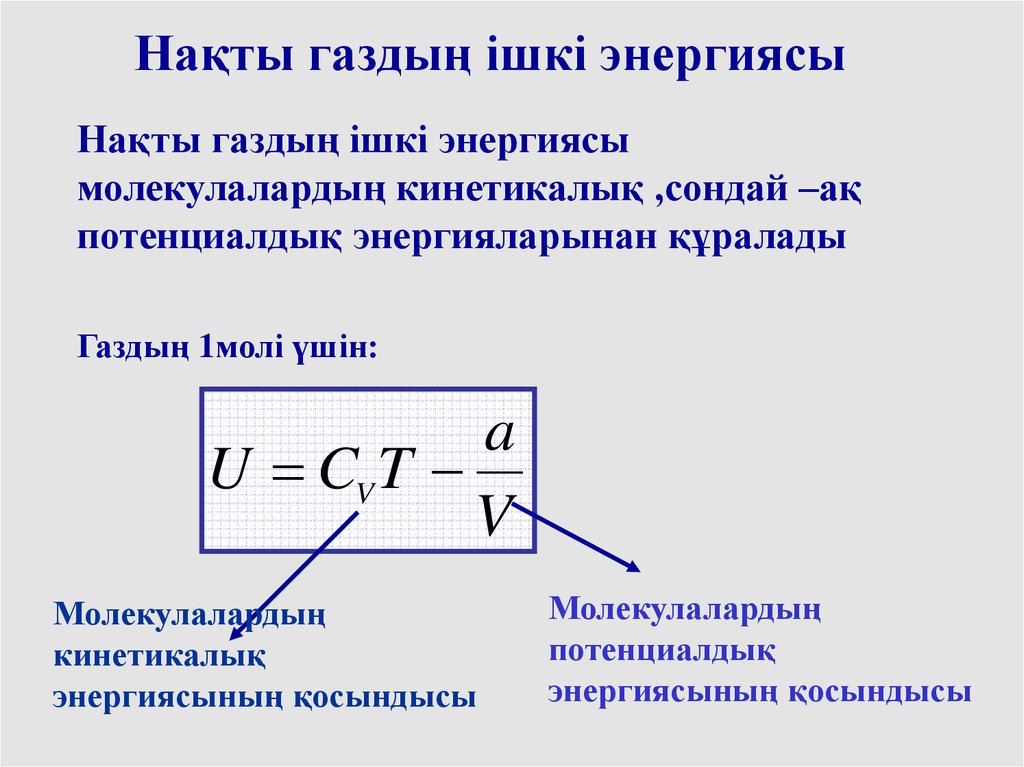
Нақты газдың ішкі энергиясыНақты газдың ішкі энергиясы
молекулалардың кинетикалық ,сондай –ақ
потенциалдық энергияларынан құралады
Газдың 1молі үшін:
a
U CV T
V
Молекулалардың
кинетикалық
энергиясының қосындысы
Молекулалардың
потенциалдық
энергиясының қосындысы
56.
Ван-дер-Ваальс теңдеуіне бағынатын газ үшінкүйлердің сындық шамаларының мәндері
1 a
p
k
2
27 b
Vk 3b
8 a
Tk
27 bR
57.
Фазалық ауысуларФаза – химиялық құрамы бірдей және 1
термодинамикалық күйдегі
жүйенің барлық бөліктерінің байланысы
1 реттік фазалық ауысу мысалдары:
•балқу – қату
•булану – конденсация
•Сублимация
2 реттік фазалық ауысу мысалдары:
•ферромагнетиктің парамагнетикке ауысуы және
керісінше. Металдың жоғары өтімді күйге ауысуы
•Сұйық гелийдің аққыштығы жоғары күйге айналуы
58.
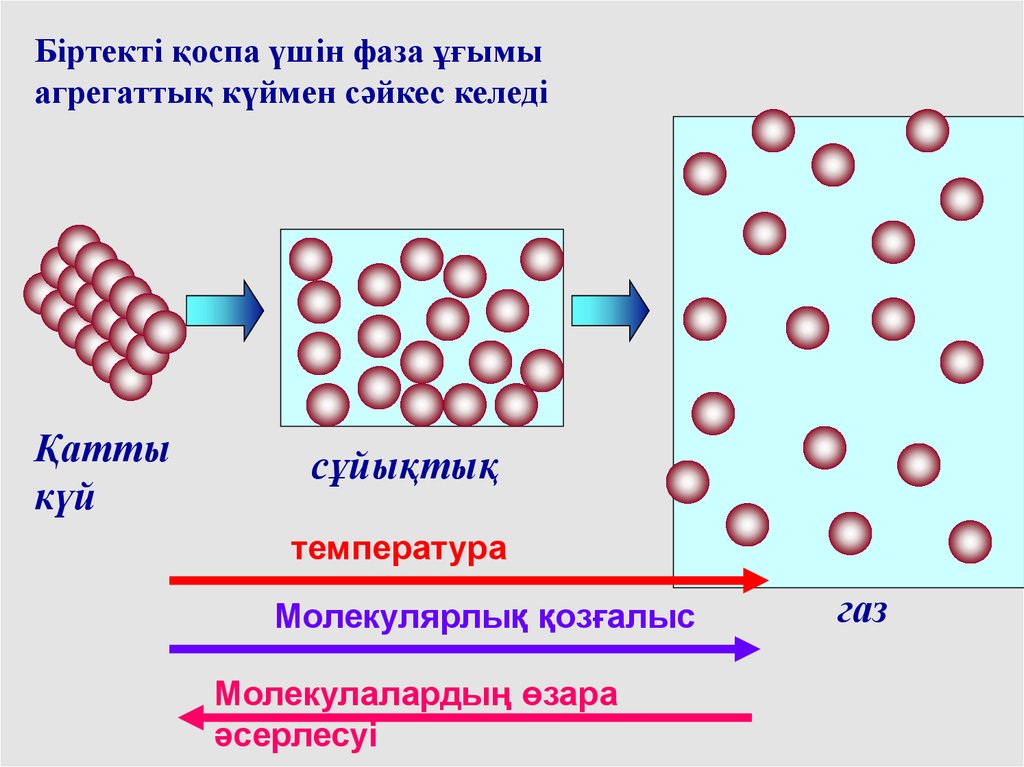
Біртекті қоспа үшін фаза ұғымыагрегаттық күймен сәйкес келеді
Қатты
күй
сұйықтық
температура
Молекулярлық қозғалыс
Молекулалардың өзара
әсерлесуі
газ
59.
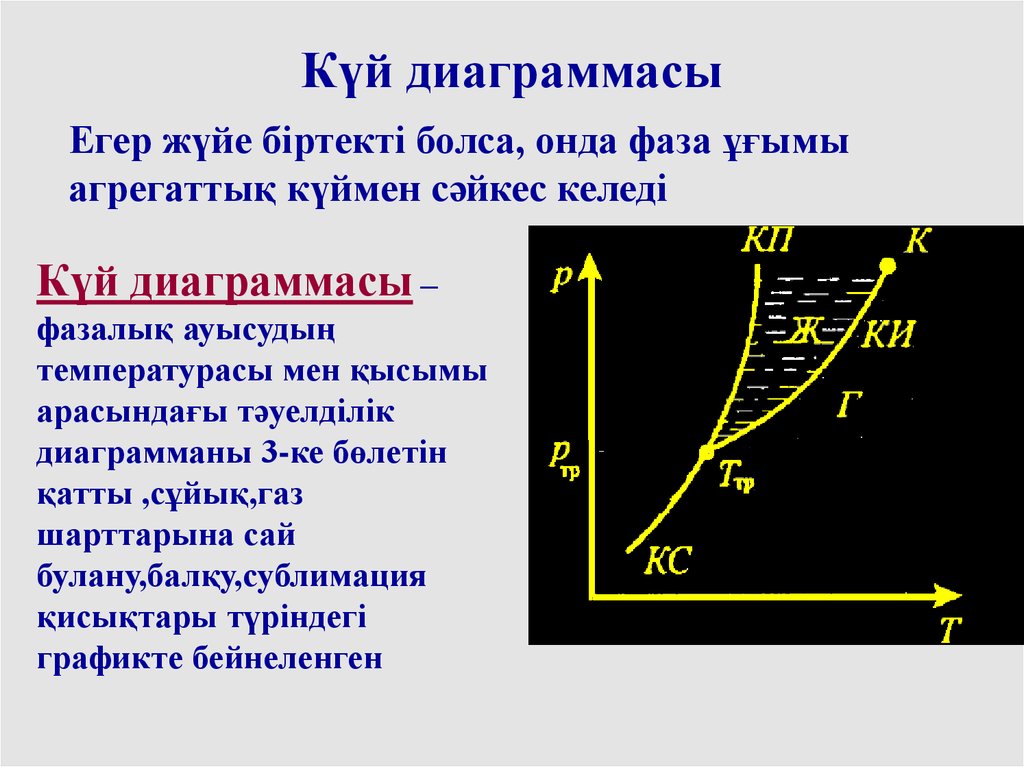
Күй диаграммасыЕгер жүйе біртекті болса, онда фаза ұғымы
агрегаттық күймен сәйкес келеді
Күй диаграммасы –
фазалық ауысудың
температурасы мен қысымы
арасындағы тәуелділік
диаграмманы 3-ке бөлетін
қатты ,сұйық,газ
шарттарына сай
булану,балқу,сублимация
қисықтары түріндегі
графикте бейнеленген
60.
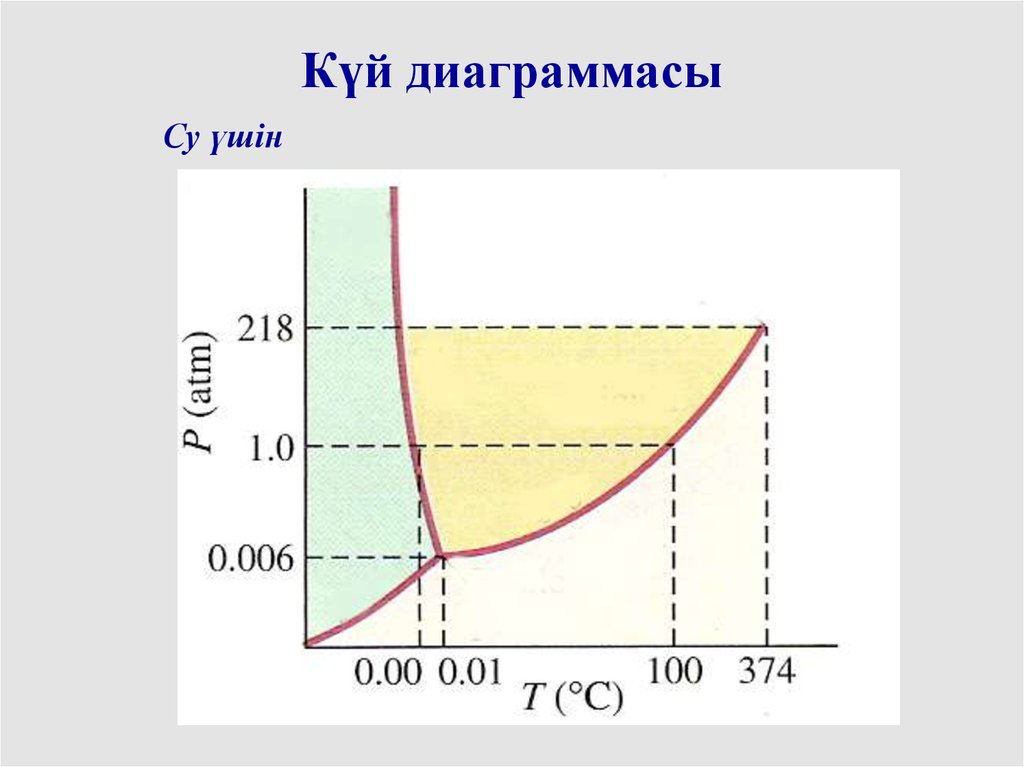
Күй диаграммасыСу үшін
61.
Сындық нүктеҮштік нүкте
Сындық нүкте: сындықтан жоғары температурада
ешқандай қысым ұлғаюымен газды сұйыққа айналдыруға
болмайды
Үштік нүкте: заттың 3фазасының бірдей болуының
шарты
62.
Назараударғандарыңызға
рахмет!






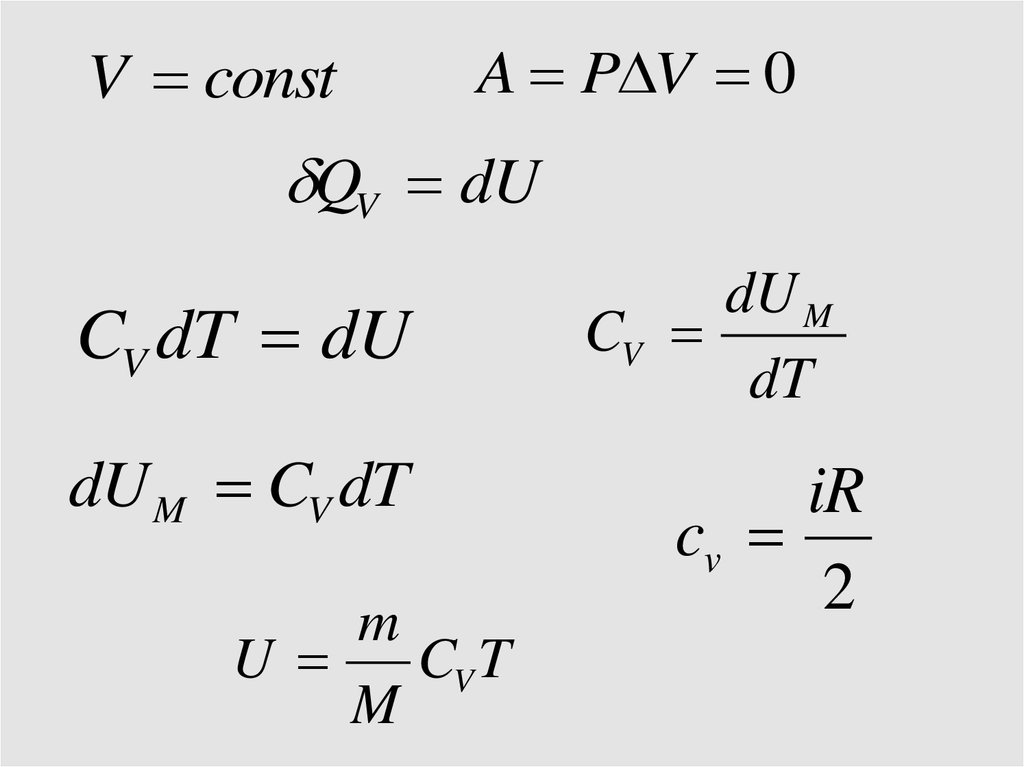
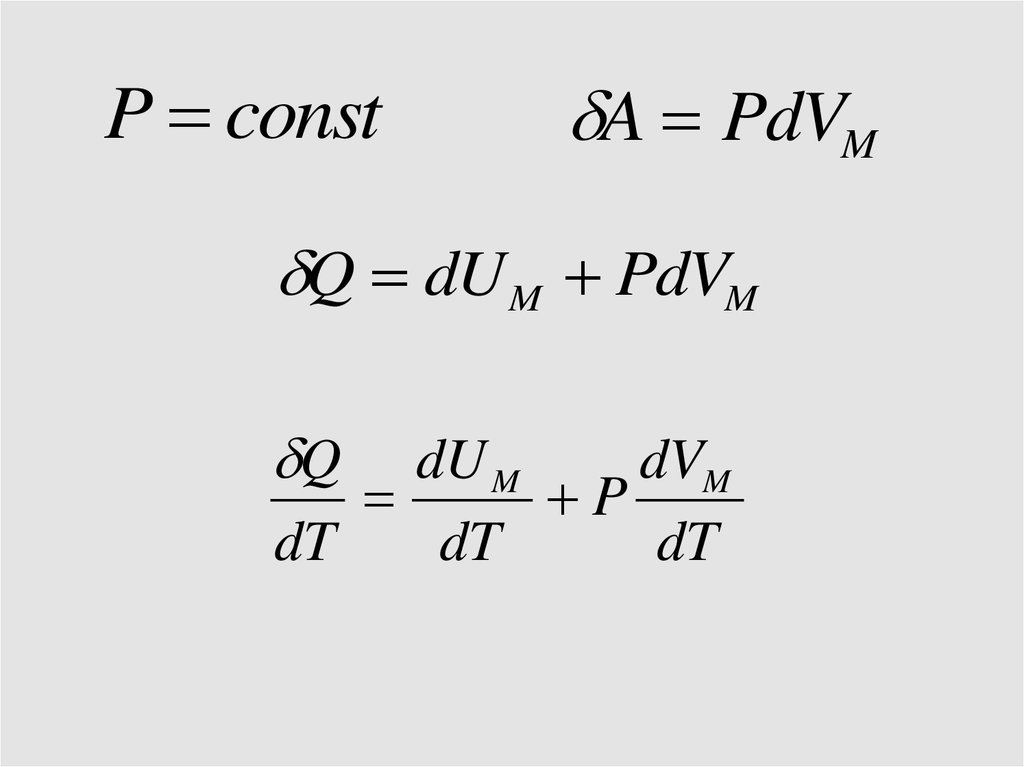









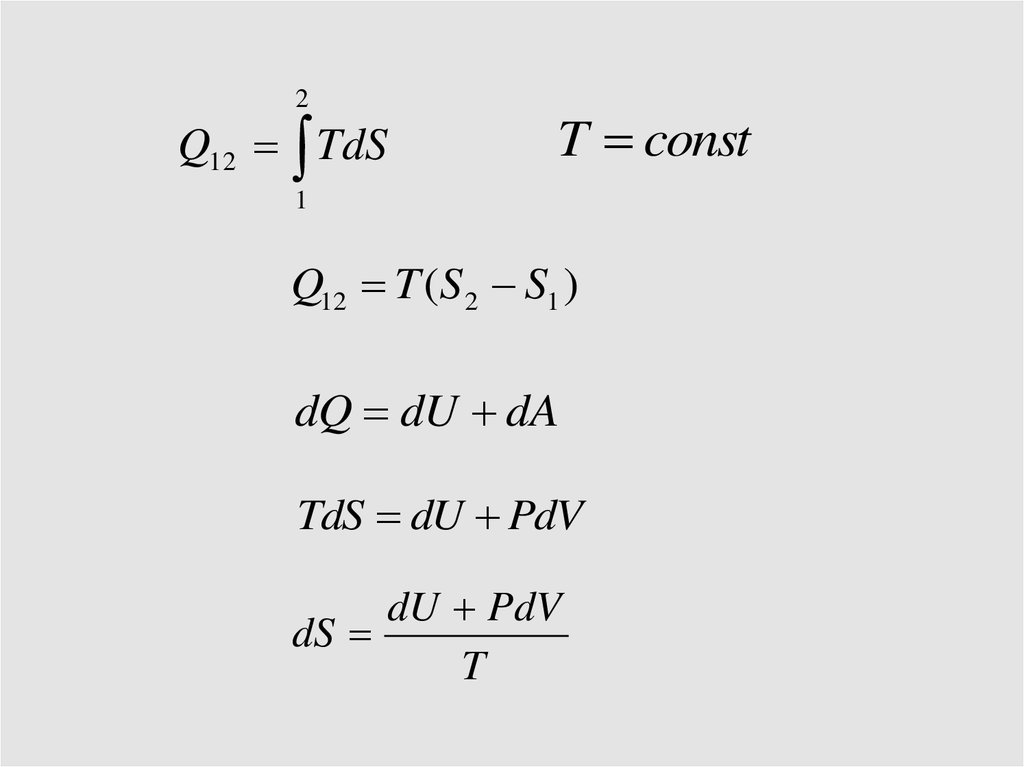


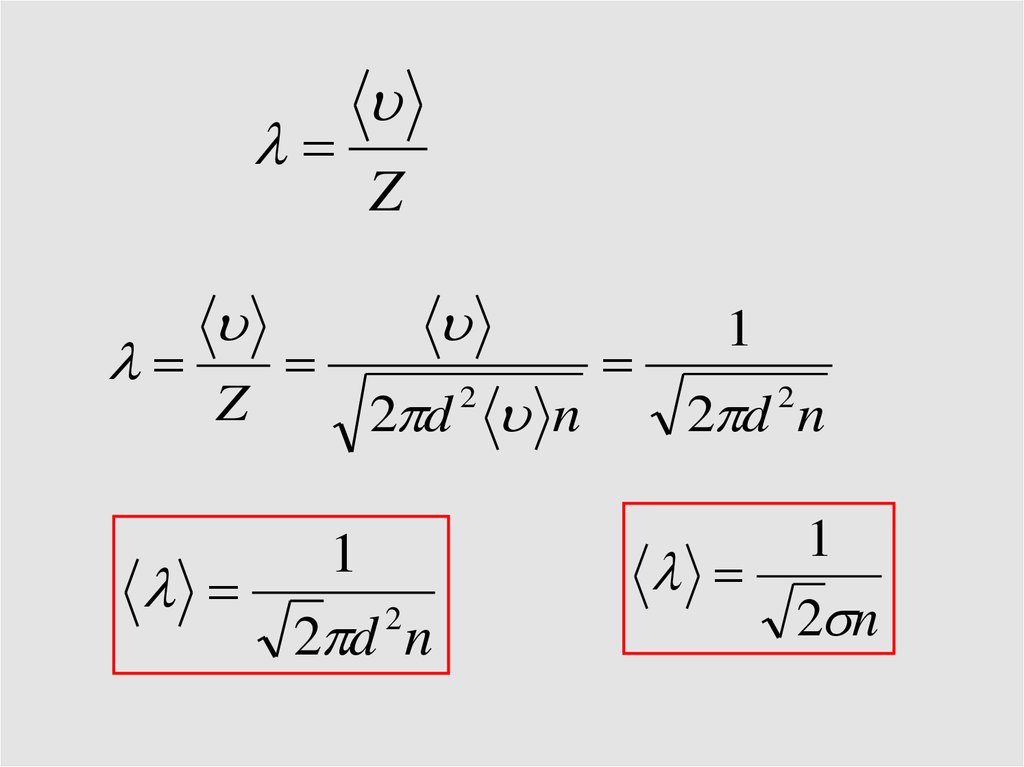



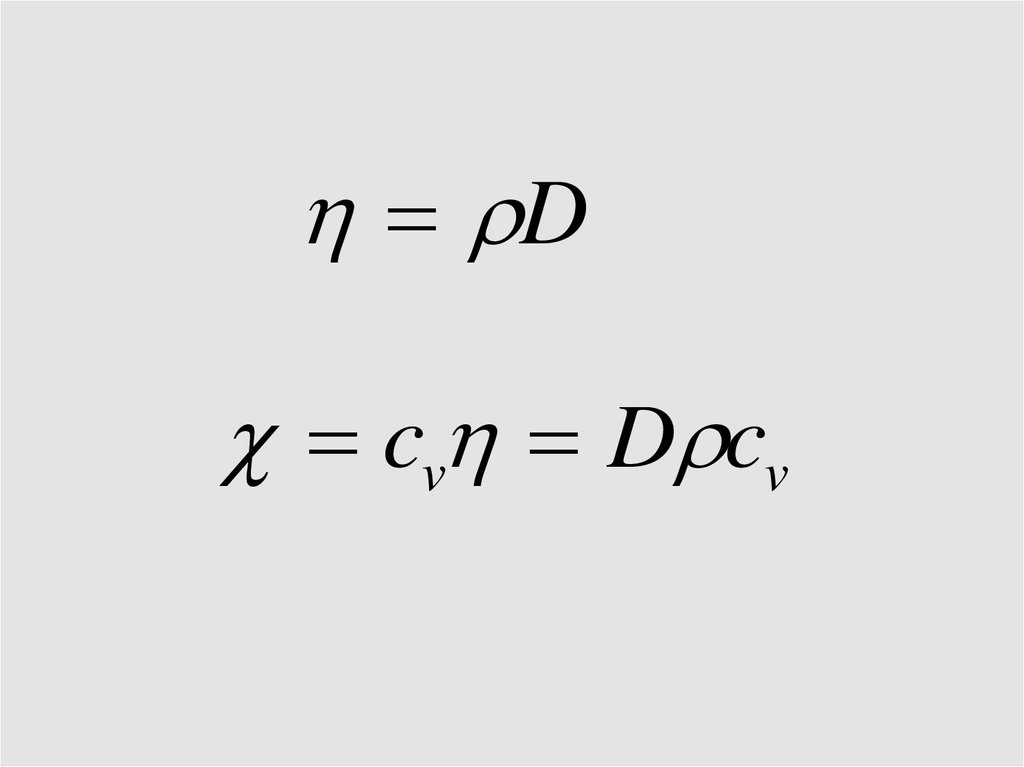










 Физика
Физика








