Похожие презентации:
Химическая термодинамика. Основные понятия
1.
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ – МСХА имени К.А.
ТИМИРЯЗЕВА
(ФГОУ ВПО РГАУ - МСХА имени К.А. Тимирязева)
КАФЕДРА ФИЗИЧЕСКОЙ И ОРГАНИЧЕСКОЙ ХИМИИ
Лекции
Дисциплина:
Физическая и коллоидная химия
Лектор:
Ст. Преподаватель кафедры физической и органической
химии
Моргунов Андрей Владимирович
2.
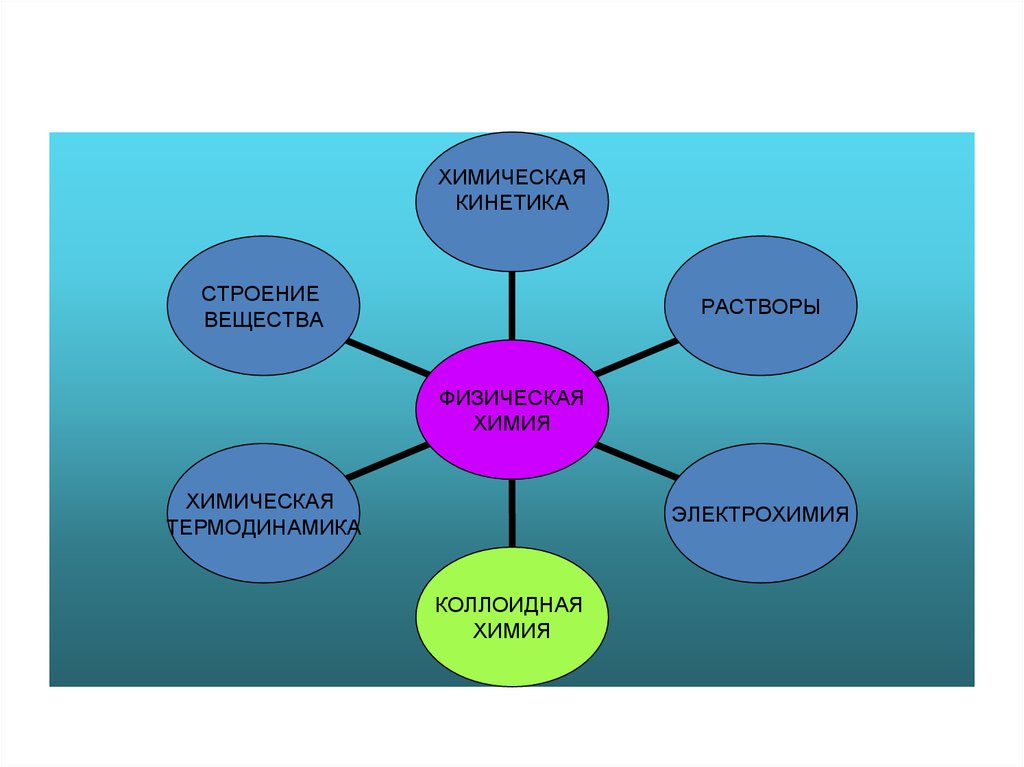
ХИМИЧЕСКАЯКИНЕТИКА
СТРОЕНИЕ
ВЕЩЕСТВА
РАСТВОРЫ
ФИЗИЧЕСКАЯ
ХИМИЯ
ХИМИЧЕСКАЯ
ТЕРМОДИНАМИКА
ЭЛЕКТРОХИМИЯ
КОЛЛОИДНАЯ
ХИМИЯ
3.
Лекция 1. Химическая термодинамика.Основные понятия.
4.
Химическая термодинамика – раздел физической химии, изучающийпревращение энергии в химических процессах и энергетические
характеристики различных веществ.
Система – часть физического мира, ограниченная каким-либо образом:
- изолированная – отсутствует обмен веществом и энергией с
окружающей средой (герметично закрытая смесь бензола с толуолом,
установленная в термостат);
- закрытая – отсутствует только обмен веществом с окружающей средой
(воздушный шарик);
- открытая – присутствует обмен веществом и энергией с окружающей
средой (капелька воды на листе, мечтающий на занятиях студент);
Независимые термодинамические параметры состояния – величины,
поддающиеся непосредственному измерению и характеризующие какоелибо макроскопическое свойство рассматриваемой системы:
- интенсивные – величина не зависит от массы: температура, давление;
- экстенсивные – величина пропорциональна массе: объем системы,
масса, количество вещества, концентрация и т. п.
Термодинамическое равновесие – состояние системы, при котором
значения параметров состояния одинаковы в любой точке системы, и
остаются таковыми во времени.
5.
Обратимый процесс – система бесконечно медленно (на практике исп.конечное время) переходит из одного состояния равновесия в другое
через непрерывный ряд промежуточных равновесных состояний.
N 2 3H 2 2 NH3
Необратимый процесс – процесс, который нельзя провести в
противоположном направлении через тот же непрерывный ряд
промежуточных равновесных состояний. Обычно реальные процессы,
протекающие самопроизвольно в одном направлении – в сторону
приближения к равновесному состоянию (прекращаются при его
достижении) Пример: теплопроводность, диффузия, испарение
перегретой жидкости.
Энергия – мера различных форм движения и взаимодействия материи
[Дж].
- внутренняя энергия [U] (полная энергия, включающая Ек. и Еп.
элементарных частиц, Е поступательного, колебательного, вращательного
движения; притяжения и отталкивания; внутримолекулярную и
внутриатомную химическую энергию; внутриядерную, гравитационную и
пр.);
- кинетическая [Eк.] – энергия движения системы (как целого);
- потенциальная [Eп.] – энергия положения и взаимодействия частиц
системы (как целого).
6.
Работа и Теплота – единственно возможные неравноценные формыпередачи энергии, зависящие от способа перехода системы из одного
состояния в другое.
Sdx dV
А pSdx
А pdV
Vb
А pdx
Va
Теплообмен не связан с изменением положения тел, составляющих
систему, а состоит в непосредственной передаче энергии между
молекулами тел при контакте.
Функция состояния системы – функция F(x,y) параметров состояния,
значение которой зависит только от этих параметров состояния, и не
определяется процессами, приводящими к этому состоянию (U, Еп., pV) .
dF
dF
dy
dF
dx
dx y
dy x
dU
dU
dU
dT
dV
dT V
dV T
7.
Первое начало термодинамики (Ю. Майер (1842г.); Дж. Джоуль (1843г.))В замкнутой системе сумма всех видов энергии постоянна, при их взаимных
превращениях энергия не теряется и не создается вновь (Р. Клаузиус).
Невозможно создать машину, которая совершает работу не затрачивая на нее
соответствующее количество энергии.
U A Q
Состояние 1 → Состояние 2 процесс А или процесс В, тогда:
U U 2 U1 AA QA AB QB
AA QA AB QB
Однако совсем не обязательно AA AB и QA QB
Работа (А) и теплота (Q) не являются функциями состояния системы, т.к. их
соотношение зависят от протекания процесса.
8.
Процессы при постоянном объеме:dV 0 A pdV 0
Тогда
U Q V - тепловая энергия процесса при постоянном объеме (в
данном случае является функцией состояния системы).
Протекают в закрытом сосуде, между тв. телами и жидкостями без
выделения газа, между газами (при условии, что число молекул остается
постоянным).
Процессы при постоянном давлении:
Система: Сост.№1 (m, p, T1, V1) → Сост.№2 (m, p, T2, V2)
U U 2 U1 A QP
U 2 U1 QP p(V2 V1 )
или QP U 2 U1 p(V2 V1 ) , или
QP (U 2 pV2 ) (U1 pV1 )
Величина H U pV называется энтальпией, [Дж] (функция сост.
системы).
Тогда QP H 2 H1 H - тепловая энергия процесса при постоянном
давлении (функция сост. системы).
Соотношение Qv и Qp: QP QV nRT )
9.
Эндотермический процесс – идет с поглощением тепловой энергии системой:QV 0
QP Н 0
Экзотермический процесс – идет с выделением тепловой энергии системой:
QP Н 0 QV 0
Стандартное состояние (условия) – нужны для сравнения энергетических
функций системы:
P 101,3кПа; T 2980 К
точно задано физическое (устойчивое) агрегатное состояние.
Энтальпия образования соединения - равна изменению энтальпии,
сопровождающему реакцию образования 1 моль этого соединения из
элементов или простых веществ при постоянном давлении.
Стандартная энтальпия образования соединения – f H 0 соответствует
стандартным условиям образования продуктов (для простых веществ =0).
1
2C 3H 2 O2 C2 H 5OH
2
f H 0 298(C2 H5OH ) 234,8кДж/моль
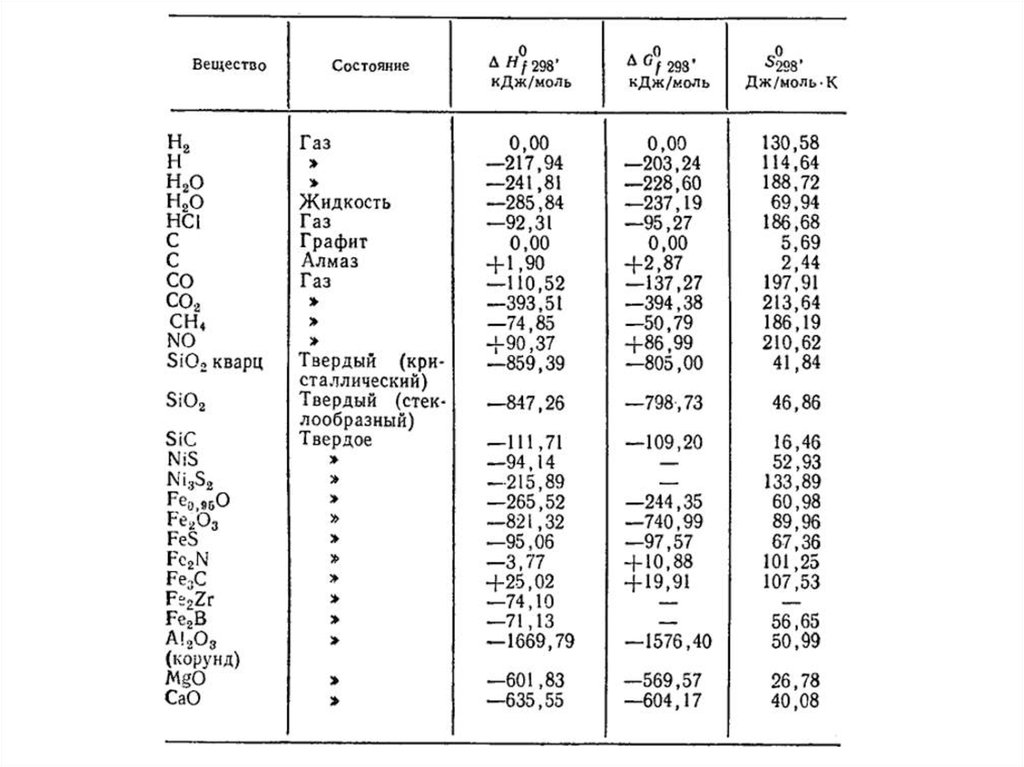
10.
Стандартные энтальпии образования некоторых веществ11.
Закон Г.И. Гесса (1840г.) Тепловой эффект химической реакции не зависит отпути перехода (промежуточных процессов), а зависит только от вида и
состояния исходных веществ и конечных продуктов.
f H 0 (2980 K ) f H 0 (продуктов) f H 0 ( реагентов)
f H 0 x (94,051 67,635) 26,416кКалл/моль
Справедлив для процессов при P=const, либо V=const.
12.
Тепловые эффекты получения веществ различными путями:Согласно закона Гесса:
Следствие №1:
H1 H 4 H 5 H 6 H 2 H 3
1
H 2 O2 H 2O f H 0 (Н 2O)(г) 241,84кДж/моль
2
1
Н 2O H 2 O2 f H 0 (разложения) 241,84кДж/моль
2
0
Следствие №2: С(графит) O2 CO2 f Н (1) 393,51кДж/моль
С(алмаз) O2 CO2 f Н 0 (2) 395,34кДж/моль
0
0
0
С ( графит) С (алмаз ) f Н (3) f Н (1) f Н (2) 1,83кДж/моль
f Н 0 (1) f Н 0 (2) f Н 0 (3)
13.
Следствие №3:1
H 2 O2 H 2O( газ )
2
f Н 0 (1) 241,83кДж/моль
1
H 2 O2 H 2O( жидкость) f Н 0 (2) 285,84кДж/моль
2
H 2O(газ) H 2O(жидкость)
f Н 0 (3) f Н 0 (1) f Н 0 (2) 44,01кДж/моль
14.
Второе начало термодинамикиПервое начало термодинамики не характеризует направленность и
самопроизвольность процессов. Однако процессы могут быть
самопроизвольными:
- газ заполняет весь имеющийся объем;
- тепло передается от более нагретого тела более холодному;
- диссоциация NaCl в воде;
- окисление Zn в реакции с CuSO4 (прямой процесс в элементе ДаниэляЯкоби) и пр.
и несамопроизвольными:
- сжатие газа в объеме,
- разложение CaCO3 до СО2 и CaО;
- восстановление Zn из ZnSO4 в реакции с медью (обратный процесс в
элементе Даниэля-Якоби) и пр.
15.
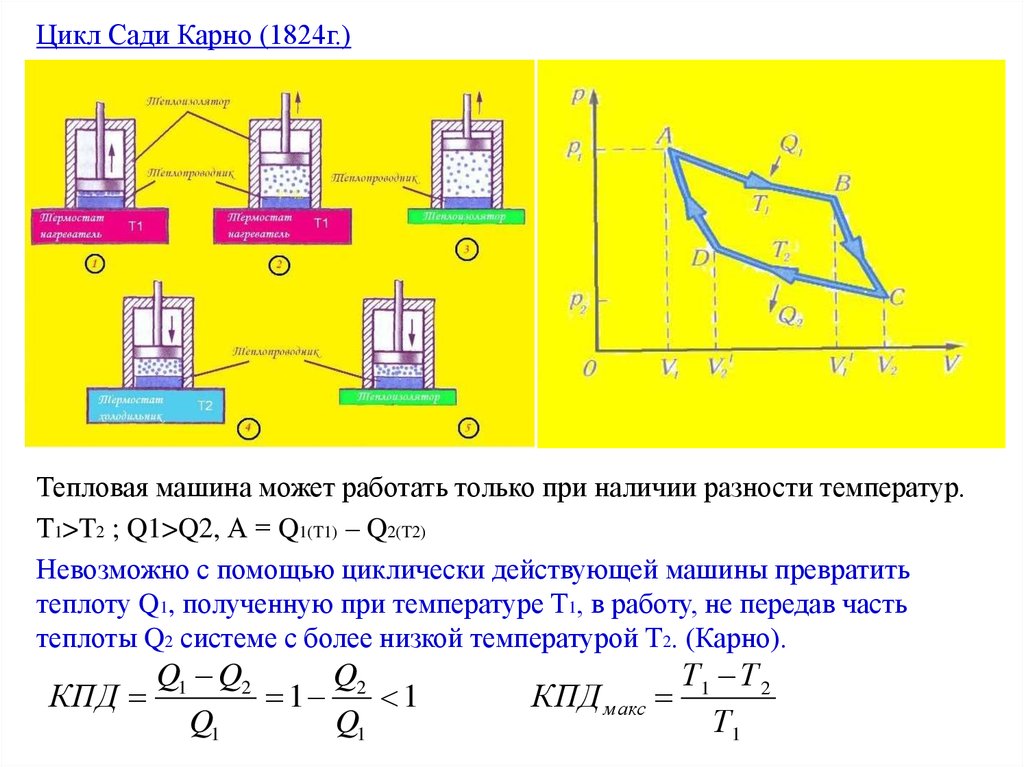
Цикл Сади Карно (1824г.)Тепловая машина может работать только при наличии разности температур.
Т1>T2 ; Q1>Q2, А = Q1(T1) – Q2(T2)
Невозможно с помощью циклически действующей машины превратить
теплоту Q1, полученную при температуре Т1, в работу, не передав часть
теплоты Q2 системе с более низкой температурой Т2. (Карно).
Q1 Q2
Q2
КПД
1
1
Q1
Q1
Т1 Т 2
КПД м акс
Т1
16.
Ни одно устройство не может извлечь работу из системы, которая находитсяна одном энергетическом уровне.
Теплота не может самопроизвольно переходить от менее нагретого тела к
более нагретому (Р. Клаузиус).
Невозможно построить периодически
действующую машину, единственным
результатом действия которой было бы
совершение механической работы за счет
охлаждения теплового резервуара
(Кельвин и Планк).
Разность температур в течение времени
совершения работы постоянно уменьшается,
следовательно, количество энергии, которое может быть потрачено на работу
постоянно уменьшается, а количество («связанной») энергии, которую уже
нельзя превратить в работу неуклонно растет.
Для учета недоступной энергии Р. Клаузиус (1865г.) предложил ввести
величину энтропии [S]
Q
dS
обр
Т
17.
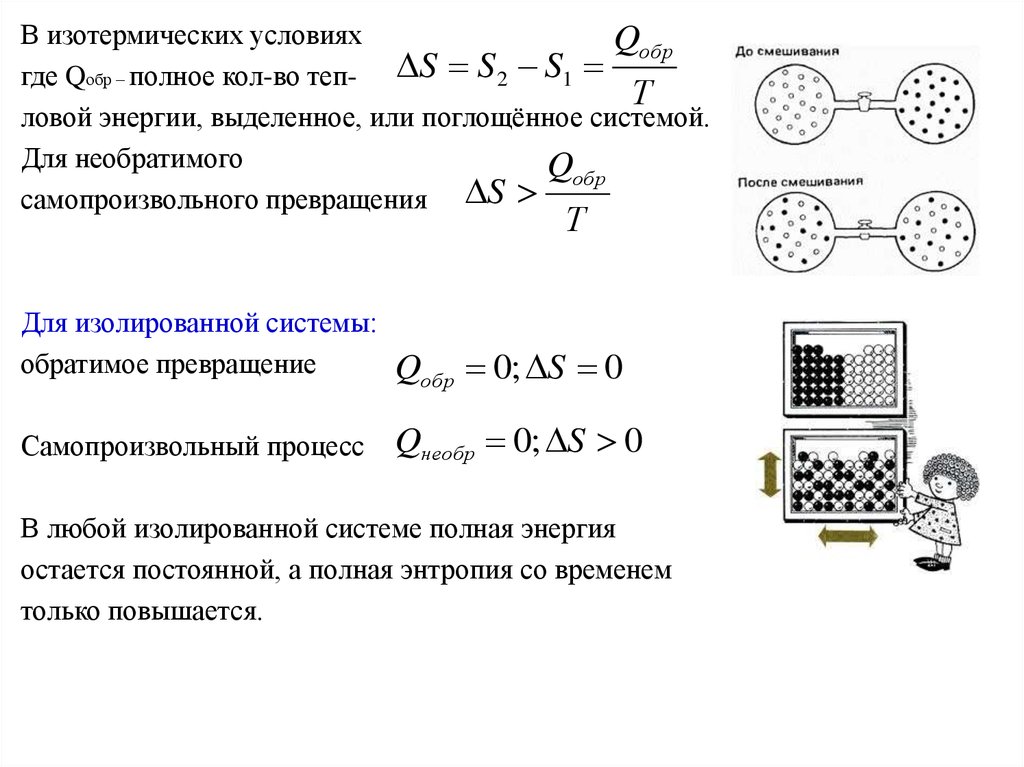
В изотермических условияхQобр
где Qобр – полное кол-во теп- S S 2 S1
Т
ловой энергии, выделенное, или поглощённое системой.
Для необратимого
Qобр
самопроизвольного превращения S
Т
Для изолированной системы:
обратимое превращение
Qобр 0; S 0
Самопроизвольный процесс
Qнеобр 0; S 0
В любой изолированной системе полная энергия
остается постоянной, а полная энтропия со временем
только повышается.
18.
Статистическая интерпретация энтропии.Шарики в коробке – макросостояние.
Черные к черным, белые к белым (вариант упаковки
шариков) – микросостояние.
W – термодинамическая вероятность – число
микросостояний, которыми может быть реализовано
R
данное макросостояние. Тогда:
S k ln W
ln W
Энтропия – мера беспорядка
Na
в системе (функция состояния).
Третье начало термодинамики – энтропия чистых веществ, существующих в
виде идеальных кристаллов, при температуре абсолютного нуля равна нулю.
S k ln W 0;W 1
19.
Третье начало позволяет определить абсолютную энтропиюSТ [Дж/(моль*К)] всех чистых веществ при любой температуре.
тела
0 K нагрев
_ тв
. _
Т пл нагрев
_ жидкости
Т кип нагрев
_ газа
Т
S S T S 0
Tп л
0K
Tки п
Tп л
С p (ж)
T
С p (тв)
T
H пл
dT
Т пл
T
С p (г)
H кип
dT
dT
Т кип
T
Tки п
аА bB cC dD
ST cST (C) dST ( D) aST ( A) bST ( B)
ST ST (продуктов) ST ( реагентов)
20.
Свободная энергия (рассматривается закрытая система при T=const.)Обратимый процесс
Необратимый процесс
S
Qобр
S
Т
Qобр Т S 0
Qнеобр
Т
Qнеобр Т S 0
Если P = const., то:
QP Т S 0
QP Т S 0
Или H Т S 0
H Т S 0
G (изобарно-изотермический потенциал, функция состояния) – свободная
энергия Гиббса.
G H ТS
При T=const.
G H Т S
G H Т S
или
H G Т S
21.
Обратимый процесс (равновесный)Необратимый процесс
H Т S 0
H Т S 0
G 0
G 0
Если T = const. и V = const.:
U Т S 0
U Т S 0
F (изохорно-изотермический потенциал, функция состояния) – свободная
энергия Гельмгольца.
F U ТS
F 0
F 0
Для реакции: аА bB cC dD
G 0 - наступило термодинамическое равновесие;
G 0 - самопроизвольно протекает прямой процесс образования
продуктов С и D;
G 0 - прямой процесс самопроизвольно протекать не может (возможен
самопроизвольный обратный процесс).
22.
Примеры реакций1.
2980 K ; _ P 101,3кПа
H 0; _ S 0
2 H 2O 2 ( Г ) 2 H 2О( Г ) О2 ( Г )
H 211,43кДж ; _ S 129 Дж; _ G 250,37кДж
2.
H 0; _ S 0
N2 ( Г ) 2O2 2 NO2( Г )
H 67,83кДж ; _ S 122 Дж; _ G 103,83кДж
3.
H 0; _ S 0
N2 ( Г ) 3H 2 2 NH3( Г )
H 98,53кДж ; _ S 195 Дж; _ G 33,49кДж
4.
H 0; _ S 0
N 2О4 ( Г ) 2 NО2 ( Г )
H 58,20кДж ; _ S 177 Дж; _ G 5,44кДж
23.
Свободная энергия образования соединения - равна изменению свободнойэнергии, сопровождающему реакцию образования 1 моль сложного соединения
из элементов или простых веществ при постоянном давлении.
Стандартная свободная энергия образования соединения – f G 0 соответствует
стандартным условиям образования продуктов из элементов или простых
веществ (для простых веществ f G 0 0 ).
f G0 (2980 K ) f G0 (продуктов ) f G0 ( реагентов)
f H 0 (2980 K ) f H 0 (продуктов ) f H 0 ( реагентов)
f S 0 (2980 K ) f S 0 (продуктов ) f S 0 ( реагентов)
24.
25.
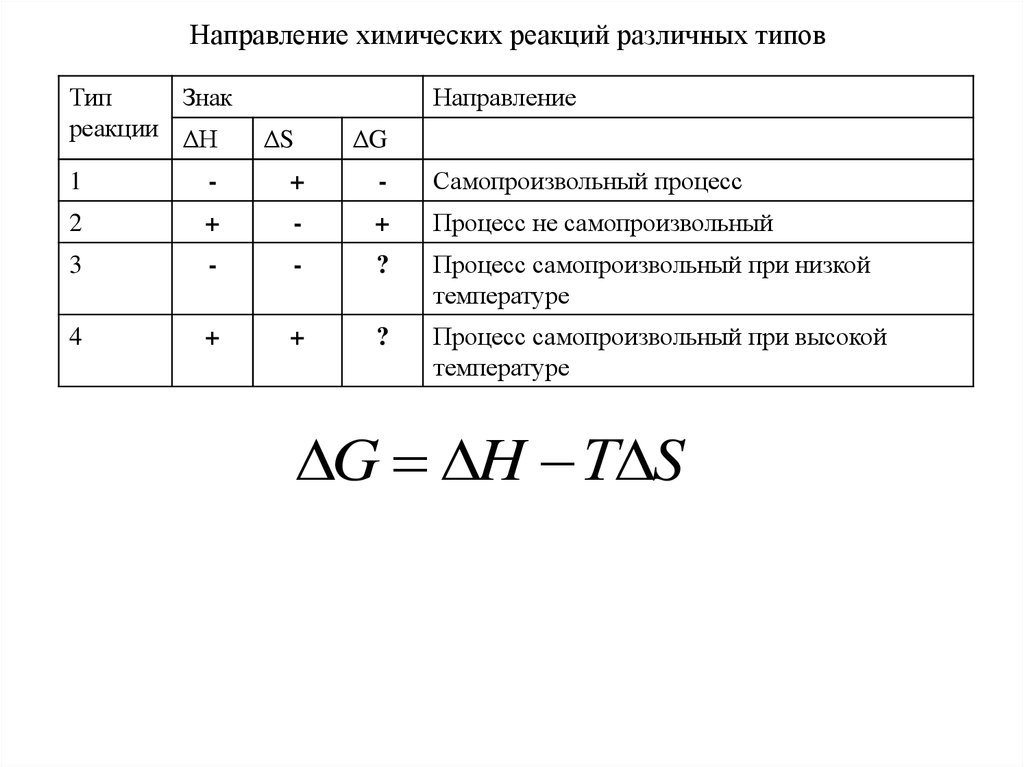
Направление химических реакций различных типовТип
Знак
реакции ΔН
Направление
ΔS
ΔG
1
-
+
-
Самопроизвольный процесс
2
+
-
+
Процесс не самопроизвольный
3
-
-
?
Процесс самопроизвольный при низкой
температуре
4
+
+
?
Процесс самопроизвольный при высокой
температуре
G H Т S




















 Химия
Химия








