Похожие презентации:
Углеводы. Классификация углеводов
1. УГЛЕВОДЫ
900igr.net2. Содержание
Классификация углеводовМоносахариды
Нахождение в природе
Изомерия
Получение
Физические свойства
Химические свойства
Источники информации
3. Классификация углеводов
Углеводы входят в состав клеток и тканей всехрастительных и животных организмов и по массе
составляют основную часть органического
вещества на Земле. На долю углеводов
приходится около 80% сухого вещества растений
и около 20% животных. Растения синтезируют
углеводы из неорганических соединений углекислого газа и воды (СО2 и Н2О).
Углеводы делятся на три группы: моносахариды
(монозы), дисахариды(биозы) и полисахариды
(полиозы).
4. Углеводы
Моносахаридыпентозы – рибоза C5H10O5, дезоксирибоза C5H10O4,
гексозы – C6H12O6 глюкоза, фруктоза.
Дисахариды
Сахароза, мальтоза C12H22O11 .
Полисахариды
Крахмал, целлюлоза, гликоген, хитин (C6H10O5 )n
5. Моносахариды
Углеводы имеют общую формулу Cn(H2O)m.Моносахариды являются
гетерофункциональными соединениями. В их
молекулах одновременно содержатся и
карбонильная (альдегидная или кетонная) и
несколько гидроксильных групп. В зависимости
от этого моносахариды подразделяются на
альдозы (в моносахариде содержится
альдегидная группа) и кетозы (содержится
кетогруппа).
6. Нахождение в природе
В свободном виде глюкоза содержится почти вовсех органах зеленых растений. Особенно её
много в соке винограда, поэтому глюкозу
иногда называют виноградным сахаром. Мёд в
основном состоит из смеси глюкозы с
фруктозой.
В организме человека глюкоза содержится в
мышцах, в крови и в небольших количествах во
всех клетках.
7. Изомерия
Наиболее часто встречаются два моносахарида: глюкоза ифруктоза. Они являются изомерами и имеют молекулярну
формулу С6H12O6.Глюкоза является альдегидоспиртом, а
фруктоза – кетоноспиртом.
глюкоза – это альдоза
фруктоза – это кетоза
8. Получение
В свободном виде в природе встречаетсяпреимущественно глюкоза. Она же является
структурной единицей многих полисахаридов.
Другие моносахариды в свободном состоянии
встречаются редко и в основном известны как
компоненты олиго- и полисахаридов. В природе
глюкоза получается в результате реакции
фотосинтеза:
6CO2 + 6H2O → C6H12O6(глюкоза) + 6O2
9.
Впервые глюкоза получена в 1811 году русскимхимиком Г.Э.Кирхгофом при гидролизе
крахмала.
Позже синтез моносахаридов из формальдегида в
щелочной среде предложен А.М.Бутлеровым.
O
||
6 C–H
|
H
Ca(OH)2
→
C6H12O6
10.
В промышленности глюкозу получаютгидролизом крахмала в присутствии
серной кислоты.
H2SO4,t°
(C6H10O5)n + nH2O →
крахмал
nC6H12O6
глюкоза
11. Физические свойства
Моносахариды – твердые вещества, легкорастворимые в воде, плохо – в спирте и совсем
нерастворимые в эфире. Водные растворы имеют
нейтральную реакцию на лакмус. Большинство
моносахаридов обладают сладким вкусом,
однако меньшим, чем свекловичный сахар.
12. Химические свойства
Моносахариды проявляют свойства спиртов икарбонильных соединений.
Вещества, проявляющие характерные свойства двух
различных классов органических соединений,
имеют двойственную функцию.
13.
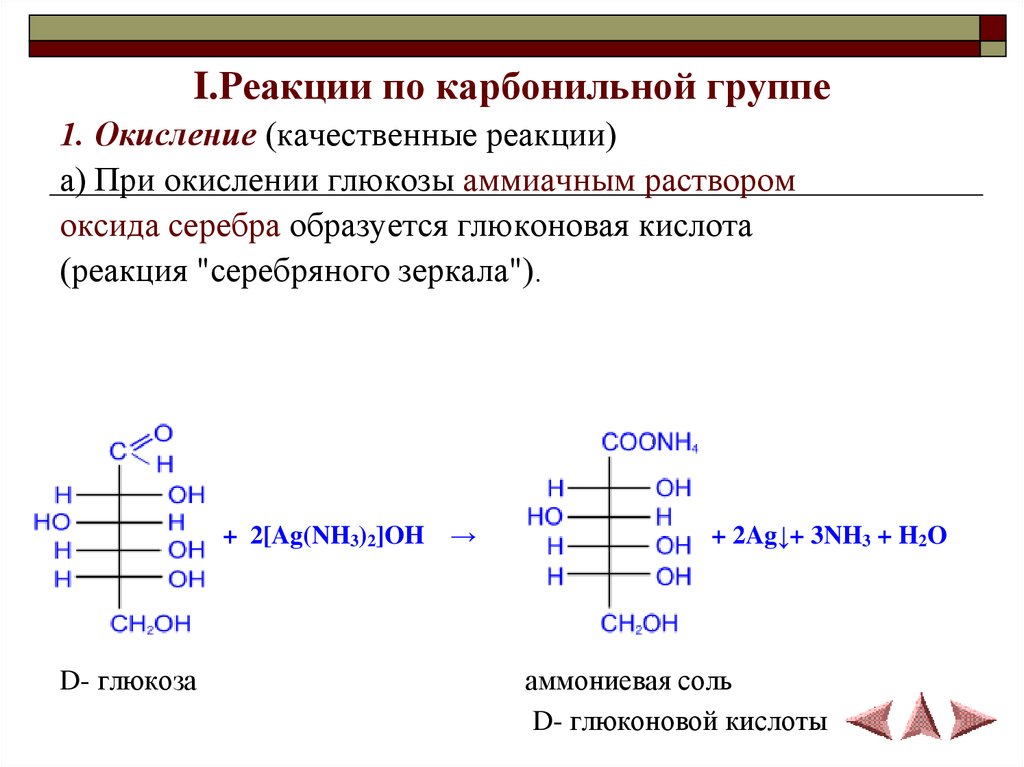
I.Реакции по карбонильной группе1. Окисление (качественные реакции)
а) При окислении глюкозы аммиачным раствором
оксида серебра образуется глюконовая кислота
(реакция "серебряного зеркала").
+ 2[Ag(NH3)2]OH
D- глюкоза
→
+ 2Ag↓+ 3NH3 + H2O
аммониевая соль
D- глюконовой кислоты
14.
б) Реакция глюкозы с гидроксидом меди принагревании так же приводит к образованию
глюконовой кислоты.
O
O
//
//
t
CH2OH(CHOH)4 – C + Cu(OH)2 → CH2OH(CHOH)4 – C + CuOH ↓+ H2O
\
\ желтый
H
OH
2CuOH → Cu2O↓ + H2O
красный
15.
2. ВосстановлениеВосстановление сахаров приводит к многоатомным
спиртам. В качестве восстановителя используют
водород в присутствии никеля, алюмогидрид лития
и др.
LiAlH4
+ H2 →
D- глюкоза
D- сорбит
16.
II. Реакции по гидроксильным группам1. Алкилирование (образование простых эфиров).
При действии метилового спирта в присутствии
газообразного хлористого водорода атом водорода
гликозидного гидроксила замещается на метильную
группу.
+ СH3ОН
a, D- глюкопираноза
HCl (газ)
→
+ H2О
метил- a,
D- глюкопиранозид
17.
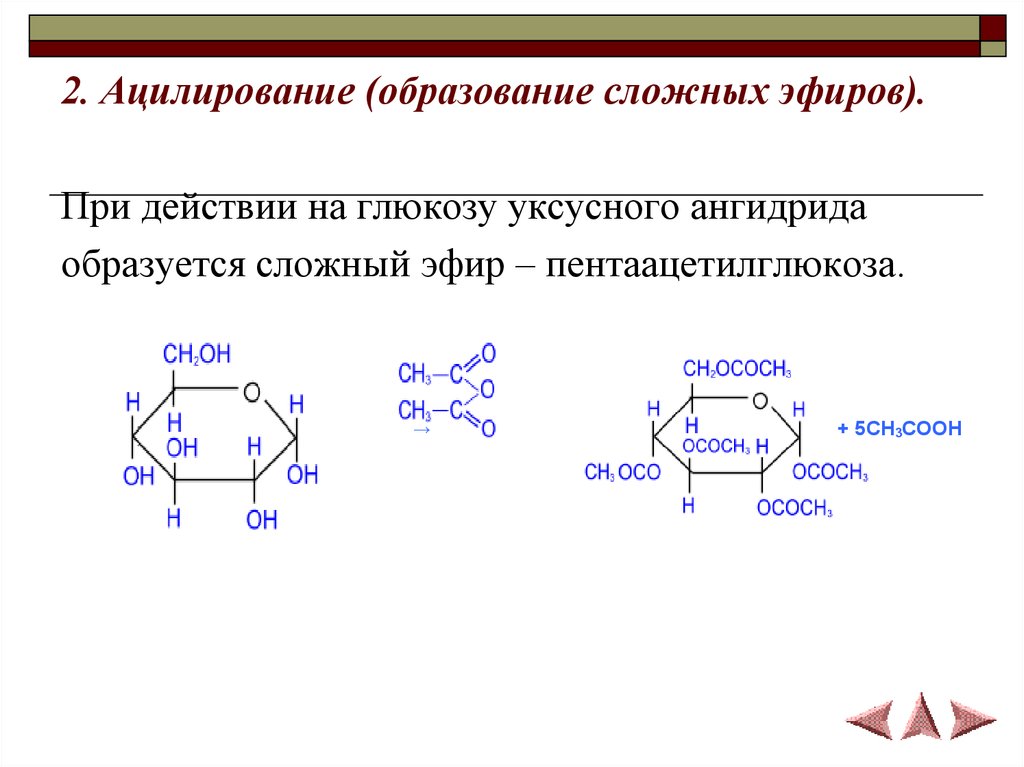
2. Ацилирование (образование сложных эфиров).При действии на глюкозу уксусного ангидрида
образуется сложный эфир – пентаацетилглюкоза.
→
+ 5CH3COOH
18.
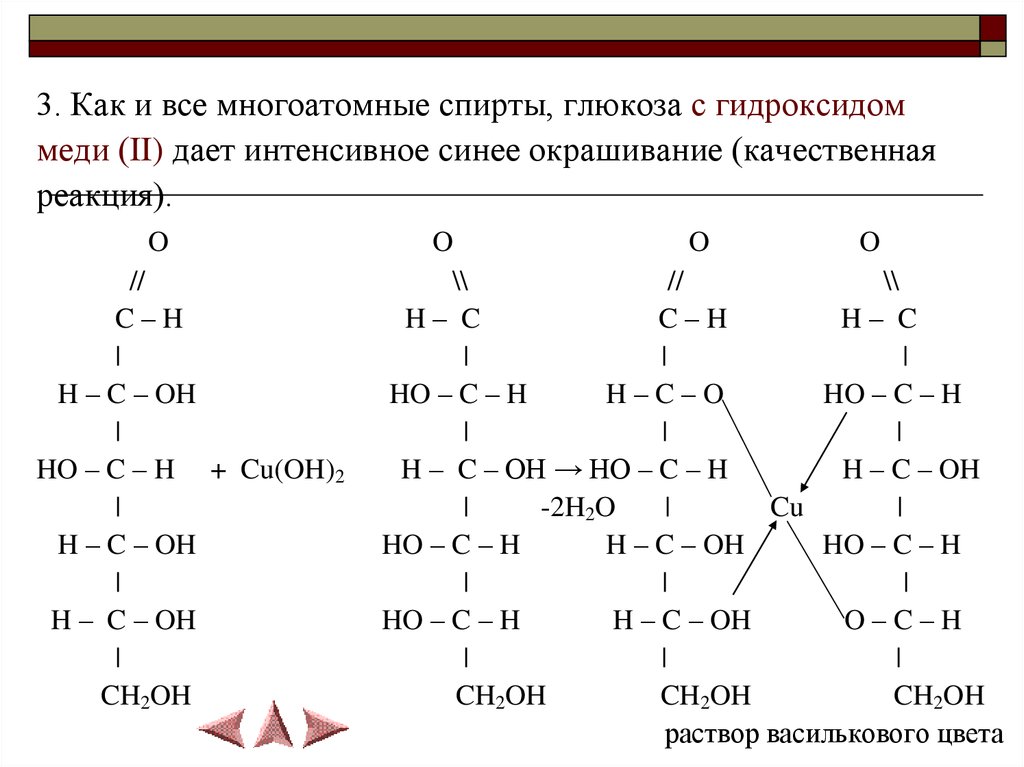
3. Как и все многоатомные спирты, глюкоза с гидроксидоммеди (II) дает интенсивное синее окрашивание (качественная
реакция).
O
//
C–H
|
H – C – OH
|
HO – C – H + Cu(OH)2
|
H – C – OH
|
H – C – OH
|
CH2OH
O
O
O
\\
//
\\
H– C
C–H
H– C
|
|
|
HO – C – H
H–C–O
HO – C – H
|
|
|
H – C – OH → HO – C – H
H – C – OH
|
-2H2O
|
Cu
|
HO – C – H
H – C – OH
HO – C – H
|
|
|
HO – C – H
H – C – OH
O–C–H
|
|
|
CH2OH
CH2OH
CH2OH
раствор василькового цвета
19.
III. Специфические реакцииГлюкоза характеризуется и некоторыми
специфическими свойствами – процессами
брожения. Брожением называется
расщепление молекул сахаров под воздействием
ферментов (энзимов).
а) спиртовое брожение
C6H12O6 → 2C2H5OH + 2CO2
глюкоза
этиловый спирт
20.
б) молочнокислое брожениемолочно-кислые
бактерии
C6H12O6
→
2 CH3 – CH – COOH
|
OH
молочная кислота
в) лимоннокислое брожение OH
[O]
|
C6H12O6 → HOOC – CH2 – C – CH2 – COOH
грибки
|
COOH
лимонная кислота
21.
г) маслянокислое брожениемасляно-кислые
бактерии
C6H12O6 → CH3 – CH2 – CH2 – COOH + 2H2O +2CO2
масляная кислота
Упомянутые виды брожения, вызываемые
микроорганизмами, имеют широкое практическое
значение. Например, спиртовое – для получения
этилового спирта, в виноделии, пивоварении и т.д.,
а молочнокислое – для получения молочной
кислоты и кисломолочных продуктов, лимоннокислое
- для получения лимонной кислоты.
22. IV.Горение и разложение глюкозы.
Как все органические вещества, глюкозаможет гореть и разлагаться при
нагревании:
C6H12O6 + 6O2 → 6H2O + 6CO2
t
C6H12O6 → 6H2O + 6C
23. Источники информации
1. Денисов В.Г. Химия. 10 класс. Поурочныепланы. – Волгоград: Учитель, 2004.
2. Аргишева А.И., Задумина Э.А. Химия:
Подготовка к государственному
централизованному тестированию. – Саратов:
Лицей, 2002.
3. Петров А.А., Бальян Х.В., Трощенко А.Т.
Органическая химия. Учебник для вузов./ Под
ред. Петрова А.А. – М.: Высшая школа, 1981
24.
4. Хомченко Г.П. Пособие по химии дляпоступающих в вузы. – М.: ООО «Издательство
Новая Волна», 2002.
5. Курмашева К.К. Химия в таблицах и схемах.
Серия «Школа в клеточку». – М.: «Лист», 1997.
6. Потапов В.М., Чертков И.Н. Строение и
свойства органических веществ. Пособие для
учащихся 10 кл. – М.: Просвещение, 1980.
7. Штремплер Г.И. Тесты, вопросы и ответы по
химии: Книга для учащихя 8-11 классов
общеобразовательных учреждений. – М.:
Просвещение, 1999.
25.
8. Малыхин З.В. Тестовые задания для проверкизнаний учащихся по органической химии. – М.: ТЦ
«Сфера», 2001.
9. Городничева И.Н. Контрольные и
проверочные работы по химии. 8-11 класс. – М.:
Аквариум, 1997.
10. Гаврусейко Н.П. Проверочные работы по
органической химии: Дидактический материал:
Пособие для учителя. – М.: Просвещение, 1991.






















 Химия
Химия








