Похожие презентации:
Моносахариды. Классификация углеводов
1. МОНОСАХАРИДЫ
Выполнила:Черемных Алёна
Группа 16 «М»
2. Содержание
Классификация углеводовМоносахариды
Нахождение в природе
Изомерия
Получение
Физические свойства
Химические свойства
Применение глюкозы
3. Классификация углеводов
Углеводы входят в состав клеток и тканей всехрастительных и животных организмов и по массе
составляют основную часть органического
вещества на Земле. На долю углеводов
приходится около 80% сухого вещества растений
и около 20% животных. Растения синтезируют
углеводы из неорганических соединений углекислого газа и воды (СО2 и Н2О).
Углеводы делятся на три группы: моносахариды
(монозы), дисахариды(биозы) и полисахариды
(полиозы).
4. Углеводы
Моносахаридыпентозы – рибоза C5H10O5, дезоксирибоза C5H10O4,
гексозы – C6H12O6 глюкоза, фруктоза, манноза,
галактоза.
Дисахариды
Сахароза, мальтоза C12H22O11 .
Полисахариды
Крахмал, целлюлоза, гликоген, хитин (C6H10O5 )n
5. Моносахариды
Углеводы имеют общую формулу Cn(H2O)m.Моносахариды являются
гетерофункциональными соединениями. В их
молекулах одновременно содержатся и
карбонильная (альдегидная или кетонная) и
несколько гидроксильных групп. В зависимости
от этого моносахариды подразделяются на
альдозы (в моносахариде содержится
альдегидная группа) и кетозы (содержится
кетогруппа).
6. Нахождение в природе
В свободном виде глюкоза содержится почти вовсех органах зеленых растений. Особенно её
много в соке винограда, поэтому глюкозу
иногда называют виноградным сахаром. Мёд в
основном состоит из смеси глюкозы с
фруктозой.
В организме человека глюкоза содержится в
мышцах, в крови и в небольших количествах во
всех клетках.
7. Изомерия Линейные формы
Наиболее часто встречаются два моносахарида: глюкоза ифруктоза. Они являются изомерами и имеют молекулярну
формулу С6H12O6.Глюкоза является альдегидоспиртом, а
фруктоза – кетоноспиртом.
D-глюкоза
L-глюкоза
глюкоза – это альдоза
D-фруктоза
L-фруктоза
фруктоза – это кетоза
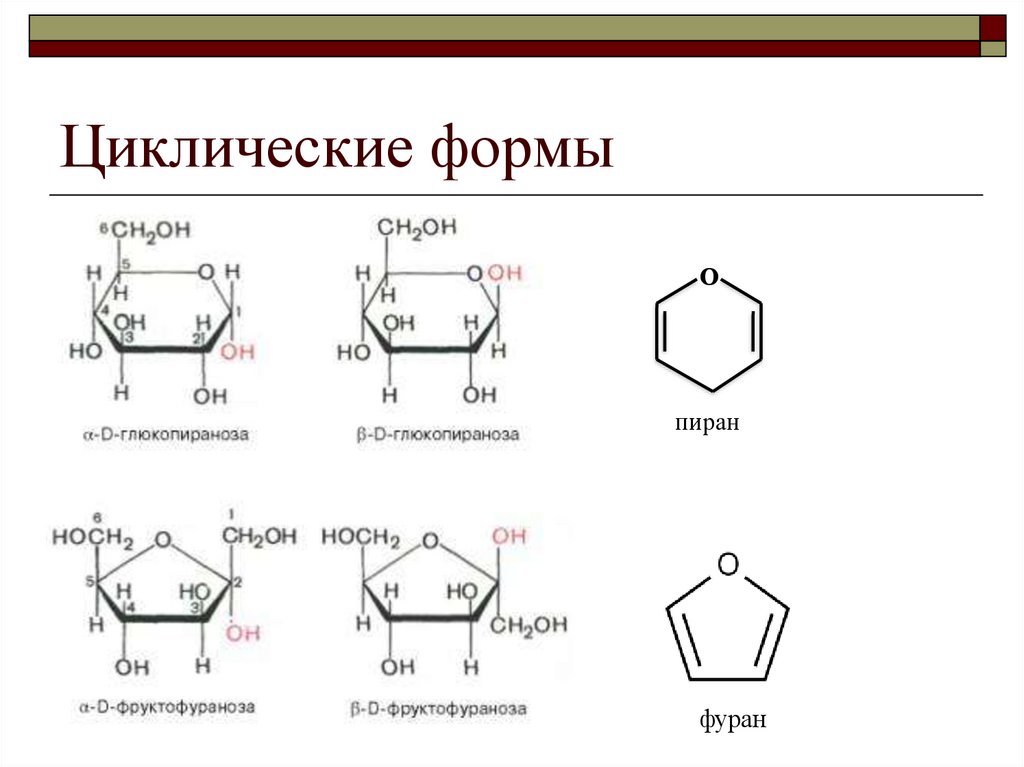
8. Циклические формы
Опиран
фуран
9. Получение
В свободном виде в природе встречаетсяпреимущественно глюкоза. Она же является
структурной единицей многих полисахаридов.
Другие моносахариды в свободном состоянии
встречаются редко и в основном известны как
компоненты олиго- и полисахаридов. В природе
глюкоза получается в результате реакции
фотосинтеза:
6CO2 + 6H2O → C6H12O6(глюкоза) + 6O2
10.
Впервые глюкоза получена в 1811 году русскимхимиком
Г.Э.Кирхгофом
при
гидролизе
крахмала.
Позже синтез моносахаридов из формальдегида в
щелочной среде предложен А.М.Бутлеровым.
O
||
6 C–H
|
H
Ca(OH)2
→
Муравьиный альдегид
C6H12O6
11.
В промышленности глюкозу получаютгидролизом крахмала в присутствии
серной кислоты.
H2SO4,t°
(C6H10O5)n + nH2O →
крахмал
nC6H12O6
глюкоза
12. Физические свойства
Моносахариды–
кристаллические
белые
вещества, легко растворимые в воде, плохо – в
спирте и совсем нерастворимые в эфире.
Большинство моносахаридов обладают сладким
вкусом.
13. Химические свойства
Моносахариды проявляют свойства спиртов икарбонильных соединений (вступают в химические
реакции как по карбонильной так и по гидроксильной
группам).
14.
I.Реакции по карбонильной группе1. Окисление (качественные реакции)
При окислении глюкозы аммиачным раствором оксида
серебра образуется глюконовая кислота
(реакция "серебряного зеркала").
+ 2[Ag(NH3)2]OH
D- глюкоза
→
+ 2Ag↓+ 3NH3 + H2O
аммониевая соль D- глюконовой кислоты
15.
б) Реакция глюкозы с гидроксидом меди при нагревании так жеприводит к образованию глюконовой кислоты.
Как и все многоатомные спирты, глюкоза с гидроксидом меди
(II) дает интенсивное синее окрашивание (качественная
реакция).
O
O
//
//
t
CH2OH(CHOH)4 – C + Cu(OH)2 → CH2OH(CHOH)4 – C + CuOH ↓+ H2O
\
голубой
желтый
H
OH
t
2СuОH → Cu2O + H2O
желтый
красный
16.
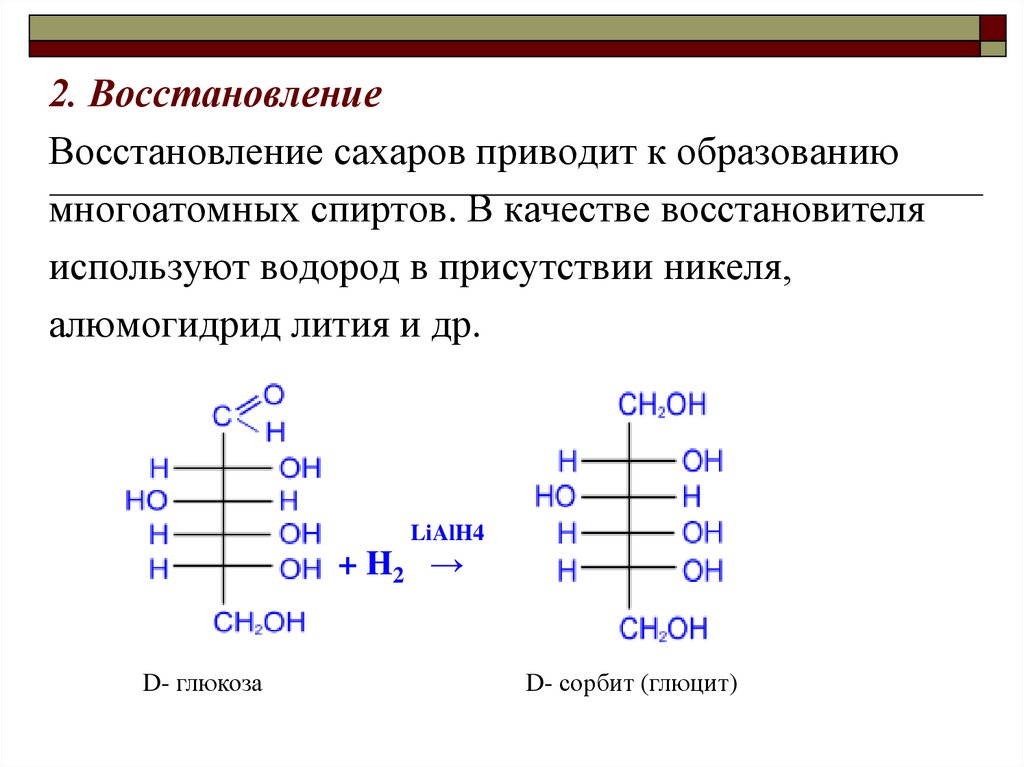
2. ВосстановлениеВосстановление сахаров приводит к образованию
многоатомных спиртов. В качестве восстановителя
используют водород в присутствии никеля,
алюмогидрид лития и др.
LiAlH4
+ H2 →
D- глюкоза
D- сорбит (глюцит)
17.
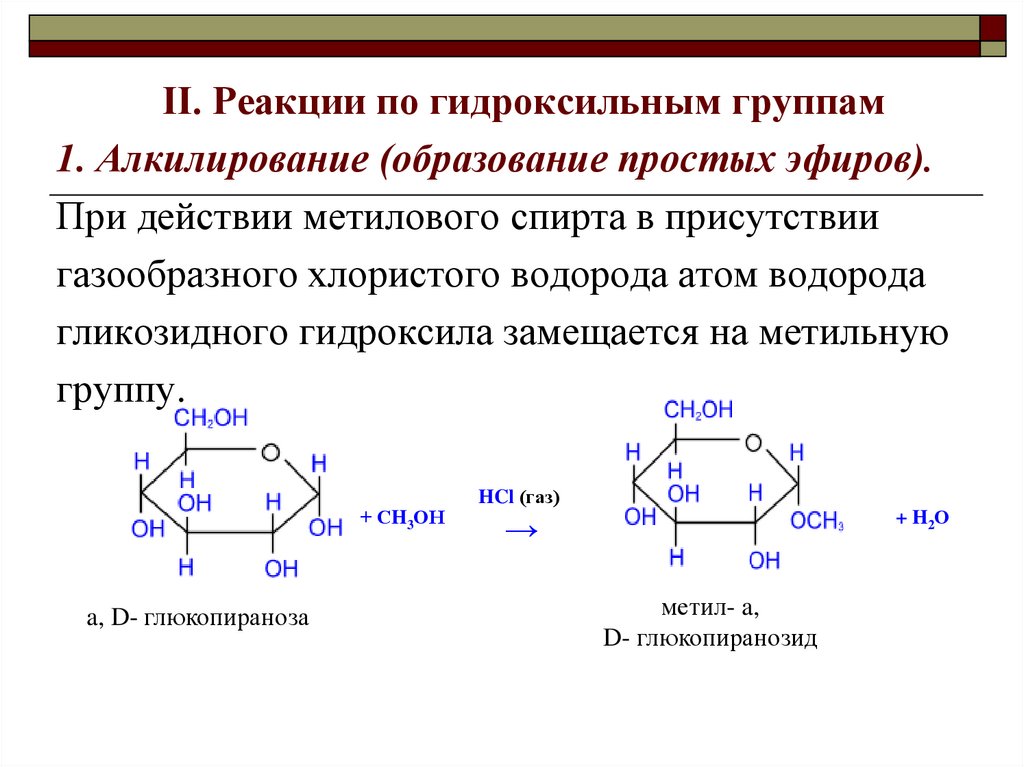
II. Реакции по гидроксильным группам1. Алкилирование (образование простых эфиров).
При действии метилового спирта в присутствии
газообразного хлористого водорода атом водорода
гликозидного гидроксила замещается на метильную
группу.
+ СH3ОН
a, D- глюкопираноза
HCl (газ)
+ H2О
→
метил- a,
D- глюкопиранозид
18.
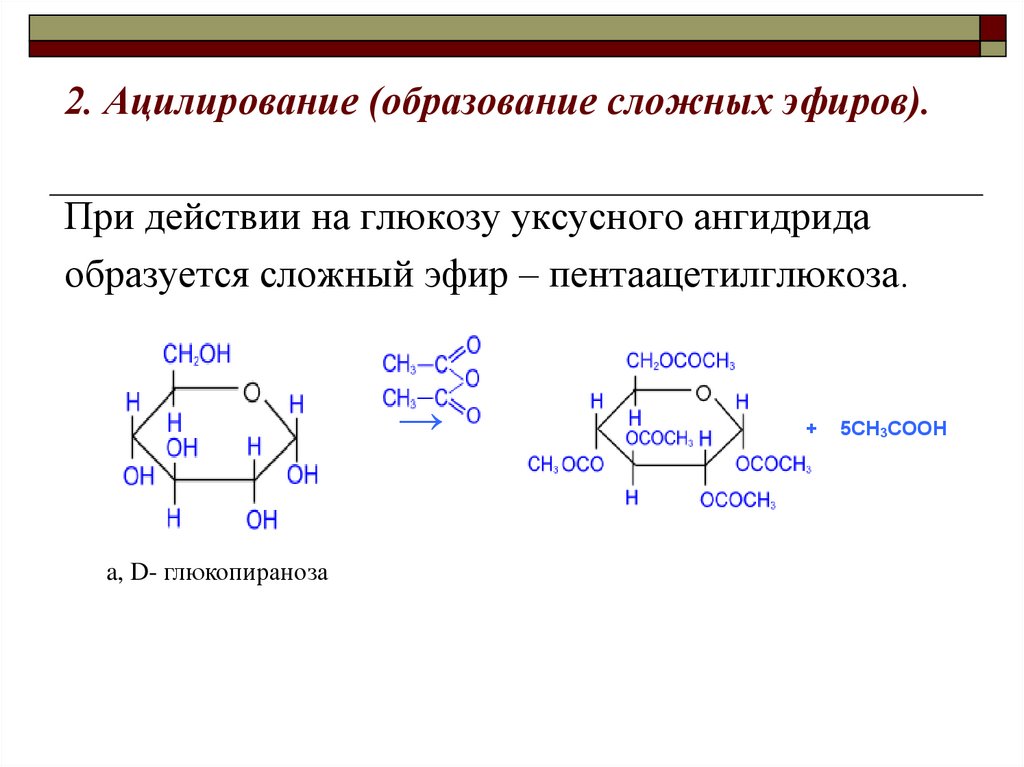
2. Ацилирование (образование сложных эфиров).При действии на глюкозу уксусного ангидрида
образуется сложный эфир – пентаацетилглюкоза.
→
a, D- глюкопираноза
+
5CH3COOH
19.
III. Специфические реакцииГлюкоза характеризуется и некоторыми
специфическими свойствами – процессами брожения.
Брожением называется расщепление молекул сахаров
под воздействием ферментов (энзимов).
а) спиртовое брожение
C6H12O6 → 2C2H5OH + 2CO2
глюкоза этиловый спирт
20.
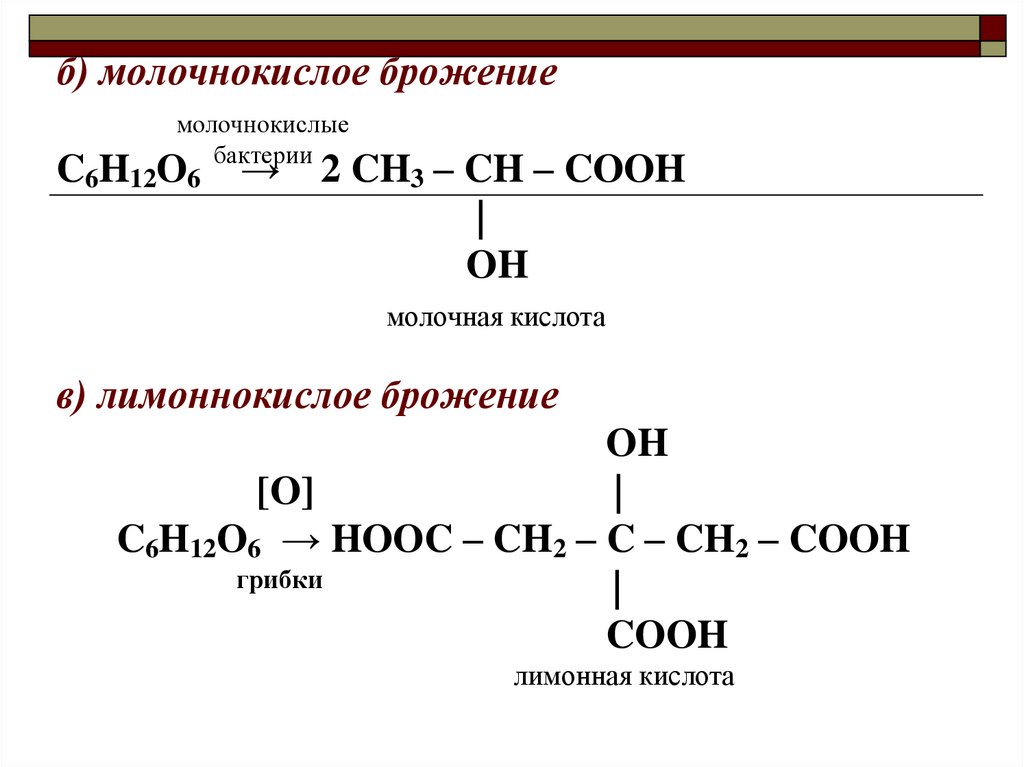
б) молочнокислое брожениемолочнокислые
бактерии
C6H12O6 → 2 CH3
– CH – COOH
|
OH
молочная кислота
в) лимоннокислое брожение
OH
[O]
|
C6H12O6 → HOOC – CH2 – C – CH2 – COOH
грибки
|
COOH
лимонная кислота
21.
г) масляно-кислое брожениемасляно-кислые
бактерии
C6H12O6 → CH3 – CH2 – CH2 – COOH + 2H2O +2CO2
масляная кислота
Упомянутые виды брожения, вызываемые
микроорганизмами, имеют широкое практическое
значение. Например, спиртовое – для получения
этилового спирта, в виноделии, пивоварении и т.д.,
а молочнокислое – для получения молочной
кислоты и кисломолочных продуктов, лимоннокислое
- для получения лимонной кислоты.
22. IV.Горение и разложение глюкозы.
Как все органические вещества, глюкозаможет гореть и разлагаться при
нагревании:
C6H12O6 + 6O2 → 6H2O + 6CO2
t
C6H12O6 → 6H2O + 6C
23. Применение моносахаридов
В пищевой промышленности глюкоза используется какзаменитель сахарозы;
Моносахариды
применяются
в
кондитерской
промышленности при изготовлении мягких конфет,
десертных сортов шоколада, тортов и различных
диетических изделий;
В хлебопечении глюкоза улучшает условия брожения,
придает пористость и хороший вкус изделиям, замедляет
очерствение;
24.
Используются в производстве мороженого - занижаютточку замерзания, увеличивает его твердость;
Используются при производстве фруктовых консервов,
соков, ликеров, вин, безалкогольных напитков;
В молочной промышленности при изготовлении
молочных продуктов и продуктов детского питания
рекомендуется использовать глюкозу в определенной
пропорции с сахарозой для придания этим продуктам
более высокой питательной ценности;
Кристаллическую глюкозу используют для питания
больных, травмированных, выздоравливающих, а также
людей, работающих с большими перегрузками;
25.
Медицинскую глюкозу применяют в антибиотиках идругих лекарственных препаратах, в том числе для
внутривенных инъекций, и для получения витамина С;
Фруктоза используется как заменитель сахара (для
диабетиков);
Техническая глюкоза находит применение в качестве
восстановителя
в
кожевенном
производстве,
в
текстильном - при производстве вискозы;
Моносахариды используются в качестве питательной
среды
при
выращивании
различных
видов
микроорганизмов в медицинской и микробиологической
промышленности.
26.
Спасибо за внимание!27. Источники информации
1. Денисов В.Г. Химия. 10 класс. Поурочныепланы. – Волгоград: Учитель, 2004.
2. Аргишева А.И., Задумина Э.А. Химия:
Подготовка к государственному
централизованному тестированию. – Саратов:
Лицей, 2002.
3. Петров А.А., Бальян Х.В., Трощенко А.Т.
Органическая химия. Учебник для вузов./ Под
ред. Петрова А.А. – М.: Высшая школа, 1981
28.
4. Хомченко Г.П. Пособие по химии дляпоступающих в вузы. – М.: ООО «Издательство
Новая Волна», 2002.
5. Курмашева К.К. Химия в таблицах и схемах.
Серия «Школа в клеточку». – М.: «Лист», 1997.
6. Потапов В.М., Чертков И.Н. Строение и
свойства органических веществ. Пособие для
учащихся 10 кл. – М.: Просвещение, 1980.
7. Штремплер Г.И. Тесты, вопросы и ответы по
химии: Книга для учащихя 8-11 классов
общеобразовательных учреждений. – М.:
Просвещение, 1999.
29.
8. Малыхин З.В. Тестовые задания для проверкизнаний учащихся по органической химии. – М.: ТЦ
«Сфера», 2001.
9. Городничева И.Н. Контрольные и
проверочные работы по химии. 8-11 класс. – М.:
Аквариум, 1997.
10. Гаврусейко Н.П. Проверочные работы по
органической химии: Дидактический материал:
Пособие для учителя. – М.: Просвещение, 1991.
























 Химия
Химия








