Похожие презентации:
Углеводы. Сn(H2O)m – общая формула углеводов
1.
2.
Сn(H2O)m –общая формула
углеводов
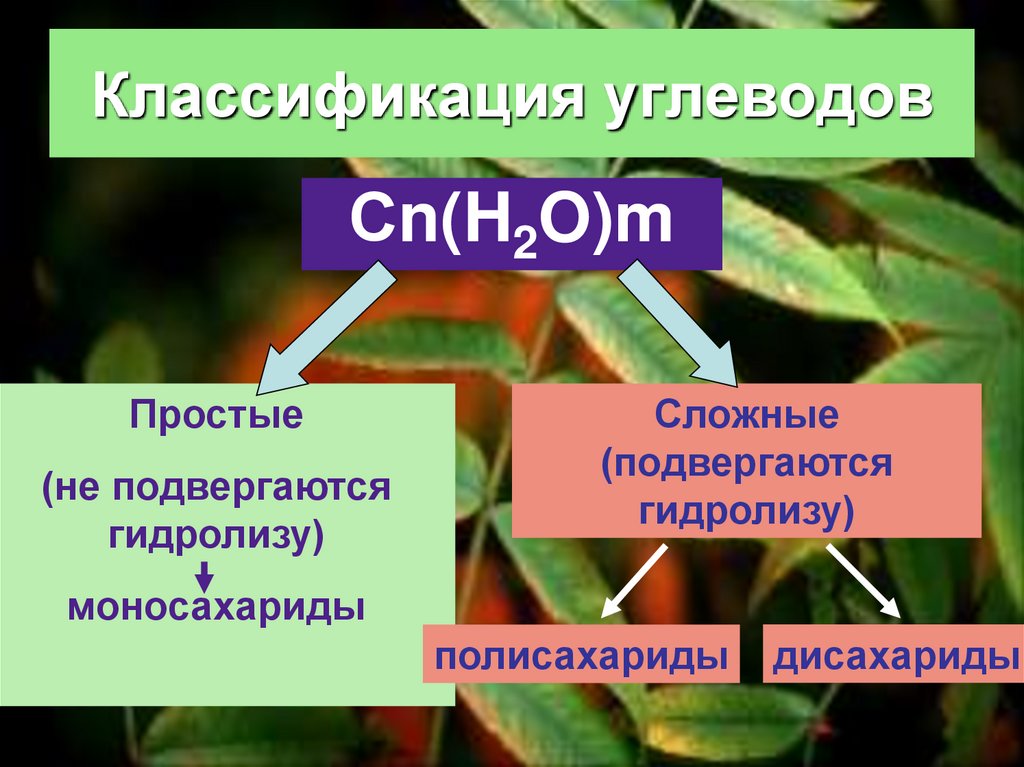
3. Классификация углеводов
Сn(H2O)mПростые
(не подвергаются
гидролизу)
Сложные
(подвергаются
гидролизу)
моносахариды
полисахариды
дисахариды
4. Классификация углеводов
Моносахариды:Пентозы – рибоза, ксилоза
Гексозы – глюкоза,
фруктоза, галактоза
5. Классификация углеводов
Дисахариды:Сахароза (обычный сахар)
Лактоза (молочный сахар)
Мальтоза (солодовый
сахар)
6. Классификация углеводов
Полисахариды:Крахмал
Целлюлоза
Гликоген
7. Глюкоза
Глюкоза – этобесцветное
кристаллическое
вещество,
хорошо
растворяется в
воде, имеет
сладкий вкус
(глюкос – сладкий)
8. Глюкоза
Содержитсяглюкоза в
свободном виде
во всех зелёных
растениях, но
особенно много
её в винограде.
Виноградный
сахар.
9.
Доказательствостроения глюкозы
10.
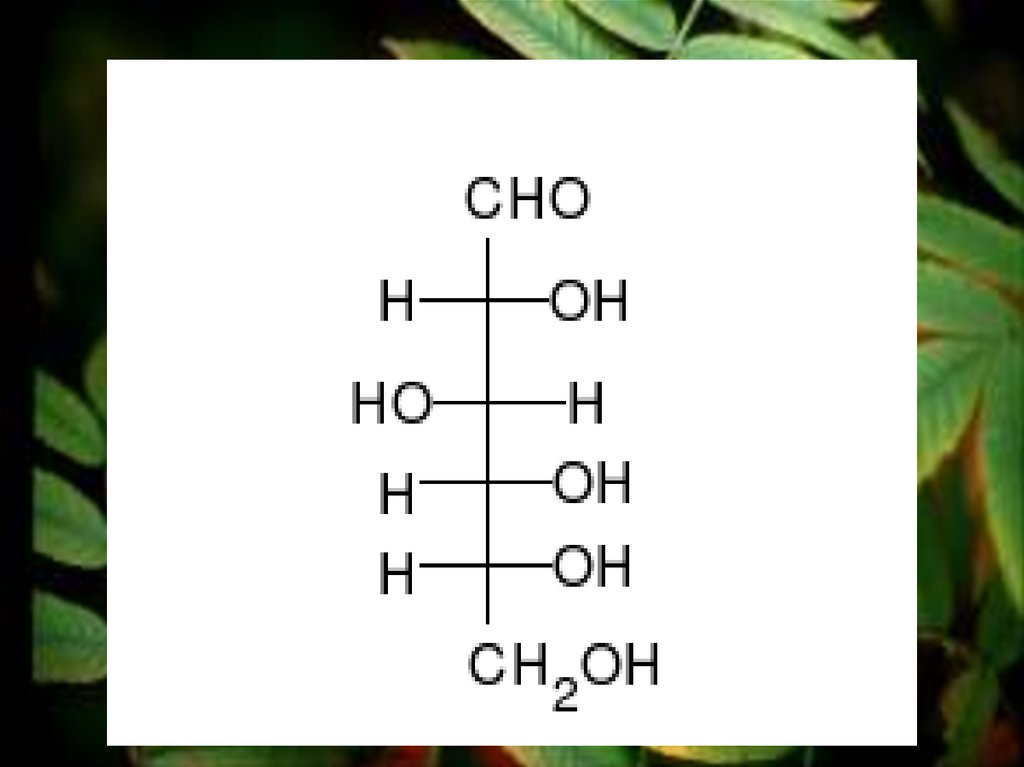
Эмпирическая формулаглюкозы С6Н12О6
Не содержит ли глюкоза уже
известные
функциональные группы?
1. Не является ли глюкоза
многоатомным спиртом?
11. Смотрим видео по ссылке 1
12.
Реакция со свежеосаждённымгидроксидом меди (II) даёт
положительный ответ.
2. Сколько групп ОН
содержится в молекуле?
13.
Известен эфир глюкозы,содержащий 5 остатков
уксусной кислоты.
С–С–С–С–С–С
ОН ОН ОН ОН ОН
14.
3. Каков характер шестогокислородного атома?
15. Смотрим видео по ссылке 2
16.
3. Каков характер шестогокислородного атома?
Реакция с аммиачным
раствором оксида серебра
даёт положительный
ответ.
17.
3. Каков характер шестогокислородного атома?
О
H2С – СH – СH – СH – СH – С
ОН ОН
ОН ОН
ОН
Н
18.
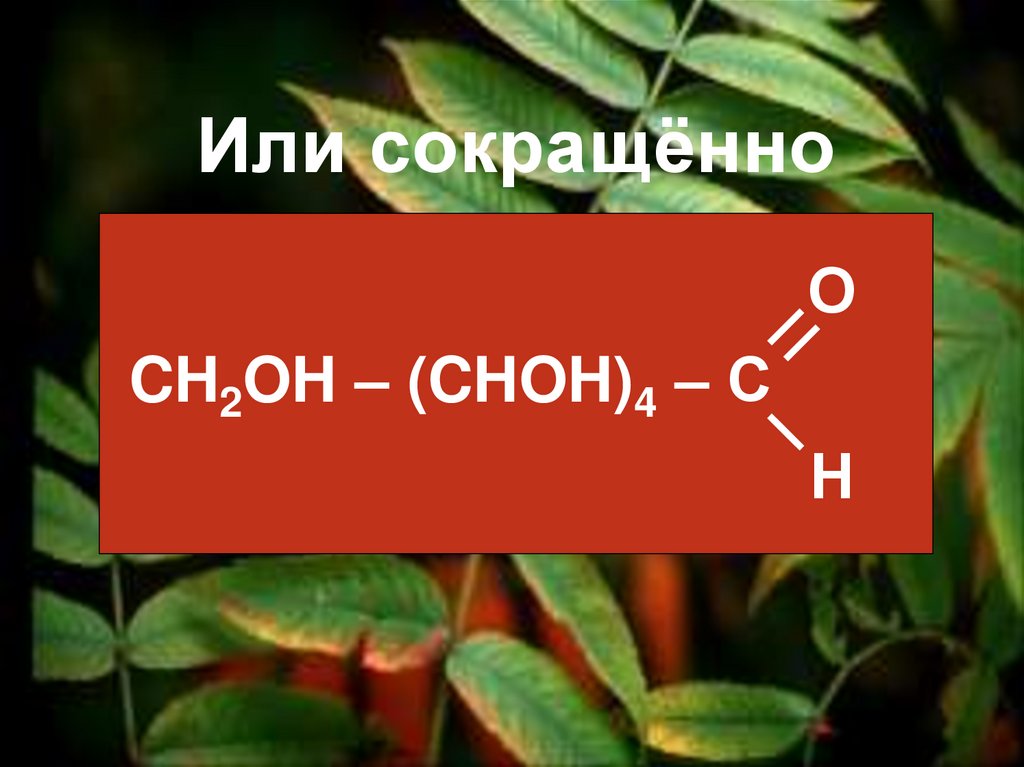
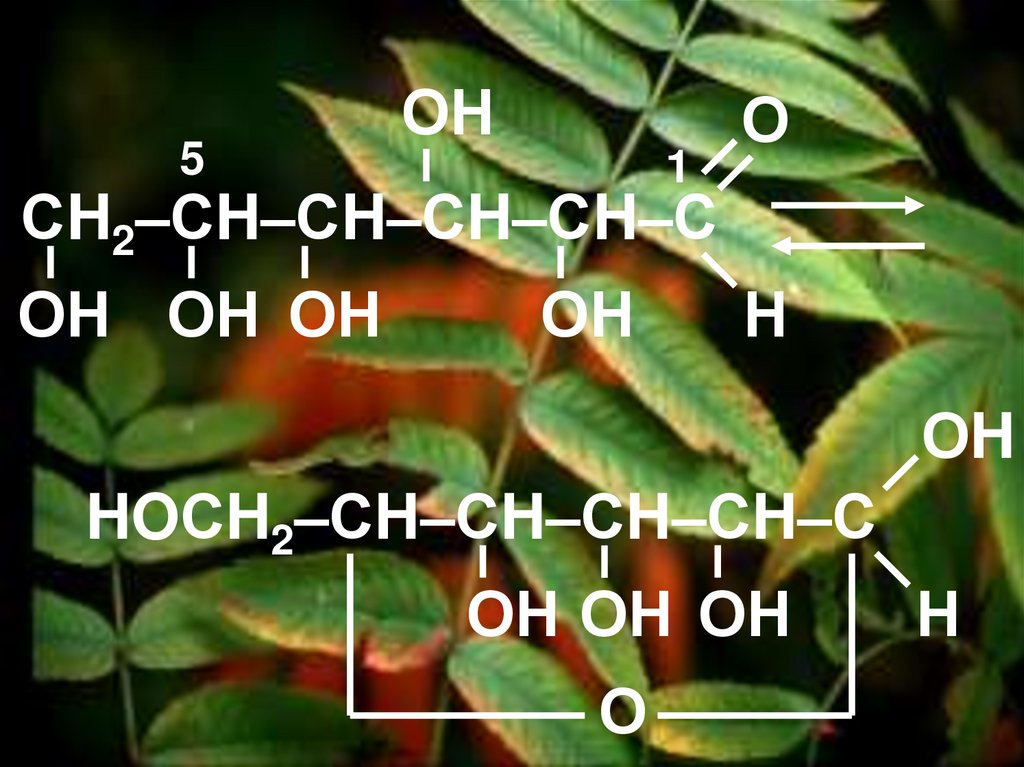
Вывод: глюкоза –альдегидоспирт.
19.
Или сокращённоО
CH2OH – (CHOH)4 – С
Н
20. Изомерия глюкозы
а) оптическая изомерияБолее 100 лет назад стало
известно явление оптической
активности некоторых
веществ, их способности
вращать плоскость
поляризации света.
21. Изомерия глюкозы
При пропускании света черезнекоторые кристаллы (турмалин,
исландский шпат) он становится
поляризованным: т.е. его
электромагнитная волна
колеблется в одной плоскости,
называемой плоскостью
поляризации.
22.
ТурмалинИсландский шпат
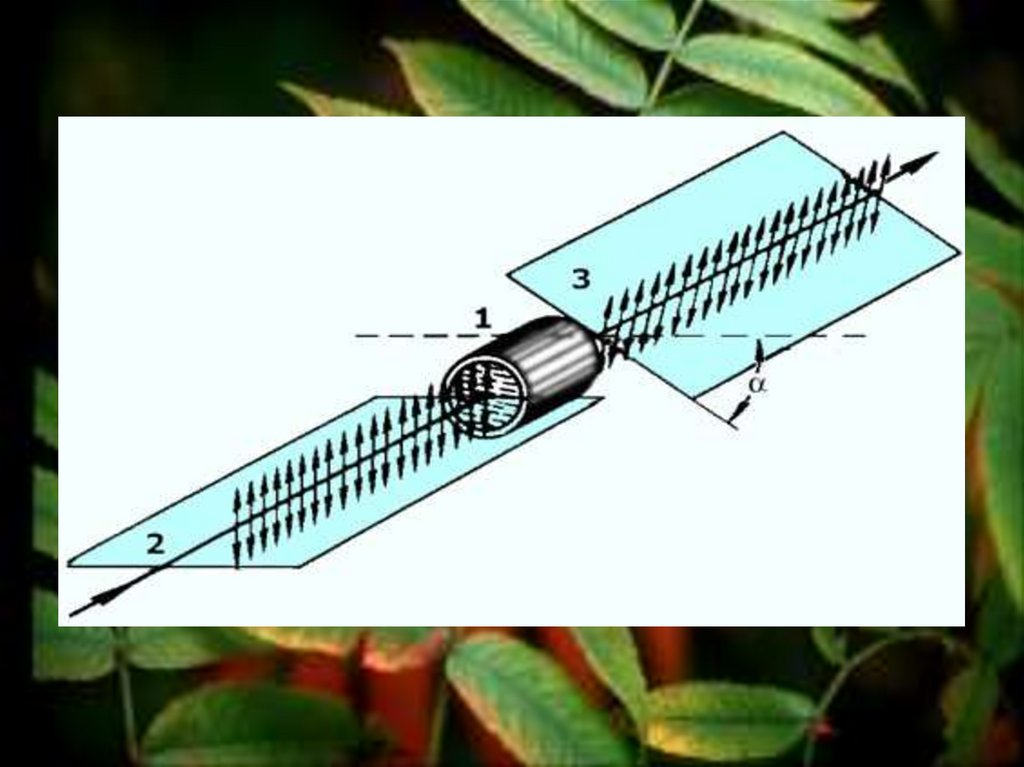
23. Изомерия глюкозы
Прибор, которыйпомогает
определить
отклонение
плоскости
вращения,
называется
поляриметр.
24.
25.
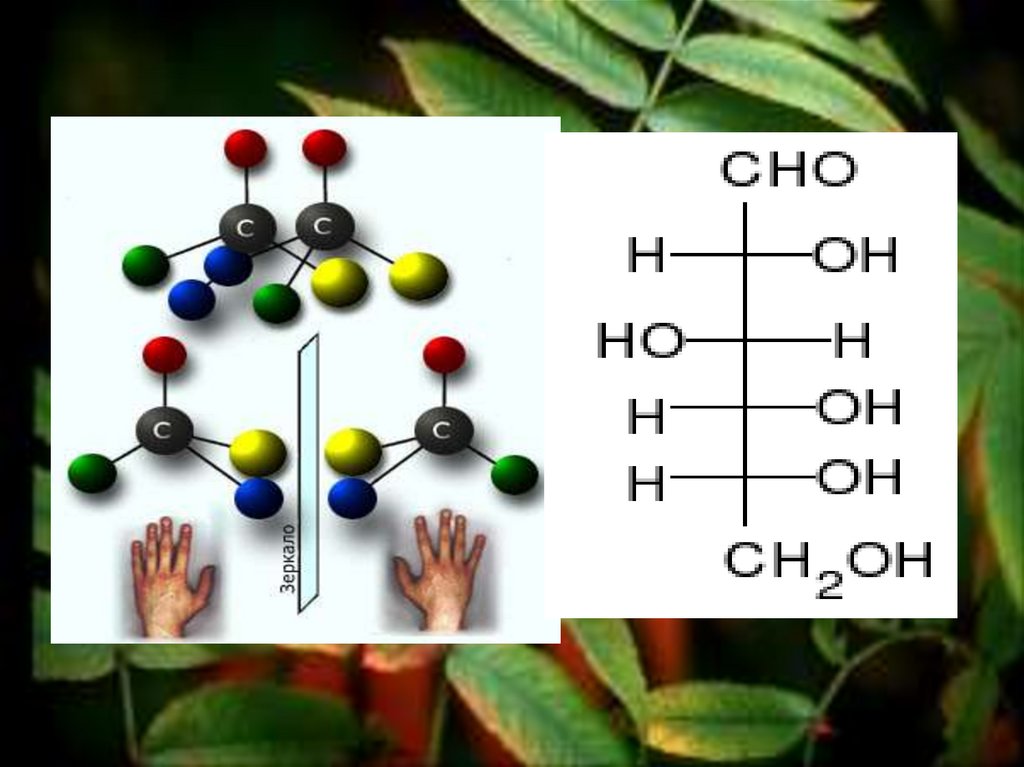
26. Изомерия глюкозы
Оптические изомеры –изомеры, имеющие
зеркальное
пространственное
строение молекул.
27. Изомерия глюкозы
Они отличаются только знакомвращения плоскости
поляризации (D или L), все
остальные физические и
химические свойства
оптических антиподов
совершенно одинаковы.
28. Изомерия глюкозы
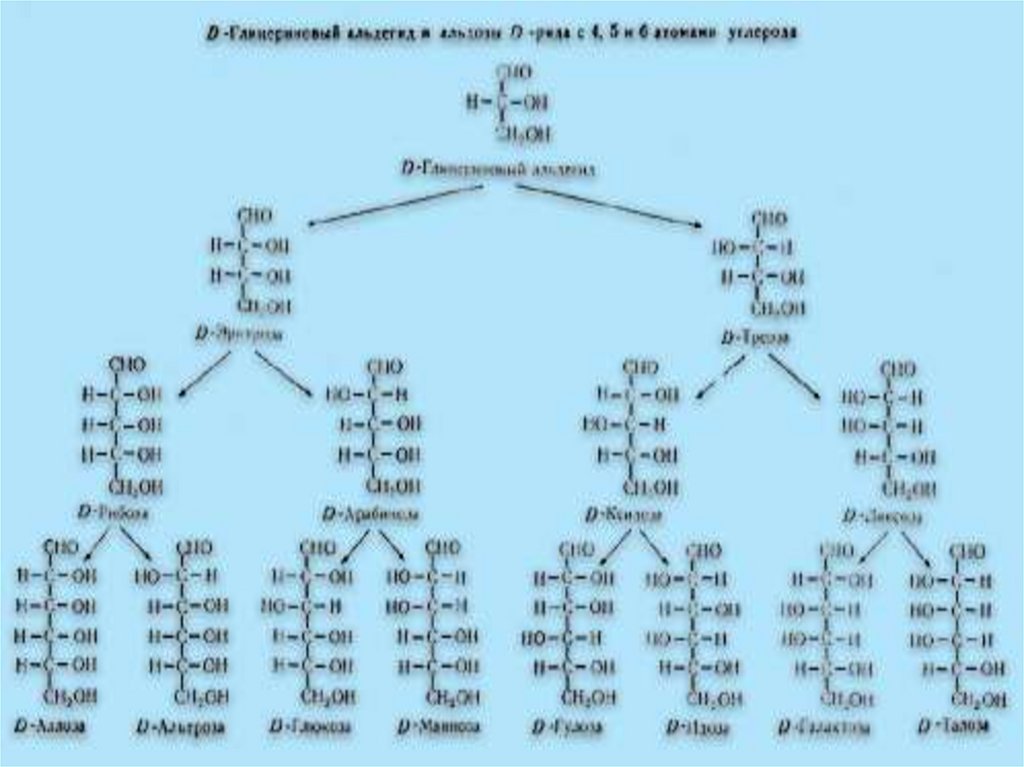
Формуле С6Н12О6соответствует 16
стереоизомерных
альдоз и 8
стереоизомерных
кетоз.
Из них в природе
встречается только
один - D глюкоза,
остальные
получены
искусственно.
29.
30.
ГЕРМАН ЭМИЛЬ ФИШЕР,немецкий химик-органик.
В 1902 году ему была вручена
Нобелевская премия по химии.
ФИШЕР (Fischer),
Эмиль
(1852 – 1919)
Рихард Вильшеттер
считал его «не
имеющим равных
классиком, мастером
органической химии
как в области анализа,
так и в области
синтеза,
а в личностном
отношениипрекраснейшим
человеком».
31. Изомерия глюкозы
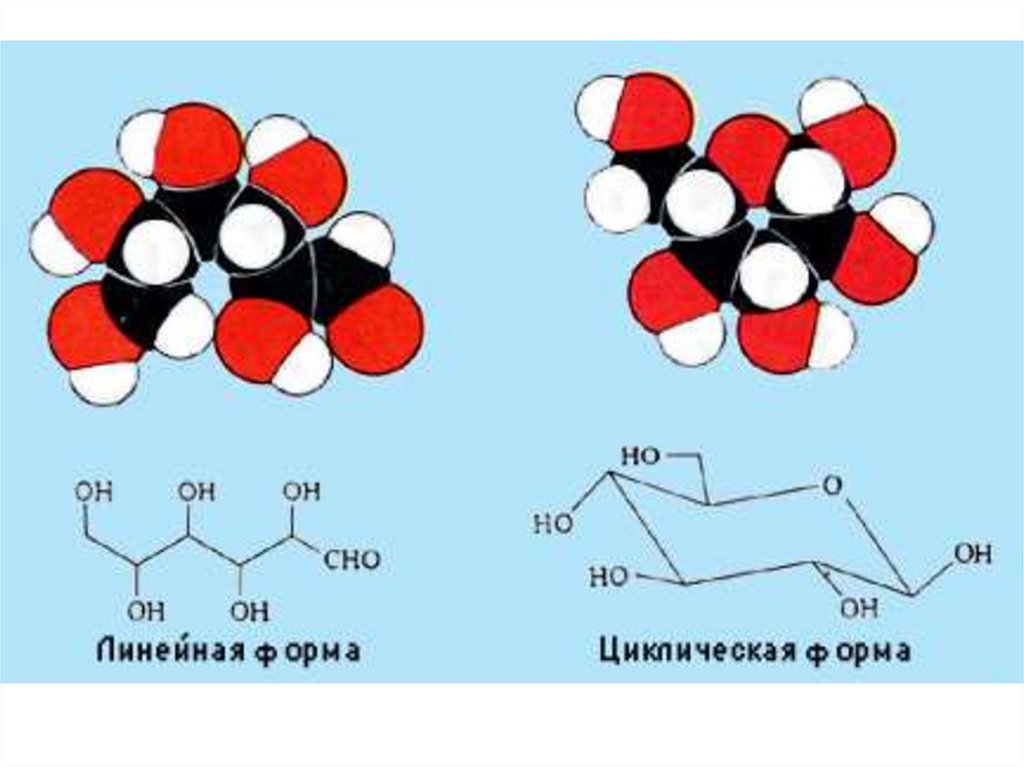
Б) таутомерияАльдегидная форма глюкозы
может превращаться в
циклическую (замкнутую).
Замыкание цикла происходит
при 1 и 5 углеродных атомах.
32.
33.
5ОН
1
О
СH2–СH–СH–СH–СH–С
ОН ОН ОН
ОН
Н
ОH
HOСH2–СH–СH–СH–СH–С
ОН ОН ОН
О
Н
34.
35.
65
О
О
4
1
3
2
36.
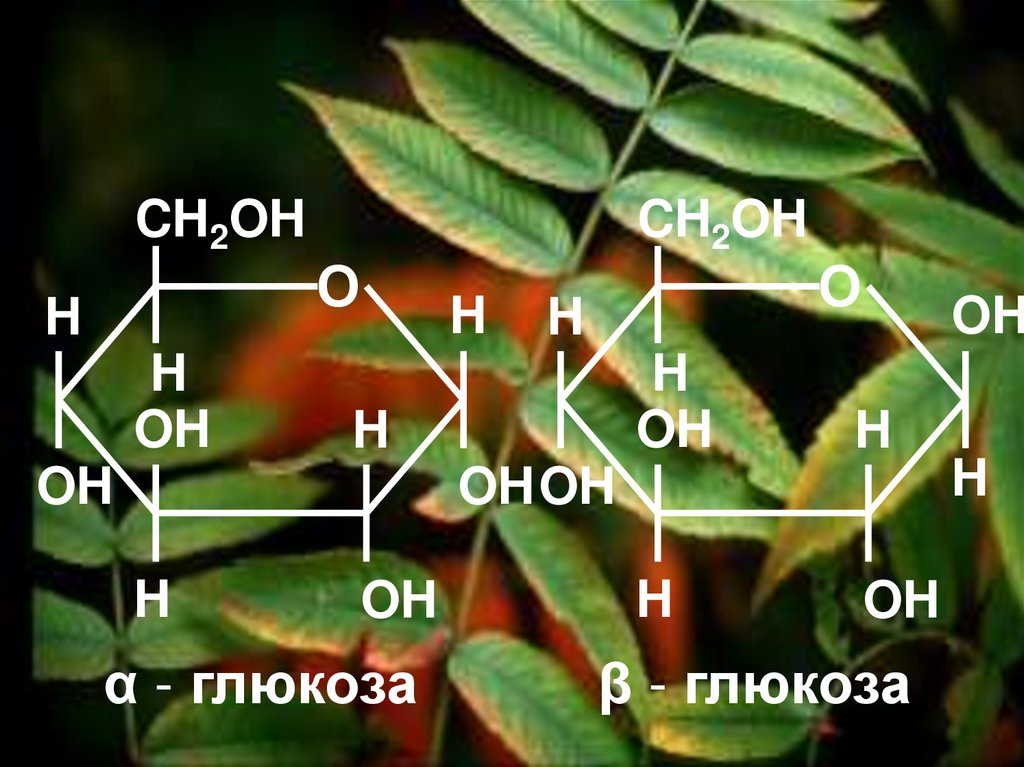
CH2OHH
H
OH
CH2OH
О
H
H
H
OH
H
OH
О
OH
H
H
OH OH
H
OH
α - глюкоза
H
OH
β - глюкоза
37. Изомерия глюкозы
Явление, когда органическоевещество может
существовать в нескольких
находящихся в равновесии
формах, называется
таутомерией, а сами эти
формы – таутомерами.
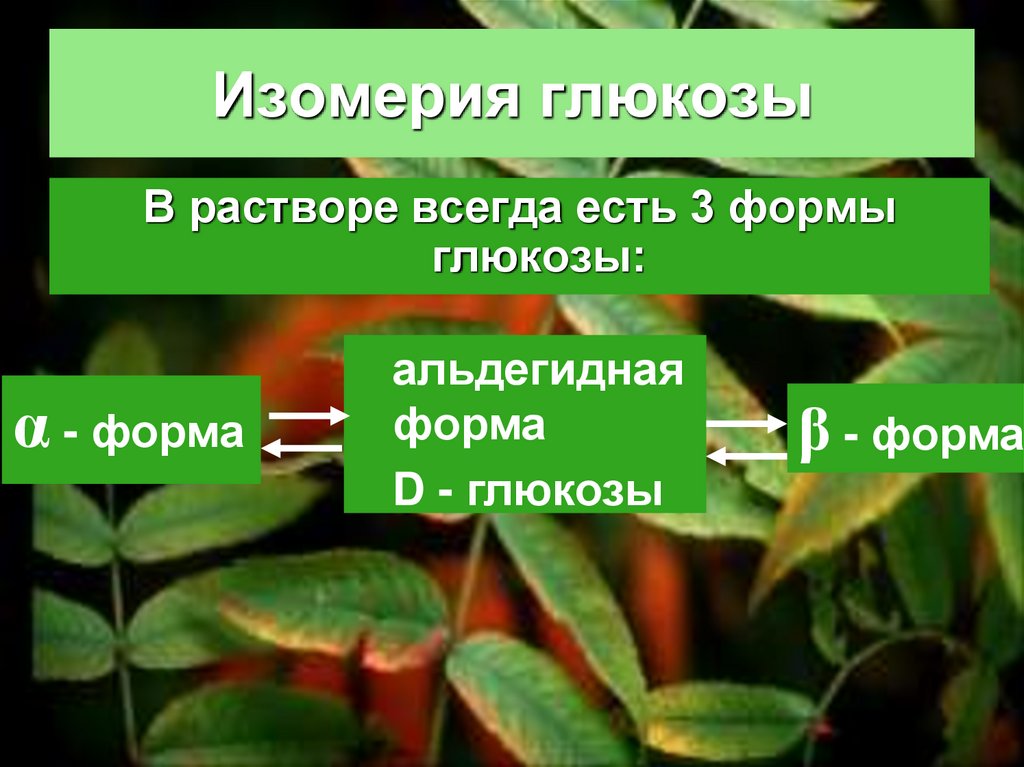
38. Изомерия глюкозы
В растворе всегда есть 3 формыглюкозы:
α - форма
альдегидная
форма
D - глюкозы
β - форма
39. Химические свойства глюкозы
Поскольку глюкоза –альдегидоспирт, то она
проявляет свойства и
альдегидов, и многоатомных
спиртов, а также свои особые
свойства.
40. Химические свойства глюкозы
А) Свойства многоатомныхспиртов
1. Реакция со свежеосаждённым
гидроксидом меди (II)
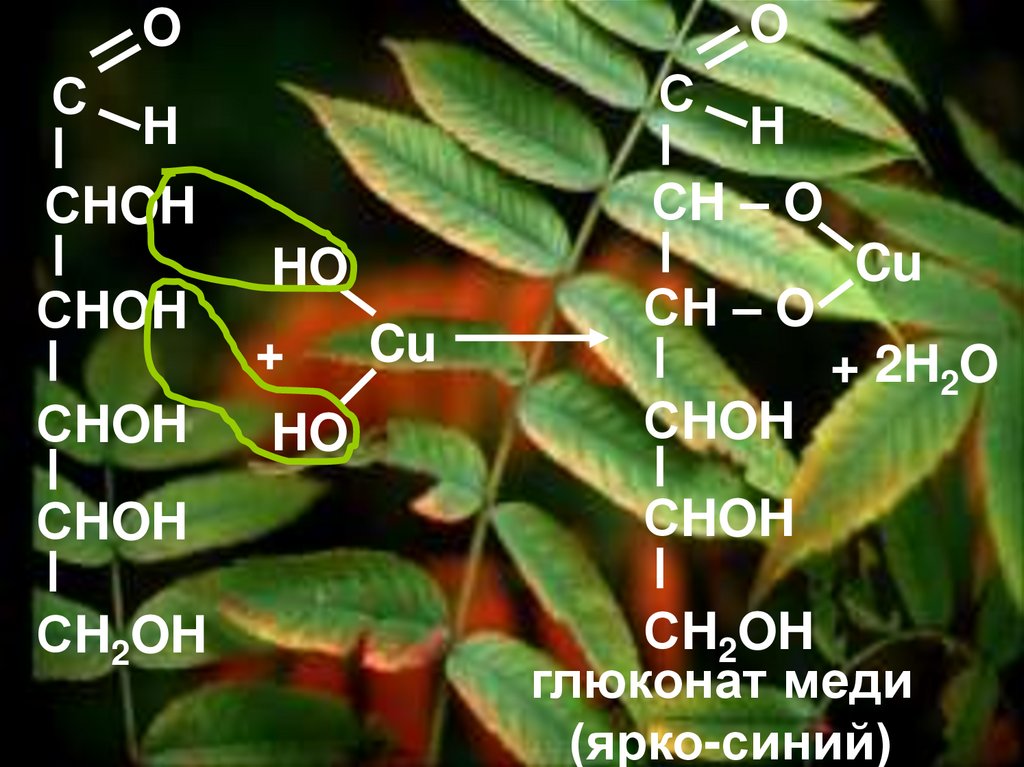
41.
OO
С
С
H
H
СH – O
СHOH
СHOH
СHOH
HO
+
HO
Cu
СH – O
СHOH
Cu
+ 2H2O
СHOH
СHOH
СH2OH
СH2OH
глюконат меди
(ярко-синий)
42. Химические свойства глюкозы
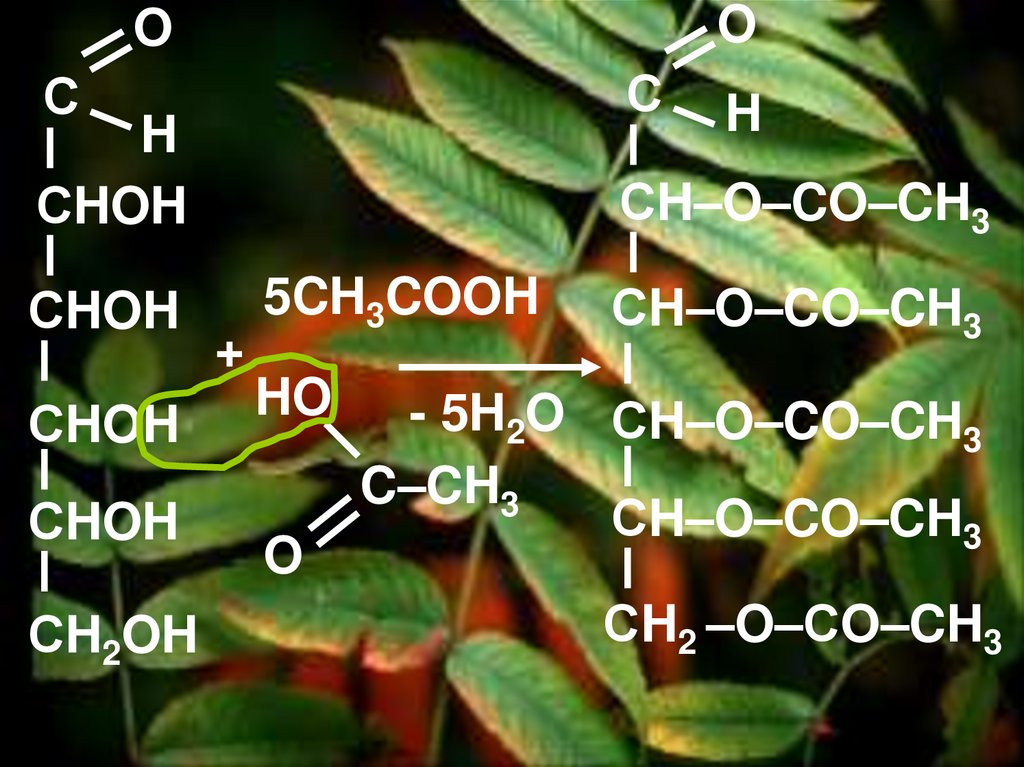
2. Реакция этерификацииа) с уксусной кислотой
43.
OO
С
С
H
СHOH
СHOH
СHOH
СHOH
СH2OH
H
СH–O–CO–CH3
+
5CH3COOH
HO
O
СH–O–CO–CH3
- 5H2O СH–O–CO–CH3
C–CH3
СH–O–CO–CH3
СH2 –O–СO–CH3
44. Химические свойства глюкозы
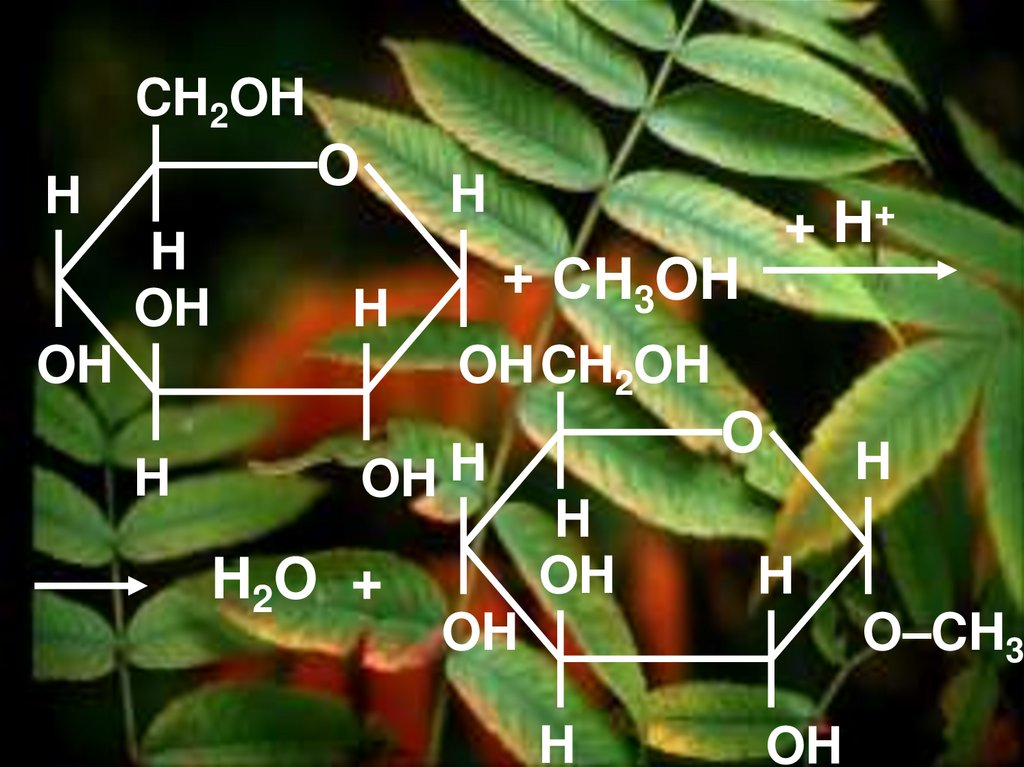
2. Реакция этерификацииб) с метиловым спиртом
45.
CH2OHH
H
OH
О
H
+ СH3OH
H
OH
OH CH2OH
H
OH H
H2O +
+ H+
H
OH
О
H
H
OH
O–CH3
H
OH
46. Химические свойства глюкозы
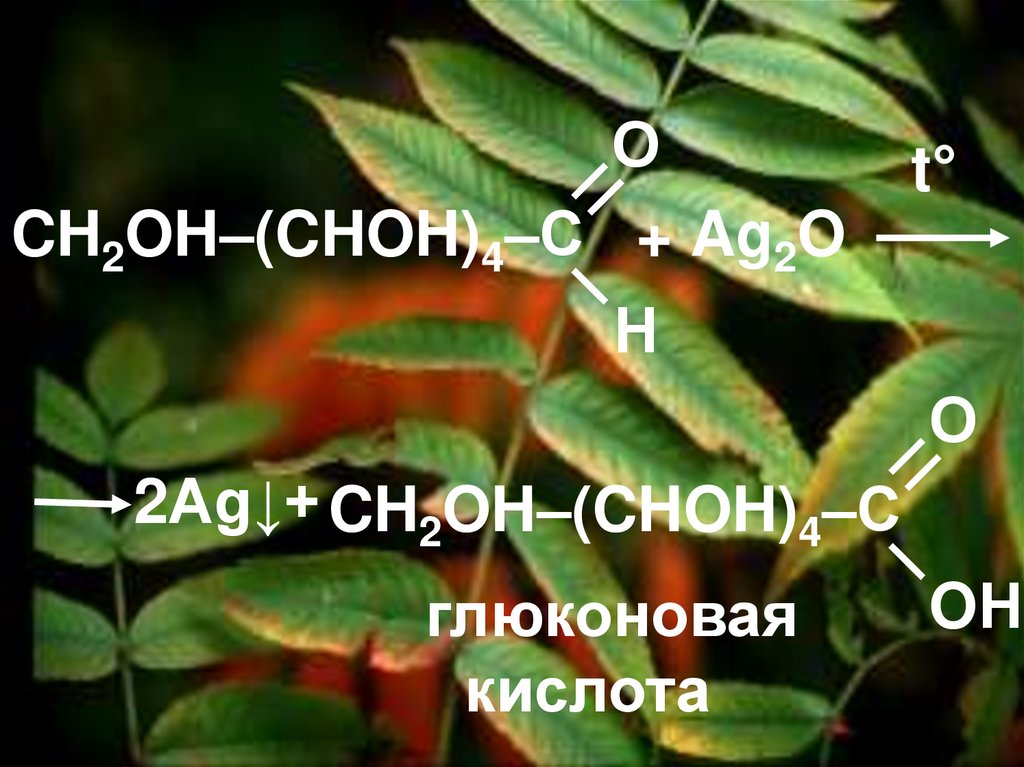
Б) Свойства альдегидов1. Реакция серебряного
зеркала
47.
ОCH2OH–(CHOH)4–С + Ag2O
t°
Н
О
2Ag↓+ CH2OH–(CHOH)4–С
глюконовая
кислота
OН
48. Химические свойства глюкозы
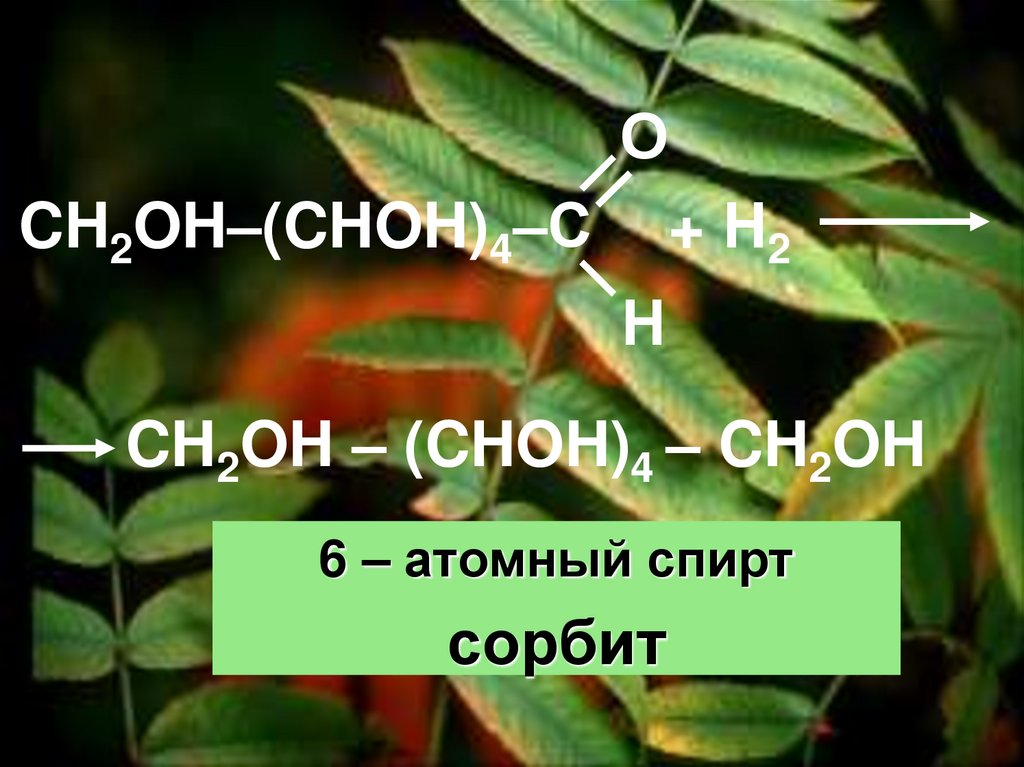
Б) Свойства альдегидов2. Реакция восстановления
49.
ОCH2OH–(CHOH)4–С + Н2
Н
CH2OH – (CHOH)4 – CH2OH
6 – атомный спирт
сорбит
50.
51. Химические свойства глюкозы
В) Реакции брожения1. Спиртовое брожение
С6H12O6
2С2H5OH + 2CO2↑
этанол
52. Химические свойства глюкозы
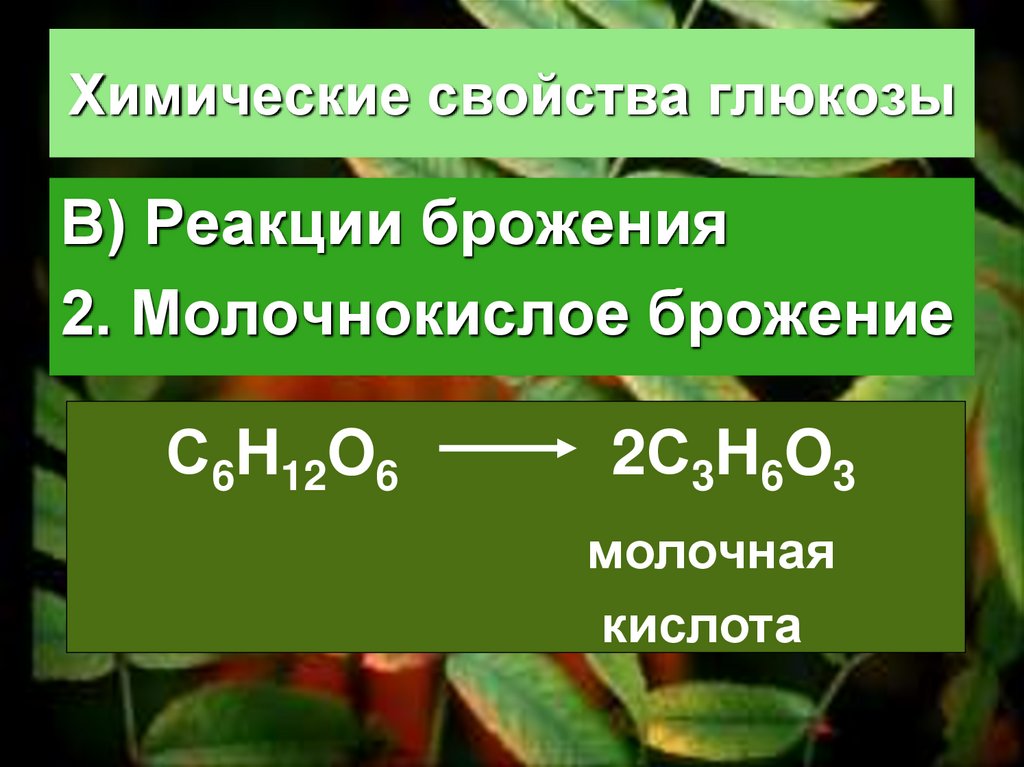
В) Реакции брожения2. Молочнокислое брожение
С6H12O6
2С3H6O3
молочная
кислота
53. Химические свойства глюкозы
В) Реакции брожения3. Маслянокислое брожение
С6H12O6
С3H7СООH + 2CO2↑ + 2Н2↑
масляная кислота
54. Химические свойства глюкозы
Г) Реакция с синильнойкислотой
55. Химические свойства глюкозы
Г) Реакция с синильнойкислотой
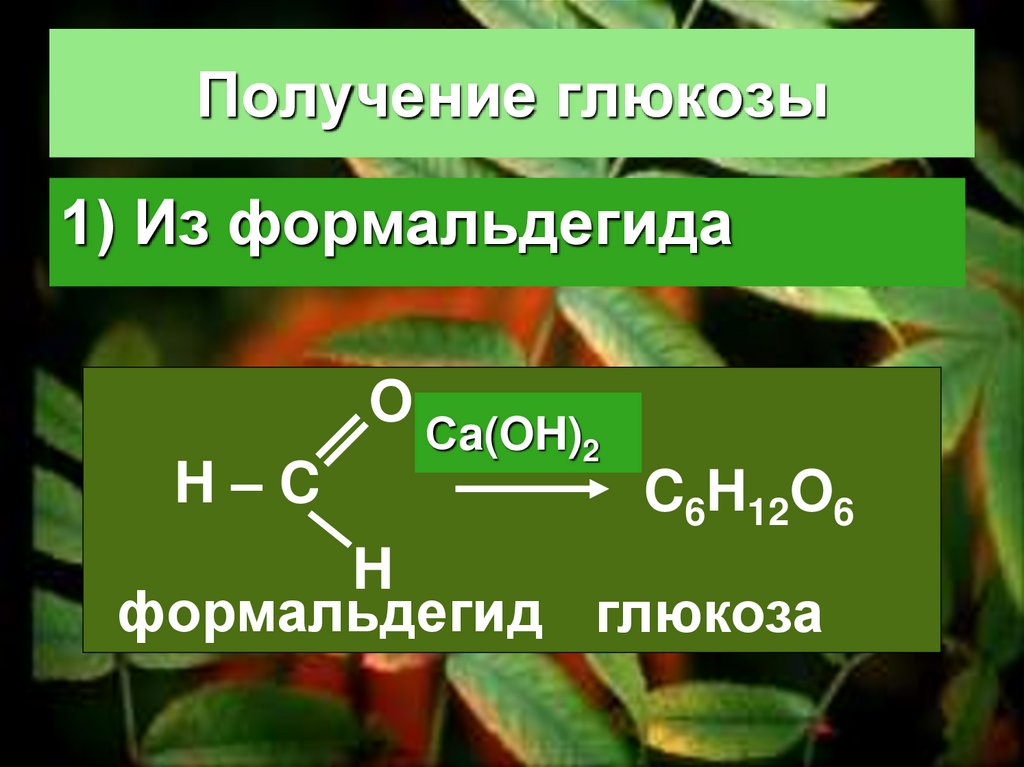
56. Получение глюкозы
1) Из формальдегидаO
H–C
Сa(OH)2
C6H12O6
H
формальдегид глюкоза
57. Получение глюкозы
2) Из крахмалаH2SO4(разб.)
(С6Н10О5)n + nH2O
nC6H12O6
крахмал
глюкоза
58. Получение глюкозы
3) фотосинтез6СO2 + 6H2O
Свет
C6H12O6 + 6O2
59. Смотрим видео по ссылке 3
60. Применение глюкозы
Применяетсяглюкоза в
медицине,
кондитерской
промышленности,
для производства
аскорбиновой и
глюконовой кислот,
для получения
зеркал.
61. Фруктоза
62. Вопросы
Появились ли у вас вопросы?Если нет, то уменя есть два:
Чей портрет изображен на слайде с
реакцией с синильной кислотой?
Почему?
Чем является фруктоза по
отношению к глюкозе?
63. Вопросы
Появились ли у вас вопросы?Задавайте свои вопросы!
• И готовьтесь к следующему уроку
– будет проверочная работа по
теме «Глюкоза»














































 Химия
Химия








