Похожие презентации:
Ферменты. Классификация ферментов
1. ферменты
2. Ферменты-это белковые катализаторы биохимических реакций, происходящих в организме
Высокая эффективность действияВсе ферменты-это белки, не все белки
ферменты
3.
4.
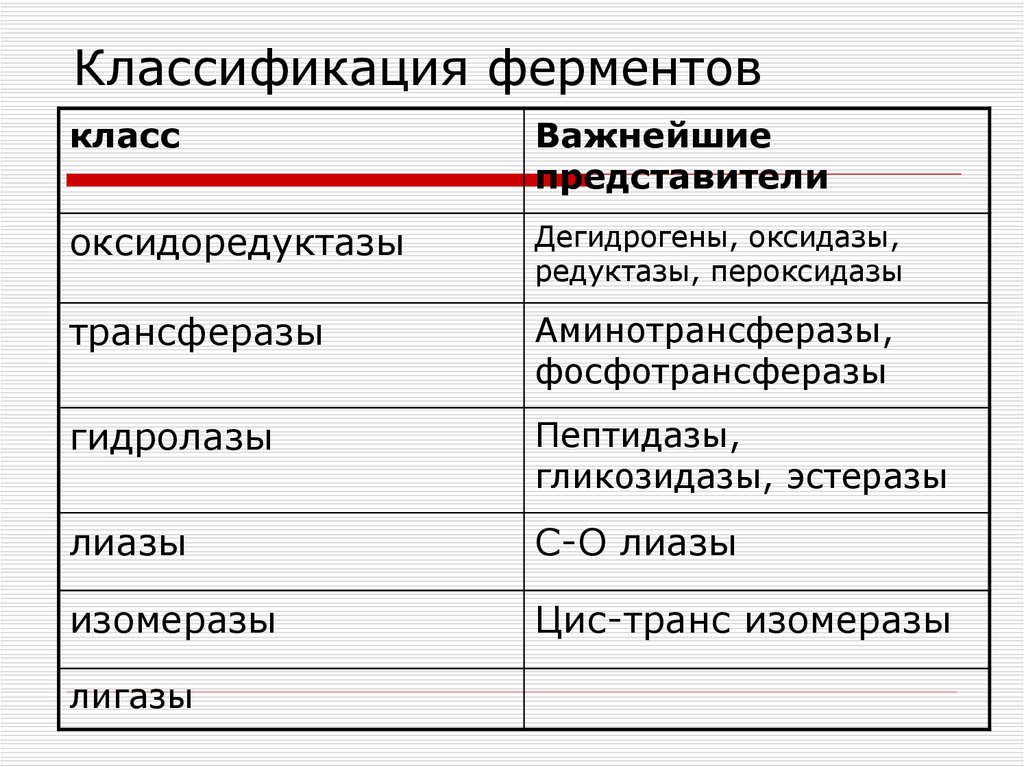
5. Классификация ферментов
классВажнейшие
представители
оксидоредуктазы
Дегидрогены, оксидазы,
редуктазы, пероксидазы
трансферазы
Аминотрансферазы,
фосфотрансферазы
гидролазы
Пептидазы,
гликозидазы, эстеразы
лиазы
С-О лиазы
изомеразы
Цис-транс изомеразы
лигазы
6. Факторы, влияющие на активность фермента
ТемпературарH
Концентрация фермента
Концентрация субстрата
Наличие ингибиторов (обратимые
и необратимые)
7. Регуляция ферментативной активности
АллостерическаяФосфорилированиедефосфорилирование
Протеолиз
Образование макромолекулярных
комплексов
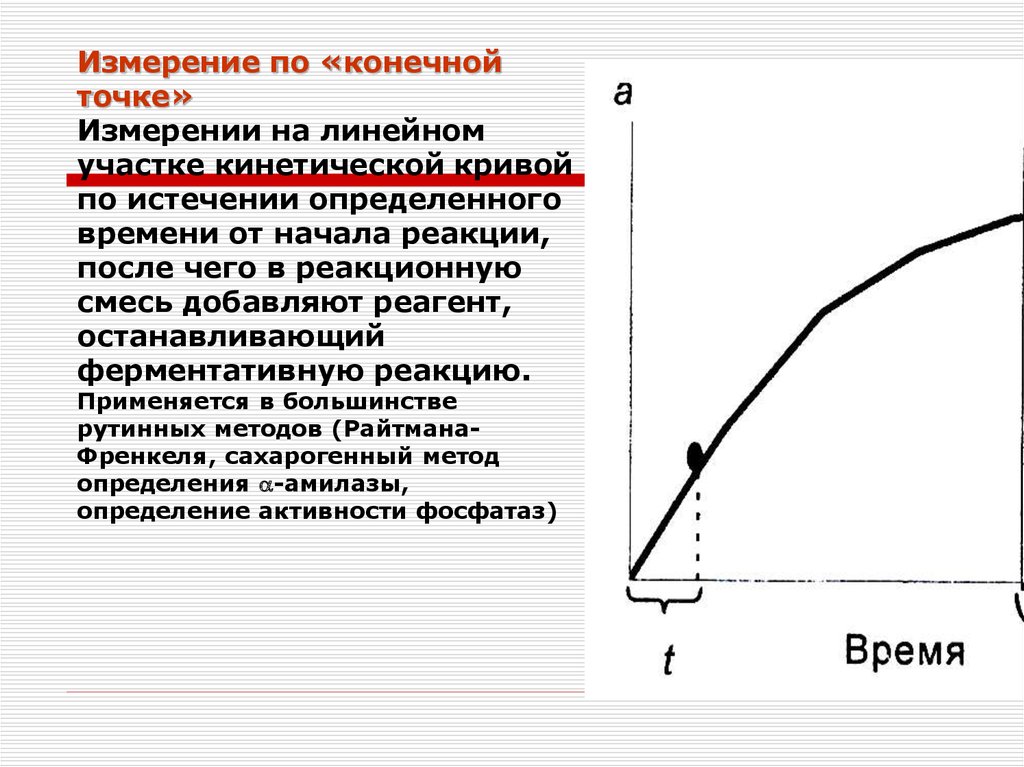
8. Принципы определения активности ферментов
Метод по конечной точкеКинетический метод
Радиоиммунный метод
ИФА
иммунотурбидиметрия
9.
Измерение по «конечнойточке»
Измерении на линейном
участке кинетической кривой
по истечении определенного
времени от начала реакции,
после чего в реакционную
смесь добавляют реагент,
останавливающий
ферментативную реакцию.
Применяется в большинстве
рутинных методов (РайтманаФренкеля, сахарогенный метод
определения -амилазы,
определение активности фосфатаз)
10.
Кинетическое измерениеДвухточечное измерение
Оптическую плотность определяют
на линейном участке кинетической
кривой дважды, фиксируя
интервал времени t между
измерениями.
Формула расчета:
А/мин= (А2-А1)/t
Используется в современных методиках
измерения -амилазы и щелочной
фосфатазы
Многоточечная кинетика
Оптическую плотность на
линейном участке
кинетической кривой
определяют 3-5 раз через
фиксированные интервалы
времени t.
Формула расчета:
А/мин= Аср/t
Используется только для
биохимических анализаторов
На этом способе основано измерение
АЛТ, АСТ, ЛДГ, КК
11. Кинетические методы
Это определение меняющейся в ходереакции оптической плотности за равные
промежутки времени
Требования: соответствующее
фотометрическое оборудование, точное
поддержание температуры, правильный
отсчет времени (30 сек, 1 мин)
Все одинаково перемешано и одной
температуры
12. иммунотурбидиметрия
реакция антиген-антителопроявляется в растворе в
виде образования агрегатов
Калибровочный график
нелинейный, не менее 5
концентраций. Строится для
каждого белка, для каждого
прибора, при любых
изменениях исследований
13. Единицы активности фермента
Международная система единиц – СИ (Катал - количество фермента,
превращающего 1 моль субстрата за 1
секунду (кат/л=моль/(с∙л)
Международный биохимический союз
Международные единицы (МЕ)количество фермента, превращающего 1
мкмоль субстрата в 1 минуту
14. Класс 1. оксидоредуктазы
Лактатдегидрогеназа (ЛДГ)цинксодержащий ферментуглеводного обмена, катализирует
важнейшую реакцию гликолиза:
Превращение лактата в пируват и
обратная реакция
Непременный участник реакции-НАДН
15. Изоферментный состав: ЛДГ2 ЛДГ1 ЛДГ3 ЛДГ4 ЛДГ5
ЛДГ 1: эритроциты, тромбоциты,сердце, мозг
ЛДГ 2: легкие, селезенка, сердце,
эритроциты, тромбоциты
ЛДГ 3: легкие, селезенка,
надпочечники
ЛДГ 4: мышцы
ЛДГ 5: мышцы, печень
16. Клиническое значение
Инфаркт миокарда: максимальнаяактивность через 48-72 часа после
ангинозного приступа, на 10-12 сутки
снижается до нормы
Значительно повышается изофермент
ЛДГ1 уже через 12-24 часа ( клинические
рекомендации не рекомендуют)
ЛДГ1 выявляется при опухолях мозга и
половых органов
17.
При заболеваниях печени повышаетсяизофермент ЛДГ5 (тяжелые формы
вирусного гепатита, печеночная
недостаточность, метастазы рака в печень)
При лейкозах преобладают ЛДГ2 и ЛДГ3
При опухолях предстательной железы,
молочных желез, желудка увеличивается
активность ЛДГ4 и ЛДГ5
При почечной и легочной патологии
наиболее высокая активность ЛДГ3 и ЛДГ4
18. Глутаматдегидрогеназа-органоспецифичный фермент печени
Глутаматдегидрогеназаорганоспецифичный фермент печениАктивность значительно повышена
при: вирусных гепатитах, раке
печени, обострении цирроза,
алкогольной интоксикации,
тяжелых токсических поражениях
печени, остром снижении кровотока
в печени, острым тромбозе
печеночных вен
19. Класс 2. Трансферазы
АТФ:креатин-N-фосфотрансферазаКреатин+АТФ ↔
АДФ+креатинфосфат
Скорость прямой реакции максимальна при рН
9, обязательно присутствие магния,
равновесие сдвинуто в сторону обратной
реакции
20. Гетерогенность КК
КК-это димер,состоящий из двух
субъединиц В (brain) и М
(muscle).
Образуются 3 пары
субъединиц:
КК-ММ (мышечный)
КК-МВ (сердечный)
КК-ВВ (мозговой)
ККмит
21. Диагностическое значение
Повышениеактивности КК-МВ
наиболее специфично
для ИМ: увеличение
через 4-8 часов
после острого
приступа, максимум
через 12-24 часа, и
на 3-и сутки
снижается до нормы
Величина повышения
КК-МВ соответствует
величине пораженной
зоны миокарда
22. Повышение оКК в отдельных случаях наблюдается при:
миокардитах,миокардиодистрофиях
(повышение умеренное, более
длительное)
повреждении скелетной
мускулатуры (КК-ММ),
дегенеративные,
воспалительные, токсические
поражения мышц,
прогрессирующая мышечная
дистрофия-до 50 раз
стресс
шизофрении, психозах
При приеме алкоголя, после
приема преднизолона
гипотиреозе
23. Гамма-глутамил транспептидаза
Маркер холестазаОстрый панкреатит
Алкоголизм
Гепатотоксичность и
нефротоксичность лекарственных
препаратов
Опухолевый рост в печени
24. аминотрансферазы
Это ферменты печеночногопрофиля
Аспартатаминотрансферазачувствительный тест для
диагностики хронических процессов
Аланинаминотрансфераза-для
диагностики острых заболеваний
печени и желчевыводящих путей
25. Клиническое значение Асат
ИМ повышается Асат через 6-8часов, максимум через 24-36,
снижение до нормы к 5-6 дню.
Степень повышения отражает массу
миокарда, вовлеченного в
патологический процесс






















 Биология
Биология








