Похожие презентации:
Изоформы ядерных рецепторов и их функциональное значение
1. Изоформы ядерных рецепторов и их функциональное значение
2.
3.
Сравнение С-концевых лигандсвязывающих доменовканонических вариантов ядерных рецепторов и форм их альтернативного сплайсинга
по наличию 12-й альфа-спирали
4.
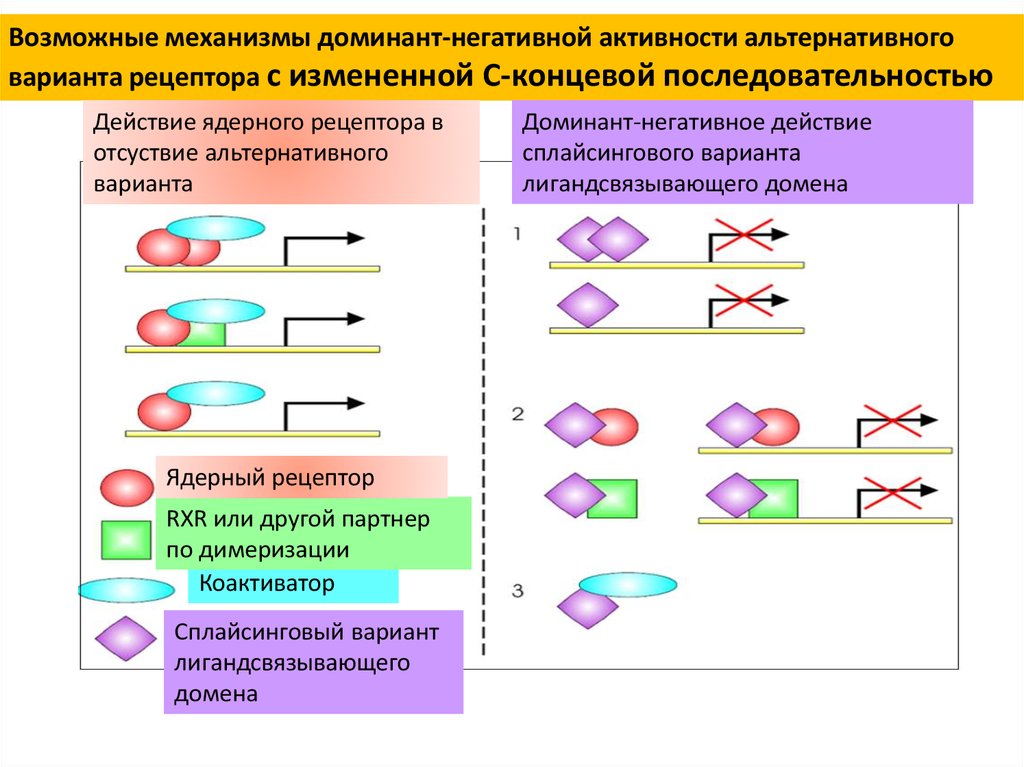
Возможные механизмы доминант-негативной активности альтернативноговарианта рецептора с измененной С-концевой последовательностью
Действие ядерного рецептора в
отсуствие альтернативного
варианта
Ядерный рецептор
RXR или другой партнер
по димеризации
Коактиватор
Сплайсинговый вариант
лигандсвязывающего
домена
Доминант-негативное действие
сплайсингового варианта
лигандсвязывающего домена
5.
Сплайсинговый вариант рецептора альфа эстрогенов (ERα 46 kDa)66 кДа
A/B DBD
ядро
LBD
46 кДа
плазматическая
мембрана
пальмитат
Сплайсинговый вариант рецептора альфа эстрогенов может
опосредовать быстрые негеномные эффекты эстрогенов
Shc
ER
c-Src
MNAR
[Grb2, Sos]
p85
PI3K
[PDK]
Ras
Akt
Raf
MEK
JUN
eNOS
ERK
пролиферация
эндотелия
NO
вазодилятация
6. Фосфорилирование как способ регуляции активности ядерных рецепторов
7. Фосфорилирование как способ регуляции активности ЯР
– Фосфорилирование а/к остатков в домена А/В• Конститутивное фосфорилирование
• Зависимое от лиганда фосфорилирование
– Результаты фосфорилирования ЯР:
• Появление негативной транскрипционной ак-ти (ГлР)
• Появление позитивной транскрипционной ак-ти (ЕР)
• Направление на деградацию
• Пример: EGF → MAPK→ фосфорилирование
ER→эстрогеноподобное действие EGF в опухолях
молочной железы
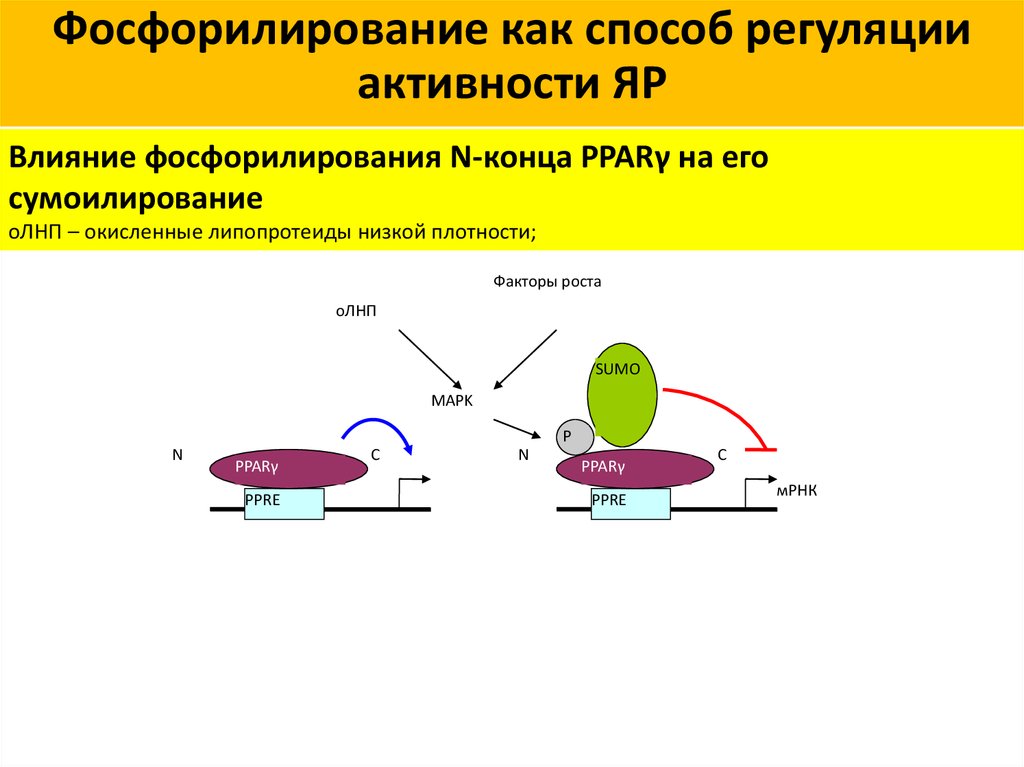
8.
Фосфорилирование как способ регуляцииактивности ЯР
Влияние фосфорилирования N-конца PPARγ на его
сумоилирование
оЛНП – окисленные липопротеиды низкой плотности;
Факторы роста
оЛНП
SUMO
MAPK
P
N
PPARγ
PPRE
C
N
PPARγ
PPRE
C
мРНК
9. Терминация рецепторного цикла
10. Терминация рецепторного цикла
Лиганд ускоряет деградацию собственного рецептора:– Свободный эстрогенный рецептор: Т1/2=5 дней
– Комплекс эстрогенного рецептора с эстрадиолом: Т
½=3-4 часа
– Деградация с участием убиквитина, сумоилирование
11.
Пример влияния сумоилированияА
Индуцируемое лигандом
сумоилирование C-конца PPARγ не
влияет на трансактивационную
функцию PPARγ (А)
Лиганд
N
SU
M
O
Коактиваторный
комплекс
PPARγ
мРНК белков
липидного обмена
PPRE
Б
Индуцируемое лигандом
сумоилирование C-конца PPARγ
индуцирует его трансрепрессорную
функцию (Б) в отношении NF-kB
Лиганд
N
SU
M
O
Корепрессорный
комплекс
HDAC3
NCoR
PPARγ
NF-kB
мРНК
провоспалительных
белков
HDAC – гистондеацетилаза; NCoR – корепрессор ядерных
рецепторов; NF-κB – ядерный фактор kB.
12. Негативная регуляция транскрипции ядерными рецепторами
13.
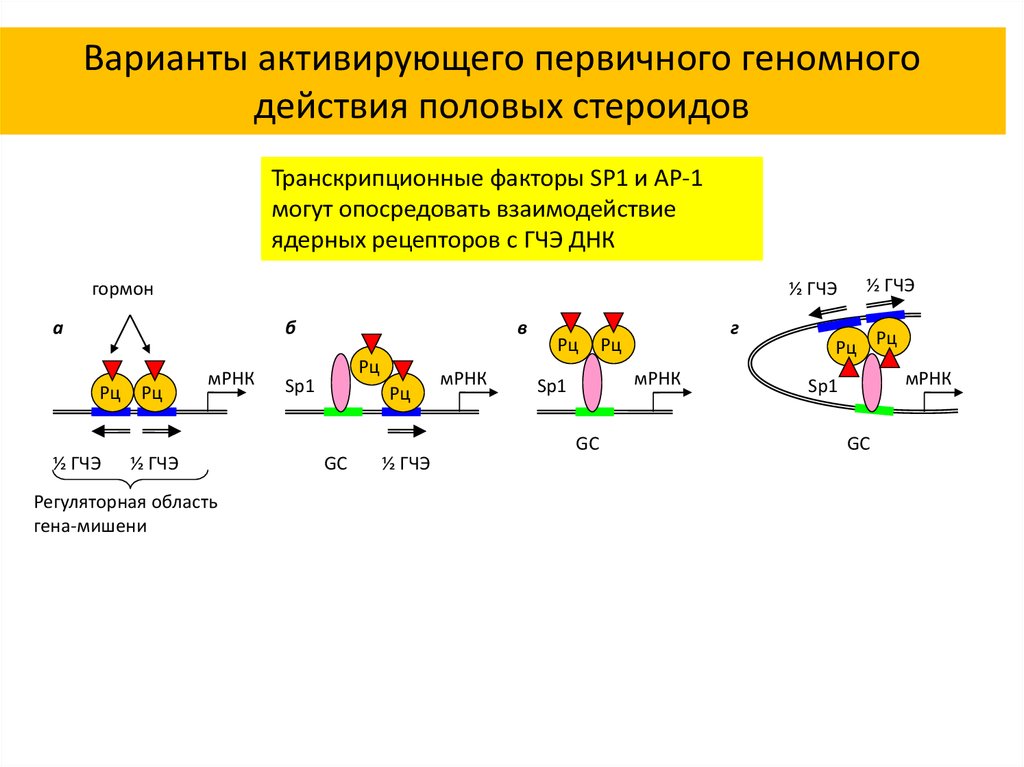
Варианты активирующего первичного геномногодействия половых стероидов
Транскрипционные факторы SP1 и AP-1
могут опосредовать взаимодействие
ядерных рецепторов с ГЧЭ ДНК
гормон
½ ГЧЭ
а
б
Рц
½ ГЧЭ
Рц
мРНК
½ ГЧЭ
Регуляторная область
гена-мишени
в
Рц
Sp1
Рц
GC
½ ГЧЭ
мРНК
Рц
г
Рц
мРНК
Sp1
GC
½ ГЧЭ
Рц Рц
мРНК
Sp1
GC
14. Негативные гормончувствительные элементы (nRE)
ОСОБЕННОСТИ nRE:1. Отличаются от позитивных гормончувствительных элементов (pRE)
по последовательностям нуклеотидов, их количеству и ориентации
полусайтов
2. Часто перекрываются с сайтами связывания других
транскрипционных факторов (например, SP1), оказывающими
стимулирующее действие на транскрипцию
15.
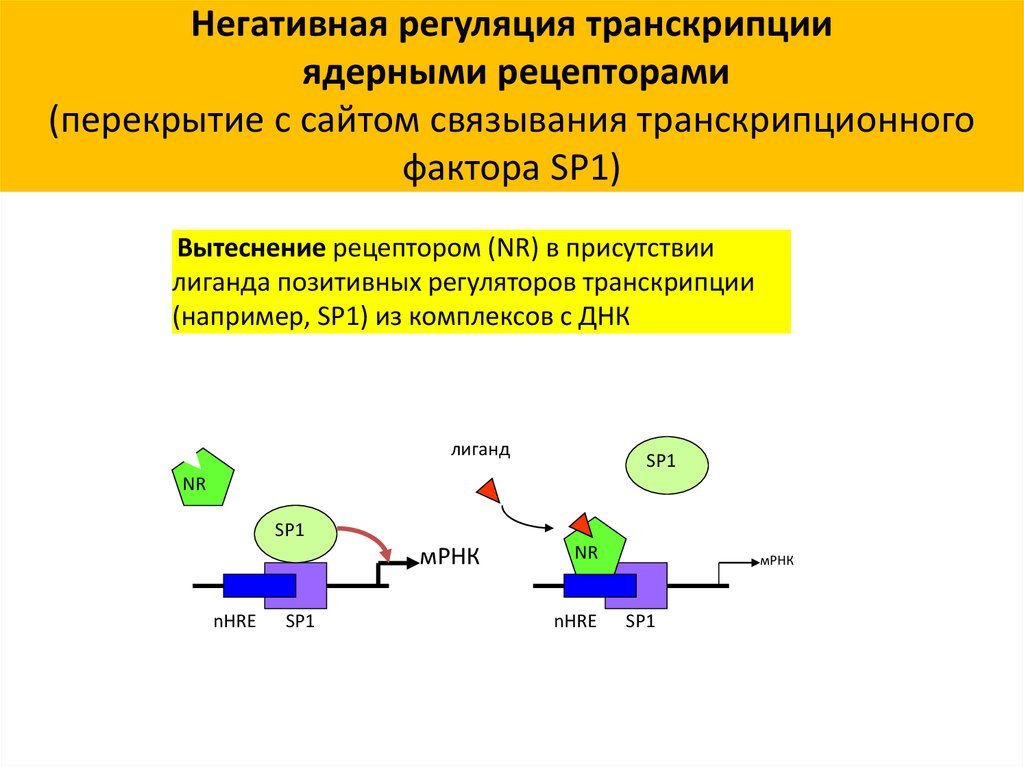
Негативная регуляция транскрипцииядерными рецепторами
(перекрытие с сайтом связывания транскрипционного
фактора SP1)
Вытеснение рецептором (NR) в присутствии
лиганда позитивных регуляторов транскрипции
(например, SP1) из комплексов с ДНК
лиганд
SP1
NR
SP1
мРНК
nHRE
SP1
NR
nHRE
мРНК
SP1
16.
Негативная регуляция транскрипцииядерными рецепторами
(аллостерическое измерение конформации NR –
рекрутирование корепрессора)
Негативный гормончувствительный элемент (nHRE) служит
аллостерическим регулятором конформации NR, которая
обеспечивает рекрутирование корепрессора вместо коактиватора
CoR
CoA
NR
pRE Позитивный
HRE
мРНК
NR
nHRE
Негативный HRE
мРНК
17.
Негативная регуляция транскрипцииядерными рецепторами
(Действие обратных агонистов)
гОбратные
агонисты стимулируют рекрутирование
рецептором корепрессора вместо коактиватора
прямой
агонист
CoA
NR
обратный
агонист
мРНК
CoR
NR
18.
Негативная регуляция транскрипцииядерными рецепторами
(аллостерическое измерение конформации NRизменение конформации коактиватора)
Негативный гормончувствительный элемент (nHRE) служит
аллостерическим регулятором конформации NR, которая
в свою очередь меняет конформацию
рекрутируемого коактиватора на репрессорную
CoA
CoA
NR
мРНК
NR
pHRE
nHRE
Позитивный
HRE
Негативный
HRE
мРНК
19.
Негативная регуляция транскрипцииядерными рецепторами
(Транс-репрессия –
конкуренция NR за коактиватор)
Непрямая репрессия (транс-репрессия):
Рецептор может конкурировать с другими
транскрипционными факторами за корегуляторы
NR
CoA
CoA
TF
сайт TF
мРНК
TF
сайт TF
мРНК
20.
Негативная регуляция транскрипцииядерными рецепторами
(Транс-репрессия –
корепрессорное действие NR)
Непрямая репрессия (транс-репрессия):
При транс-репрессии рецептор сам выступает в роли
корепрессора, не взаимодействуя прямо с ДНК
CoA
NR
CoA
TF
TF
мРНК
мРНК
сайт TF
CoR
сайт TF
21. Патологии, связанные с мутациями ядерных рецепторов
22. Мутации ядерных рецепторов на примере андрогенного рецептора (АР)
• Полиморфизм АР с изменением количества триплетныхповторов (CAG)n в регуляторной области гена АР (обратная
корреляция между числом повторов и функцией АР):
- 9-36 повторов - норма,
- Меньше 9 повторов – рак простаты или гиперандрогения у
женщин
- Больше 40 повторов – пониженная вирилизация, нарушения
сперматогенеза, мужское бесплодие, нейродегенеративные
заболевания
• Инактивирующие мутации АР – синдром полной или частичной
нечувствительности к андрогенам (синдром тестикулярной
феминизации , мужской псевдогермафродитизм)
• Активирующие мутации АР – рак репродуктивных органов
23. Мутация, ведущая к дисфункции андрогенного рецептора
Мутация андрогенсвязывающего карманаандрогенного рецептора
Появление способности неактивных андрогенов и
прогестерона опосредовать активацию рецептора
Прогрессия
карциномы
простаты
24.
Нарушения, связанные с мутациями ядерных рецепторовРецептор 1,25(OH)2-D3 (VDR)
ДНК
Большинство мутаций (замены аминокислот, стопкодоны, нарушение сплайсинга) являются рецессивными,
т.е. проявляются только у гомозигот.
Лиганд
1
424
Мутации
Наследственный
зависимый от витамина D
рахит типа II (VDDR-II)
Мутации, нарушающие
связывание VDR с
лигандом,
коактиватором
Не работает:
зависимая от витамина
D3 трансактиваторная
функция VDR
Облысение
Мутации, нарушающие
связывание VDR с ДНК и
RXR, или отсутствие VDR
Не работает:
трансрепрессорная
функция VDR
25. Рецепторы арильных углеводородов
26.
Лиганды рецептора арильных углеводородовПоллютант агонист 2,3,7,8-тетрахлордибензо-п-диоксин (а),
Растительный антагонист кампферол (б),
Эндогенные агонисты:
метаболиты триптофана - 3-индоксилсульфат, или индикан (в)
и кинуреновая кислота
(г)
б
а
HO
в
Cl
O
Cl
Cl
O
Cl
г
O
OH
HO
O
OH
O
O
S
O
N
H
OH
OH
N
H
O
27. Структура рецептора арильных углеводородов (AhR)
AhR функционирует сходно с ядернымирецепторами, хотя структурно с ними не связан
Hsp90
ДСД
AhR
Hsp90
ЛСД
XAP2
XAP-2
иммунофилинподобный белок
ТАД
838
bHLH – основной мотив
спираль-петля-спираль
NLS
bHLH
NES
ДСД – ДНК-связывающий домен: bHLH – основной мотив
спираль-петля-спираль
ЛСД – лигандсвязывающий домен;
ТАД – трансактиваторный домен;
NLS-сигнал ядерной локализации; NES – сигнал экспорта из ядра
28. Роль комплексирования рецептора арильных углеводородов с белками теплового шока
В цитоплазме гетеродимеры:• Неактивный AhR+
• димер белка теплового шока (Hsp90)+
иммунофиллинподобный белок ХАР2+
• кошаперон р23
Роль hsp90:
• Комплексирование с гормонсвязывающим доменом
• Поддержание и усиление аффинности гормонсвязывающего
кармана к гормону
• Блокирование ДНК-связывающего домена в отсутствие гормона
• Транспорт вновь синтезированных рецепторов к ядру
29.
Система проведения сигнала рецептора арильных углеводородов (AhR) и его ауторегуляции.1 и 2 – этапы репрессорного действия AhRR.
XAP-2 = HBV X-associated protein 2 (иммунофилин-подобный белок); Hsp90 – белок теплового шока
90; AhRR – репрессор AhR; XRE – ксенобиотикчувствительный элемент
лиганд
а
XAP2
AhR
Hsp90
Фаза детоксикации 1:
Фаза детоксикации 2:
Цитохромы P450
(гидроксилирование
субстратов) флавиновые
монооксигеназы
(окисление гетероатомов
N, S) аминооксидазы
гидролазы
Ариламин-Nацетилтрансфераза
УДФ-глюкуронил-трансферазы
сульфотрансферазы г
лутатион-S-трансферазы
O-, S-, N-метилтрансферазы
цитоплазма
XAP-2
иммунофилинподобный белок
Arnt
ядро
AhRR
Метаболизм
ксенобиотиков
Arnt – ядерный
переносчик AhR
(HIF1β)
1
XRE
Ксенобиотикчувствительный элемент
AhRR – репрессор AhR
2
XRE
GCGTG
мРНК
CYP1A1
AhRR и др.
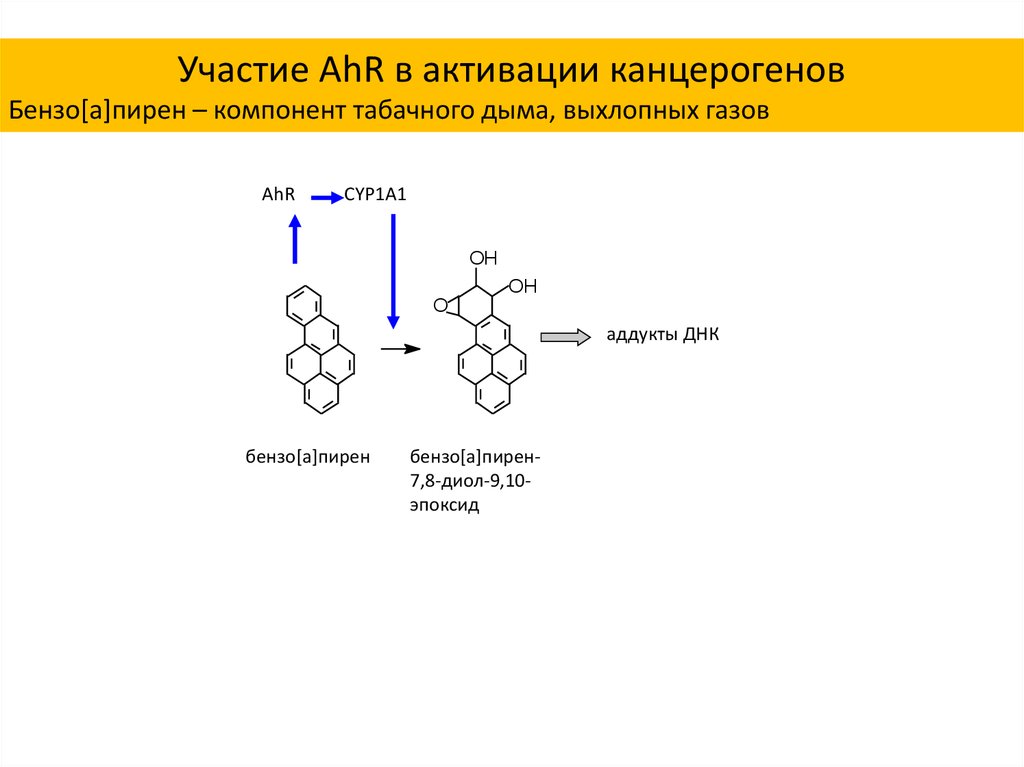
30.
Участие AhR в активации канцерогеновБензо[a]пирен – компонент табачного дыма, выхлопных газов
AhR
CYP1A1
OH
OH
O
аддукты ДНК
бензо[a]пирен
бензо[a]пирен7,8-диол-9,10эпоксид
31.
AhR и репродуктивная функция•Активация AhR ведет к ускоренной инактивации половых гормонов за счет
индукции метаболизирующих ферментов
•Некоторые лиганды AhR могут быть агонистами/антагонистами Э-Рц и А-Рц
•AhR и Arnt могут служить корегуляторами Э-Рц и А-Рц и стимулировать их
убиквитинилирование
•Перекрытие эстрогенчувствительных и ксенобиотикчувствительных элементов
ДНК → конкуренция ER и AhR за ДНК
•Полиморфизм Pro185Ala в AhRR → недостаточность маскулинизации,
предрасположенность к олиго- и азооспермии
32. Сенсор электрофильных ксенобиотиков и окислительного стресса белок Keap1
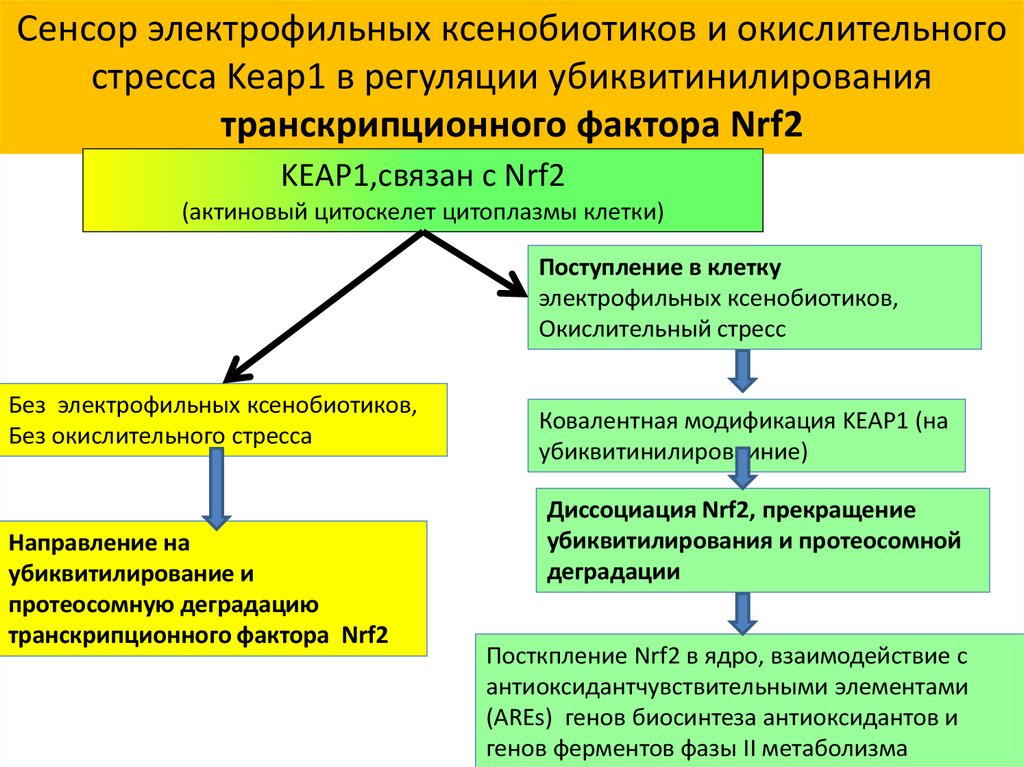
33.
Сенсор электрофильных ксенобиотиков и окислительногостресса Keap1 в регуляции убиквитинилирования
транскрипционного фактора Nrf2
KEAP1,связан с Nrf2
(актиновый цитоскелет цитоплазмы клетки)
Поступление в клетку
электрофильных ксенобиотиков,
Окислительный стресс
Без электрофильных ксенобиотиков,
Без окислительного стресса
Направление на
убиквитилирование и
протеосомную деградацию
транскрипционного фактора Nrf2
Ковалентная модификация KEAP1 (на
убиквитинилироваиние)
Диссоциация Nrf2, прекращение
убиквитилирования и протеосомной
деградации
Посткпление Nrf2 в ядро, взаимодействие с
антиоксидантчувствительными элементами
(AREs) генов биосинтеза антиоксидантов и
генов ферментов фазы II метаболизма
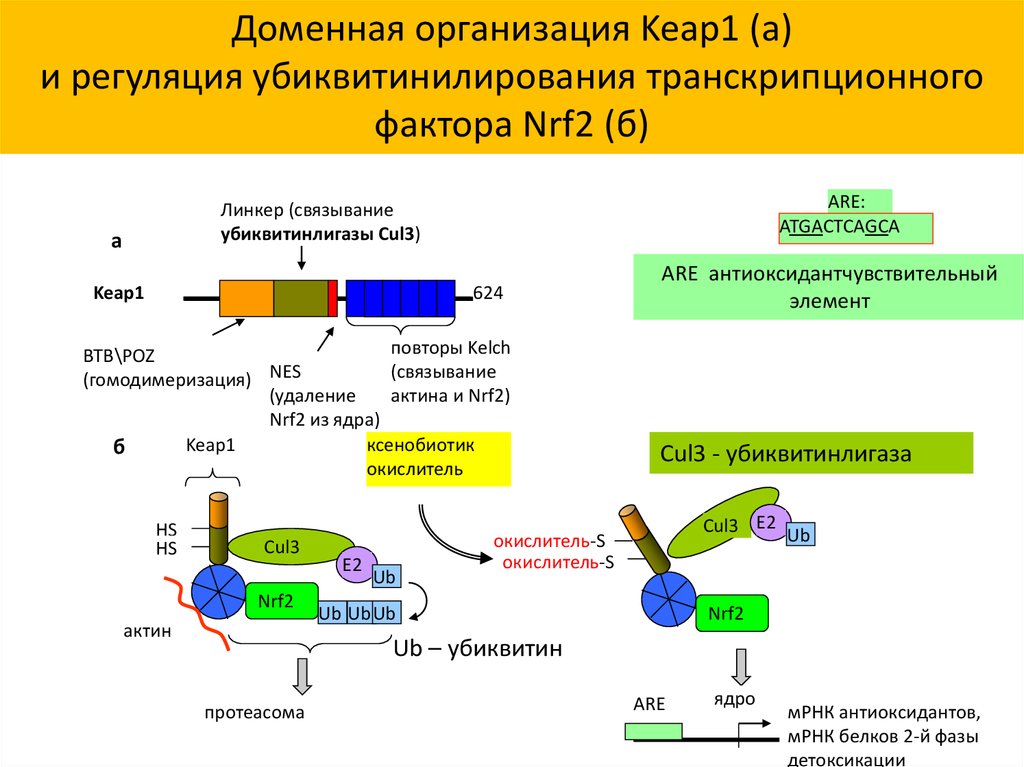
34.
Доменная организация Keap1 (а)и регуляция убиквитинилирования транскрипционного
фактора Nrf2 (б)
ARE:
ATGACTCAGCA
Линкер (связывание
убиквитинлигазы Cul3)
а
Keap1
624
повторы Kelch
BTB\POZ
(связывание
(гомодимеризация) NES
актина и Nrf2)
(удаление
Nrf2 из ядра)
Keap1
ксенобиотик
б
окислитель
HS
HS
Cul3
Nrf2
актин
E2
Ub
ARE антиоксидантчувствительный
элемент
Cul3 - убиквитинлигаза
Cul3 E2 Ub
окислитель-S
окислитель-S
Nrf2
Ub UbUb
Ub – убиквитин
протеасома
ARE
ядро
мРНК антиоксидантов,
мРНК белков 2-й фазы
детоксикации
35. Мембранные рецепторы группы Notch, активируемые зависимым от лиганда протеолизом
Контактный способ передачи сигналаМембранные рецепторы
группы Notch,
активируемые зависимым от
лиганда протеолизом
36. Лиганды рецептора Notch
Интегральные трансмембранные белки с однимтрансмембранным доменом:
Delta-like-1, Delta-like-3, Delta-like-4, Jagged-1, Jagged-2
Основной эффект:
Регуляция судьбы клетки – стимуляция пролиферации предшественников,
торможение дифференцировки
Delta-like-1
Недоразвитие поджелудочной железы
(ускоренная дифференцировка клетокпредшественников)
37. Принцип работы рецепторов Notch
Взаимодействие с лигандом, заякоренным на соседней клеткеДвухступечатое протеолитическое отщепление внутриклеточного домена рецептора
Поступление внутриклеточного домена в ядро
Лигандсвязывающая
субъединица вместе с
лигандом с помощью
эндоцитоза поступает в
клетку-донор лиганда
Действие внутриклеточного домена как
корегулятора транскрипционных факторов
Дифференцировка (чаще ингибирование),
пролиферация, апоптоз, органогенез
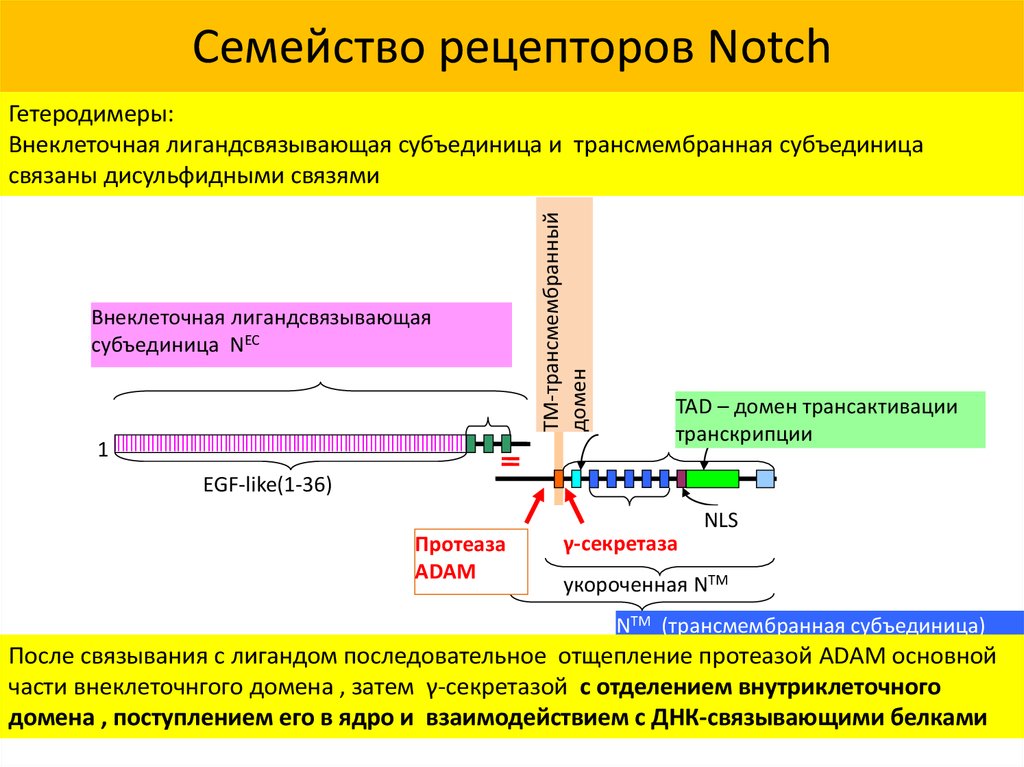
38. Семейство рецепторов Notch
Внеклеточная лигандсвязывающаясубъединица NEC
1
TM-трансмембранный
домен
Гетеродимеры:
Внеклеточная лигандсвязывающая субъединица и трансмембранная субъединица
связаны дисульфидными связями
TAD – домен трансактивации
транскрипции
EGF-like(1-36)
NLS
Протеаза
ADAM
γ-секретаза
укороченная NTM
NTM (трансмембранная субъединица)
После связывания с лигандом последовательное отщепление протеазой ADAM основной
части внеклеточнгого домена , затем γ-секретазой с отделением внутриклеточного
домена , поступлением его в ядро и взаимодействием с ДНК-связывающими белками
39.
Внутриклеточный домен Notch (NIC) индуцирует вытеснение корепрессорногобелкового комплекса из связи с транскрипционным фактором CBF и
рекрутирование коактиваторного белкового комплекса, что обеспечивает
инициацию транскрипции
Корепрессорный комплекс
CIR
SMRT
SHARP
Внутриклеточный
домен Notch (NIC)
HDAC
CtBP/CtIP
NIC
Коактиваторный
комплекс
SKIP
HAT
MAML
NIC
CBF-1
CGTGGGAA
CBF-1 – промоторсвязывающий фактор 1
(конститутивный транскрипционный фактор)
мРНК
40.
Активирующие мутациитрансмембранной субъединицы рецептора Notch
Активирующие мутации
N-концевого внеклеточного домена трансмембранной субъединицы:
облегчают отделение внеклеточной субъединицы и высвобождение внутриклеточного
домена Notch
Активирующие мутации
С-концевого внеклеточного домена трансмембранной субъединицы:
увеличивают продолжительность жизни внутриклеточного домена Notch
50% T-клеточного острого лимфобластного лейкоза
связано с активирующими мутациями Notch-1
































 Медицина
Медицина Биология
Биология








