Похожие презентации:
Оксокислоти. Номенклатура
1. ОКСоКИСЛОТИ
ОКСОКИСЛОТИ• Оксокислотами називають гетерофункціональні сполуки, що містять у
молекулі одночасно карбоксильну
і карбонільну
групи.
Інша назва карбонільної групи – оксогрупа, звідки стає зрозумілою назва
цього класу сполук – оксокислоти.
• Оксогрупа може бути кетонною, якщо вона сполучена з двома
радикалами, або входити до складу альдегідної групи C O .Тому
H
оксокислоти поділяють на кетокислоти та альдегідокислоти.
• За взаємним розташуванням карбоксильної та карбонільної груп вони
поділяються на α, β, γ і так далі, за аналогією до гідроксикислот.
2. НОМЕНКЛАТУРА
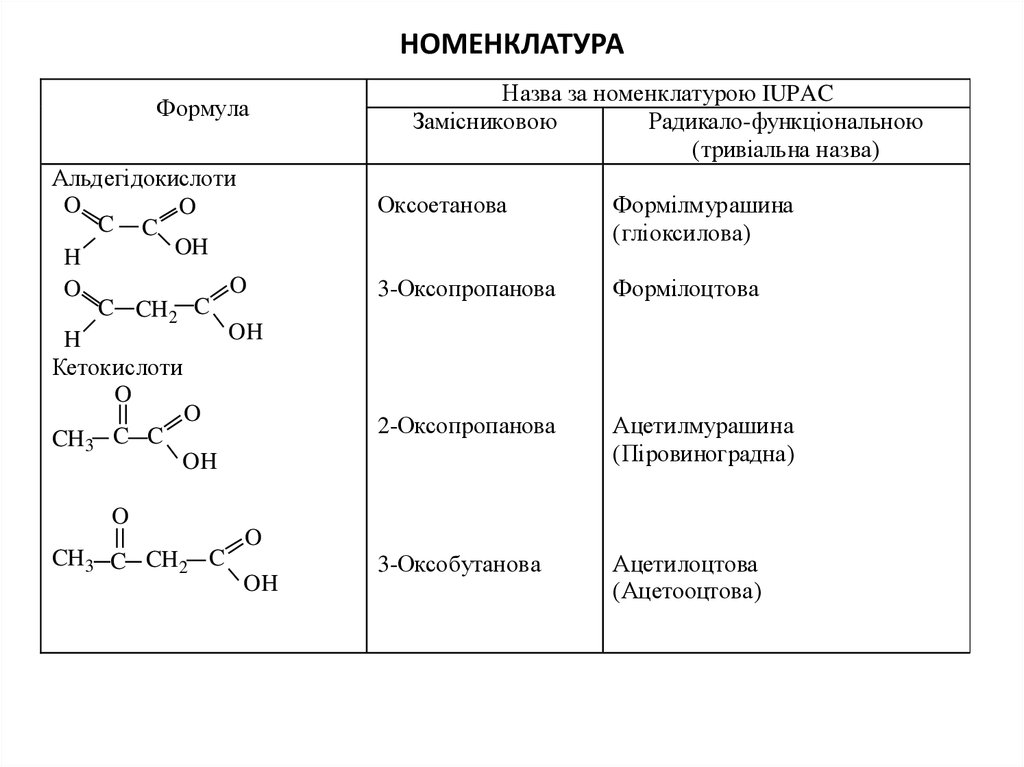
ФормулаАльдегідокислоти
O
O
C C
OH
H
O
O
C CH 2 C
OH
H
Кетокислоти
O
O
C
C
CH 3
OH
O
CH 3 C CH 2 C
Назва за номенклатурою IUPAC
Замісниковою
Радикало-функціональною
(тривіальна назва)
Оксоетанова
Формілмурашина
(гліоксилова)
3-Оксопропанова
Формілоцтова
2-Оксопропанова
Ацетилмурашина
(Піровиноградна)
3-Оксобутанова
Ацетилоцтова
(Ацетооцтова)
O
OH
3. За замісниковою номенклатурою IUPAC назви оксокислот утворюються з назв відповідних карбонових кислот додаванням префікса
оксо-.За радикало-функціональною номенклатурою до назви
карбонової кислоти додається назва ацила, що містить
оксогрупу.
Збережені також деякі тривіальні назви.
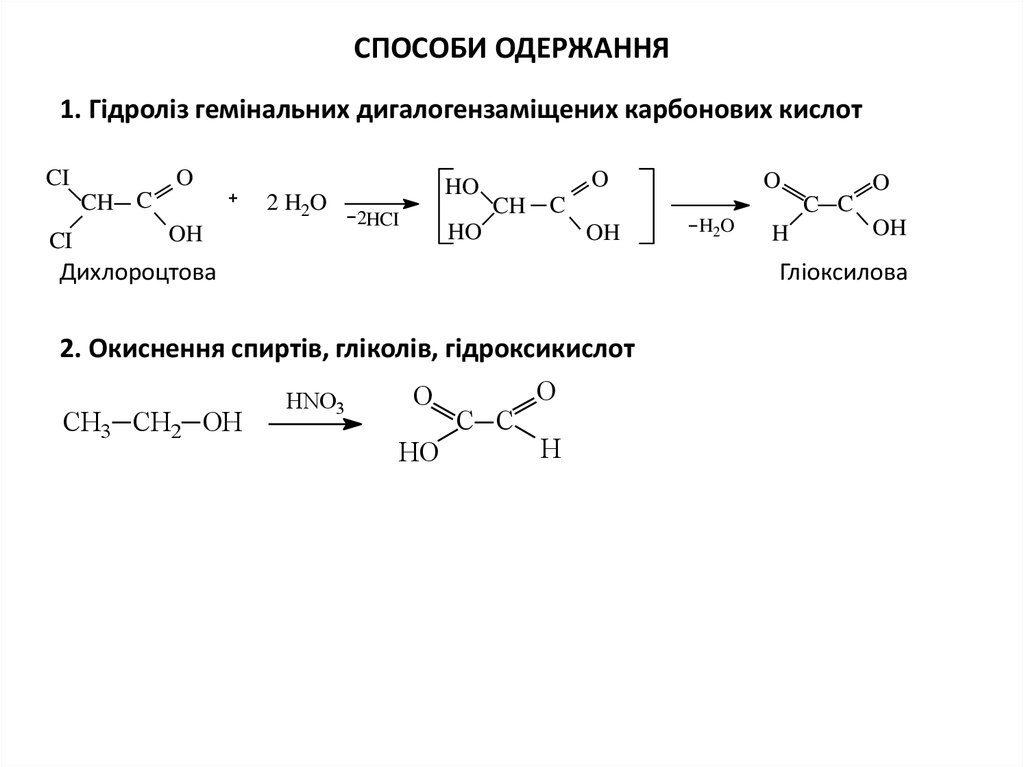
4. СПОСОБИ ОДЕРЖАННЯ
1. Гідроліз гемінальних дигалогензаміщених карбонових кислотCI
O
CH C
CI
2 H2O
OH
HO
2HCI
O
CH
HO
O
C C
C
OH
Дихлороцтова
H2O
H
OH
Гліоксилова
2. Окиснення спиртів, гліколів, гідроксикислот
СН3 СН2 ОН
O
HNO3
O
HO
C C
O
H
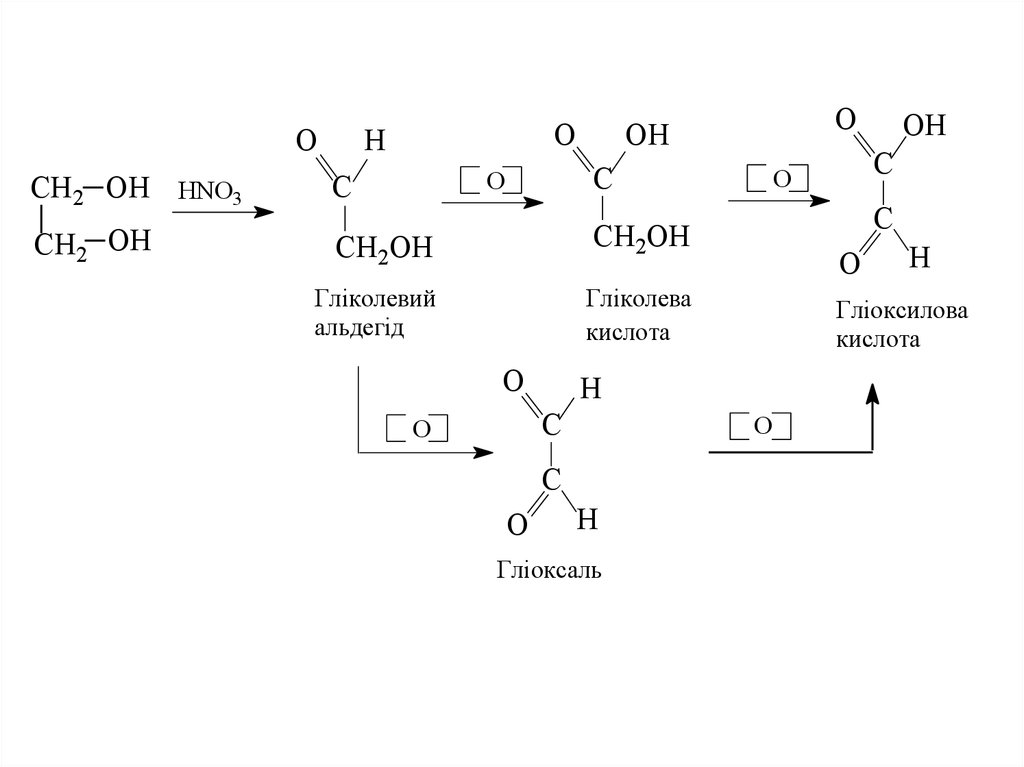
5.
OCH2 OH HNO3
CH2 OH
O
H
C
O
C
O
OH
CH2OH
CH2OH
Гліколевий
альдегід
Гліколева
кислота
O
O
C
O
H
Гліоксаль
H
Гліоксилова
кислота
O
C
C
O
H
C
O
OH
6. Молочна кислота Піровиноградна кислота
OHO
CH3 CH C
O
O
OH
Молочна кислота
CH3 C C
O
OH
Піровиноградна кислота
3. Взаємодія ацилгалогенідів з ціанідами з наступним гідролізом
оксонітрилів
CH3 C
O
CI
Ацетилхлорид
O
O
CuCN
CuCI
CH3 C C
Оксонітрил
N
2H2O
NH3
O
CH3 C C
OH
2-Оксопропанова
кислота
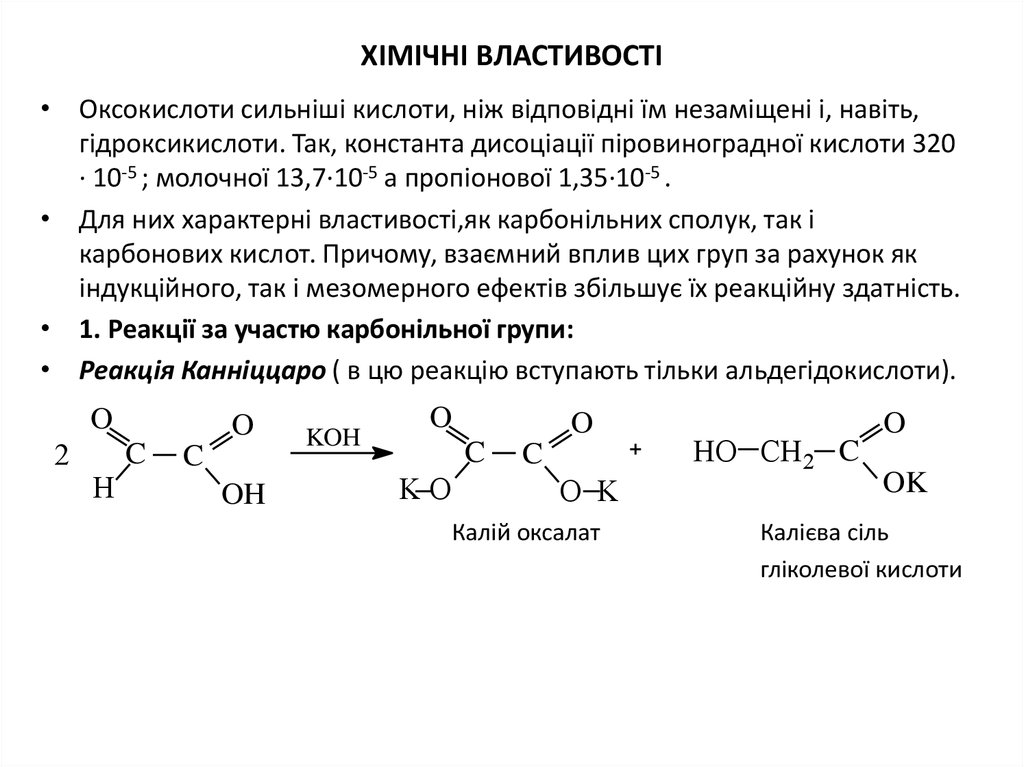
7. ХІМІЧНІ ВЛАСТИВОСТІ
• Оксокислоти сильніші кислоти, ніж відповідні їм незаміщені і, навіть,гідроксикислоти. Так, константа дисоціації піровиноградної кислоти 320
· 10-5 ; молочної 13,7·10-5 а пропіонової 1,35·10-5 .
• Для них характерні властивості,як карбонільних сполук, так і
карбонових кислот. Причому, взаємний вплив цих груп за рахунок як
індукційного, так і мезомерного ефектів збільшує їх реакційну здатність.
• 1. Реакції за участю карбонільної групи:
• Реакція Канніццаро ( в цю реакцію вступають тільки альдегідокислоти).
O
2
O
C
H
C
OH
KOH
O
O
C
KO
C
O K
Калій оксалат
HO CH2 C
O
OK
Калієва сіль
гліколевої кислоти
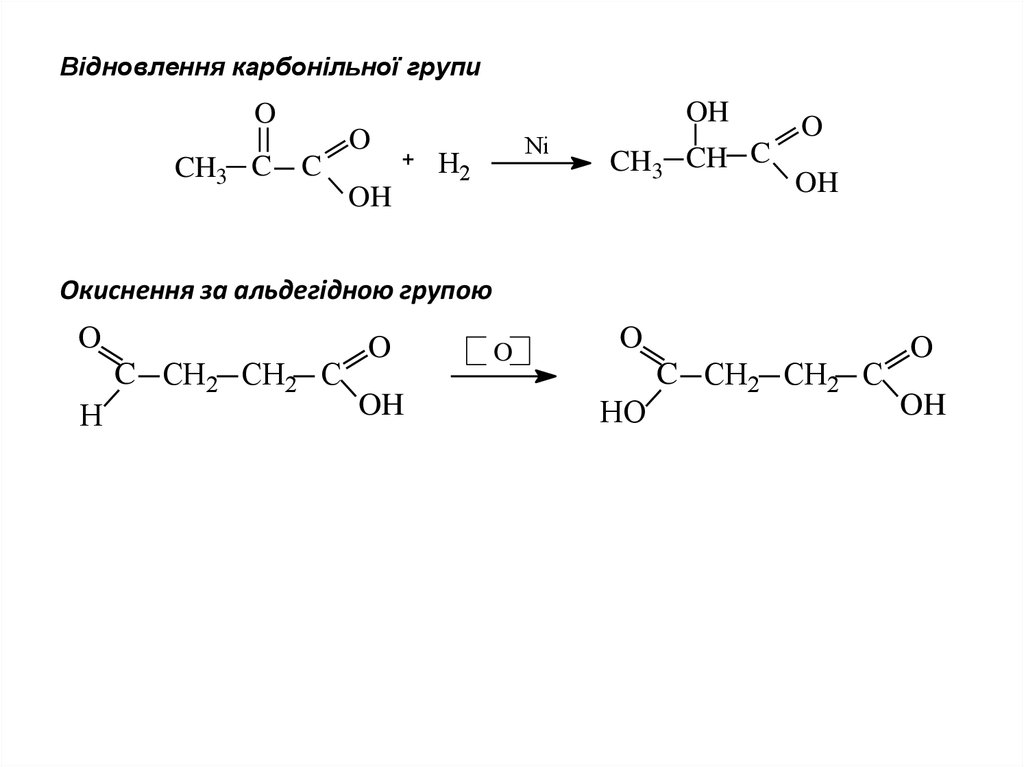
8. Відновлення карбонільної групи
OHO
CH3 C
O
C
Ni
H2
CH3 CH C
OH
O
OH
Окиснення за альдегідною групою
O
C СН2 СН2 C
H
O
OH
O
O
HO
C СН2 СН2 C
O
OH
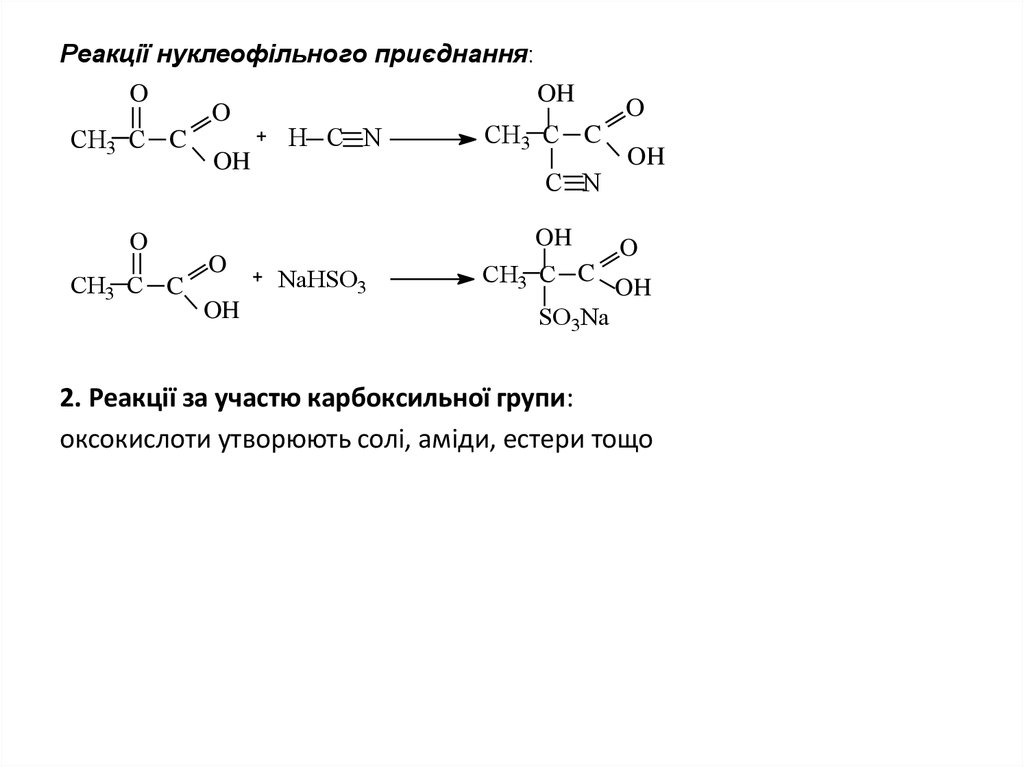
9. Реакції нуклеофільного приєднання:
OСН3 C C
O
СН3 C C
O
OH
O
OH
OH
H C N
СН3 C C
C N
NaHSO3
OH
СН3 C C
O
OH
O
OH
SO3Na
2. Реакції за участю карбоксильної групи:
оксокислоти утворюють солі, аміди, естери тощо
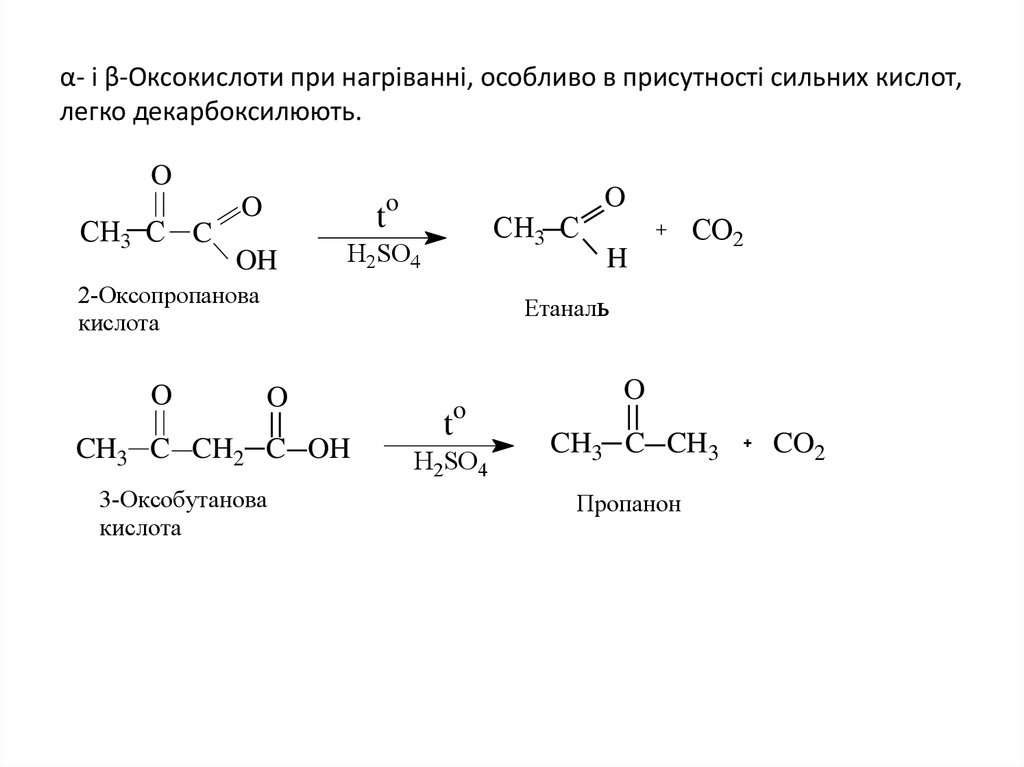
10. α- і β-Оксокислоти при нагріванні, особливо в присутності сильних кислот, легко декарбоксилюють.
OСН3 C C
o
O
t
OH
H2SO4
СН3 C
2-Оксопропанова
кислота
O
O
H
CO2
Етаналь
O
CH3 C CH2 C OH
3-Оксобутанова
кислота
o
t
H2SO4
O
CH3 C CH3
Пропанон
CO2
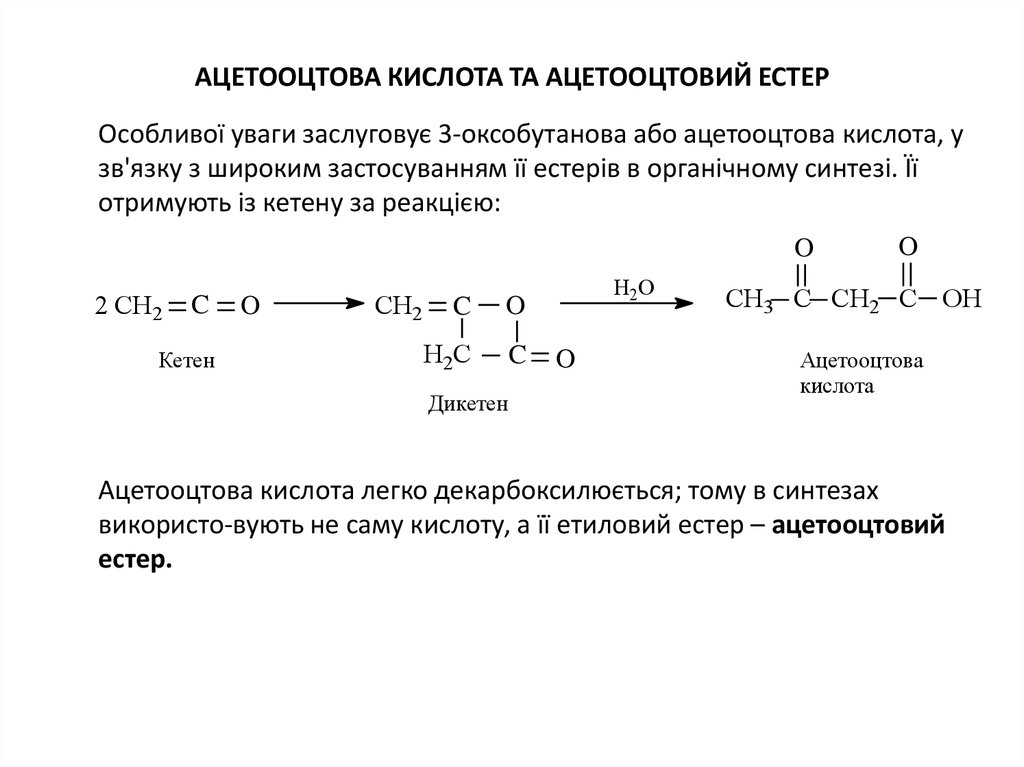
11. Ацетооцтова кислота та ацетооцтовий естер
АЦЕТООЦТОВА КИСЛОТА ТА АЦЕТООЦТОВИЙ ЕСТЕРОсобливої уваги заслуговує 3-оксобутанова або ацетооцтова кислота, у
зв'язку з широким застосуванням її естерів в органічному синтезі. Її
отримують із кетену за реакцією:
O
2 CH2
C
Кетен
O
CH2
C
O
H2C
C
Дикетен
H2O
O
O
СН3 C СН2 C OH
Ацетооцтова
кислота
Ацетооцтова кислота легко декарбоксилюється; тому в синтезах
використо-вують не саму кислоту, а її етиловий естер – ацетооцтовий
естер.
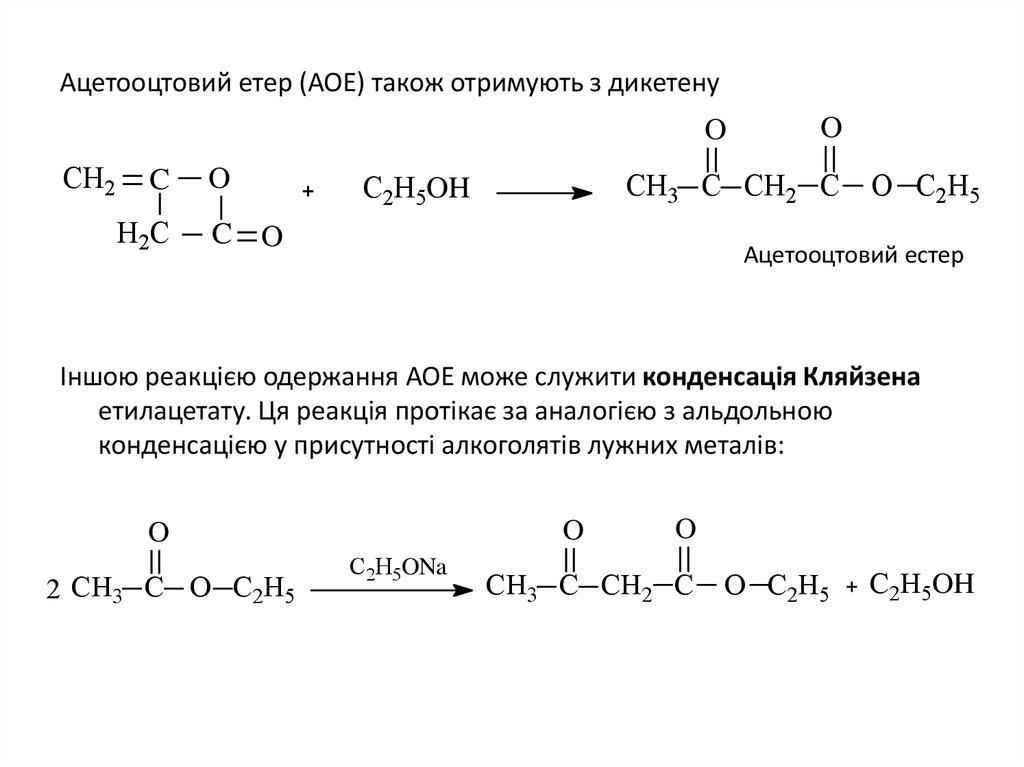
12. Ацетооцтовий етер (АОЕ) також отримують з дикетену
OCH2
C
H2C
O
O
СН3 C СН2 C
С2Н5OH
C O
O С2Н5
Ацетооцтовий естер
Іншою реакцією одержання АОЕ може служити конденсація Кляйзена
етилацетату. Ця реакція протікає за аналогією з альдольною
конденсацією у присутності алкоголятів лужних металів:
O
O
2 СН3 C O С2Н5
С2Н5ONa
O
СН3 C СН2 C
O С2Н5
С2Н5OH
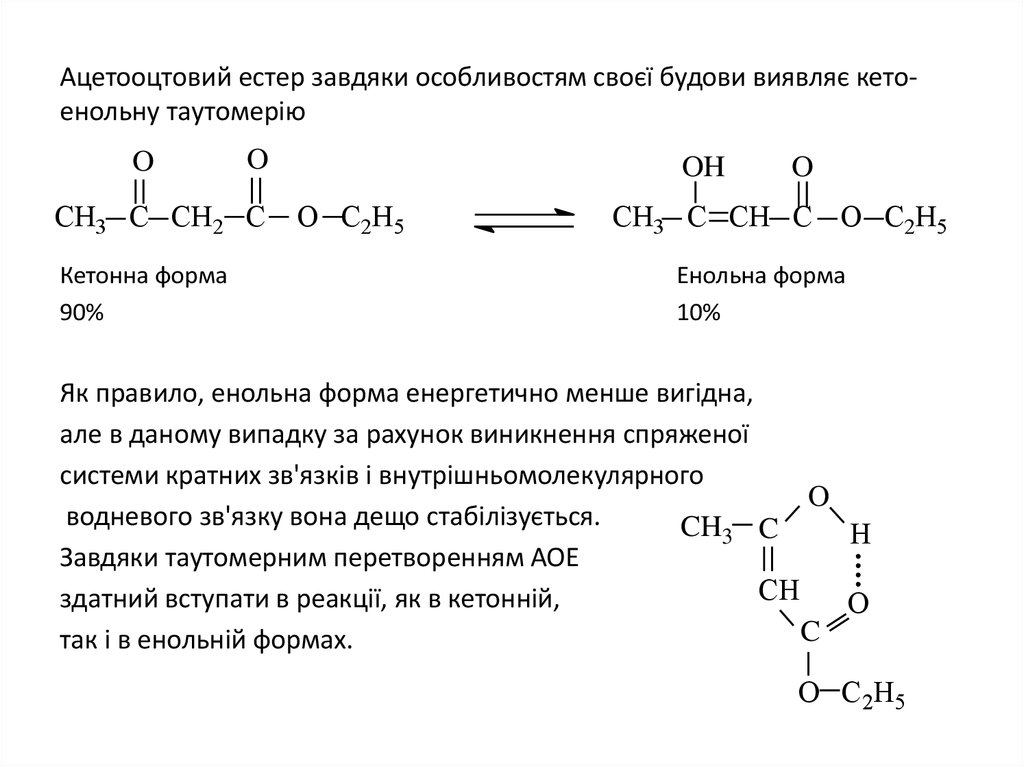
13. Ацетооцтовий естер завдяки особливостям своєї будови виявляє кето-енольну таутомерію
Ацетооцтовий естер завдяки особливостям своєї будови виявляє кетоенольну таутомеріюO
O
СН3 C СН2 C
Кетонна форма
90%
OH
O С2Н5
O
СН3 C СН C O С2Н5
Енольна форма
10%
Як правило, енольна форма енергетично менше вигідна,
але в даному випадку за рахунок виникнення спряженої
системи кратних зв'язків і внутрішньомолекулярного
O
водневого зв'язку вона дещо стабілізується.
CH3 C
H
Завдяки таутомерним перетворенням АОЕ
CH
здатний вступати в реакції, як в кетонній,
O
C
так і в енольній формах.
O С2Н5
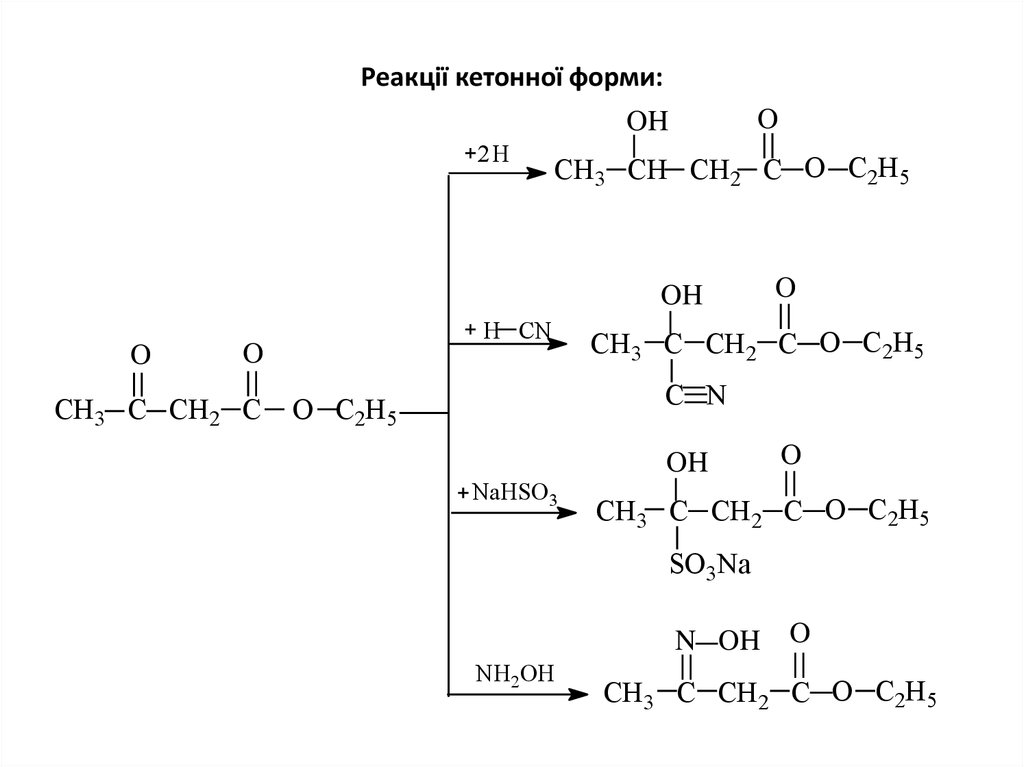
14. Реакції кетонної форми:
OOH
2H
СН3 СН СН2 C O С2Н5
OH
O
H CN
O
СН3 C СН2 C
O
СН3 С СН2 C O С2Н5
C N
O С2Н 5
OH
NaHSO3
O
СН3 С СН2 C O С2Н5
SO3Na
N OH
NH2ОН
O
СН3 С СН2 C O С2Н5
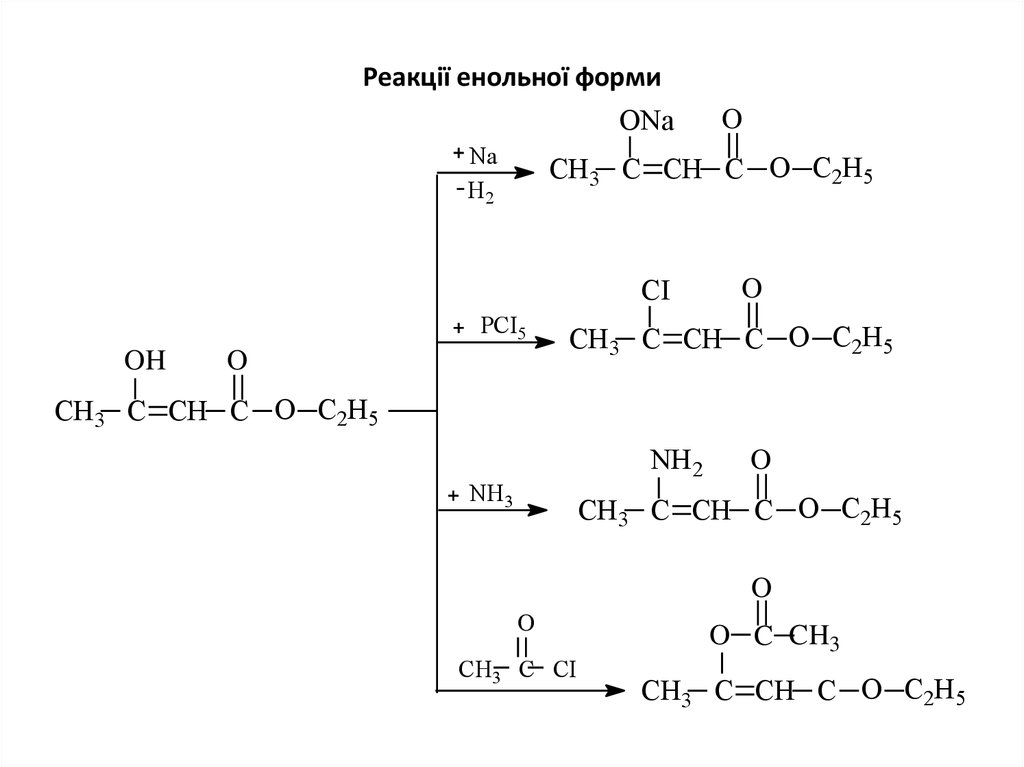
15. Реакції енольної форми
ONaNa
Н2
СН3 C СН C O С2Н5
CI
PCI5
OH
O
O
O
СН3 C СН C O С2Н5
СН3 C СН C O С2Н5
NH2
NH3
O
СН3 C СН C O С2Н5
O
O
СН3 С CI
O C CH3
СН3 C СН C O С2Н5
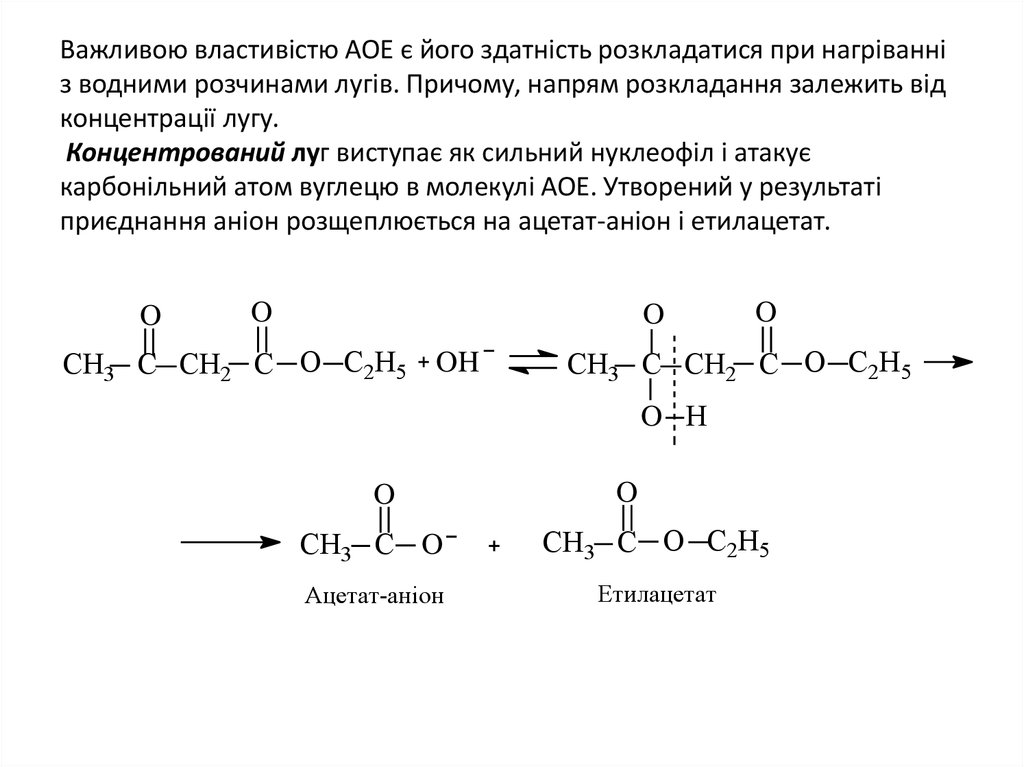
16. Важливою властивістю АОЕ є його здатність розкладатися при нагріванні з водними розчинами лугів. Причому, напрям розкладання
залежить відконцентрації лугу.
Концентрований луг виступає як сильний нуклеофіл і атакує
карбонільний атом вуглецю в молекулі АОЕ. Утворений у результаті
приєднання аніон розщеплюється на ацетат-аніон і етилацетат.
O
O
O
СН3 C СН2 C O С2Н5 OH
O
СН3 C СН2 C O С2Н5
O H
O
O
СН3 C O
СН3 C O С2Н5
Ацетат-аніон
Етилацетат
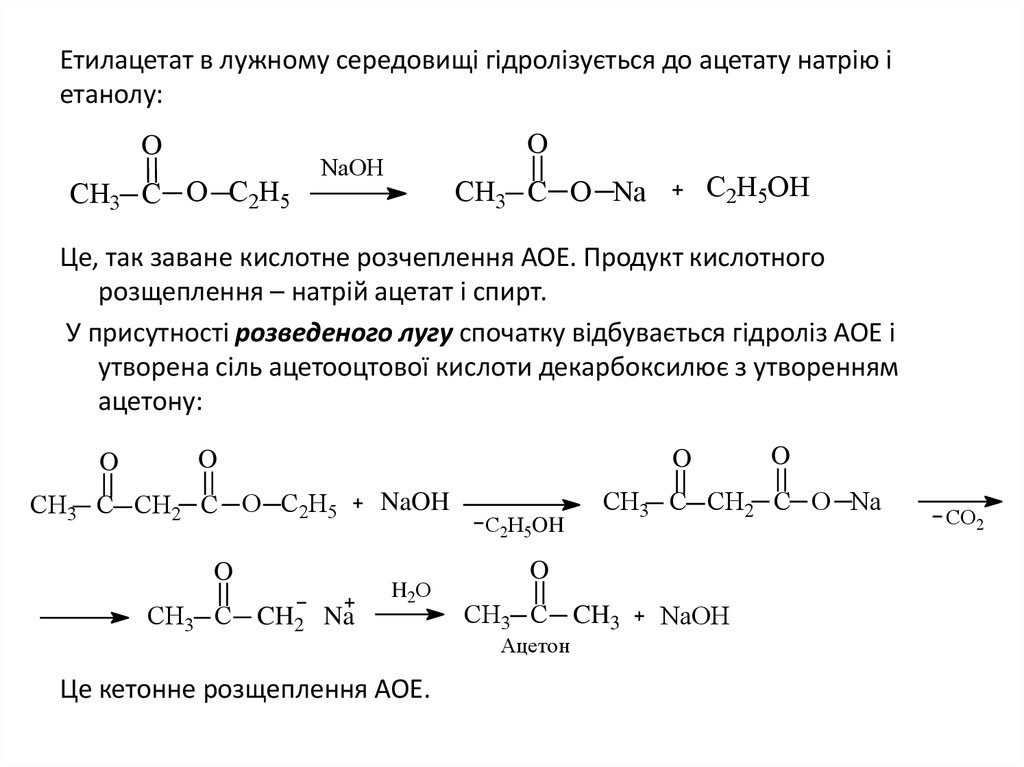
17. Етилацетат в лужному середовищі гідролізується до ацетату натрію і етанолу:
OСН3 C O С2Н5
O
NaОН
C2H5OH
СН3 C O Na
Це, так заване кислотне розчеплення АОЕ. Продукт кислотного
розщеплення – натрій ацетат і спирт.
У присутності розведеного лугу спочатку відбувається гідроліз АОЕ і
утворена сіль ацетооцтової кислоти декарбоксилює з утворенням
ацетону:
O
O
O
СН3 C СН2 C O С2Н5
O
СН3 C CH2 Na
NaOH
H2О
Це кетонне розщеплення АОЕ.
С2Н5OH
СН3 C СН2 C O Na
O
СН3 C CH3
Ацетон
O
NaOH
CO2
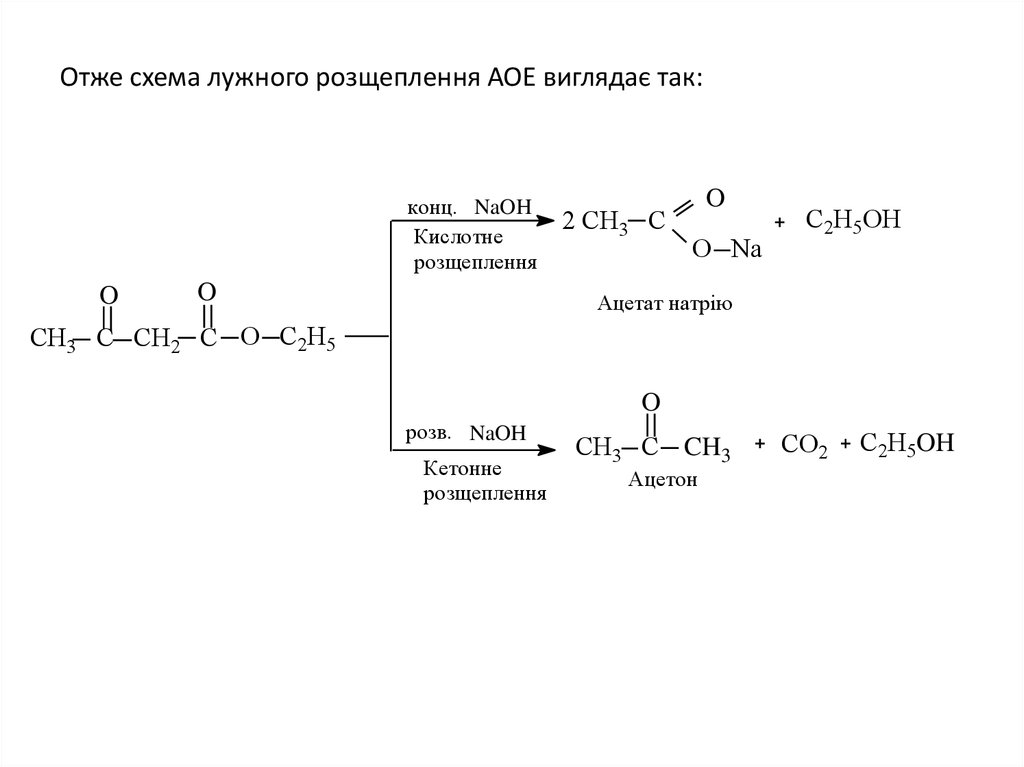
18. Отже схема лужного розщеплення АОЕ виглядає так:
конц. NaOHКислотне
розщеплення
O
O
2 СН3 C
O
O Na
С2Н5ОН
Ацетат натрію
СН3 C СН2 C O С2Н5
O
розв. NaOH
Кетонне
розщеплення
СН3 C CH3
Ацетон
CO2
С2Н5OH
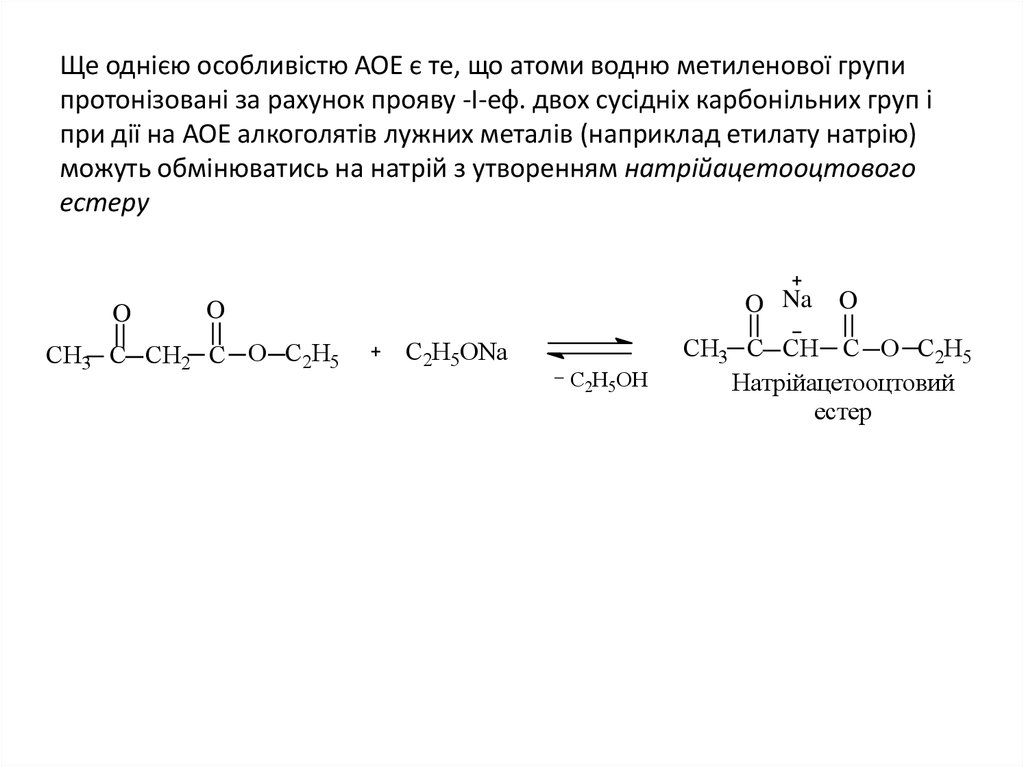
19. Ще однією особливістю АОЕ є те, що атоми водню метиленової групи протонізовані за рахунок прояву -І-еф. двох сусідніх
карбонільних груп іпри дії на АОЕ алкоголятів лужних металів (наприклад етилату натрію)
можуть обмінюватись на натрій з утворенням натрійацетооцтового
естеру
O
O Na
O
СН3 C СН2 C O С2Н5
С2Н5ONa
C2H5OH
O
СН3 C СН C O С2Н5
Натрійацетооцтовий
естер
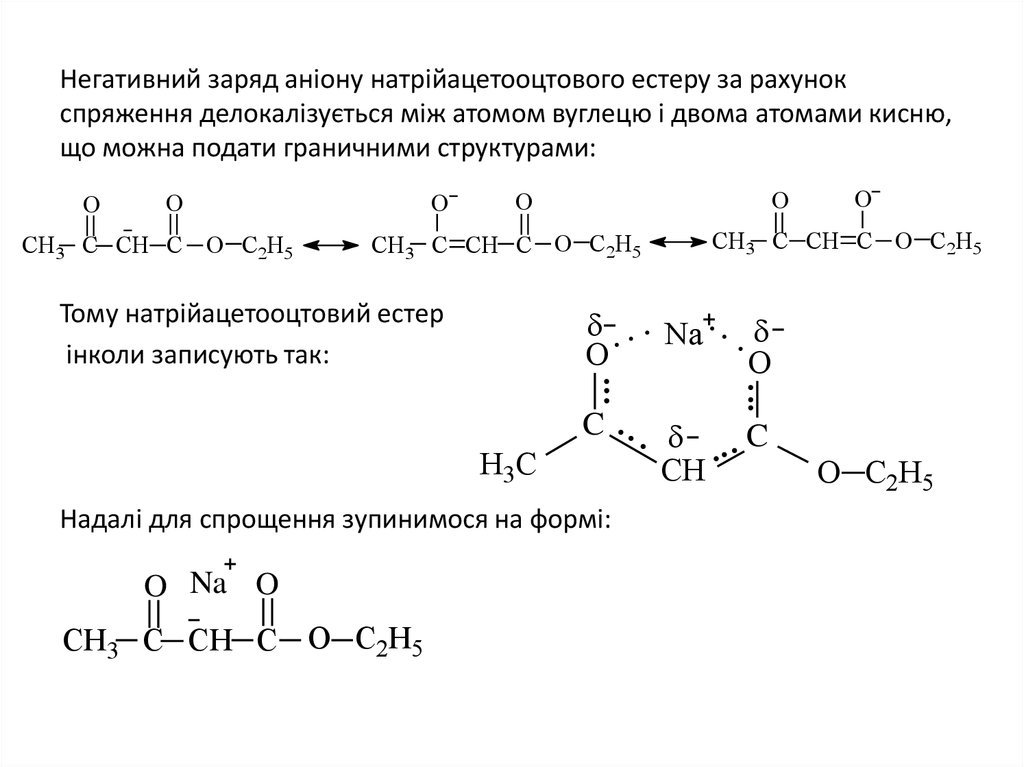
20. Негативний заряд аніону натрійацетооцтового естеру за рахунок спряження делокалізується між атомом вуглецю і двома атомами
Негативний заряд аніону натрійацетооцтового естеру за рахунокспряження делокалізується між атомом вуглецю і двома атомами кисню,
що можна подати граничними структурами:
O
O
СН3 C СН C O С2Н5
O
O
O
СН3 C СН C O С2Н5
СН3 C СН C O С2Н5
Тому натрійацетооцтовий естер
інколи записують так:
O
Na
O
C
СН
C
Н3С
Надалі для спрощення зупинимося на формі:
O Na O
СН3 C СН C O С2Н5
O
O С2Н5
21. Аніон АОЕ містить спряжену систему з вирівняними зв'язками і делокалізо-ваним негативним зарядом. Отже, у реакціях він реагує
як закиснем з утворенням О-похідних, так і за вуглецевим атомом з
утворенням С-похідних. Тому для нього характерна подвійна реакційна
здатність. Так, наприклад, алкілювання і ацилювання протікає, головним
чином, у вуглецевого атома. Утворення О- або С-похідних можна
показати на прикладі реакції алкілювання.
O Na
O
O
СН3 C СН2 C O С2Н5
R Br
NaBr
R
O R
O
СН3 C СН C
С-похідна
O С2Н5
O
СН3 C СН C O С2Н5
О-похідна
Але слід зауважити, що алкілювання і ацилювання протікає, головним
чином, у вуглецевого атома.
Здатність натрійацетооцтового естеру утворювати С-похідні, а також
розщеплюватись під дією лугів використовують для синтезу на його
основі карбонових кислот та метилкетонів.
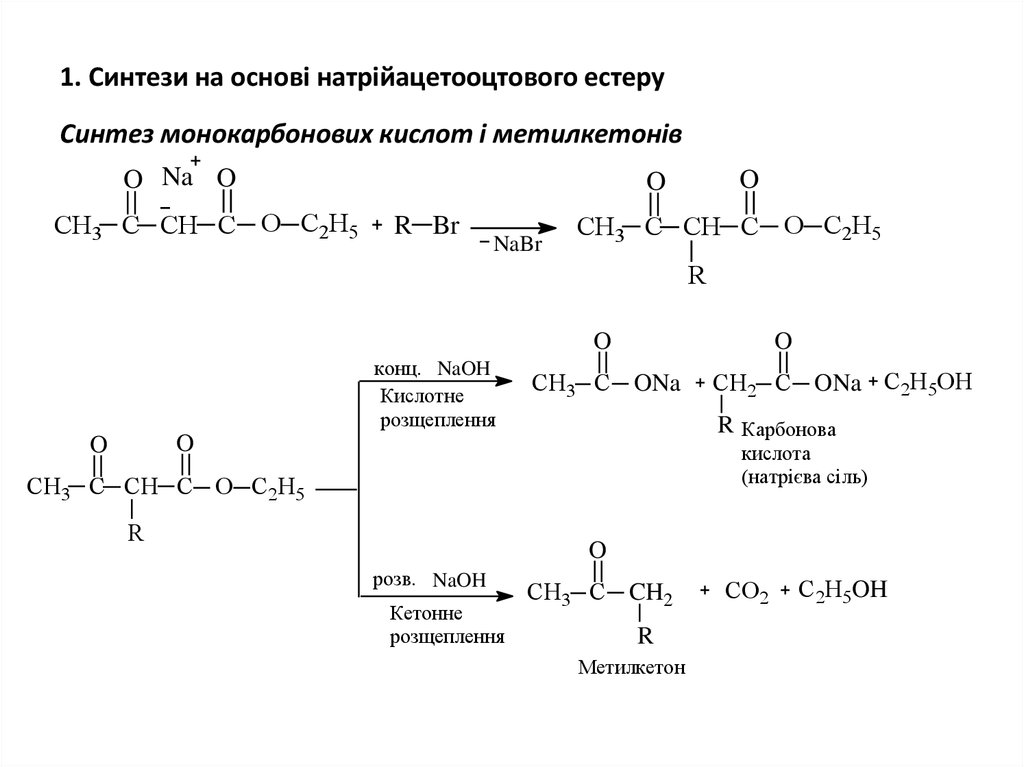
22. 1. Синтези на основі натрійацетооцтового естеру
Синтез монокарбонових кислот і метилкетонівO Na O
СН3 C СН C O С2Н5
O
O
R Br
NaBr
СН3 C СН C O С2Н5
R
O
конц. NaOH
Кислотне
розщеплення
O
СН3 C ONa
R Карбонова
O
O
СН2 C ONa С2Н5ОН
кислота
(натрієва сіль)
СН3 C СН C O С2Н5
R
O
розв. NaOH
Кетонне
розщеплення
СН3 C CH2
R
Метилкетон
CO2
С2Н5OH
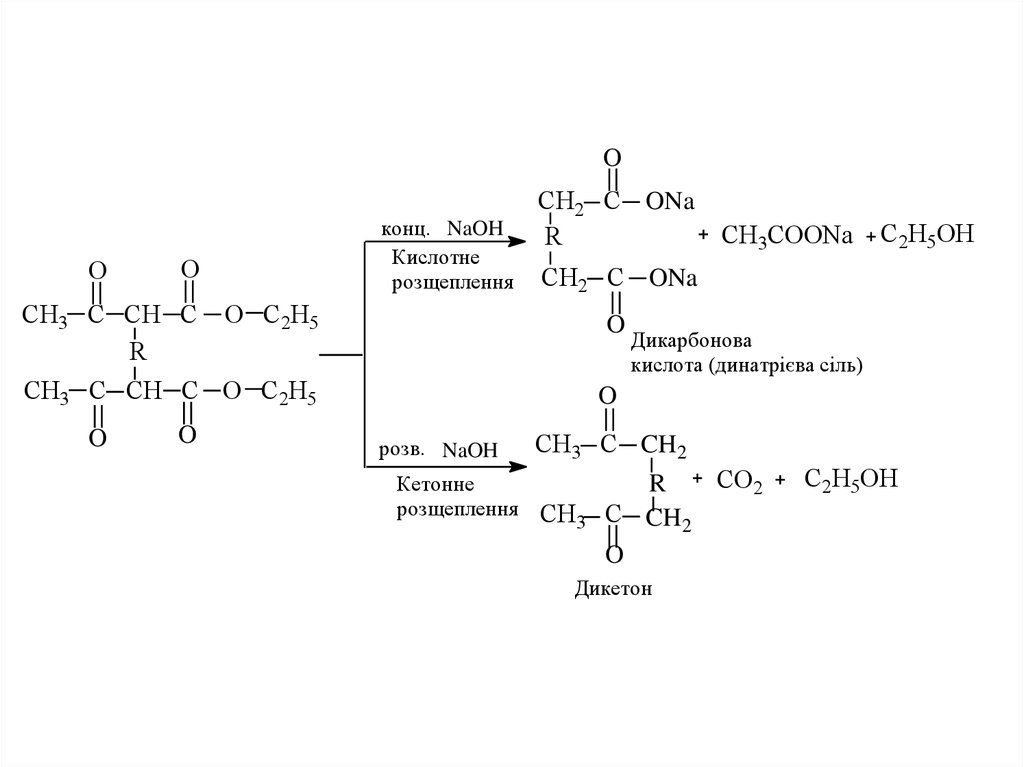
23. 1.2. Одержання дикарбонових кислот і дикетонів
OO
СН3 C СН C O С2Н5
Na
СН3 C СН C
Br
R
O С2Н5
R
2NaBr
Br
СН3 C СН C O С2Н5
Na
СН3 C СН C
O
O
O
O
O С2Н5
O
O
24.
OO
конц. NaOH
Кислотне
розщеплення
O
СН3 C СН C
R
СН2 C ONa
R
O
С2Н5ОН
СН2 C ONa
O С 2Н 5
O
СН3 C СН C O С2Н5
O
СН3СООNa
Дикарбонова
кислота (динатрієва сіль)
O
розв. NaOH
Кетонне
розщеплення
СН3 C CH2
СН3
CO2
R
C CH2
O
Дикетон
С2Н5ОН





 Химия
Химия








