Похожие презентации:
Азотовмісні сполуки
1. АЗОТОВМІСНІ СПОЛУКИ
До азотовмісних органічних сполук відносять такі, щомістять атоми азоту, безпосередньо зв'язані з атомами
вуглецю. Їх поділяють на: нітросполуки (RNO2),
нітрозосполуки (RNO), аміни (RNH2, R2NH, R3N), нітрили
карбонових кислот або ціаніди (RC≡N), азосполуки
(RN═NR), похідні гідроксил аміну (RNH―OH) тощо. В усіх
вищенаведених формулах R ― алкільний, циклоалкільний
або арильний залишок.
Найбільше значення мають нітросполуки та аміни.
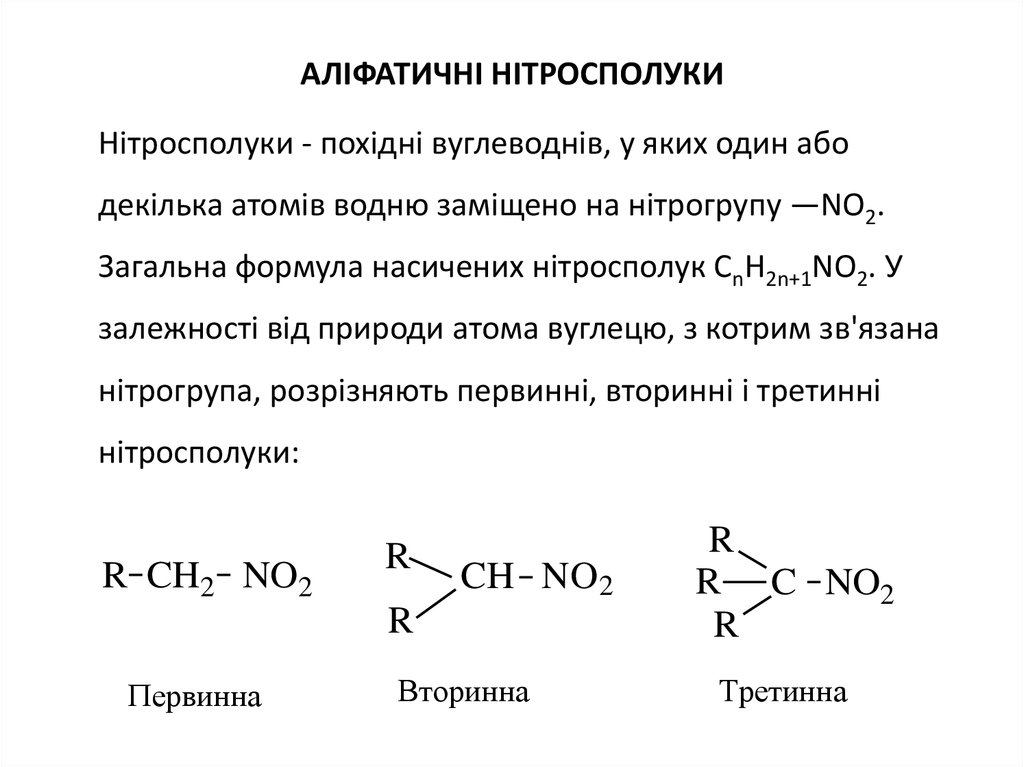
2. АЛІФАТИЧНІ НІТРОСПОЛУКИ
Нітросполуки - похідні вуглеводнів, у яких один абодекілька атомів водню заміщено на нітрогрупу —NO2.
Загальна формула насичених нітросполук CnН2n+1NО2. У
залежності від природи атома вуглецю, з котрим зв'язана
нітрогрупа, розрізняють первинні, вторинні і третинні
нітросполуки:
R CH2 NO2
R
CH NO2
R
Первинна
Вторинна
R
R C NO2
R
Третинна
3.
Назви нітросполукФормула
Назва за замісниковою
номенклатурою
CH 3 NO 2
Нітрометан
CH3 CH2 NO2
Нітроетан
CH3 CH2 CH2 NO 2
1-Нітропропан
CH3 CH CH3
NO 2
2-Нітропропан
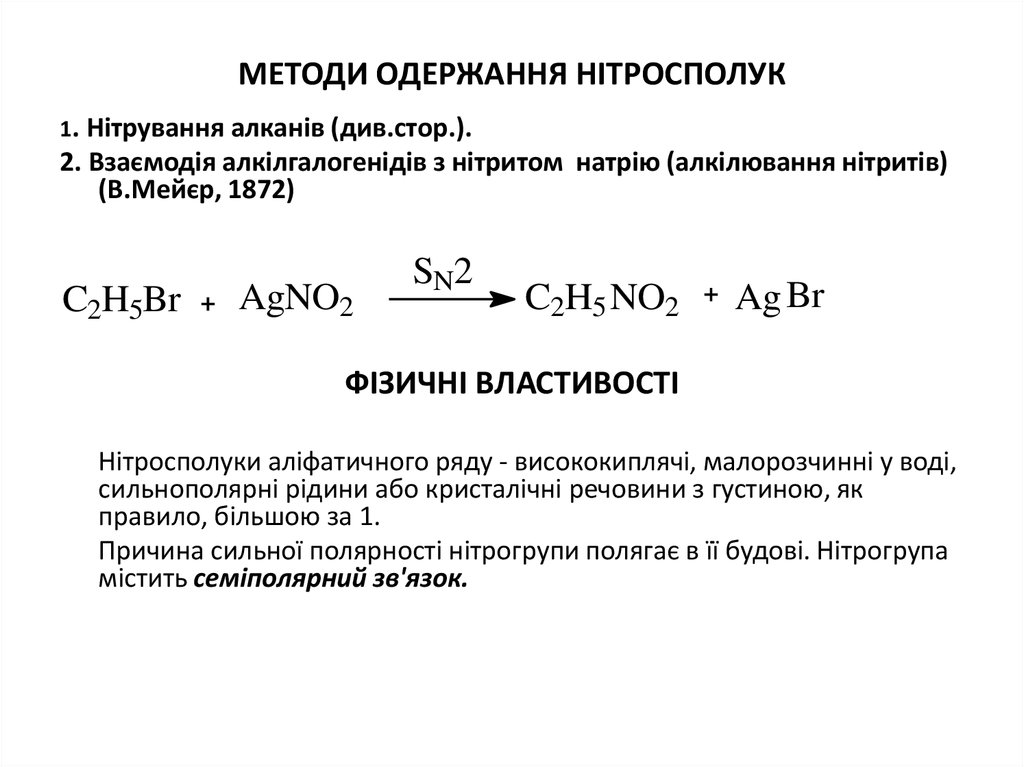
4. МЕТОДИ ОДЕРЖАННЯ НІТРОСПОЛУК
1. Нітрування алканів (див.стор.).2. Взаємодія алкілгалогенідів з нітритом натрію (алкілювання нітритів)
(В.Мейєр, 1872)
C2H5Br
AgNO2
SN2
C2H5 NO2
Ag Br
ФІЗИЧНІ ВЛАСТИВОСТІ
Нітросполуки аліфатичного ряду - висококиплячі, малорозчинні у воді,
сильнополярні рідини або кристалічні речовини з густиною, як
правило, більшою за 1.
Причина сильної полярності нітрогрупи полягає в її будові. Нітрогрупа
містить семіполярний зв'язок.
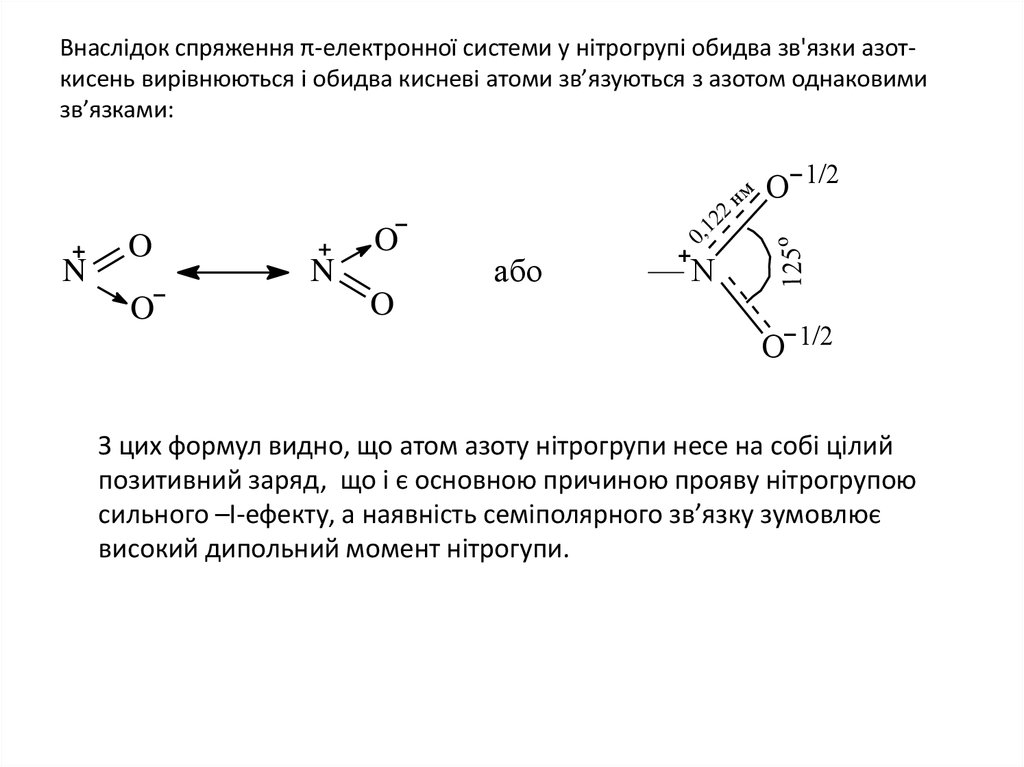
5. Внаслідок спряження π-електронної системи у нітрогрупі обидва зв'язки азот-кисень вирівнюються і обидва кисневі атоми
Внаслідок спряження π-електронної системи у нітрогрупі обидва зв'язки азоткисень вирівнюються і обидва кисневі атоми зв’язуються з азотом однаковимизв’язками:
O
O
N
O
або
N
O 1/2
125о
N
O
2
12
,
0
нм
O 1/2
З цих формул видно, що атом азоту нітрогрупи несе на собі цілий
позитивний заряд, що і є основною причиною прояву нітрогрупою
сильного –І-ефекту, а наявність семіполярного зв’язку зумовлює
високий дипольний момент нітрогупи.
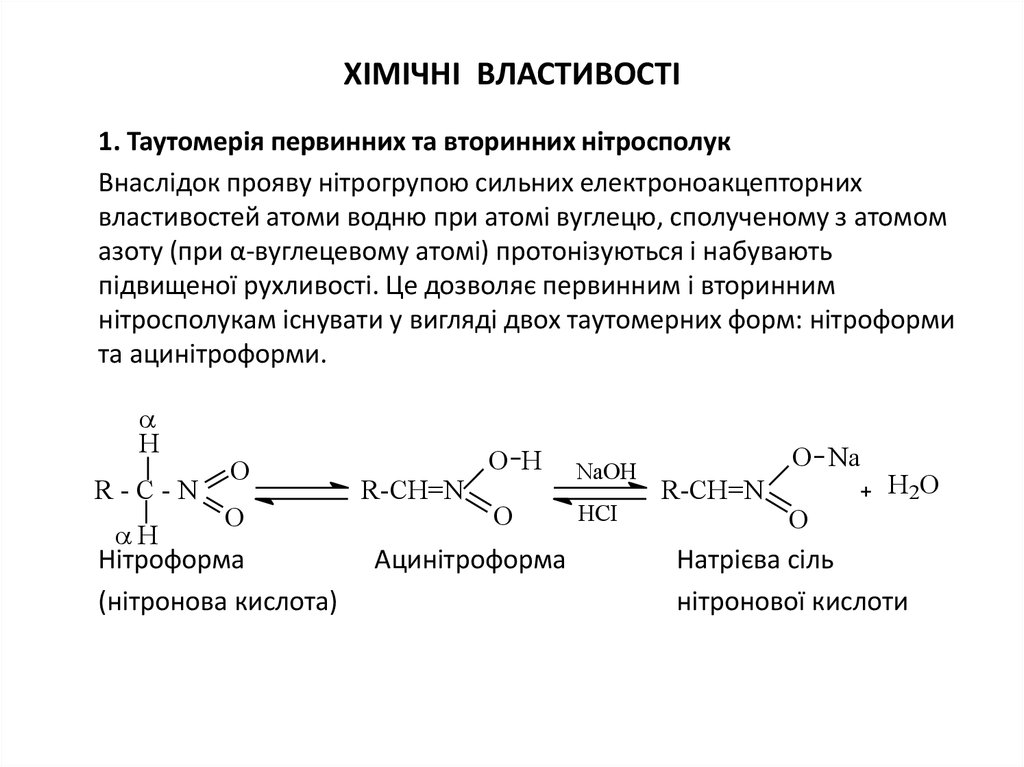
6. ХІМІЧНІ ВЛАСТИВОСТІ
1. Таутомерія первинних та вторинних нітросполукВнаслідок прояву нітрогрупою сильних електроноакцепторних
властивостей атоми водню при атомі вуглецю, сполученому з атомом
азоту (при α-вуглецевому атомі) протонізуються і набувають
підвищеної рухливості. Це дозволяє первинним і вторинним
нітросполукам існувати у вигляді двох таутомерних форм: нітроформи
та ацинітроформи.
Н
R-С-N
O
O
Н
Нітроформа
(нітронова кислота)
R-CH=N
O H
NaOH
O
HCI
Ацинітроформа
O Na
R-CH=N
Н2О
O
Натрієва сіль
нітронової кислоти
7. Ациформа хоча і має кислі властивості, але не володіє електропровідністю. Такі сполуки називаються "псевдокислотами". У лужних
Ациформа хоча і має кислі властивості, але не володієелектропровідністю. Такі сполуки називаються "псевдокислотами". У
лужних середовищах вони утворюють солі. У кислому середовищі
рівновага зсувається вліво. Третинні нітросполуки до такої таутомерії не
здатні (немає атома водню в α-положенні).
• 2. Відновлення нітросполук
R - NO2
3Н2
R - NН2
2 Н2О
• 3. Реакція з нітритною кислотою
Ця реакція дозволяє розпізнати первинні, вторинні та третинні
нітросполуки.
R-CH2 NO2 HONO
R CH NO2
N=O
H2O
R C NO2
NaOH
N OH -H2O
R
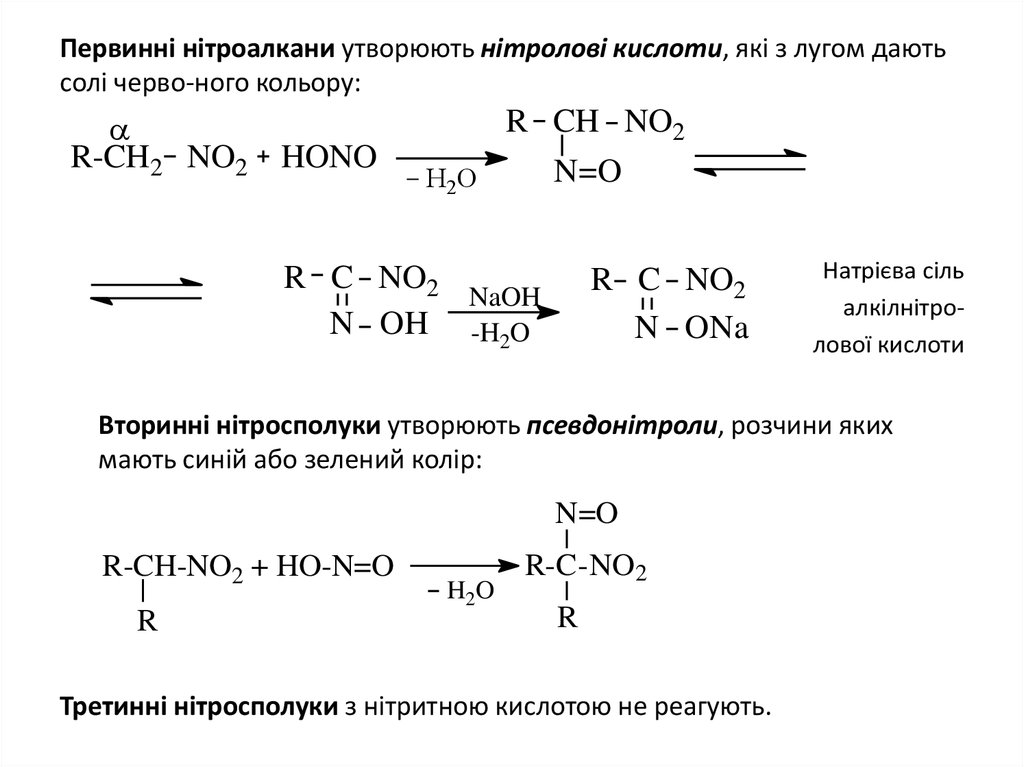
8. Первинні нітроалкани утворюють нітролові кислоти, які з лугом дають солі черво-ного кольору:
R-CH2 NO2 HONOR CH NO2
N=O
H2O
R C NO2
NaOH
N OH -H2O
R C NO2
N ONa
Натрієва сіль
алкілнітролової кислоти
Вторинні нітросполуки утворюють псевдонітроли, розчини яких
мають синій або зелений колір:
N=O
R-CH-NO2 + HO-N=O
R
H2O
R-C-NO2
R
Третинні нітросполуки з нітритною кислотою не реагують.
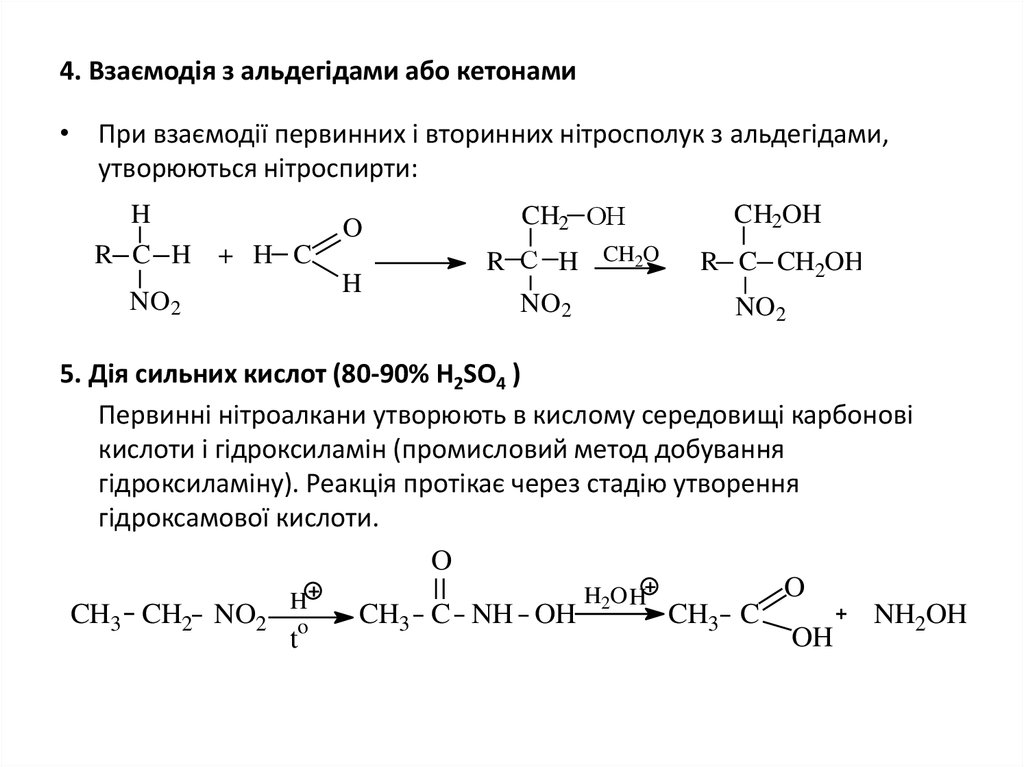
9. 4. Взаємодія з альдегідами або кетонами
• При взаємодії первинних і вторинних нітросполук з альдегідами,утворюються нітроспирти:
H
O
R C H + H C
H
NO2
CH2 ОН
CH2OH
R С H CH2O
R C CH2OH
NO2
NO2
5. Дія сильних кислот (80-90% Н2SО4 )
Первинні нітроалкани утворюють в кислому середовищі карбонові
кислоти і гідроксиламін (промисловий метод добування
гідроксиламіну). Реакція протікає через стадію утворення
гідроксамової кислоти.
O
CH3 CH2 NO2
H
o
t
CH3 C NH OH
H2O H
O
CH3 C
OH
NH2OH
10. АЛIФАТИЧНI АМIНИ
Аміни можна розглядати як похідні аміаку (NН3), в якому атоми воднюзаміщені на вуглеводневі залишки (алкільні групи). Розрізняють
первинні, вторинні і третинні аміни:
CH3
NH3
CH3-NH2
Аміак
Первинний
амін
CH3-NH-CH3
Вторинний
амін
CH3 N CH3
Третинний
амін
11.
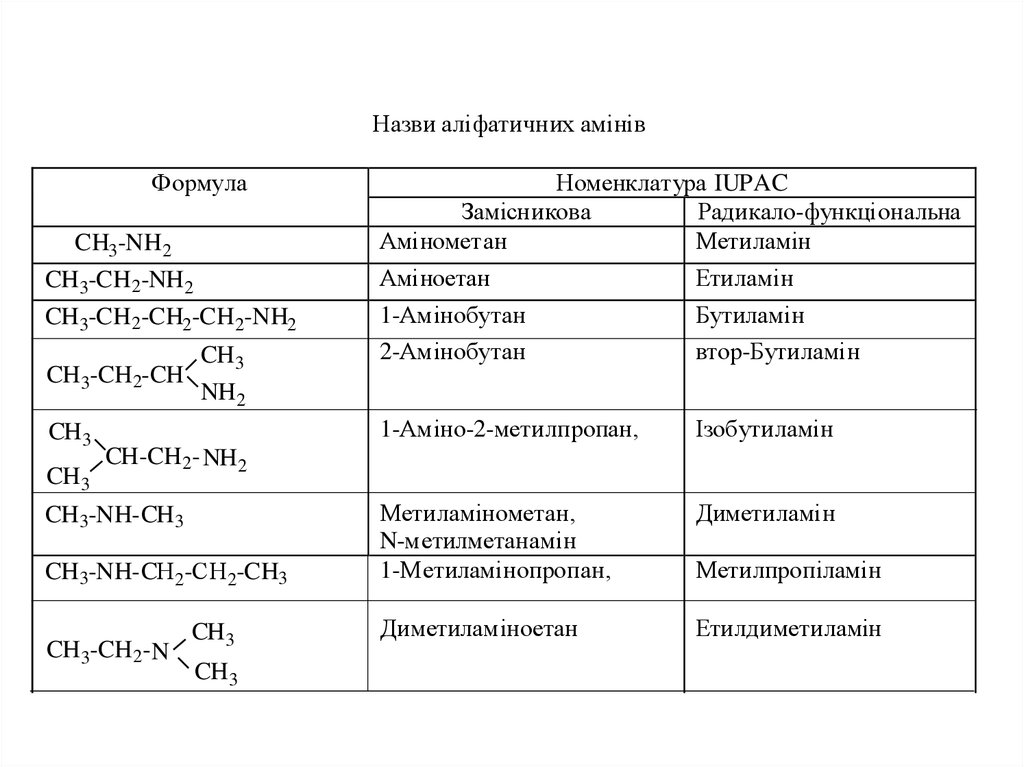
Назви аліфатичних амінівФормула
CH3-NH 2
Номенклатура IUPAC
Замісникова
Радикало-функціональна
Амінометан
Метиламін
CH 3-CH 2-NH 2
Аміноетан
Етиламін
CH 3-CH 2-CH2-CH2-NH2
1-Амінобутан
Бутиламін
2-Амінобутан
втор-Бутиламін
1-Аміно-2-метилпропан,
Ізобутиламін
Метиламінометан,
N-метилметанамін
1-Метиламінопропан,
Диметиламін
Диметиламіноетан
Етилдиметиламін
CH 3-CH 2-CH
CH3
CH 3
CH3
NH 2
CH-CH2- NH2
CH 3-NH-CH 3
CH 3-NH-CН 2-СН 2-CH3
CH 3-CH 2- N
CH 3
CH3
Метилпропіламін
12. За замісниковою номенклатурою IUPAC назви амінів утворюють шляхом додавання префікса "аміно" або суфікса "амін" до назви алкана
За замісниковою номенклатурою IUPAC назви амінівутворюють шляхом додавання префікса "аміно" або суфікса
"амін" до назви алкана і локантом показують положення
аміногрупи у вуглеводневому ланцюзі
За радикало-функціональною номенклатурою IUPAC
перелічують за алфавітним порядком назви алкільних
залишків, що сполучені з азотом і додають суфікс "амін.
13. МЕТОДИ ОДЕРЖАННЯ
• Відновлення нітросполук у присутності каталізаторівR NO2
3 H2
Ni
R NH2
2 H2O
• Відновлення інших азотовмісних сполук
R C N
2H2
RN C
2H2
Нітрил
Ізонітрил
R CH2-NH2
Первинний амін
R NH2 CH3
Вторинний амін
• Алкілювання аміаку спиртами
C16H33OH
Цетиловий спирт
NH3
300o
AI2O3
C16H33NH2
H2O
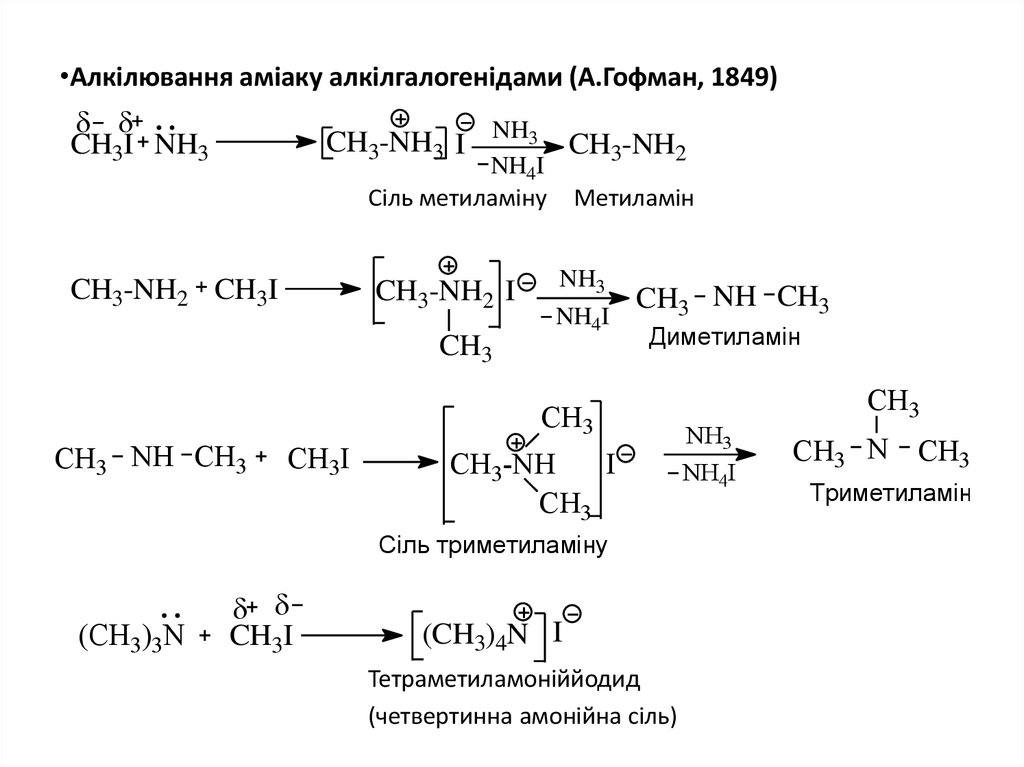
14. Алкілювання аміаку алкілгалогенідами (А.Гофман, 1849)
•Алкілювання аміаку алкілгалогенідами (А.Гофман, 1849)CH3I NH3
CH3-NH3 I NH3
CH3-NH2
NH4I
Сіль метиламіну
CH3-NH2 CH3I
CH3-NH2 I
CH3
Метиламін
NH3
NH4I
CH3 NH CH3
Диметиламін
CH3
CH3 NH CH3
CH3I
CH3-NH
I
CH3
Сіль триметиламіну
(СН3)3N
CH3I
(CH3)4N I
Тетраметиламоніййодид
(четвертинна амонійна сіль)
NH3
NH4I
CH3
CH3 N CH3
Триметиламін
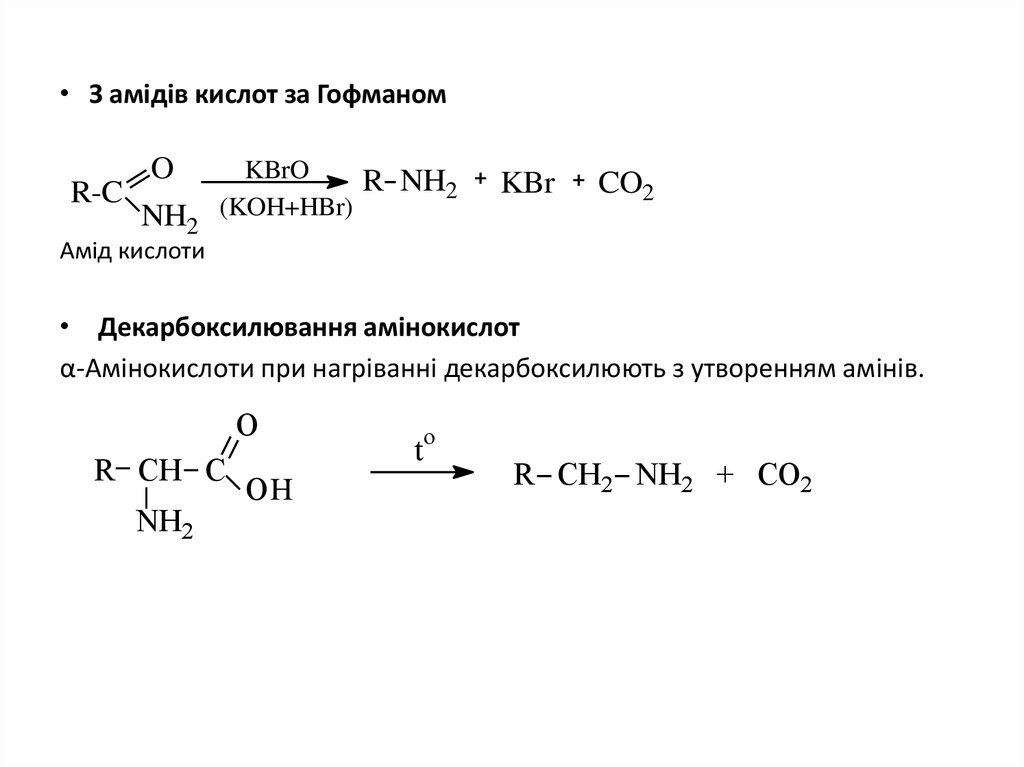
15. З амідів кислот за Гофманом
• З амідів кислот за ГофманомR-C
O
NH2
KBrO
(KOH+HBr)
R NH2
KBr
CO2
Амід кислоти
• Декарбоксилювання амінокислот
α-Амінокислоти при нагріванні декарбоксилюють з утворенням амінів.
O
R СH C
NH2
OH
o
t
R СH2 NH2 + CO2
16. ФІЗИЧНІ ВЛАСТИВОСТІ
• Алкіламіни - це гази або рідини з неприємним запахом.Середні аміни мають запах гнилої риби. Вищі аміни - без
запаху.
• Аміни побудовані аналогічно аміаку і мають пірамідальну
молекулу з атомом азоту у вершині піраміди з кутами між
зв'язками приблизно 106-108о.
• Якщо з атомом азоту зв'язані три різних замісники, то такі
третинні аміни проявляють оптичну активність. Роль
четвертого замісника виконує орбіталь з неподіленою
парою електронів атома азоту.
17. ХІМІЧНІ ВЛАСТИВОСТІ
• 1. Основність амінівАзот аміногрупи має рухливу неподілену пару електронів і може бути
їх донором. Тому аліфатичні аміни є сильними основами. Основність їх
проявляється вже у водних розчинах, які мають лужну реакцію (за
рахунок утворення іонів ОН- ).
R - NН2
H - OH
R - NН3
OH
R - NН3
При взаємодії з мінеральними кислотами аміни утворюють солі:
R - NН2
HCl
R - NН2 HCl або
R - NН3 Сl
Алкіламонійхлорид
Основність амінів зменшується при переході від третинних до
первинних.
R N R > R NH R > R NH2 > NH3
R
OH
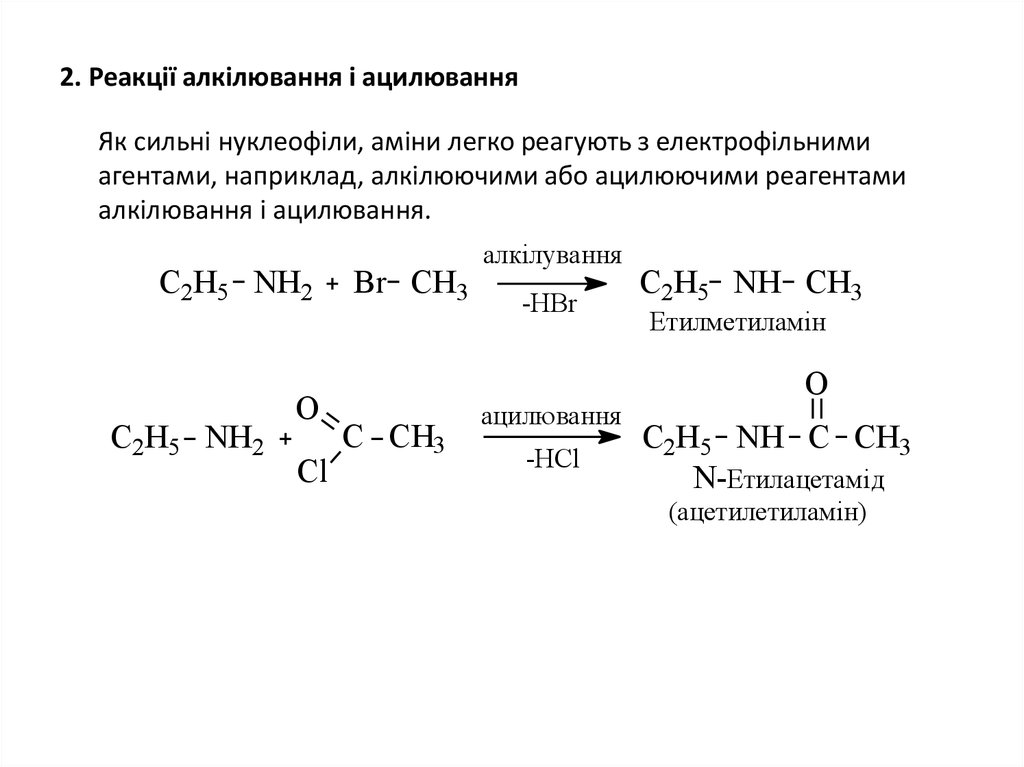
18. 2. Реакції алкілювання і ацилювання
Як сильні нуклеофіли, аміни легко реагують з електрофільнимиагентами, наприклад, алкілюючими або ацилюючими реагентами
алкілювання і ацилювання.
C2H5 NH2
С2H5 NH2
O
Cl
Br CH3
C CH3
алкілування
-HBr
ацилювання
-HCl
C2H5 NH CH3
Етилметиламін
O
C2H5 NH C CH3
N-Етилацетамід
(ацетилетиламін)
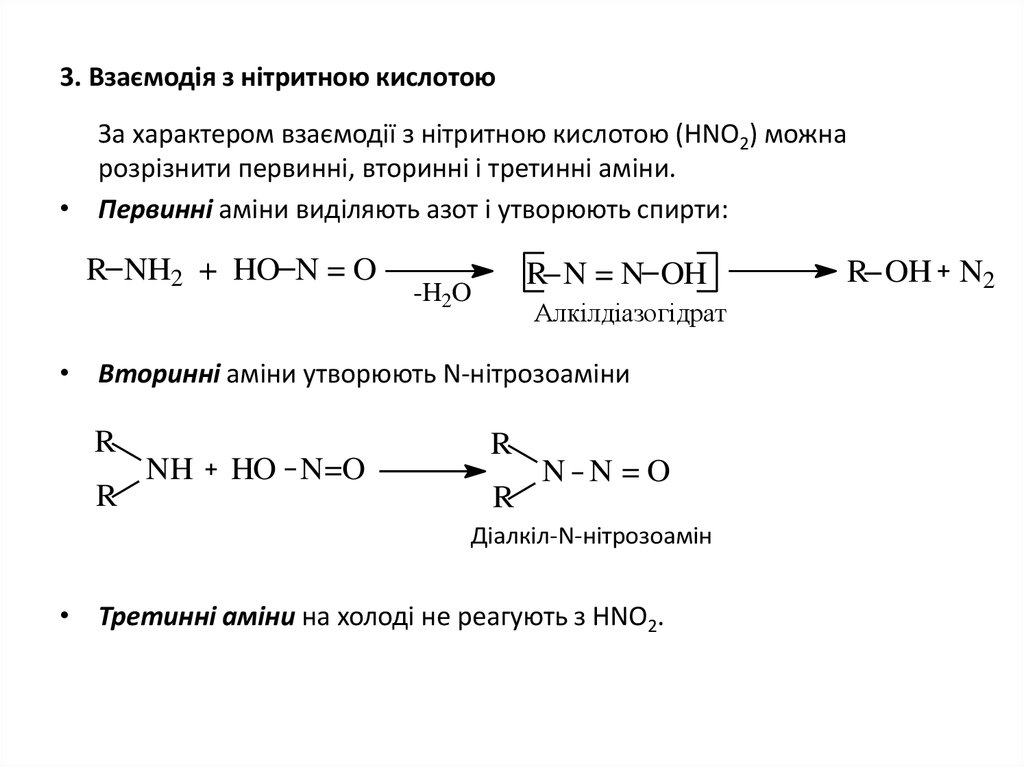
19. 3. Взаємодія з нітритною кислотою
За характером взаємодії з нітритною кислотою (НNО2) можнарозрізнити первинні, вторинні і третинні аміни.
• Первинні аміни виділяють азот і утворюють спирти:
R NH2 + HO N = O
R N = N OH
-H2O
Алкілдіазогідрат
• Вторинні аміни утворюють N-нітрозоаміни
R
R
NH
HO N=O
R
R
N N=O
Діалкіл-N-нітрозоамін
• Третинні аміни на холоді не реагують з НNО2.
R OH N2
20. ДІАМІНИ
• Аміни, що містять у молекулі дві аміногрупи називають діамінами.Назви їх за номенклатурою IUPAC утворюються аналогічно до назв
моноамінів.
H2N CH2 CH2 NH2
1,2-Діаміноетан (Етилендіамін)
H2N CH2 CH2 CH2 CH2 CH2 CH2 NH2
1,6-Діаміногексан (Гексаметилендіамін)
• Діаміни одержують тими ж методами, що й моноаміни.
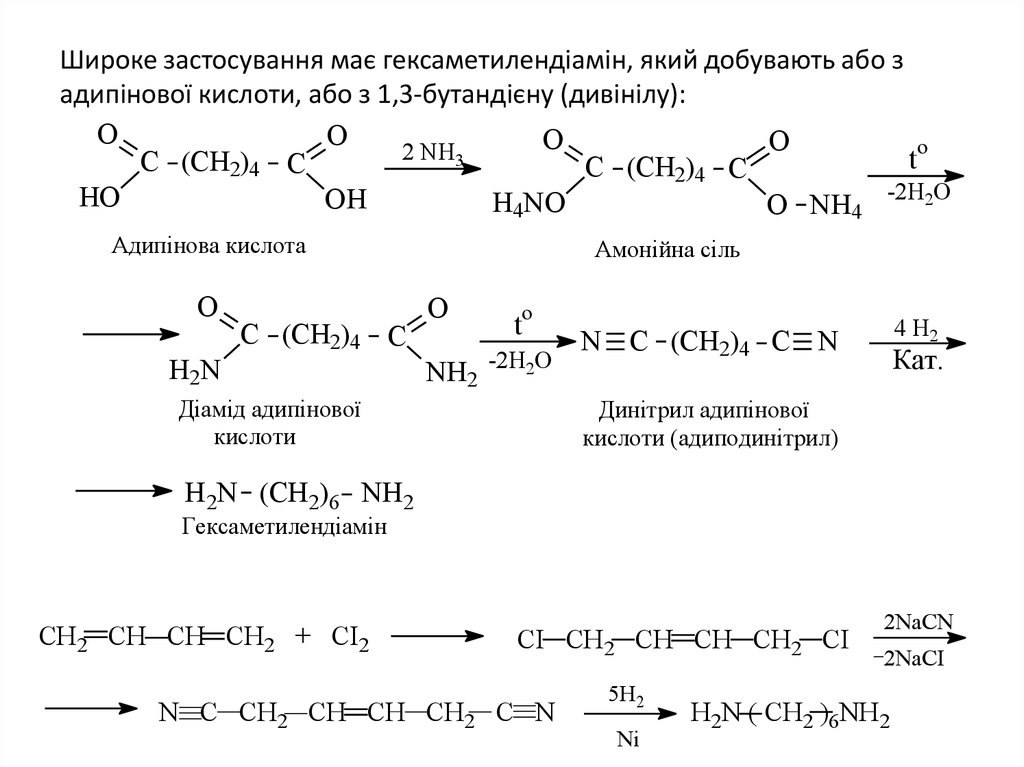
21. Широке застосування має гексаметилендіамін, який добувають або з адипінової кислоти, або з 1,3-бутандієну (дивінілу):
OO
O
O
o
2
NH
3
t
C (CH2)4 C
C (CH2)4 C
HO
OH
H4NO
O NH4 -2H2O
Адипінова кислота
O
C (CH2)4 C
H2N
Амонійна сіль
O
o
t
NH2 -2H2O
Діамід адипінової
кислоти
4 Н2
N C (CH2)4 C N
Кат.
Динітрил адипінової
кислоти (адиподинітрил)
H2N (CH2)6 NH2
Гексаметилендіамін
CH2 CH CH CH2 + CI2
CI CH2 CH CH CH2 CI
N C CH2 CH CH CH2 C N
5H2
Ni
2NaCN
2NaCI
H2N ( CH2 )6NH2
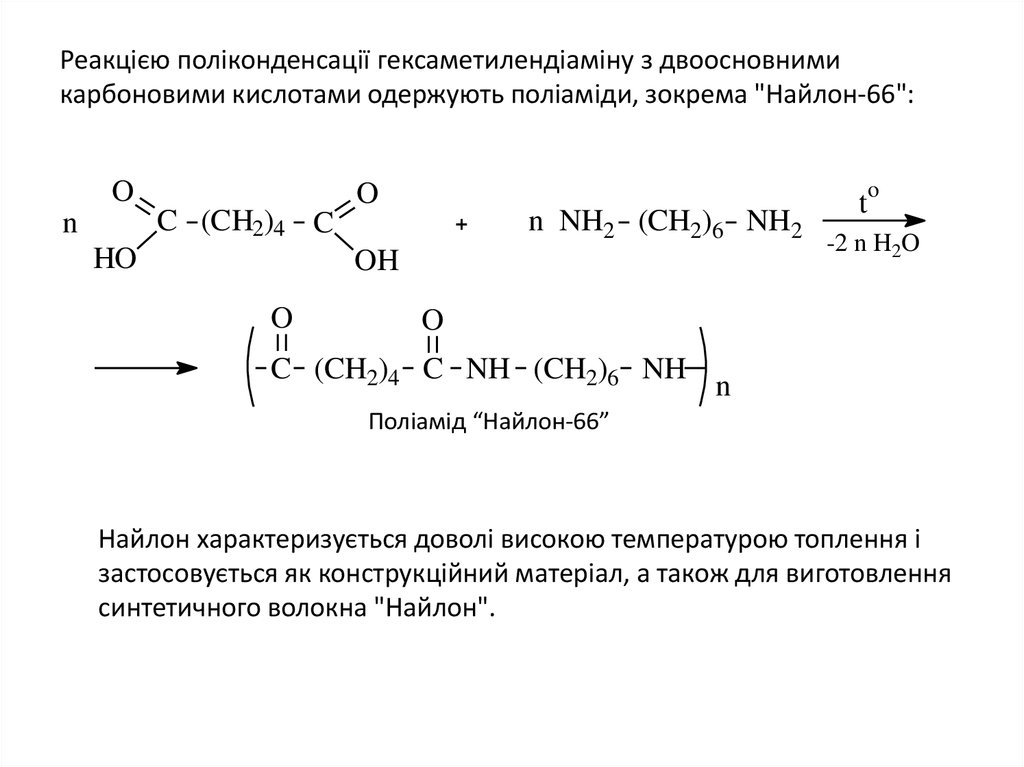
22. Реакцією поліконденсації гексаметилендіаміну з двоосновними карбоновими кислотами одержують поліаміди, зокрема "Найлон-66":
Реакцією поліконденсації гексаметилендіаміну з двоосновнимикарбоновими кислотами одержують поліаміди, зокрема "Найлон-66":
O
C (CH2)4 C
n
HO
o
O
n NH2 (CH2)6 NH2
OH
O
t
-2 n H2O
O
C (CH2)4 C NH (CH2)6 NH
n
Поліамід “Найлон-66”
Найлон характеризується доволі високою температурою топлення і
застосовується як конструкційний матеріал, а також для виготовлення
синтетичного волокна "Найлон".









 Химия
Химия








