Похожие презентации:
Карбонільні сполуки - альдегіди та кетони
1. Карбонільні сполуки - АЛЬДЕГІДИ ТА КЕТОНИ
КАРБОНІЛЬНІ СПОЛУКИ - АЛЬДЕГІДИ ТАКЕТОНИ
Альдегідами і кетонами називають похідні вуглеводнів, у
яких при одному атомі вуглецю два атоми водню
заміщено киснем.
Сполуки, в яких на кисень заміщено водні при первинному атомі
вуглецю, називаються альдегідами:
Якщо ж два атоми водню заміщено киснем при вторинному атомі
вуглецю, то такі оксосполуки називаються кетонами:
У цьому випадку групу С=О називають кетогрупою.
2. Насичені альдегіди та кетони
НАСИЧЕНІ АЛЬДЕГІДИ ТА КЕТОНИ• За номенклатурою IUPAC альдегіди називають за
назвою відповідного вуглеводня з додаванням
закінчення -аль. Кетони - з додаванням закінчення
-он. Нумерація ланцюга в молекулах альдегідів
починається з вуглецевого атома оксогрупи, а у
кетонів - з того кінця ланцюга, до якого ближче
розташована карбонільна група, при цьому
положення оксогрупи вказують локантом.
• За радикало-функціональною номенклатурою
кетони називають, вказуючи за алфавітним
порядком вуглеводневі залишки, що зв'язані з
карбонільною групою з додаванням суфіксу -кетон.
Тривіальні назви альдегідів походять, як правило,
від назв кислот, в які вони перетворюються при
окисненні, з додаванням у кінці слова "альдегід".
3. Назви альдегідів і кетонів
Структурнаформула
Номенклатура
Замісникова
Радикало-функціональна
(тривіальна)
Альдегіди
O
H С
Метаналь
H
СН3 С
Етаналь
O
H
СН3 CH 2 С
O
Пропаналь
(Пропіоновий або
пропіонатний альдегід)
Бутаналь
(Масляний або бутиратний
альдегід)
2-Метилпропаналь
(Ізомасляний або
ізобутиратний альдегід)
H
СН3 CH 2 CH 2 С
O
H
O
СН3 СН С
H
СН 3
СН3 С СН 3
(Мурашиний альдегід,
формальдегід)
(Оцтовий альдегід,
ацетальдегід)
Кетони
Пропанон
Диметилкетон (ацетон)
О
O
Бутанон
Етилметилкетон
2-Пентанон
Метилпропілкетон
3-Метил-2-бутанон
Ізопропілметилкетон
CH 3-CH2-C-CH 3
O
CH 3-С-CH 2-CН2-CH 3
CH 3-С-CH-CH 3
O СН 3
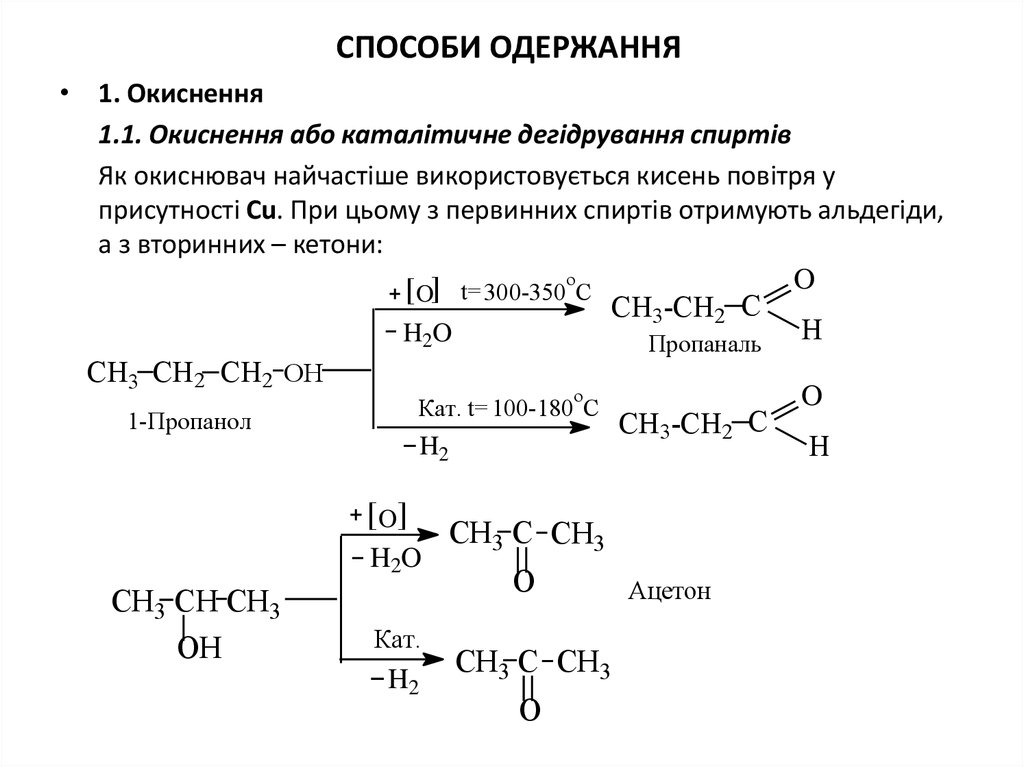
4. СПОСОБИ ОДЕРЖАННЯ
• 1. Окиснення1.1. Окиснення або каталітичне дегідрування спиртів
Як окиснювач найчастіше використовується кисень повітря у
присутності Сu. При цьому з первинних спиртів отримують альдегіди,
а з вторинних – кетони:
O
[ O] t= 300-350оС
CH3-CH2 С
Н
H2O
Пропаналь
СН3 CH2 CH2 ОН
о
O
Кат. t= 100-180 С
1-Пропанол
CH3-CH2 С
H2
Н
[ O]
H2O
СН3 СН СН3
ОН
Кат.
H2
СН3 С СН3
О
СН3 С СН3
О
Ацетон
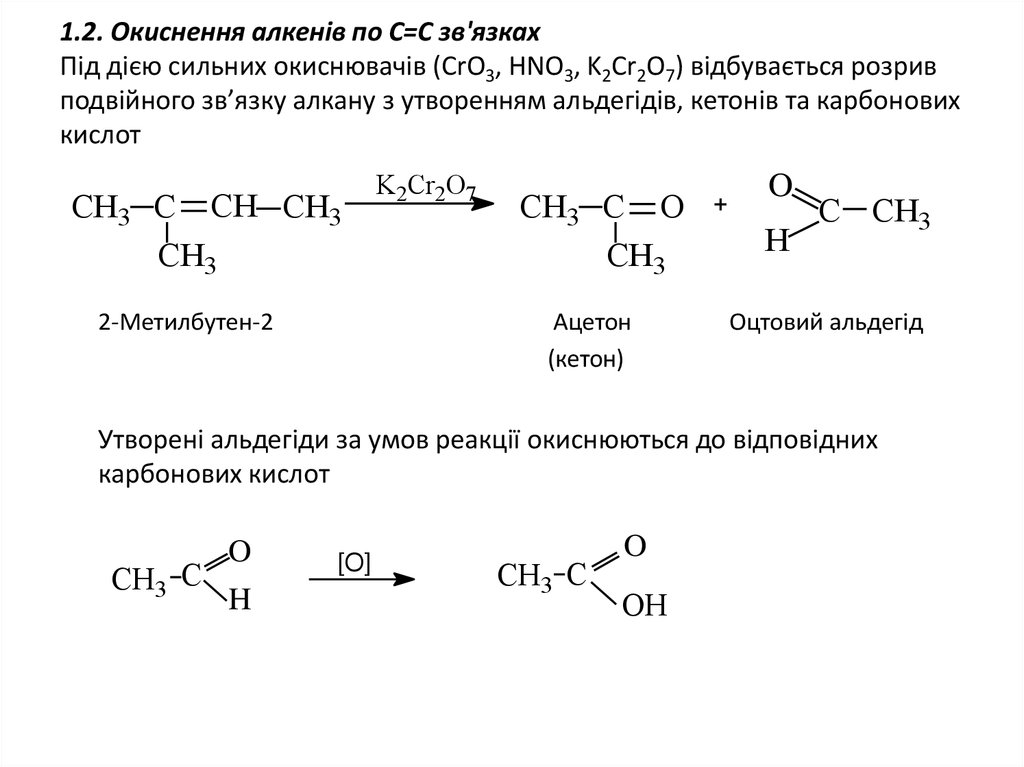
5. 1.2. Окиснення алкенів по С=С зв'язках Під дією сильних окиснювачів (CrO3, HNO3, K2Cr2O7) відбувається розрив подвійного
зв’язку алкану з утворенням альдегідів, кетонів та карбоновихкислот
СН3 С СН СН3
СН3
2-Метилбутен-2
K2Cr2O7
СН3 С О
СН3
Ацетон
(кетон)
O
Н
С СН3
Оцтовий альдегід
Утворені альдегіди за умов реакції окиснюються до відповідних
карбонових кислот
СН3 С
O
H
[O]
СН3 С
O
ОН
6. 1.3. Окиснення алканів
Важливою промисловою реакцією є каталітичнеокиснення метану до формальдегіду:
СН4 + О2
Кат.
о
t
СН2О + Н2О
2. Реакція оксосинтезу (гідроформілювання алкенів),
О.Роєлен, 1938 р.
Алкени в присутності кобальтового каталізатора під тиском
взаємодіють з синтез-газом з утворенням альдегідів:
R CН=CH2
о
СО
Н2
100-150 С
Р, Со(СО)5
R СН2 СН2 С
О
Н
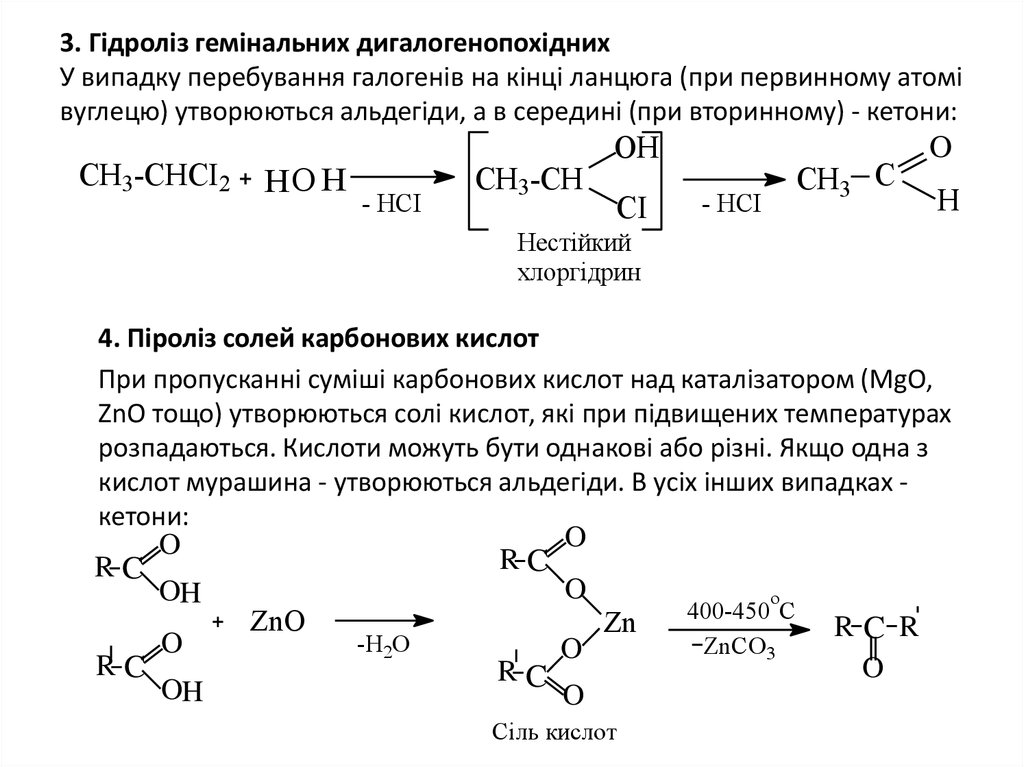
7. 3. Гідроліз гемінальних дигалогенопохідних У випадку перебування галогенів на кінці ланцюга (при первинному атомі вуглецю)
утворюються альдегіди, а в середині (при вторинному) - кетони:CH3-СНСІ2
НО Н
- НСІ
CH3-CH
ОН
СІ
- НСІ
СН3 С
O
Н
Нестійкий
хлоргідрин
4. Піроліз солей карбонових кислот
При пропусканні суміші карбонових кислот над каталізатором (MgO,
ZnO тощо) утворюються солі кислот, які при підвищених температурах
розпадаються. Кислоти можуть бути однакові або різні. Якщо одна з
кислот мурашина - утворюються альдегіди. В усіх інших випадках кетони:
O
O
R
C
RC
O
OH
o
400-450
C
ZnO
Zn
RC R
-H2О
O
ZnCO
O
3
RC
O
RC
OH
O
Сіль кислот
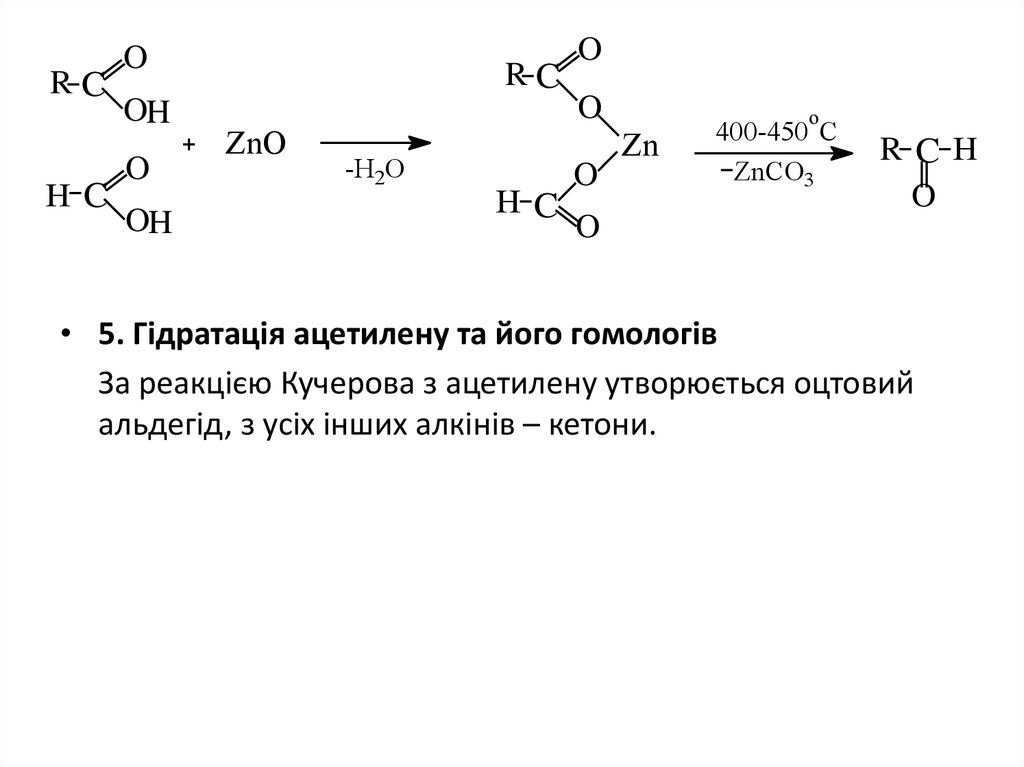
8.
RCHC
O
OH
O
OH
RC
ZnO
O
O
-H2О
HC
O
Zn
o
400-450 C
ZnCO3
RCH
O
O
• 5. Гідратація ацетилену та його гомологів
За реакцією Кучерова з ацетилену утворюється оцтовий
альдегід, з усіх інших алкінів – кетони.
9. ФІЗИЧНІ ВЛАСТИВОСТІ
Насичені альдегіди та кетони - це безбарвні рідини.Метаналь - газ з різким запахом. Їх температури кипіння
нижчі, ніж у спиртів, тому що для альдегідів і кетонів
утворення водневого зв'язку не характерне. Кетони
киплять при вищій температурі, ніж альдегіди.
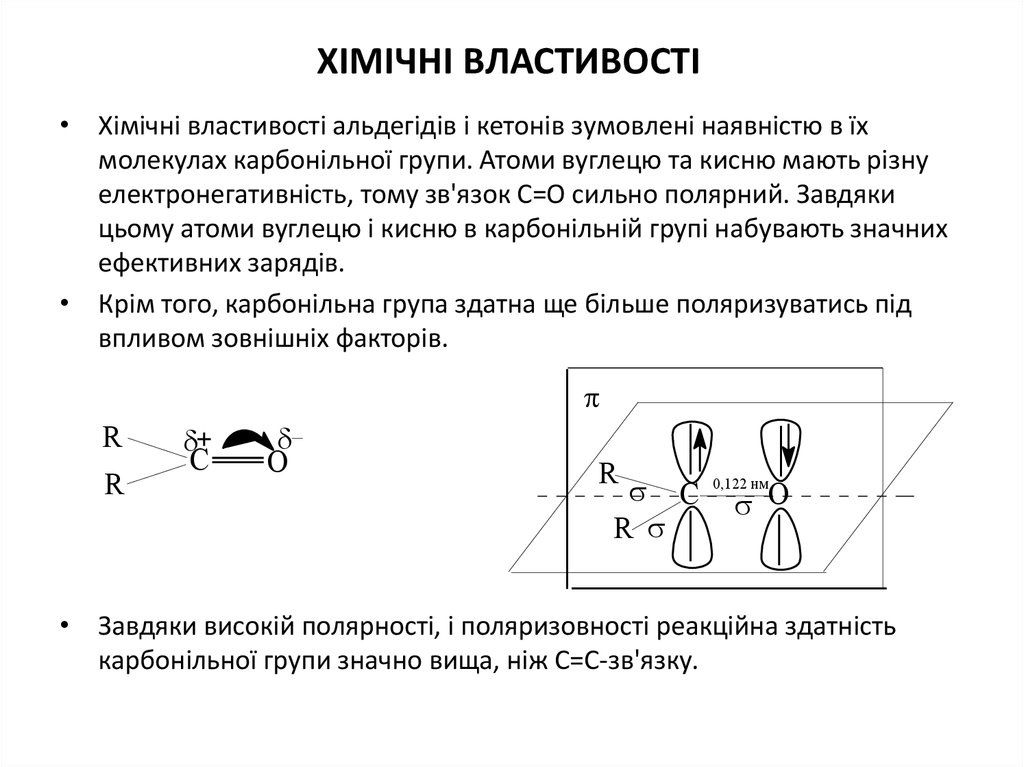
10. ХІМІЧНІ ВЛАСТИВОСТІ
• Хімічні властивості альдегідів і кетонів зумовлені наявністю в їхмолекулах карбонільної групи. Атоми вуглецю та кисню мають різну
електронегативність, тому зв'язок С=О сильно полярний. Завдяки
цьому атоми вуглецю і кисню в карбонільній групі набувають значних
ефективних зарядів.
• Крім того, карбонільна група здатна ще більше поляризуватись під
впливом зовнішніх факторів.
R
R
С
О
R
C
R
0,122 нм
О
• Завдяки високій полярності, і поляризовності реакційна здатність
карбонільної групи значно вища, ніж С=С-зв'язку.
11.
• Вуглець карбонільної групи виявляє електрофільнівластивості, а кисень - нуклеофільні. Завдяки
цьому, атом вуглецю карбонільної групи здатний
реагувати з нуклеофільними реагентами, а атом
кисню з електрофільними.
• Головними типами хімічних реакцій альдегідів і
кетонів є:
• 1) реакції приєднання за карбонільною групою;
• 2) реакції заміщення;
• 3) реакції окиснення;
• 4) реакції полімеризації та поліконденсації.
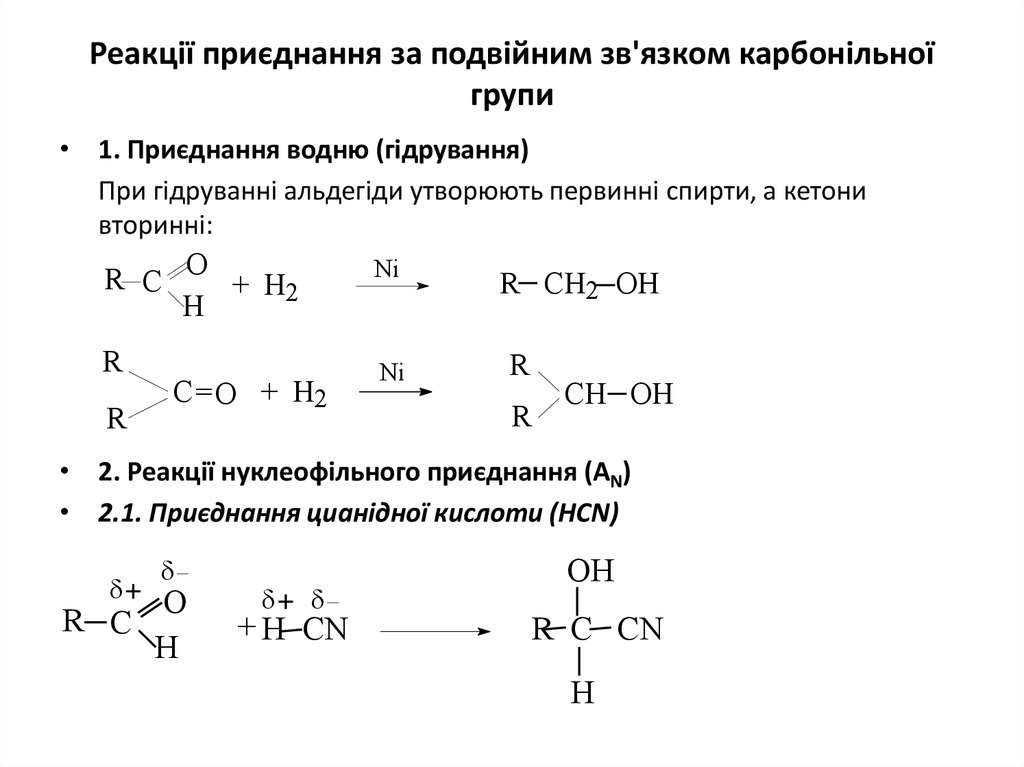
12. Реакції приєднання за подвійним зв'язком карбонільної групи
• 1. Приєднання водню (гідрування)При гідруванні альдегіди утворюють первинні спирти, а кетони
вторинні:
О
+ H2
Н
R С
R
R
Ni
C = О + H2
Ni
R CH2 OH
R
R
СН OH
• 2. Реакції нуклеофільного приєднання (АN)
• 2.1. Приєднання цианідної кислоти (HCN)
О
R С
Н
+ H CN
OН
R C CN
Н
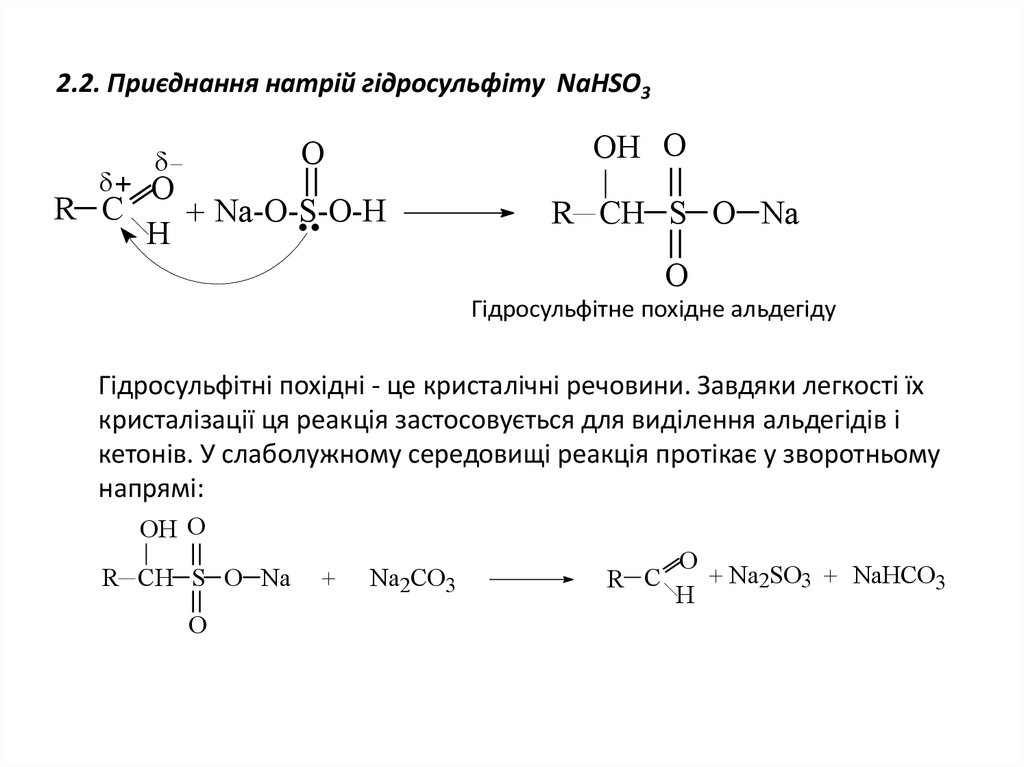
13. 2.2. Приєднання натрій гідросульфіту NaHSO3
2.2. Приєднання натрій гідросульфіту NaHSO3R С
OН O
O
О
+ Na-O-S-O-H
Н
R CH S O Na
O
Гідросульфітне похідне альдегіду
Гідросульфітні похідні - це кристалічні речовини. Завдяки легкості їх
кристалізації ця реакція застосовується для виділення альдегідів і
кетонів. У слаболужному середовищі реакція протікає у зворотньому
напрямі:
OН O
R CH S O Na
O
+
Na2CO3
R С
О
+ Na2SO3 + NaHCO3
Н
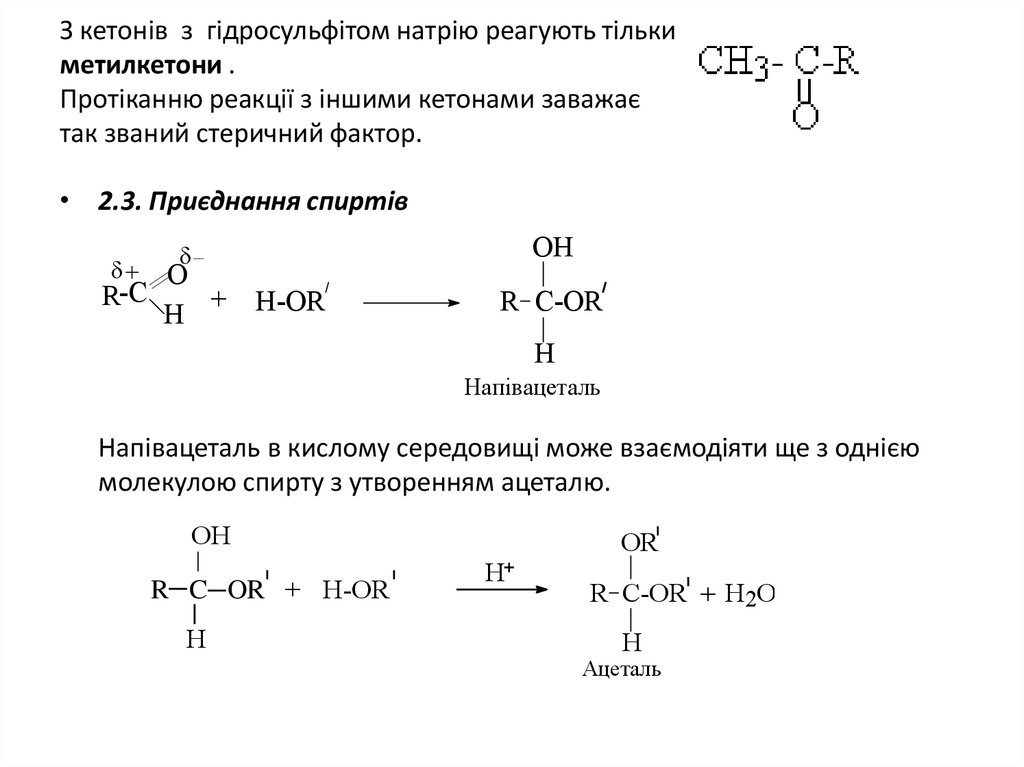
14. З кетонів з гідросульфітом натрію реагують тільки метилкетони . Протіканню реакції з іншими кетонами заважає так званий
стеричний фактор.• 2.3. Приєднання спиртів
OН
О
R-С
+ H-OR
Н
R C-OR
Н
Напівацеталь
Напівацеталь в кислому середовищі може взаємодіяти ще з однією
молекулою спирту з утворенням ацеталю.
OН
R C OR + H-OR
Н
OR
Н
R C-OR + Н2О
Н
Aцеталь
15. Ацеталі при нагріванні з розведеними кислотами піддаються гідролізу:
Ацеталі при нагріванні з розведеними кислотами піддаються гідролізу:OR
О
Н
-С
R
+ 2 H-OR
Н
О
2
R C-OR +
o
Н
t
Н
• 2.5. Приєднання аміаку
Альдегіди приєднують аміак з утворенням гідроксиамінів. Дана
реакція практично завжди закінчується відщепленням води і
утворенням зв'язку C=N. Одержані сполуки називають альдімінами.
R С
NH3
О
Н
NH3
R C O
Н
NH2
R C OH
H2O
Н
Гідроксиамін
Кетони з аміаком реагують складніше і значно повільніше.
R CH NH
Альдімін
(алканімін)
16. 2.6. Взаємодія з гідроксиламіном (NH2OH)
Дана реакція застосовується для кількісного визначення альдегідів ікетонів. При цьому утворюються альдоксими і кетоксими:
О
CH3-С
О
Н
NH2ОН
ОH
СН3 С NH2 ОН
Н
Н
О
CH3 С=О
CH3
NH2ОН
СН3 С NH ОН
СН3 С NH2 ОН
СН3
Н2О
СН3 СН N ОН
Альдоксим
(Ацетальдоксим)
ОH
СН3 С
NH ОН
СН3
Н2О
СН3 С
N
СН3
ОН
Кетоксим
(Ацетоноксим)
17. 2.7. Приєднання гідразину та його похідних
Гідразин, аналогічно до аміаку і гідроксиламіну, приєднується доелектрофільного атома вуглецю карбонільної групи з наступним
відщепленням води.
При співвідношенні 1:1 утворюються гідразони:
O
R С
О
NH2 NH2
Н
1:1
R C NH2 NH2
Н
OН
R C NH NH2
H
H2O
R CH N NH2
Гідразон
При співвідношенні карбонільна сполука гідразин - 2:1 утворюються
азини (альдазини і кетазини):
CH3
О
С
Н
H2N NH2
О
С СН3
H
-2H2O
СН3 СН=N N=СН СН3
18. Аналогічно протікають реакції з фенілгідразином NH2-NH-C6H5. При цьому утворюються фенілгідразони:
ОR-С
Н2N-NH-C6H5
Н
H2O
R CH N NH C6H5
Фенілгідразон
• 2.9. Взаємодіяз галоген-нуклеофілами (РСІ5, PCl3)
При взаємодії з РСІ5, який є сильним електрофілом, спочатку
відбувається активація карбонільної сполуки, а потім реакція з
галогенід-йоном. Цю реакцію використовують для одержання
гемінальних дихлоралканів:
О
R С
Н
РСІ5
О
R С
Н
РСІ4
СІ
СІ
ОРСІ4
R C
Н
СІ
РОСІ3
R C
Н
СІ
19. Реакції заміщення (S)
• Атоми гідрогену біля α-вуглецевого атому характеризуютьсяпідвищеною рухливістю і можуть легко обмінюватися на інші атоми чи
функціональні групи.
Ці реакції протікають за механізмом електрофільного заміщення (SЕ):
H
CH3 C С
Н
О
Н
H
СІ2
Н або ОН
HСІ
CH3 C С
СІ
О
Н
2-Хлоропропаналь
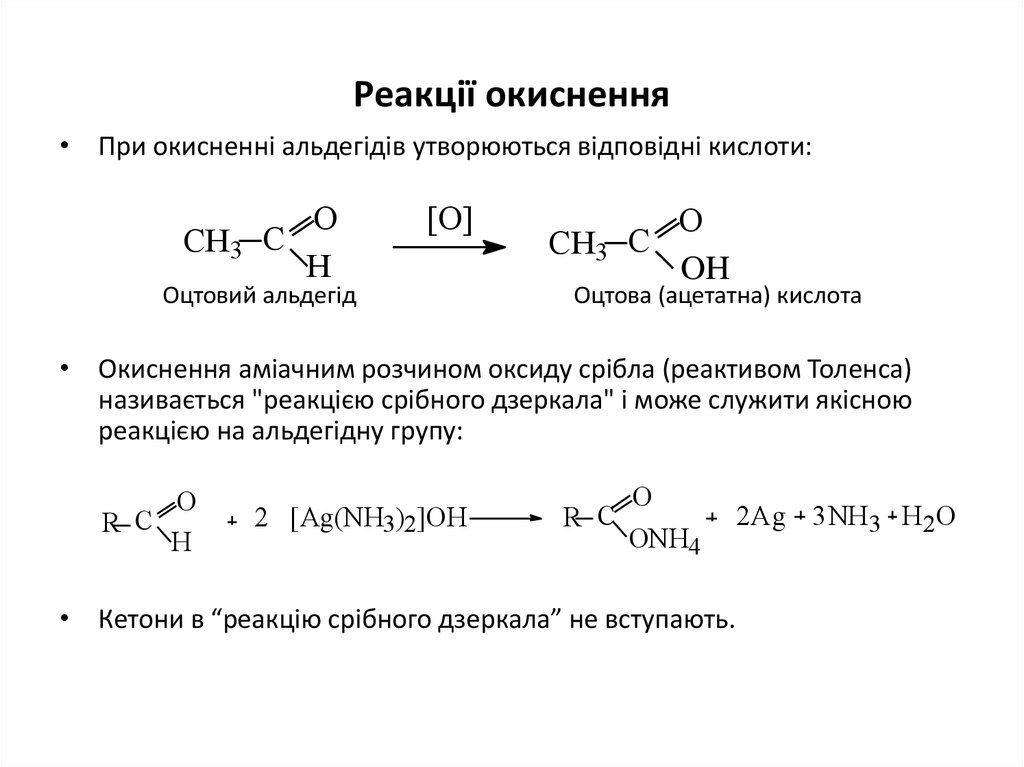
20. Реакції окиснення
• При окисненні альдегідів утворюються відповідні кислоти:О
CH3 С
Н
[O]
Оцтовий альдегід
О
CH3 С
OH
Оцтова (ацетатна) кислота
• Окиснення аміачним розчином оксиду срібла (реактивом Толенса)
називається "реакцією срібного дзеркала" і може служити якісною
реакцією на альдегідну групу:
О
R С
Н
2 [Ag(NH3)2]OH
R С
О
ONH4
• Кетони в “реакцію срібного дзеркала” не вступають.
2Ag 3 NH3 H2O
21. Окиснення кетонів відбувається складніше і протікає лише в жорстких умовах. При їх окисненні спостерігається розрив вуглецевого
ланцюга:СН3 СН2 C СН2 СН3
O
[O]
to
СН3 СН2 С
О
ОН
СН3 С
Суміш карбонових кислот
О
ОН
22. Реакції полімеризації і конденсації
• Реакції полімеризації характерні тільки для альдегідів.1. Полімеризація формальдегіду
У присутності певних каталізаторів формальдегід здатний до
полімеризації за рахунок розкриття π-зв'язку карбонільної групи
(аналогічно до полімеризації алкенів):
n H2CO
Сухий газ
Fe(CO)5
(толуєн, гексан)
H ( CH2 O )n H,
При цьому утворюється лінійний високомолекулярний
поліформальдегід, який застосовується для виробництва синтетичного
волокна.
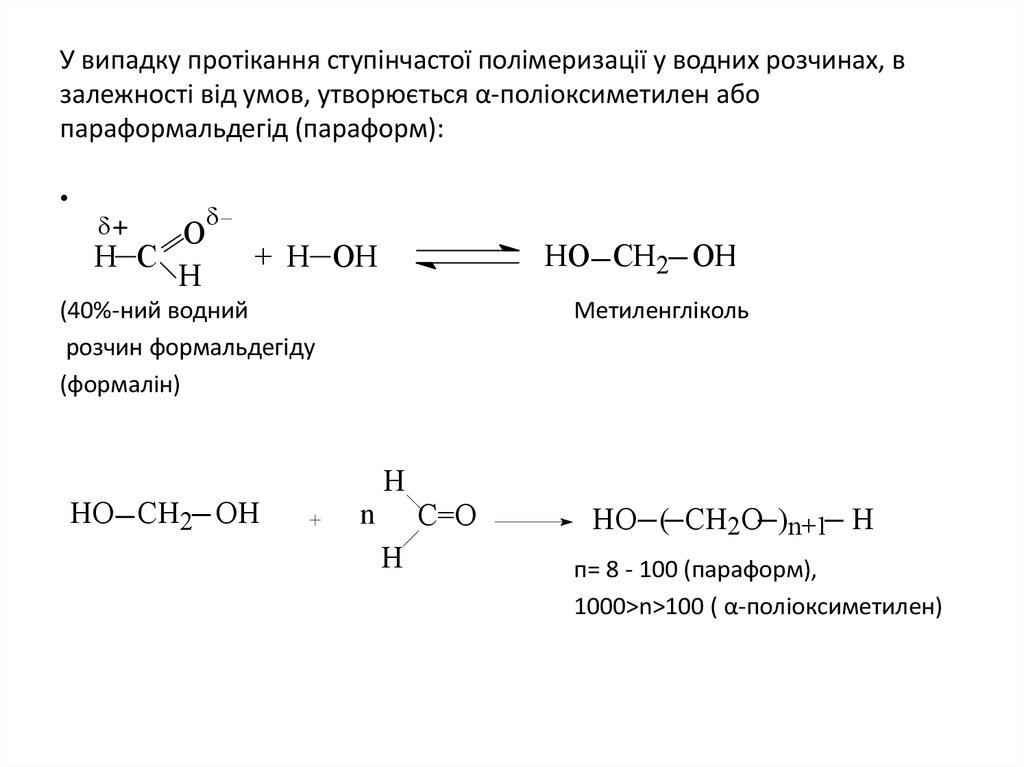
23. У випадку протікання ступінчастої полімеризації у водних розчинах, в залежності від умов, утворюється α-поліоксиметилен або
параформальдегід (параформ):О
H С
Н
HO CH2 ОН
+ H OH
(40%-ний водний
розчин формальдегіду
(формалін)
HO CH2 ОН
Метиленгліколь
H
C=О
n
H
HO ( CH2O )n+1 H
п= 8 - 100 (параформ),
1000>n>100 ( α-поліоксиметилен)
24. 2. Реакції конденсації (димеризації)
• Особливу групу реакцій альдегідів і кетонів складають реакціїконденсації, зумовлені рухливістю атомів водню що зв’язані з αвуглецевим атомом.
• 2.1. Альдольна конденсація або альдольне приєднання (О.П.Бородін,
Ж.Вюрц, 1872)
У цю реакцію вступають альдегіди, які в α-положенні до С=О групи
мають атоми водню:
СН3 С
О
Н
Н СН2 С
О
Н
NaOH
4
ОН
3
CH3 C
H
2
1
СН2 С
O
Н
3-Гідроксибутаналь
гідроксимасляний альдегід)
25. Продукт реакції містить спиртову і альдегідну функціональні групи. Такі сполуки називаються альдолями.
Механізм альдольної конденсації. Під впливом карбонільної групи атомводню, що зв’язаний з α-вуглецевим атомом, протонізується і набуває
здатності в присутності основ легко відщеплюватися у вигляді
протона:
Н СН2 С
Н O
О
Н
О
СН2 С
H О Н
Н
Аніон (нуклеофіл)
СН3 С
О
Н
СН2 С
О
Н
О
CH3 C
СН2 С
Н
ОH
CH3 C Н СН2 С
Альдоль
О
Н
H СН2 С
О
Н
СН2 С
О
Н
О
Н
26. 2.2. Кротонова конденсація
Якщо утворений в результаті альдольної конденсації альдоль містить в αположенні атоми водню, то при нагрівання він може відщеплювативоду з утворенням ненасиченого альдегіду. Таке продовження реакції
альдольної конденсації називається кротоновою конденсацією, за
назвою альдегіду, вперше одержаного таким шляхом.
О
CH3 CН СН-С
Н
ОH Н
o
t
-Н2О
О
CH3 CН СН-С
Н
2-Бутеналь
( кротоновий альдегід)
27. 2.3. Реакція диспропорціювання (Канніццаро 1853)
(формальдегід і альдегіди) при α –вуглецевому атомі, які в αположенні до групи не мають атомів водню (четвертинний атомвуглецю), вступають в реакцію диспропорціювання (окисненнявідновлення). Одна молекула альдегіду відновлюється і
перетворюється на спирт, а друга окиснюється і перетворюється на
карбонову кислоту.
CH3
СН3 С С
CH3
О
Н
CH3
СН3 С С
О
або Н С
Н
CH3
О
КОН
Н
О
Н С
Н
КОН
(СН3)3С С
H С
О
ОК
Форміат калію
О
ОК
СН3
СН3 C СН2ОН
СН3
CH3 OН
Метанол
28. Отже, в лужному середовищі альдегіди, що містять хоча б один атом водню при α-вуглецевому атомі вступають в альдольну
конденсацію. Якщо цих атомівводню є хоча б два, то альдольна конденсація
супроводжується кротоновою. А якщо у молекулі
альдегіду нема жодного атома водню при αвуглецевому атомі, то такі альдегіди вступають у
реакцію Канніццаро.
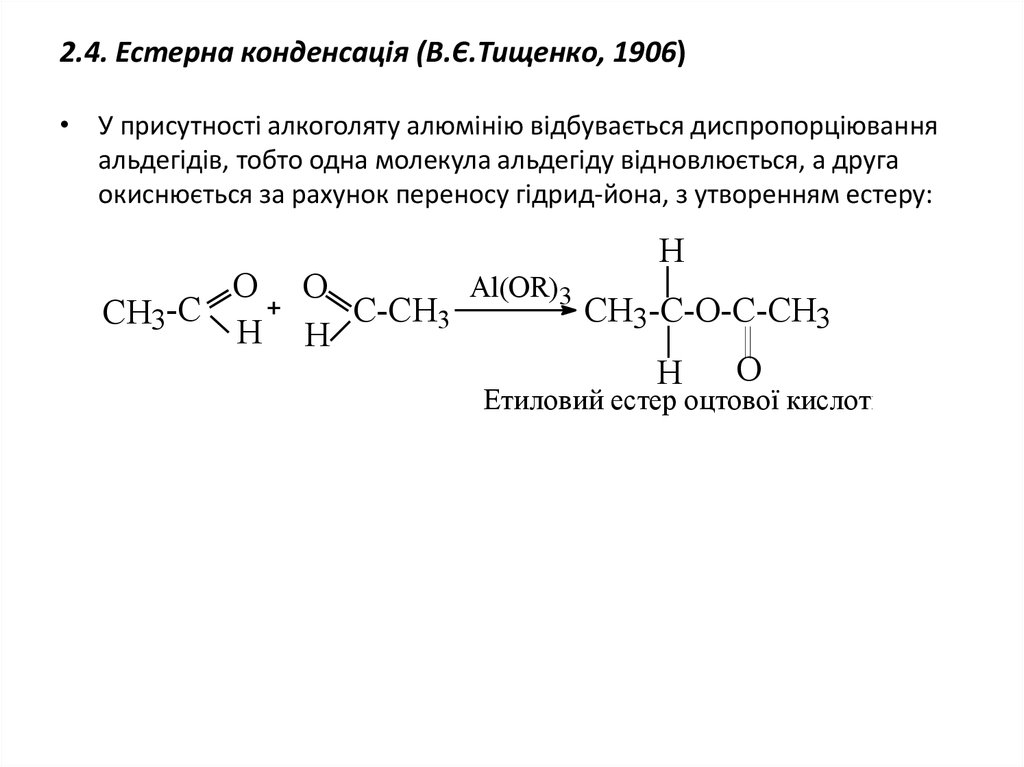
29. 2.4. Естерна конденсація (В.Є.Тищенко, 1906)
• У присутності алкоголяту алюмінію відбувається диспропорціюванняальдегідів, тобто одна молекула альдегіду відновлюється, а друга
окиснюється за рахунок переносу гідрид-йона, з утворенням естеру:
О
СН3-С
Н
H
Al(OR)3
О
С-СН3
СН3-C-O-С-СН3
Н
O
Н
Етиловий естер оцтової кислоти
30. НЕНАСИЧЕНІ АЛЬДЕГІДИ ТА КЕТОНИ
• Ненасиченими альдегідами і кетонами називаються сполуки, якімістять в молекулі карбонільну групу і кратні зв'язки С=С або С≡С.
Структурна
формула
СН 2 СН С
O
H
CH 3 CН СН-С
СН С С
Номенклатура
Замісникова
Радикало-функціональна
(тривіальна)
2-Пропеналь
(Акролеїн)
О
Н
O
Н
CH 3-С-CH=CH 2
2-Бутеналь
(Кротоновий альдегід)
Пропіналь
(Пропаргіловий альдегід)
3-Бутен-2-он
Вінілметилкетон
4-Пентин-2-он
Метилпропаргілкетон
O
CH 3-С-CH 2-С CH
O
31. Акролеїн (2-пропеналь) одержують кротоновою конденсацією суміші метаналю та етеналю через стадію альдолю:
3-Гідроксипропаналь(акролеїн)
Акролеїн (2-пропеналь) одержують кротоновою конденсацією суміші
метаналю та етеналю через стадію альдолю:
H C О
О
Н СН2 С
Н
Н
3-Гідроксипропаналь
О
Н2С СН С
Н
ОН Н
o
t
-Н2О
СН2 CH С
О
Н
Пропеналь
(акролеїн)
Крім того його отримують окисненням пропену молекулярним киснем
без каталізатора. При цьому утворюється гідропероксид, який далі
розпадається на спирт та альдегід:
CН2=СН-СН2-Н
О2, tо
о
t
CН2=СН-СН2-ООН
CН2 СНСН2О
Гідропероксид алілу
2CН2 СН СН2О
CН2 СН С
Акролеїн
O
Н
CН2 СНСН2ОH
Аліловий спирт
ОН
32. Кротоновий альдегід (2-бутеналь). Кротоновий альдегід отримують реакцією кротонової конденсації оцтового альдегіду.
Вінілметилкетон (3-бутен-2-он) - кротоновою конденсацієюформальдегіду з ацетоном через альдоль:
H
C О
Н
Н СН2 C СН3
O
H
Н
o
C СН-С CH3
ОН Н
О
t
-Н2О
СН2 CH С-СН3
О
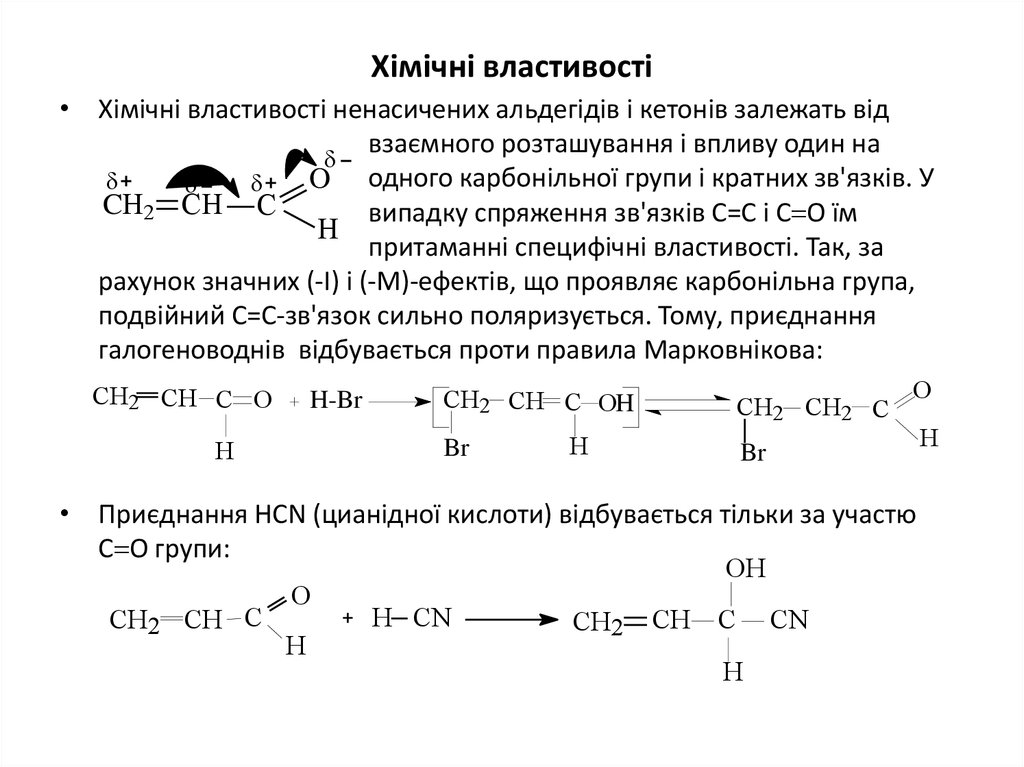
33. Хімічні властивості
• Хімічні властивості ненасичених альдегідів і кетонів залежать відвзаємного розташування і впливу один на
O одного карбонільної групи і кратних зв'язків. У
CН2 СН С
випадку спряження зв'язків С=С і С О їм
Н
притаманні специфічні властивості. Так, за
рахунок значних (-І) і (-М)-ефектів, що проявляє карбонільна група,
подвійний С=С-зв'язок сильно поляризується. Тому, приєднання
галогеноводнів відбувається проти правила Марковнікова:
СН2 CH С O
Н
H-Br
СН2 CH С OH
Br
Н
СН2 СН2 C
О
Br
• Приєднання HCN (цианідної кислоти) відбувається тільки за участю
С О групи:
ОН
О
Н СN
СН2 CH С
СН2 CH C СN
Н
Н
Н
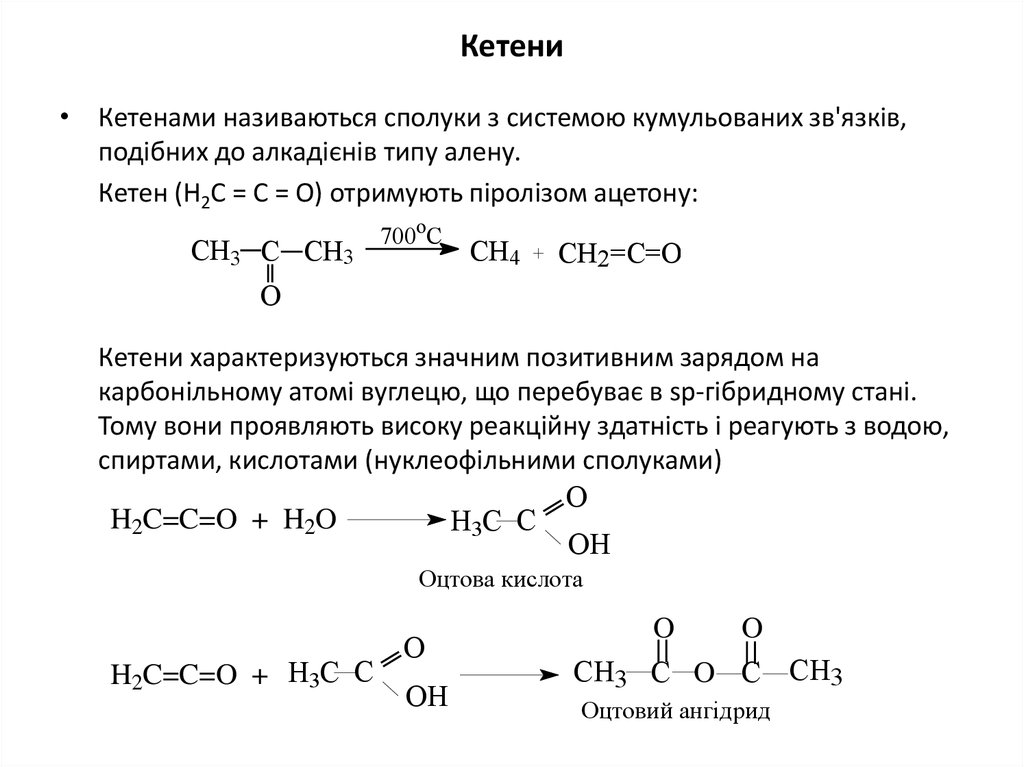
34. Кетени
• Кетенами називаються сполуки з системою кумульованих зв'язків,подібних до алкадієнів типу алену.
Кетен (Н2С = С = О) отримують піролізом ацетону:
CH3 C CH3
700oC
CH4
СН2=C=O
О
Кетени характеризуються значним позитивним зарядом на
карбонільному атомі вуглецю, що перебуває в sp-гібридному стані.
Тому вони проявляють високу реакційну здатність і реагують з водою,
спиртами, кислотами (нуклеофільними сполуками)
О
H2C=C=O + H2O
H3C С
OН
Оцтова кислота
H2C=C=O + H3C С
О
OН
O
O
СН3 C O C СН3
Оцтовий ангідрид
35.
H2C=C=O + С2Н5ОНH3C С
О
О С2Н5
Етилацетат
H2C=C=O + Н СІ
H3C С
О
СІ
Хлорангідри д
оцтової кислоти
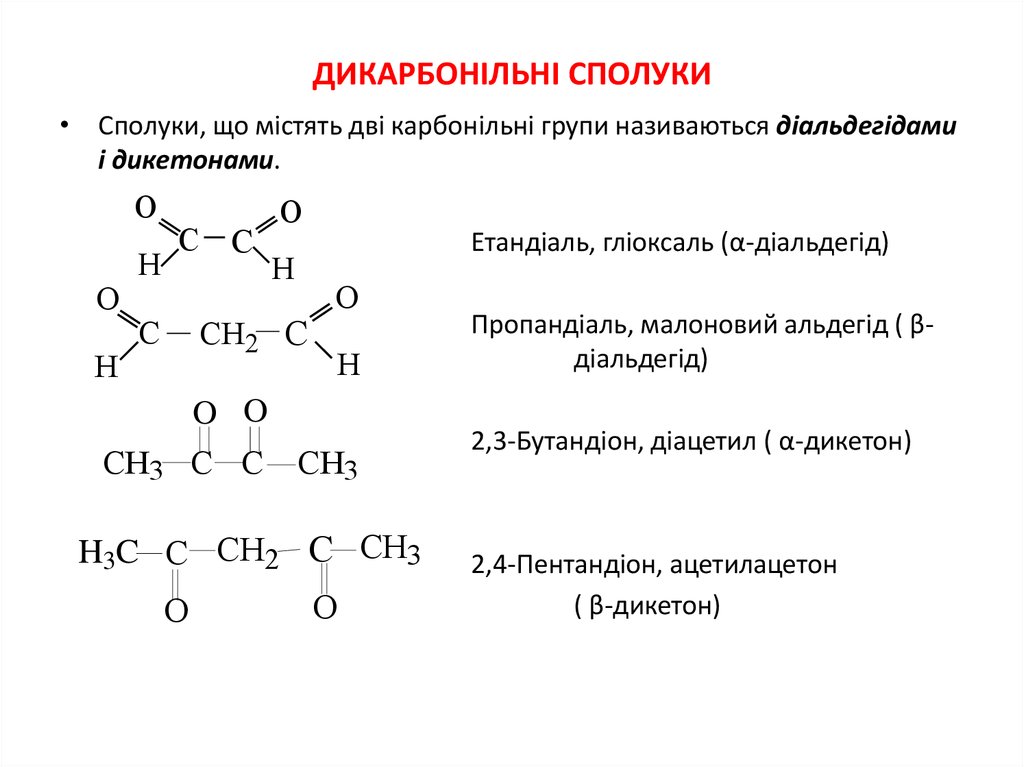
36. Дикарбонільні сполуки
ДИКАРБОНІЛЬНІ СПОЛУКИ• Сполуки, що містять дві карбонільні групи називаються діальдегідами
і дикетонами.
О
О
Н
Н
C
С
О
Етандіаль, гліоксаль (α-діальдегід)
Н
CH2 С
C
О
Н
O O
СН3 C C
СН3
H3C C CH2 С СН3
O
О
Пропандіаль, малоновий альдегід ( βдіальдегід)
2,3-Бутандіон, діацетил ( α-дикетон)
2,4-Пентандіон, ацетилацетон
( β-дикетон)
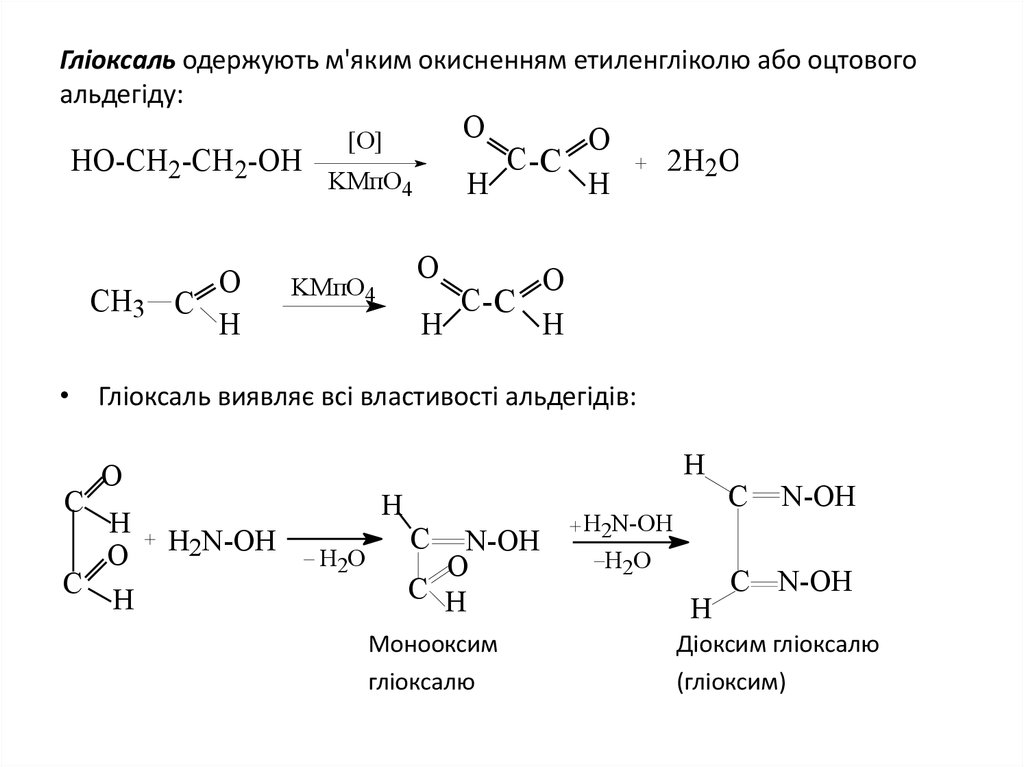
37. Гліоксаль одержують м'яким окисненням етиленгліколю або оцтового альдегіду:
HO-CH2-CH2-OHО
СН3 С
Н
О
О
C -С
Н
Н
[O]
KMпO4
О
KMпO4
Н
C -С
2H2O
О
Н
• Гліоксаль виявляє всі властивості альдегідів:
С
С
Н
O
H
O
Н
H
H2N-OH
H2O
C
N-OH
О
С Н
Монооксим
гліоксалю
H2N-OH
H2O
H
С
N-OH
С N-OH
Діоксим гліоксалю
(гліоксим)
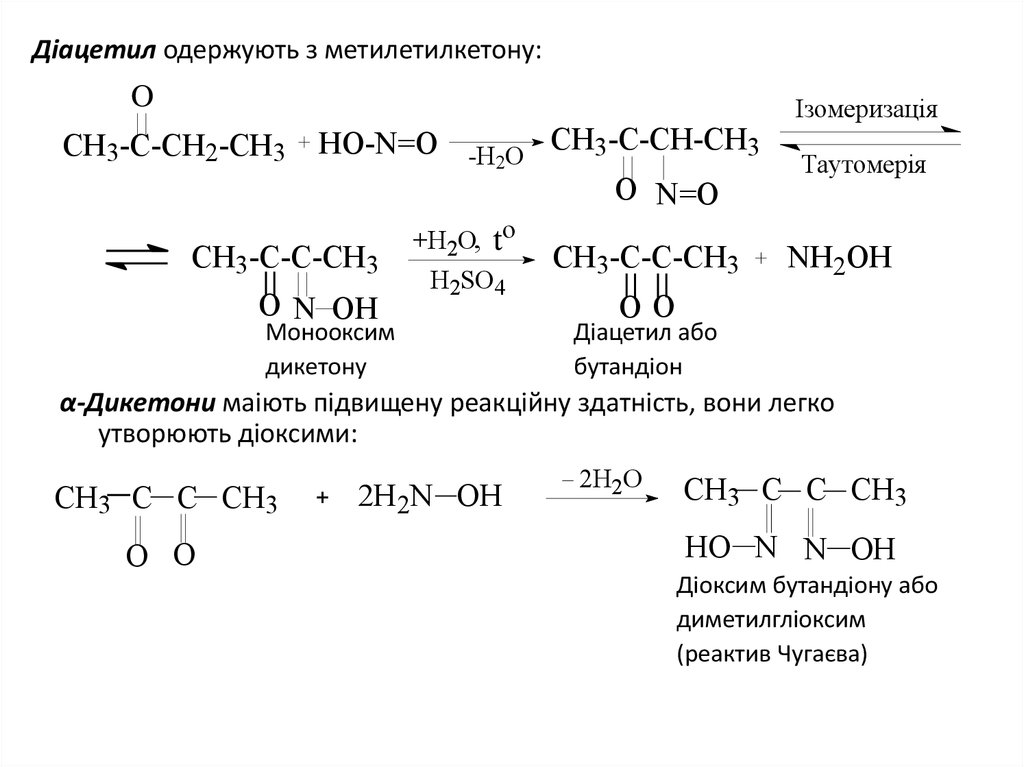
38. Діацетил одержують з метилетилкетону:
OІзомеризація
HO-N=O -Н2О СН3-С-СН-СН3
Таутомерія
О N=O
+H2O, to
СН3-С-С-СН3
СН3-С-С-СН3
NH2OH
СН3-С-СН2-СН3
О N OH
H2SO4
Монооксим
дикетону
ОO
Діацетил або
бутандіон
α-Дикетони маіють підвищену реакційну здатність, вони легко
утворюють діоксими:
СН3 С С СН3
О O
2H2N OH
2H2O
СН3 С С СН3
HO N N OH
Діоксим бутандіону або
диметилгліоксим
(реактив Чугаєва)
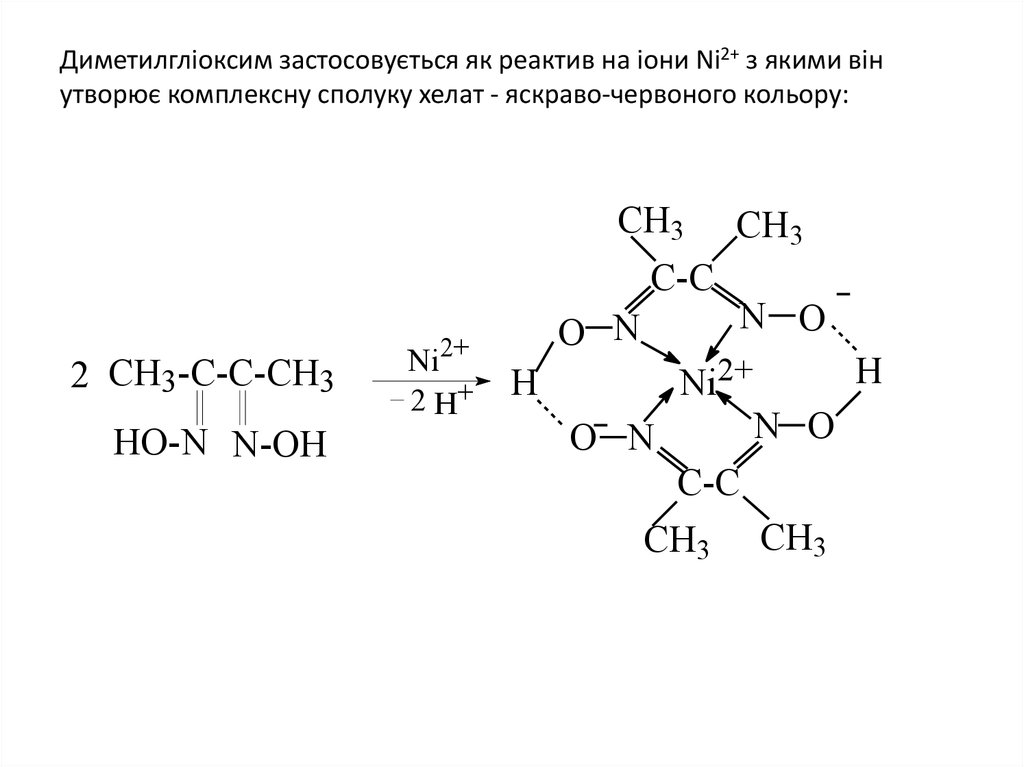
39. Диметилгліоксим застосовується як реактив на іони Ni2+ з якими він утворює комплексну сполуку хелат - яскраво-червоного
кольору:CH3
C-C
2 СН3-С-С-СН3
HO-N N-OH
Ni2+
2 H+
O N
CH3
N O
H
Ni2+
H
N O
O N
C-C
CH3
CH3
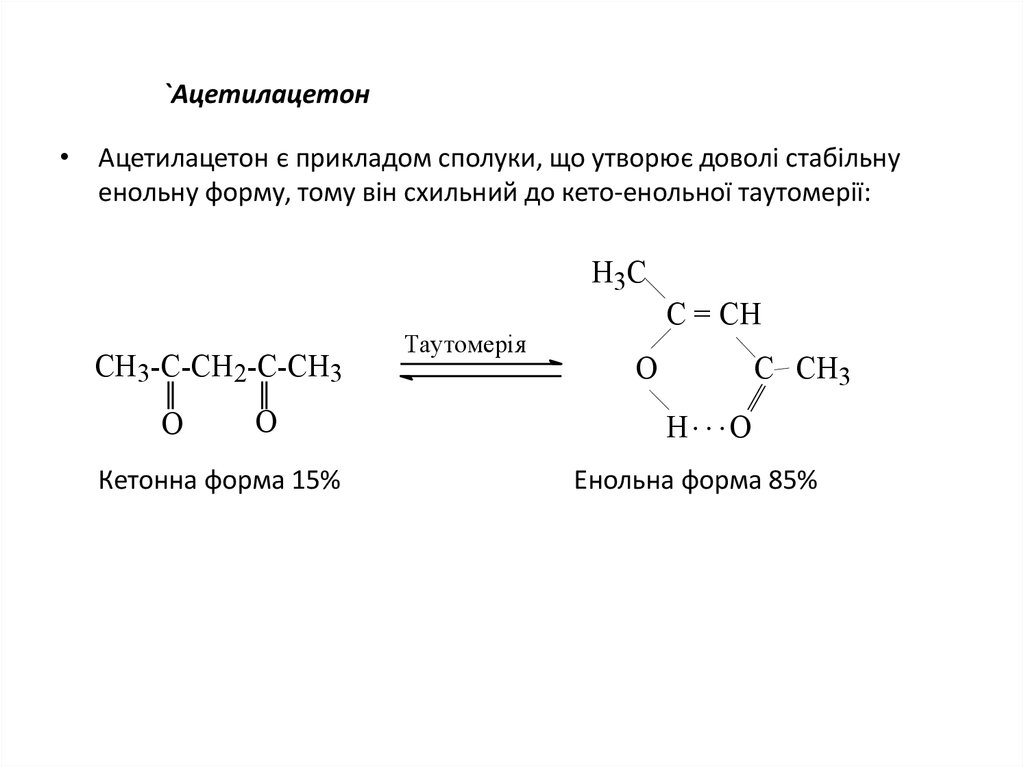
40. `Ацетилацетон
• Ацетилацетон є прикладом сполуки, що утворює доволі стабільнуенольну форму, тому він схильний до кето-енольної таутомерії:
Н3С
СН3-С-CH2-С-СН3
О
O
Кетонна форма 15%
Таутомерія
С = СН
С СН3
O
H
О
Енольна форма 85%






















 Химия
Химия








