Похожие презентации:
Группа галогенов в периодической системе
1.
2. Улыбнись новому знанию
AtF
Давайте изучим мы сегодня
отменно
элементы галогены.
А по-русски - солероды,
Все – от фтора и до йода.
Даже неустойчивый астат
Быть в семействе этом рад.
Cl
Br
I
3.
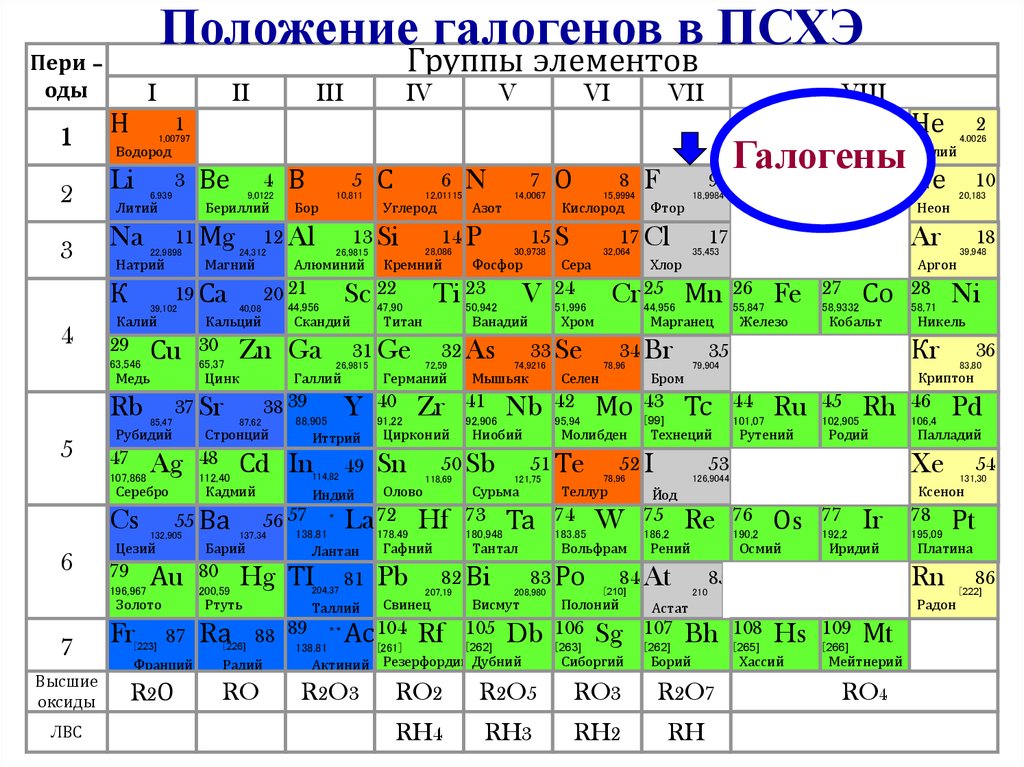
Положение галогенов в ПСХЭГруппы элементов
Пери –
оды
I
1
Н
2
Li
3
Na
6.939
3
Литий
11 Мg
22,9898
Калий
29
Сu
85,47
Ag
196,967
ЛВС
112,40
55 Ва
132,905
Аu
[223]
Бор
Скандий
Иттрий
Сd In
114,82
Барий
80
200,59
Rа
Индий
*
138,81
Hg ТI
[226]
49
Кремний
VI
204,37
91,22
81
Sn
VII
Радий
R2О
RO
118,69
Таллий
Гафний
41
92,906
Свинец
Rf
Nb
Ниобий
73
180,948
Та
Тантал
[262]
Сера
VIII
Db
9
51,996
Хром
Фтор
34 Br
Селен
42
95,94
Мо
183.85
52 I
[263]
55,847
W
58,9332
Со
Кобальт
75
186,2
Re
Рений
44
101,07
Ru
Рутений
45
102,905
Rh
Родий
[262]
Борий
RO2
R2O5
RO3
R2O7
RH4
RH3
RH2
RH
18
58,71
39,948
Ni
Никель
36
83,80
46
106,4
Pd
Палладий
54
131,30
Ксенон
76
190,2
Оs
77
192,2
Ir
Иридий
78
195,09
Рt
Платина
Rn
85
Bh
10
20,183
Xe
Радон
Астат
107
28
4.0026
Криптон
Осмий
210
Nе
Кr
53
84 At
Сиборгий
27
126,9044
[210]
Sg
Fe
Железо
Йод
Полоний
106
Технеций
78,96
Теллур
74
[99]
26
35
Тс
43
Гелий
Аргон
79,904
Бром
2
Ar
17
Хлор
Не
Неон
35,453
Марганец
78,96
Галогены
18,9984
Cr 25
Мn
44,956
24
83 Ро
Висмут
105
32,064
Вольфрам
208,980
F
17 Cl
51 Тe
121,75
Актиний Резерфордий Дубний
R2O3
Кислород
Молибден
Сурьма
82 Вi
207,19
8
15,9994
33 Se
74,9216
Мышьяк
50 Sb
Олово
** Ас 104
88 89
138,81
[261]
Франций
Zr
Цирконий
Pb
Фосфор
32 As
72,59
О
15 S
30,9738
Ванадий
Германий
40
Азот
7
14,0067
Ti 23
V
50,942
La 72
Hf
178.49
Лантан
Ртуть
87
Y
88,905
N
14 P
28,086
31 Ge
26,9815
38 39
56 57
Углерод
Титан
Галлий
137.34
6
12,01115
Sc 22
47,90
44,956
Zn Ga
87,62
С
13 Si
26,9815
Алюминий
Кадмий
Золото
Fr
48
5
10,811
20 21
Стронций
Цезий
79
65,37
37 Sr
Серебро
Cs
40,08
Кальций
30
В
12 Al
24,312
Цинк
Рубидий
47
4
9,0122
Магний
19 Сa
39,102
107,868
Высшие
оксиды
Ве
Бериллий
Натрий
Rb
7
V
Водород
Медь
6
IV
1
63,546
5
III
1,00797
К
4
II
108
[265]
Hs
Хассий
109
[266]
Мt
Мейтнерий
RO4
86
[222]
4.
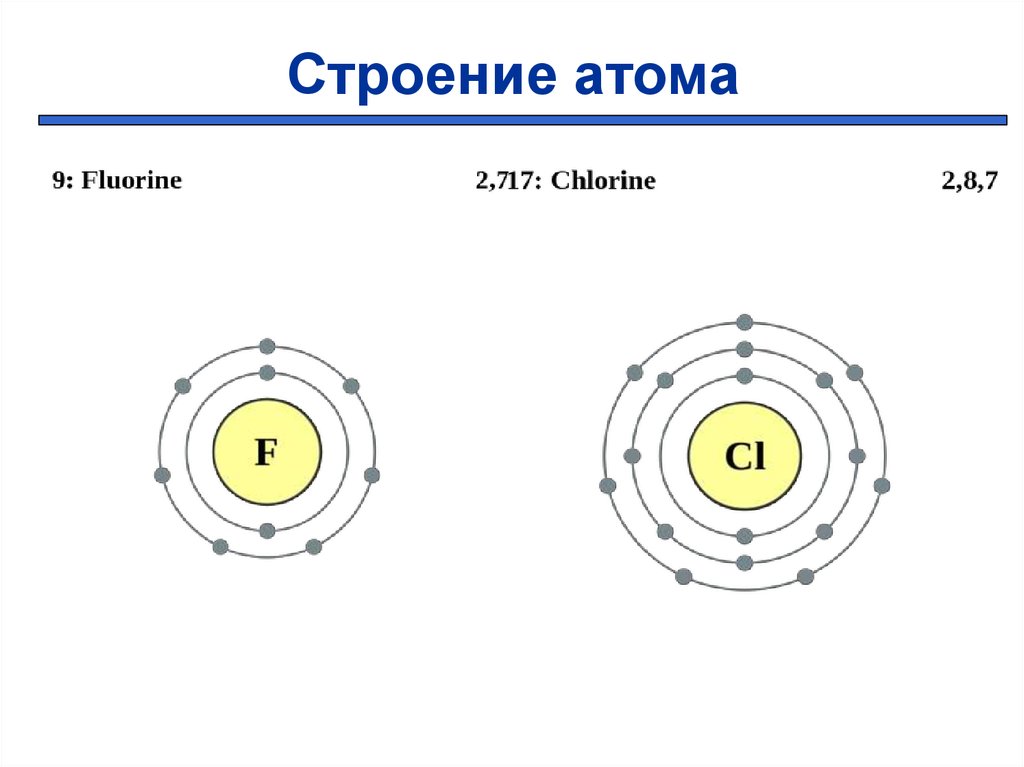
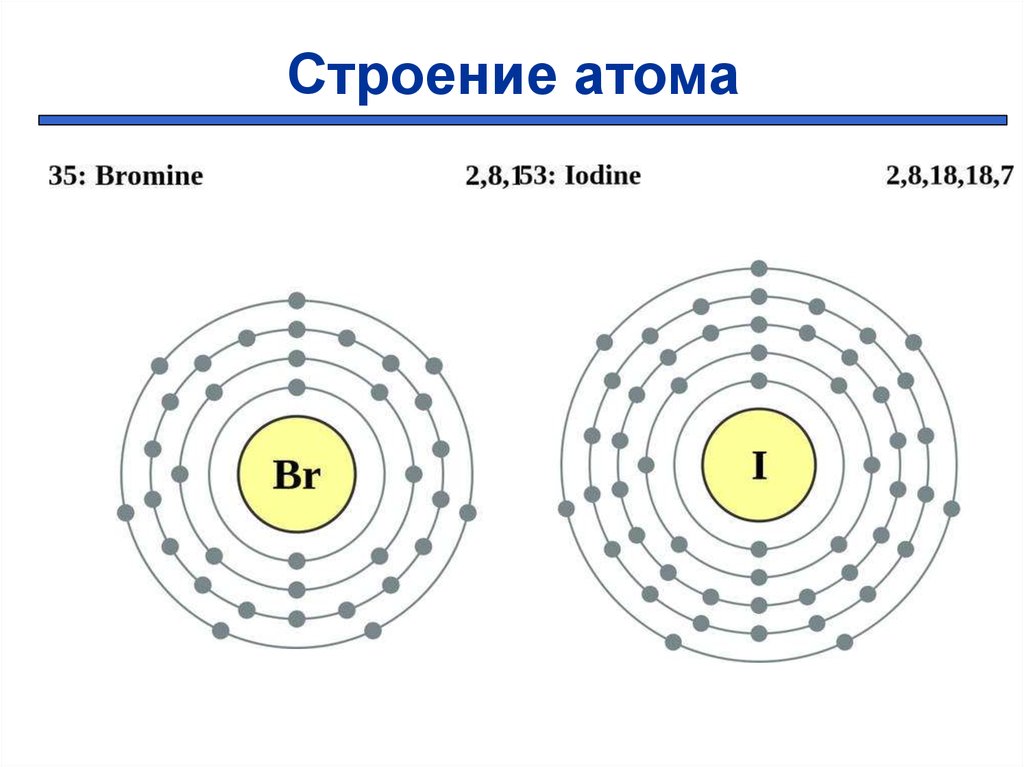
Строение атома5.
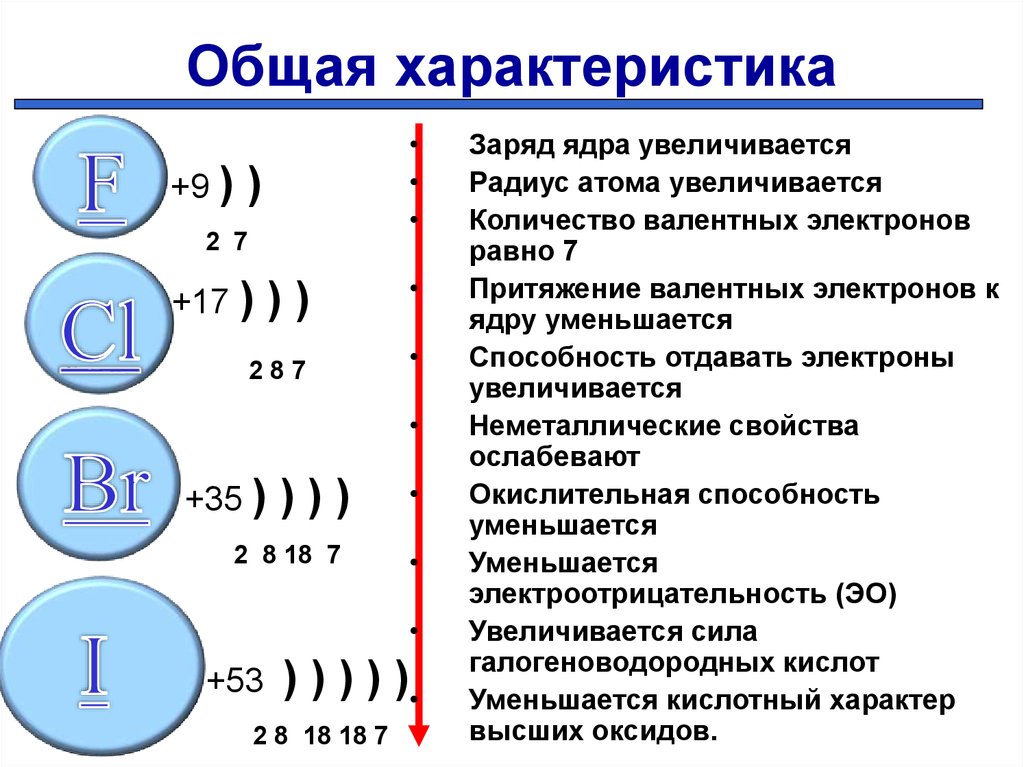
Строение атома6. Общая характеристика
+9 ))
2 7
+17 )
))
287
+35 )
)))
2 8 18 7
+53
) ) ) ) )
2 8 18 18 7
Заряд ядра увеличивается
Радиус атома увеличивается
Количество валентных электронов
равно 7
Притяжение валентных электронов к
ядру уменьшается
Способность отдавать электроны
увеличивается
Неметаллические свойства
ослабевают
Окислительная способность
уменьшается
Уменьшается
электроотрицательность (ЭО)
Увеличивается сила
галогеноводородных кислот
Уменьшается кислотный характер
высших оксидов.
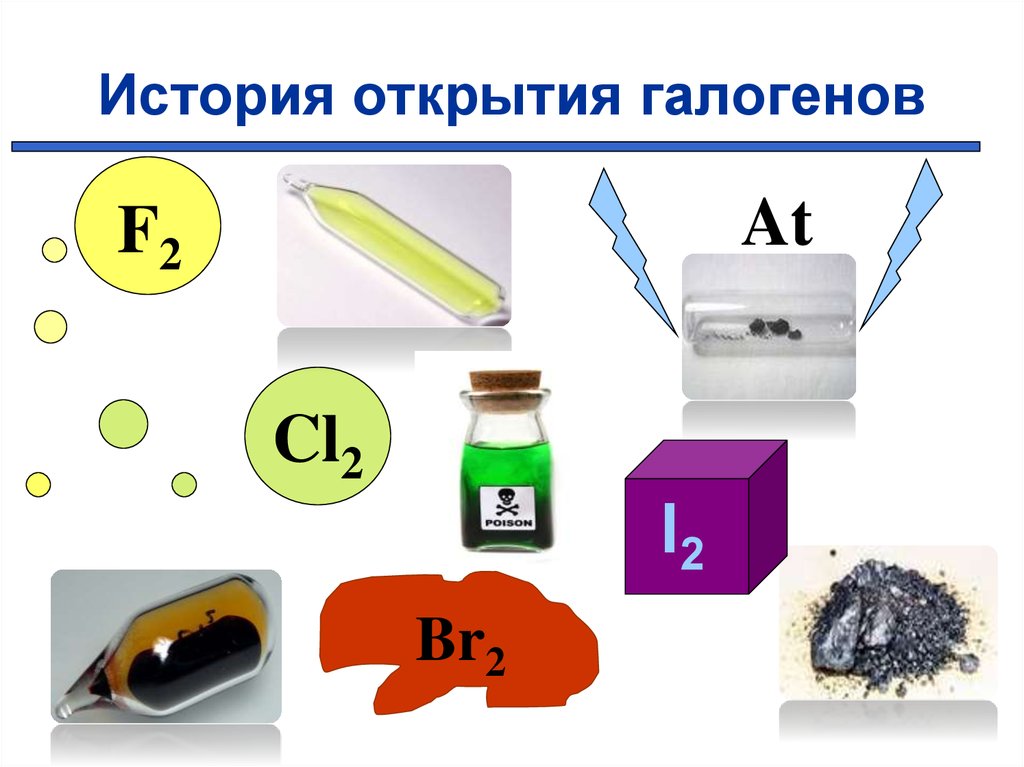
7. История открытия галогенов
AtF2
Cl2
I2
Br2
8. История открытия фтора
В 1886 году французский химик А. Муассан,используя электролиз жидкого фтороводорода,
охлажденного до температуры –23°C (в жидкости
должно содержаться немного фторида калия,
который обеспечивает ее электропроводимость),
смог на аноде получить первую порцию нового,
газа. В первых опытах для получения фтора А.
Муассан
использовал
очень
дорогой
электролизер, изготовленный из платины и
иридия. При этом каждый грамм полученного
фтора «съедал» до 6 г платины.
2HF→H2↑ + F2↑
Анри
Муассан
(1852 – 1907 г.)
9. История открытия хлора
КарлВильгельм
Шееле
(1742 – 1786 г.)
В 1774 году шведский аптекарь К. Шееле
открыл хлор. «Я поместил смесь черной
магнезии с муриевой кислотой в реторту, к
горлышку которой присоединил пузырь,
лишенный воздуха, и поставил ее на
песчаную баню. Пузырь наполнился газом,
который имел желто-зеленый
цвет и
пронзительный запах».
В 1807 году английский химик Гемфри
Дэви получил тот же газ. Он пришел к
выводу, что получил новый элемент и назвал
его "хлорин" (от "хлорос" - желто-зеленый).
В 1812 году Гей-Люсеок дал газу название
хлор.
MnO2+ 4HCl Cl2+ MnCl2 + 2H2O
10. История открытия брома
В 1825 году французский химик А.Ж.Баларпри изучении маточных рассолов выделил
темно-бурую жидкость, который он назвал "мурид" (от латинского слова muria,
означающего "рассол"). Комиссия Академии,
проверив это сообщение, подтвердила
открытие Балара и предложила назвать
элемент бромом (от "бромос", с греческого
"зловонный"). Балар писал: «Точь-в-точь
как ртуть
есть единственный металл,
который
имеет жидкую
фазу
при
комнатной температуре,
бром
есть
единственный жидкий неметалл» .
2NaBr + Cl2 → 2NaCl + Br2
Антуан Жером
Балар
(1802 – 1876 г.)
11. История открытия йода
В 1811 году французский химик БернарКуртуа открыл йод
путём перегонки
маточных растворов от азотнокислого
кальция с серной кислотой Чтобы другие
химики могли изучать новое вещество, Б.
Куртуа подарил его (фармацевтической
фирме в Дижоне.
В 1813 году Ж.-Л.Гей-Люссак подробно
изучил этот элемент и дал ему
современное название. Название "иод"
происходит от греческого слова "иодэс" "фиолетовый" (по цвету паров).
Бернар Куртуа
(1777 – 1838 г. )
2 NaI + 2 H2SO4 = I2 + SO2 + Na2 SO4 + 2 H2 O
12. История открытия астата
В1869
г
Д.И.Мендеелеев
предсказал его существование и
возможность открытия в будущем
(как «эка-иод»).
Впервые астат был получен
искусственно в 1940 г. открыт
Д.Корсоном, К.Маккензи и Э.Сегре
(Калифорнийский университет в
Беркли). Для синтеза изотопа 211At
они
облучали
висмут
альфачастицами.
Астат является наиболее редким
элементом
среди
всех,
обнаруженных
в
природе.
В
поверхностном слое земной коры
толщиной 1,6 км содержится всего
70 мг астата.
209
83Bi
+ 42He → 21185At + 2
Эрст Сегре
(1914 – 1985 г.)
1
0n
13.
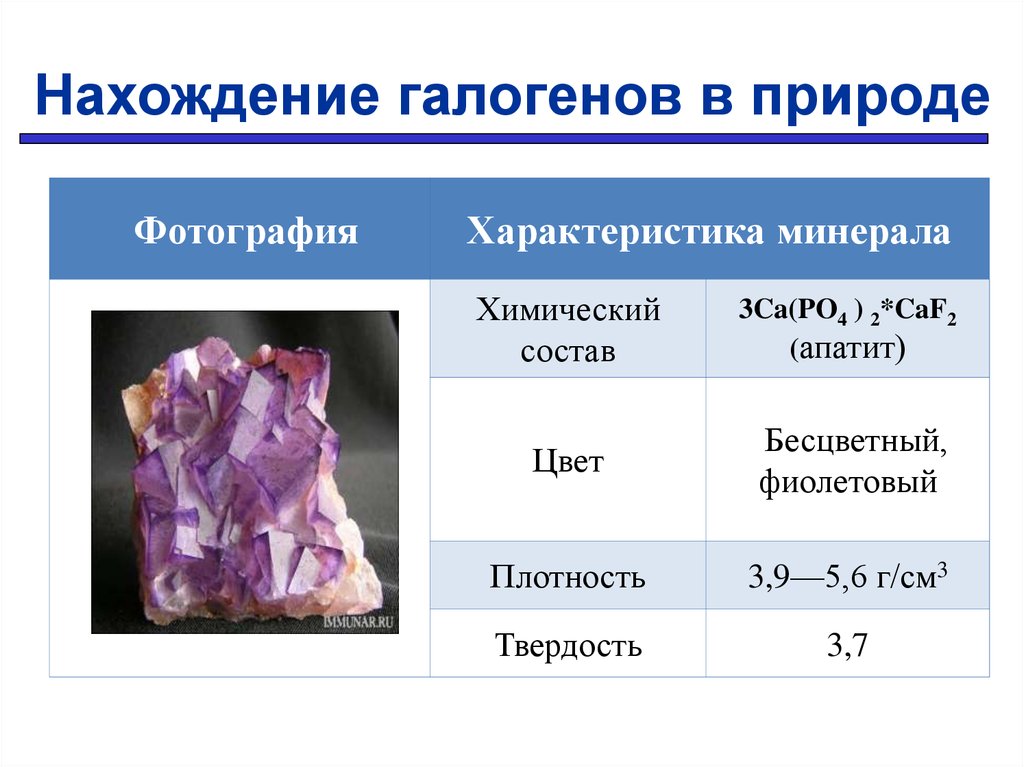
Нахождение галогенов в природеФотография
Характеристика минерала
Химический
состав
Цвет
CaF2 (флюорит)
Бесцветный,
желтый,
голубой,
фиолетовый
Плотность
3,4—4,9 г/см3
Твердость
3,3
14.
Нахождение галогенов в природеФотография
Характеристика минерала
Химический
состав
3Ca(PO4 ) 2*CaF2
(апатит)
Цвет
Бесцветный,
фиолетовый
Плотность
3,9—5,6 г/см3
Твердость
3,7
15.
Нахождение галогенов в природеФотография
Характеристика минерала
Химический
состав
NaСl (галит)
Цвет
Бесцветный,
красный, желтый,
синий, голубой
Плотность
2,2—2,3 г/см3
Твердость
2,5
16.
Нахождение галогенов в природеФотография
Характеристика минерала
Химический
состав
AgBr
(бромаргирит)примеси к другим
минералам
Цвет
Бесцветный,
розовый, желтый
Плотность
5,1—6,3г/см3
Твердость
1,9
17.
Нахождение галогенов в природеФотография
Характеристика минерала
Химический
состав
AgI
(йодаргирит)примесь к другим
минералам
Цвет
Бесцветный,
красный, желтый
Плотность
5,8—7,1 г/см3
Твердость
1,7
18.
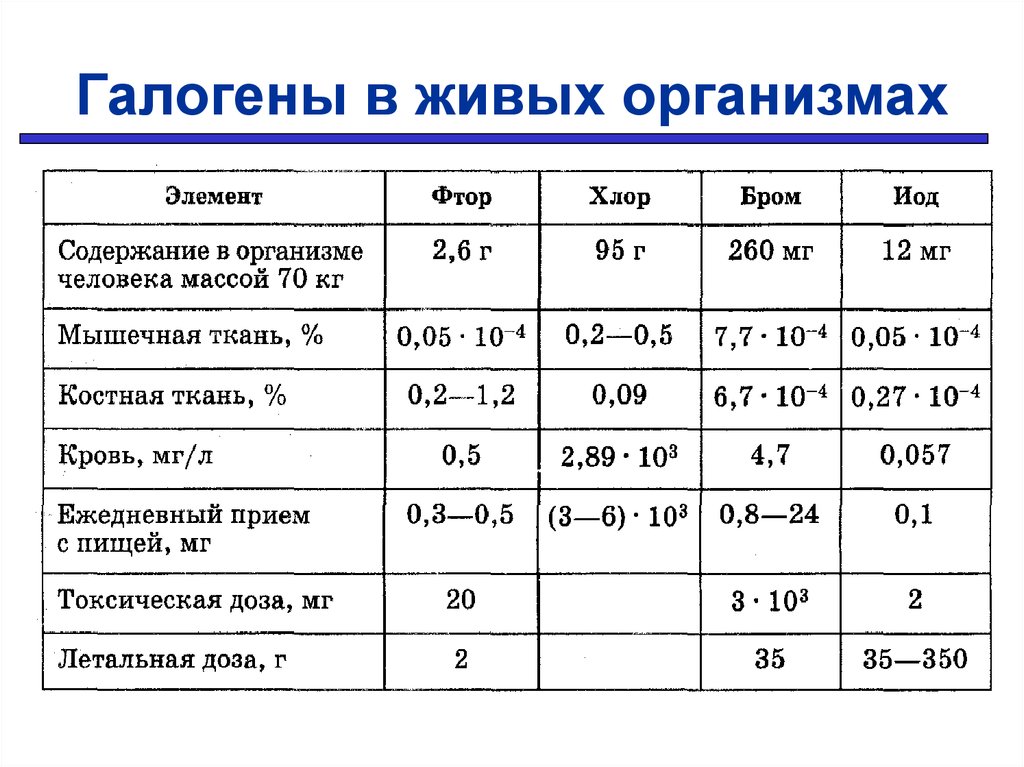
Галогены в живых организмах19.
ФТОРГруппы элементов
I
II
III
IV
V
VI
VII
VIII
1
Фтор/Fluorum (F)
II
2
Внешний вид
Бледно-жёлтый газ.
простого вещества Очень ядовит.
III
3
I
4
IV
5
6
V
7
8
VI
9
VII
10
F2
Электронная
коефигуранция
ЭО
(по Полингу)
Степень окисления
Плотность
[He] 2s2 2p5
Температура
плавления
Температура
кипения
53,53К
4 (САМЫЙ ЭО
ЭЛЕМЕНТ)
−1 (ВСЕГДА)
(при −189 °C)1,108
г/см ³
85,01 К
20.
ХЛОРГруппы элементов
I
I
II
III
2
III
3
IV
5
6
V
7
8
9
VII
10
VI
Внешний вид
простого
вещества
Электронная
коефигуранция
ЭО
(по Полингу)
Степень
окисления
Плотность
4
VI
V
VII
VIII
Хлор / Chlorum (Cl)
1
II
IV
Cl2
Температура
плавления
Температура
кипения
Газ жёлто-зеленого
цвета с резким
запахом. Ядовит.
[Ne] 3s2 3p5
3,16
7, 6, 5, 4, 3, 1, −1
(при −33.6 °C)1,56
г/см ³
172.2 К
238.6 К
21.
БРОМГруппы элементов
I
I
II
III
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
V
VI
VII
VIII
Бром / Bromum (Br)
1
II
IV
Br2
Внешний вид
простого
вещества
Электронная
конфигуранция
ЭО
(по Полингу)
Степень
окисления
Плотность
Температура
плавления
Температура
кипения
Красно-бурая
жидкость с резким
запахом
[Ar] 3d10 4s2 4p5
2,96
7, 5, 3, 1, -1
3,12 г/см³
265,9 К
331,9 К
22.
ЙОДГруппы элементов
I
I
II
III
II
III
V
VI
металлическим
блеском
3
IV
5
6
V
7
8
9
10
VIII
Черно-фиолетовые
Внешний вид
простого вещества кристаллы с
2
VI
VII
Ио́д / Iodum (I)
1
4
VII
IV
I2
Электронная
конфигуранция
ЭО
(по Полингу)
Степень
окисления
Плотность
[Kr] 4d10 5s2 5p5
Температура
плавления
Температура
кипения
386,7 К
2,66
7, 5, 3, 1, -1
4,93г/см³
457,5 К
23.
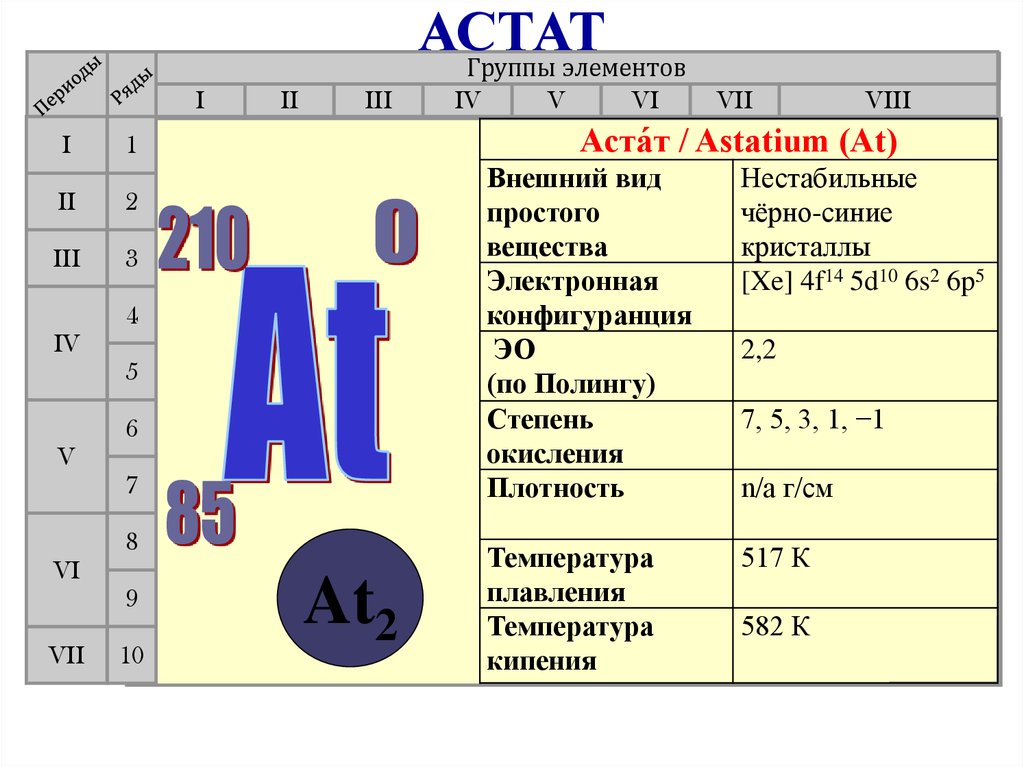
АСТАТГруппы элементов
I
I
II
III
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
V
VI
VII
VIII
Аста́т / Astatium (At)
1
II
IV
At2
Внешний вид
простого
вещества
Электронная
конфигуранция
ЭО
(по Полингу)
Степень
окисления
Плотность
Нестабильные
чёрно-синие
кристаллы
[Xe] 4f14 5d10 6s2 6p5
Температура
плавления
Температура
кипения
517 К
2,2
7, 5, 3, 1, −1
n/a г/см
582 К
24. Галогены
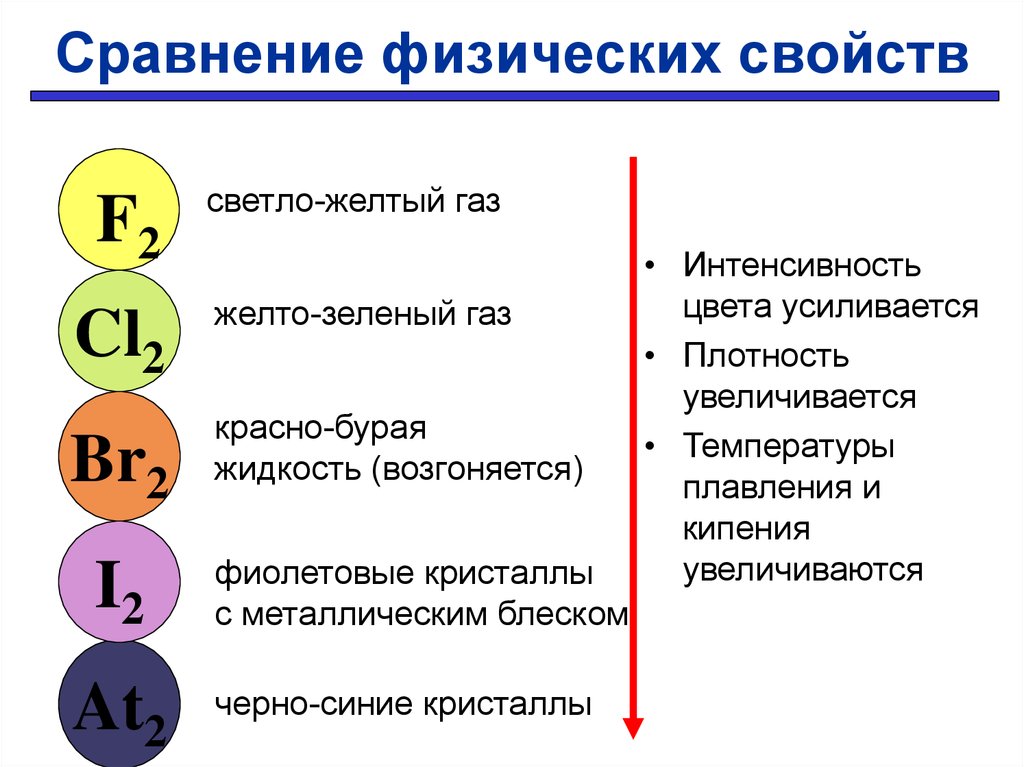
25. Сравнение физических свойств
F2светло-желтый газ
Cl2
желто-зеленый газ
Br2
I2
At2
красно-бурая
жидкость (возгоняется)
фиолетовые кристаллы
с металлическим блеском
черно-синие кристаллы
• Интенсивность
цвета усиливается
• Плотность
увеличивается
• Температуры
плавления и
кипения
увеличиваются
26.
Возгонка йодаКристаллический йод
обладает
способностью при
нагревании
переходить из
твердого состояния
в газообразное,
минуя жидкое
(возгонка),
превращаясь в
фиолетовые пары.
27.
Химические свойства галогеновХлор хвалился: «Нет мне равных!
Галоген я - самый главный.
Зря болтать я не люблю:
Всё на свете отбелю!»
Йод красой своей гордился,
Твердым был, но испарился.
Фиолетовый как ночь,
Далеко умчался прочь.
Бром разлился океаном,
Хоть зловонным. Но румяным.
Бил себя он грозно в грудь:
«Я ведь бром! Не кто-нибудь!..»
Фтор молчал и думал:
«Эх!.. Ведь приду – окислю всех…»
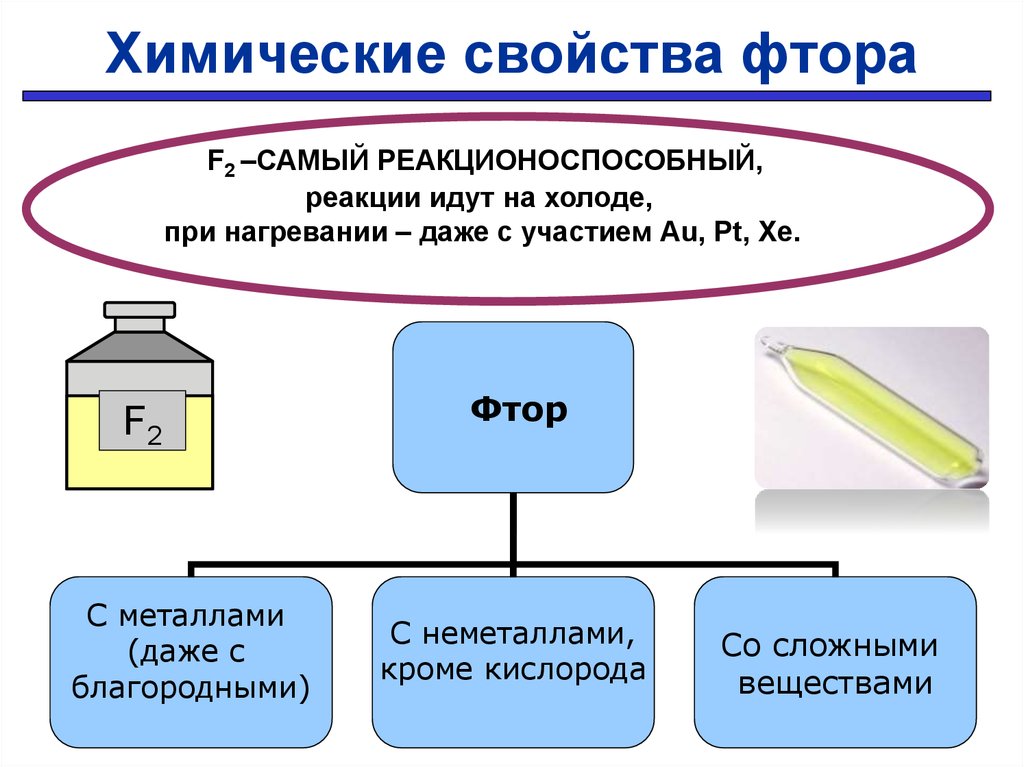
28.
Химические свойства фтораF2 –САМЫЙ РЕАКЦИОНОСПОСОБНЫЙ,
реакции идут на холоде,
при нагревании – даже с участием Au, Pt, Xe.
F2
С металлами
(даже с
благородными)
Фтор
С неметаллами,
кроме кислорода
Проверить
Со сложными
веществами
29.
Химические свойства фтораС простыми веществами:
С МЕталлами
С Неметаллами
2Na + F2 → 2NaF
Mo + 3F2 → MoF6
F2
H2 + F2 → 2HF
Xe + 2F2 → XeF4
Со сложными веществами:
Вода горит во
фторе
фиолетовым
пламенем
2H2O + F2
2KCl + F2
2KBr + F2
2KI + F2
→ 4HF + O2
→ Cl2 + 2NaF
→ Br2 + 2КF
→ I2 + 2КF
Фтор вытесняет
любой галоген из
соли
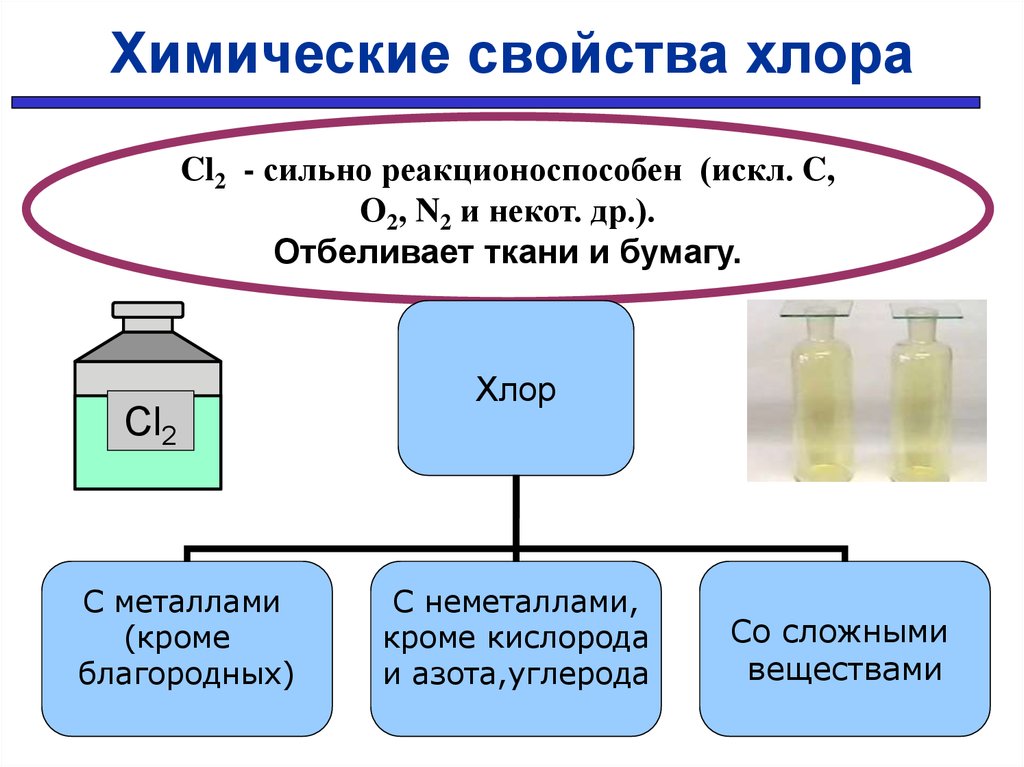
30.
Химические свойства хлораCl2 - сильно реакционоспособен (искл. C,
O2, N2 и некот. др.).
Отбеливает ткани и бумагу.
Cl2
С металлами
(кроме
благородных)
Хлор
С неметаллами,
кроме кислорода
и азота,углерода
Со сложными
веществами
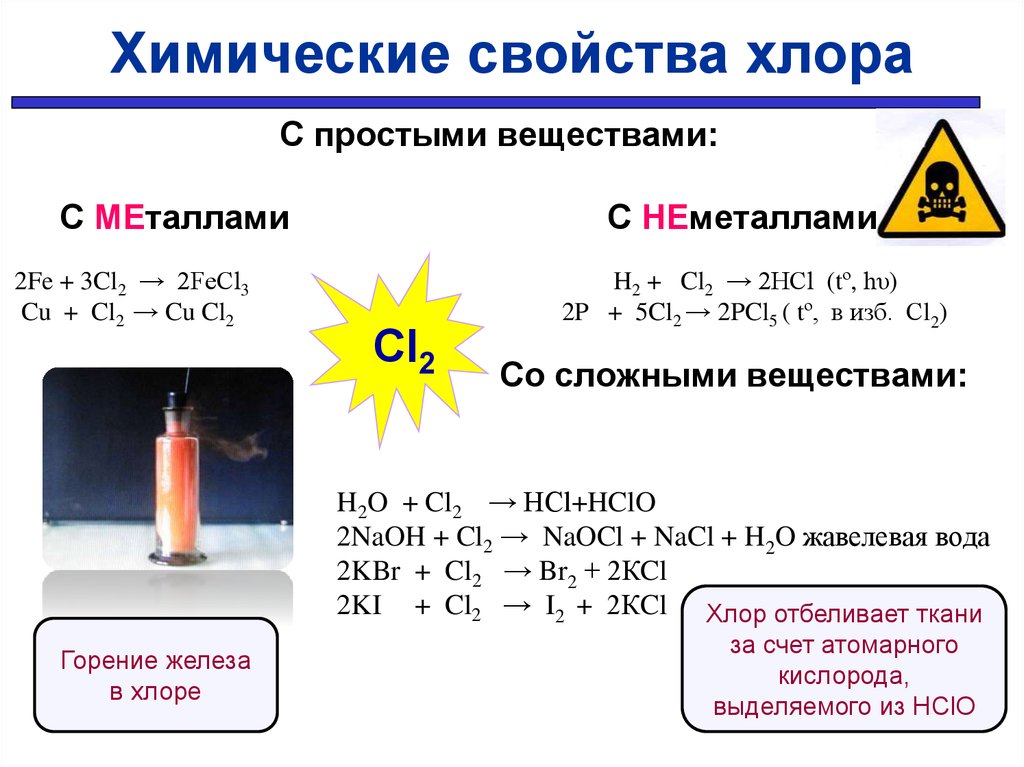
31.
Химические свойства хлораС простыми веществами:
С МЕталлами
2Fe + 3Cl2 → 2FeCl3
Cu + Cl2 → Cu Cl2
С НЕметаллами
Cl2
H2 + Cl2 → 2HCl (tº, hυ)
2P + 5Cl2 → 2PCl5 ( tº, в изб. Сl2)
Со сложными веществами:
H2O + Cl2 → HCl+HClO
2NaOH + Cl2 → NaOCl + NaCl + H2O жавелевая вода
2KBr + Cl2 → Br2 + 2КCl
2KI + Cl2 → I2 + 2КCl Хлор отбеливает ткани
Горение железа
в хлоре
за счет атомарного
кислорода,
выделяемого из НClO
32.
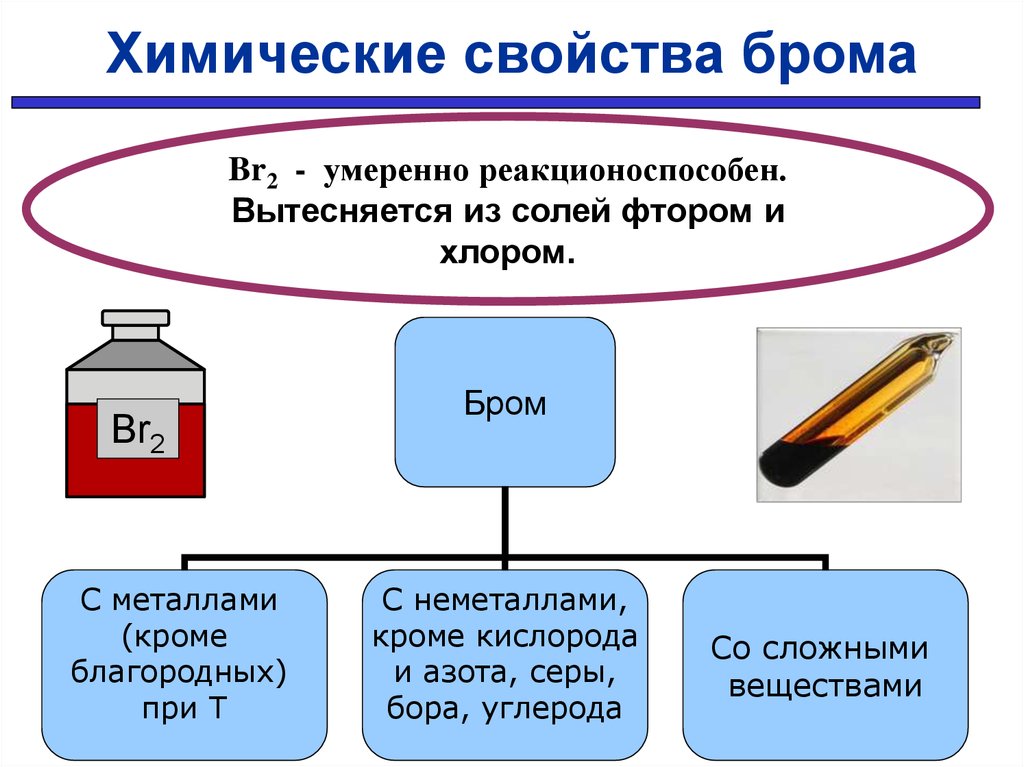
Химические свойства бромаBr2 - умеренно реакционоспособен.
Вытесняется из солей фтором и
хлором.
Br2
С металлами
(кроме
благородных)
при Т
Бром
С неметаллами,
кроме кислорода
и азота, серы,
бора, углерода
Со сложными
веществами
33.
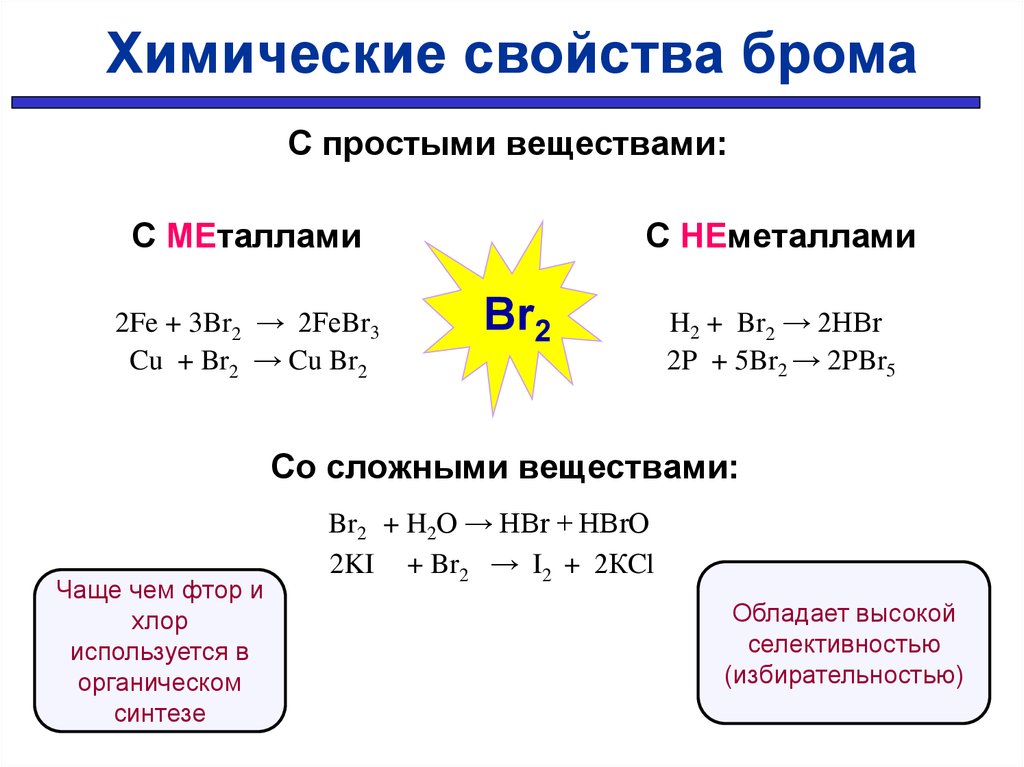
Химические свойства бромаС простыми веществами:
С МЕталлами
2Fe + 3Br2 → 2FeBr3
Cu + Br2 → Cu Br2
С НЕметаллами
Br2
H2 + Br2 → 2HBr
2P + 5Br2 → 2PBr5
Со сложными веществами:
Чаще чем фтор и
хлор
используется в
органическом
синтезе
Br2 + H2O → HBr + HBrO
2KI + Br2 → I2 + 2КCl
Обладает высокой
селективностью
(избирательностью)
34.
Химические свойства йодаI2 - мало реакционоспособен.
Вытесняется из солей фтором,
хлором и бромом.
Йод
I2
С металлами
(кроме
благородных)
при Т
С активными
неметаллами
при Т
Со сложными
веществами
при Т
35.
Химические свойства йодаС простыми веществами:
С металлами
Hg + I2 → HgI2
2Al + 3I2 → 2AlI3
С неметаллами
I2
H2 + I2 → 2HI (tº)
2P + 3Br2 → 2PI3
Со сложными веществами:
I2 + H2O → HI + HIO (практически не идет)
I2 + р-р крахмала → темно-синее окрашивание
Окисляется
конц. серной и
азотной
кислотами
36.
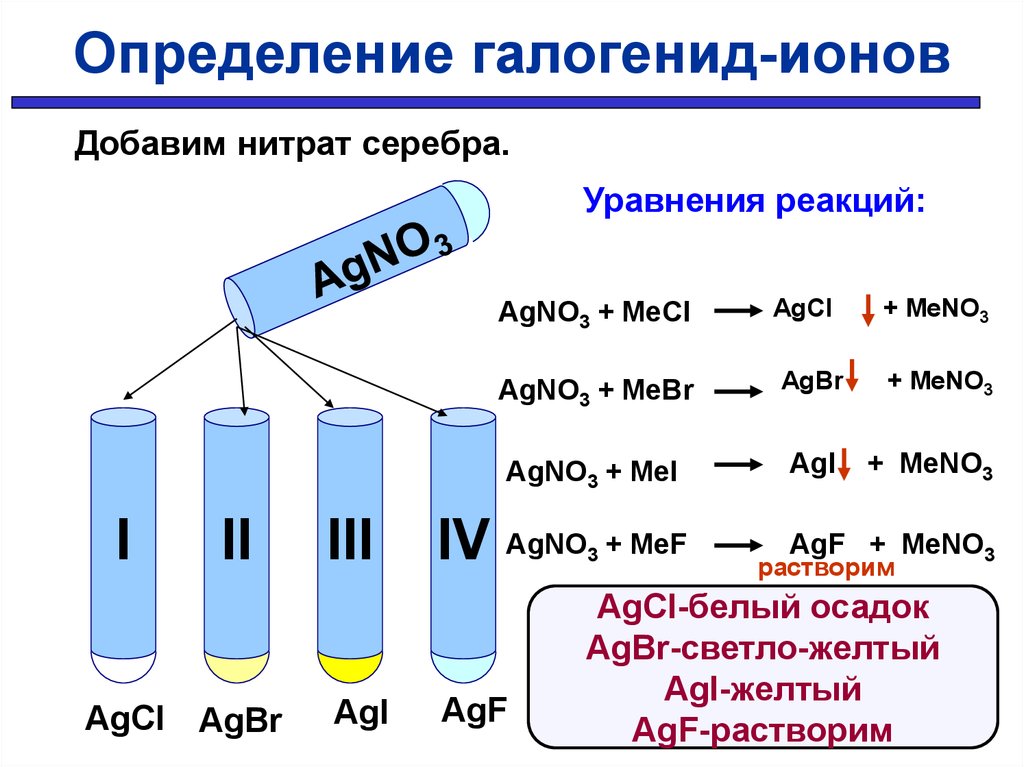
Определение галогенид-ионовОпределить в какой пробирке находится раствор
хлорида, бромида, иодида, фторида
I
II
III
IV
?
37.
Определение галогенид-ионовДобавим нитрат серебра.
Уравнения реакций:
AgNO3 + MeCl
I
II
AgCl AgBr
III
AgI
AgCl
AgNO3 + MeBr
AgBr
AgNO3 + MeI
AgI
IV AgNO
AgF
3
+ MeF
+ MeNO3
+ MeNO3
+ MeNO3
AgF + MeNO3
растворим
AgCl-белый осадок
AgBr-светло-желтый
AgI-желтый
AgF-растворим
38.
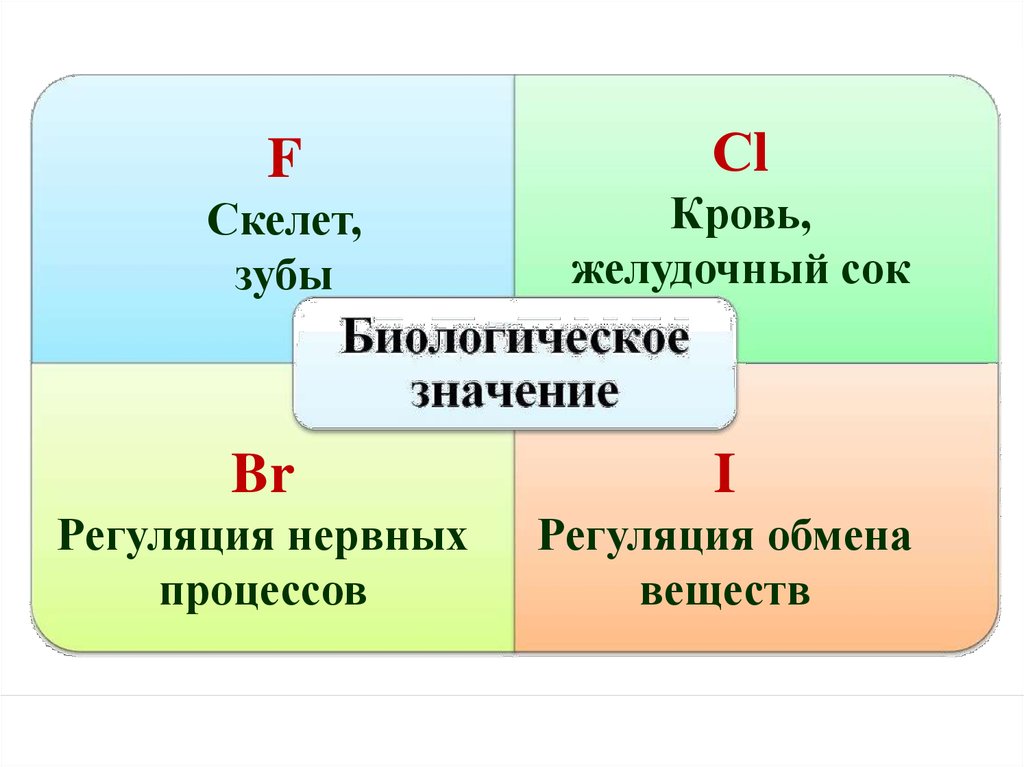
FСкелет,
зубы
Сl
Кровь,
желудочный сок
Br
I
Регуляция нервных
процессов
Регуляция обмена
веществ
39.
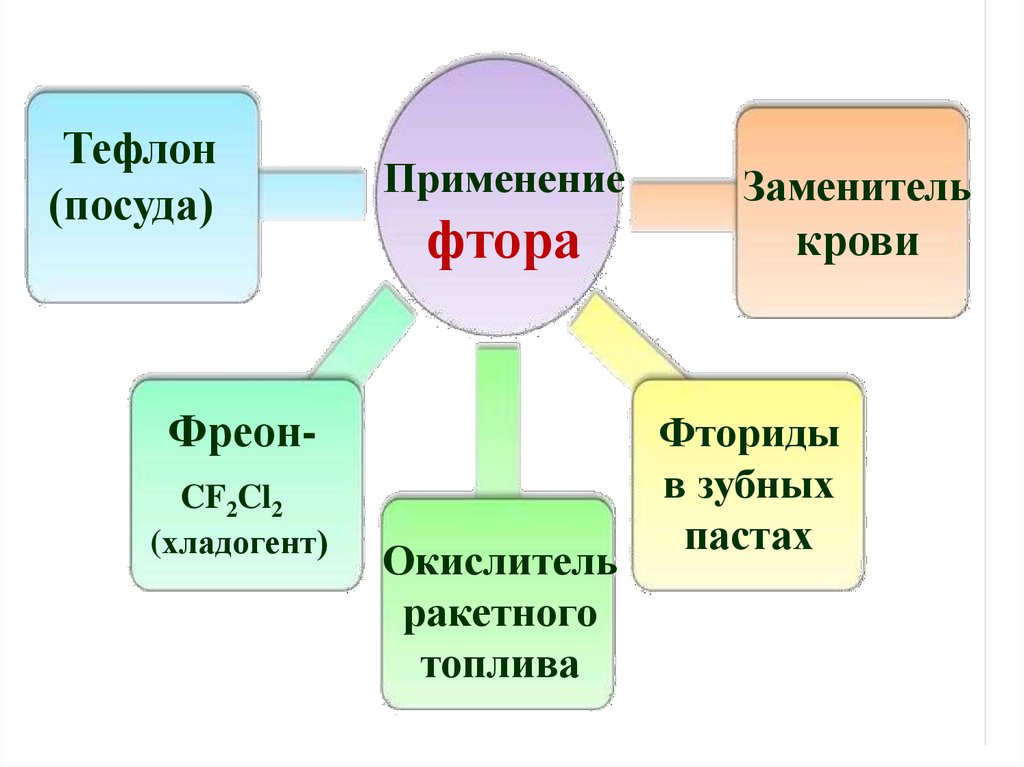
Тефлон(посуда)
Применение
фтора
ФреонCF2Cl2
(хладогент)
Окислитель
ракетного
топлива
Заменитель
крови
Фториды
в зубных
пастах
40.
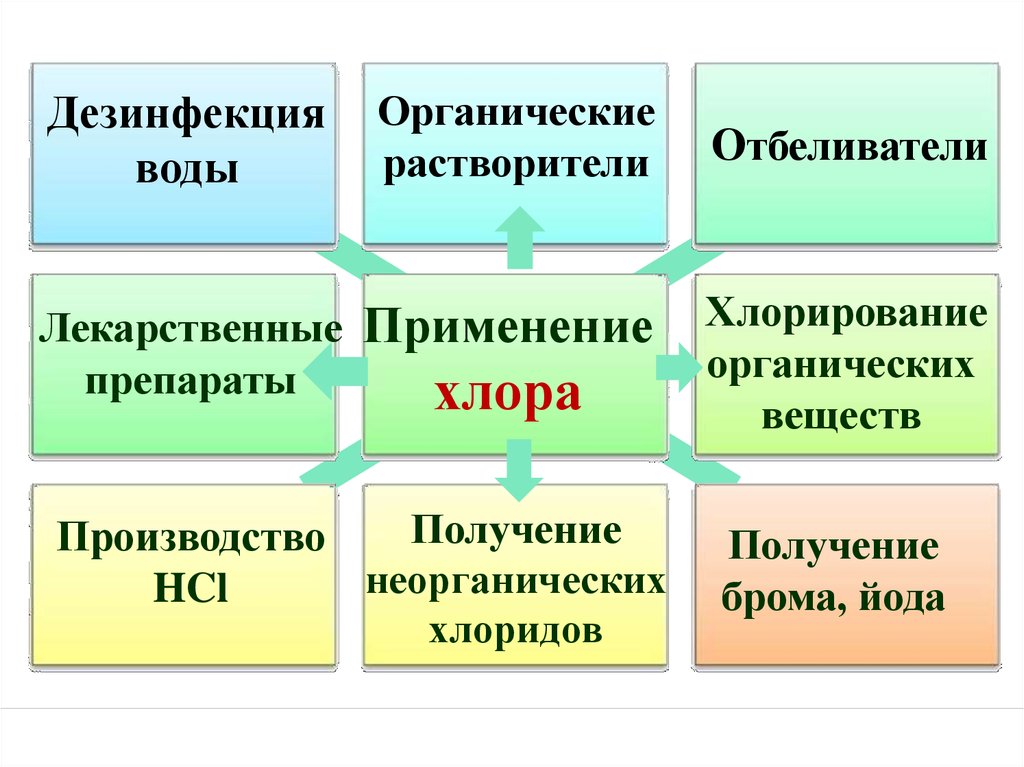
Дезинфекцияводы
Органические
растворители
Лекарственные
препараты
Применение
хлора
Получение
Производство
неорганических
HCl
хлоридов
Отбеливатели
Хлорирование
органических
веществ
Получение
брома, йода
41.
Лекарственныепрепараты
Ветеринарные
Фотография
препараты
Применение
брома
Красители
Ингибиторы
коррозии
Присадки
к бензину
42.
Лекарственныепрепараты
AgI для создания
искусственных
осадков
Применение
Фотография
йода
Галогеновые
электролампы
Красители
43.
Проверь себя2H2 O + 2F2 =
2NaOH + H2 +Cl2
Xe + 2F2 =
2NaCl + I2
H2 + F 2 =
2AuCl3
2Au + 3Cl2 =
XeF4
2NaCl + 2H2 O =
4 HF + O2
2NaI + Cl2 =
2HF
44.
Домашнее задание• Составьте кроссворд по теме «Галогены»
Ключевым
словом
является
слово
«АСТАТ».
• Решите задачу:
Определите объем хлора (н.у), который
образуется при действии на 5,8 г
перманганата калия раствора соляной
кислоты массой 100 г, с массовой долей
кислоты 36%.
45.
Спасибоза внимание !
46.
Источники информации• «Химия в действии», М. Фримантл, М,
«Мир»,1991г, стр. 269-286.
• «Неорганическая химия в таблицах»,
Н.В.Манцевич, Минск, Современная
школа, 2008г, стр 275-280.
• http://int-46.ucoz.ru/load/13-1-0-155




























 Химия
Химия








