Похожие презентации:
Основания, их классификация, способы получения и свойства. 8 класс
1. Тема урока: Основания, их классификация, способы получения и свойства.
2.
Составить формулыоснований
Гидроксид калия
KOH
Гидроксид кальция
Ca(OH)2
Гидроксид магния
Mg(OH)2
Гидроксид железа (III)
Fe(OH)3
3. Диссоциация оснований
Задание: выбрать какие вещества будут
диссоциировать и написать уравнения
диссоциации
NaOH, Ba(OH)2 , Fe(OH)3
4.
NaOH+
Na
+
OH
Ba(ОН)2 Ba2+ + 2 OH-
5. Классификация оснований
6.
Найдите лишнеевещество
1.КОН, NaOH, Ba(OH)2
2.Са(ОН)2, Ba(OH)2, Ве(OH)2
3.NaOH, Ba(OH)2 , Fe(OH)3
7. Классификация оснований
Число гидроксильных группОднокислотные
КОН
Многокислотные
Заряд
гидроксильной
группы
NaOH
LiOH
Ba(ОН)2
Fe(OH)3
-1
Cu(OH)2
8.
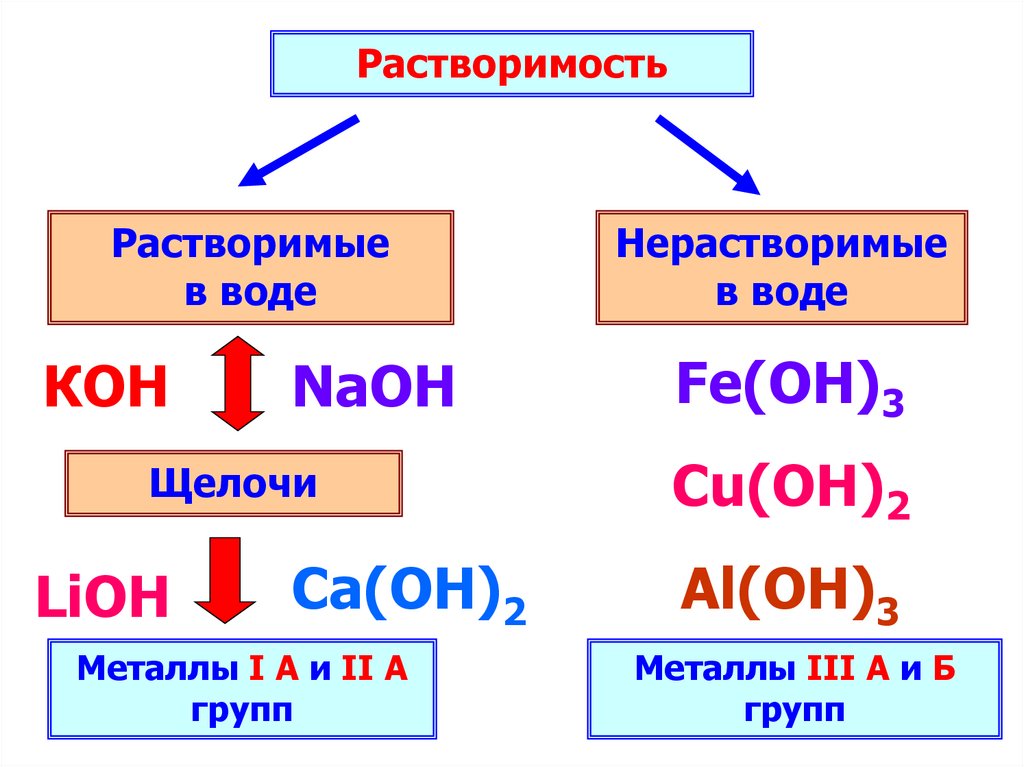
РастворимостьРастворимые
в воде
КОН
NaOH
Щелочи
LiOH
Ca(ОН)2
Металлы I А и II А
групп
Нерастворимые
в воде
Fe(OH)3
Cu(OH)2
Al(ОН)3
Металлы III А и Б
групп
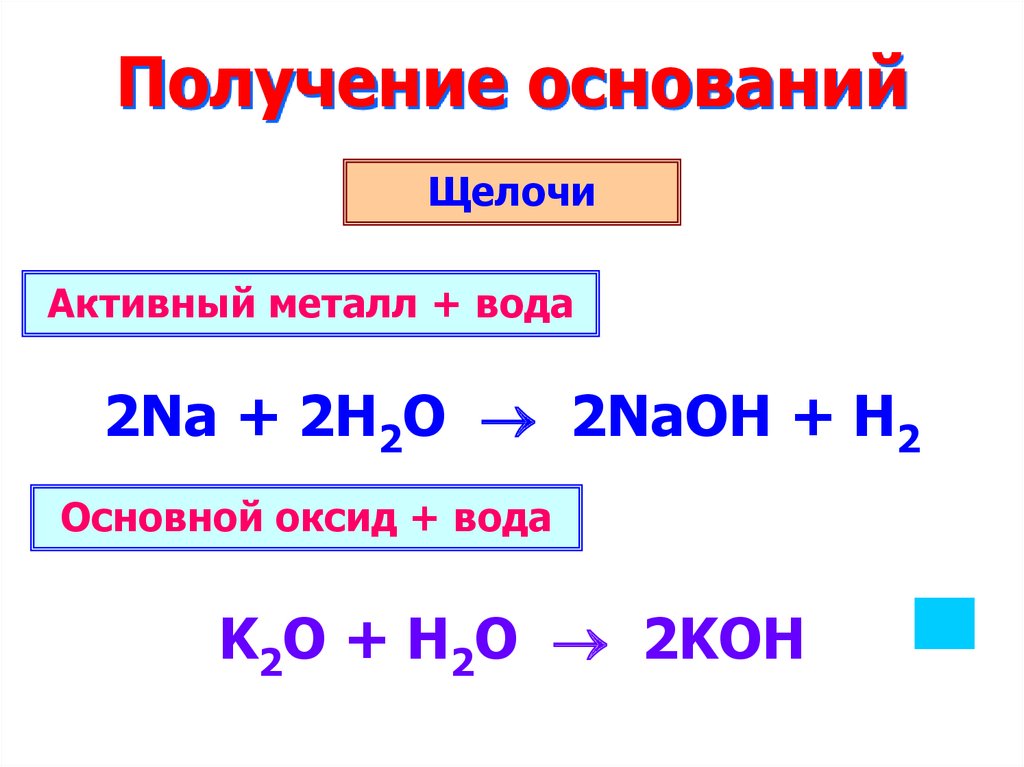
9. Получение оснований
ЩелочиАктивный металл + вода
2Na + 2H2O 2NaOH + H2
Основной оксид + вода
K2O + H2O 2KOH
10.
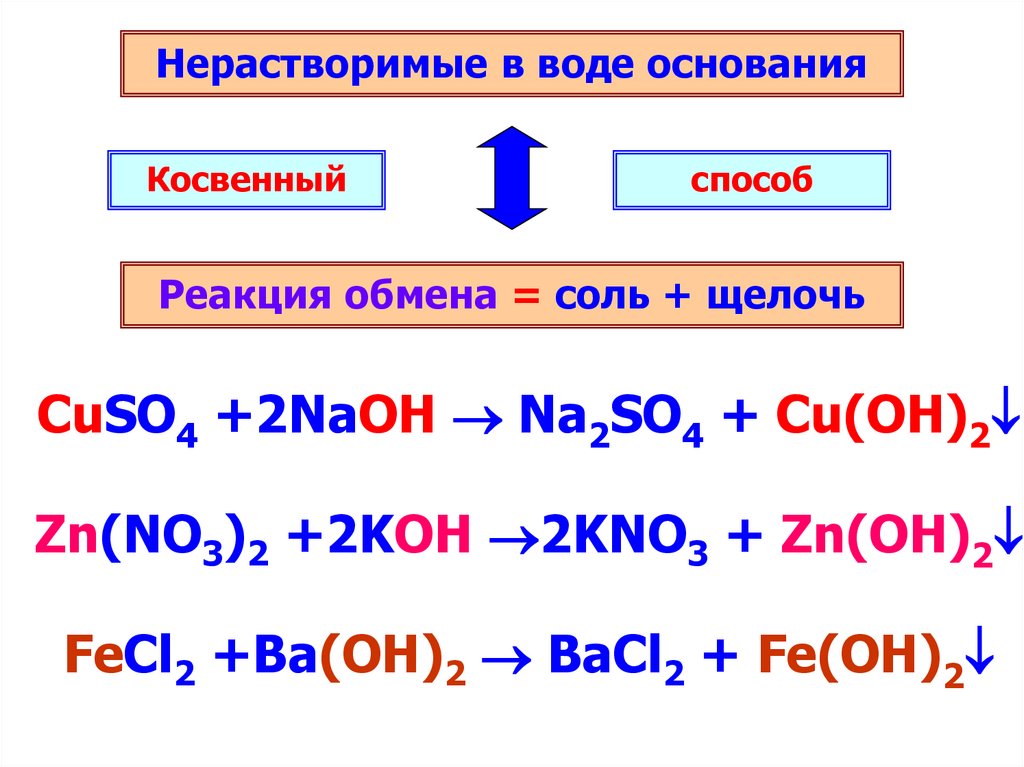
Нерастворимые в воде основанияКосвенный
способ
Реакция обмена = соль + щелочь
CuSO4 +2NaOH Na2SO4 + Cu(OH)2
Zn(NO3)2 +2KOH 2KNO3 + Zn(OH)2
FeCl2 +Ba(OH)2 BaCl2 + Fe(OH)2
11.
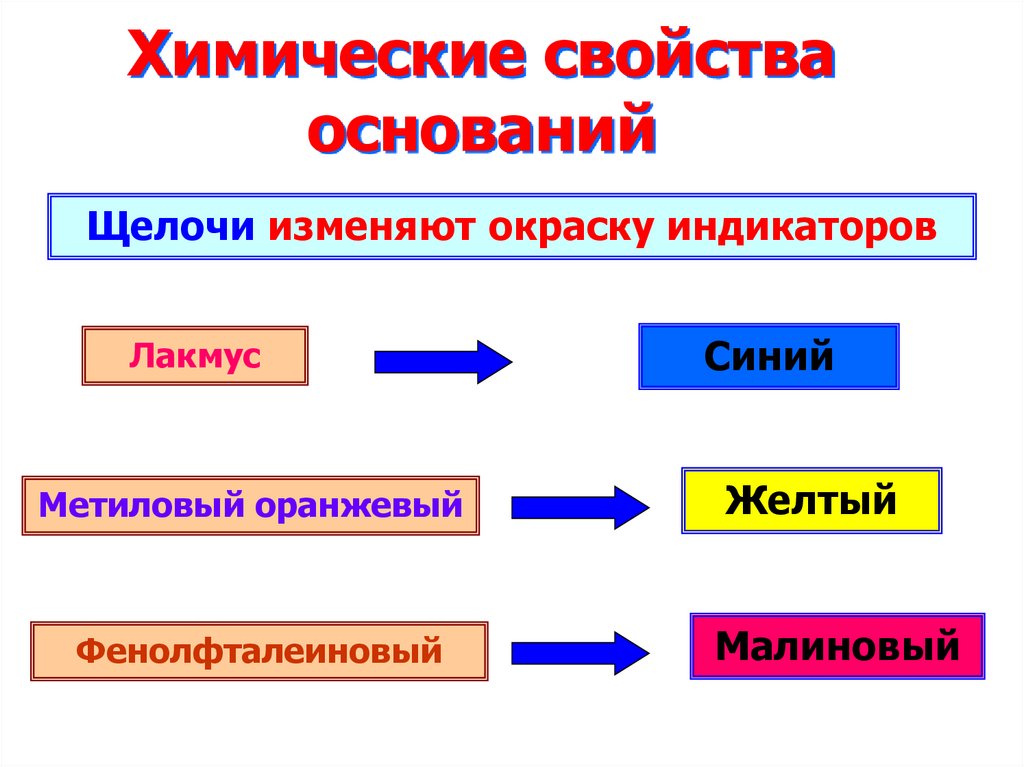
Физкультминутка12. Химические свойства оснований
Щелочи изменяют окраску индикаторовЛакмус
Метиловый оранжевый
Фенолфталеиновый
Синий
Желтый
Малиновый
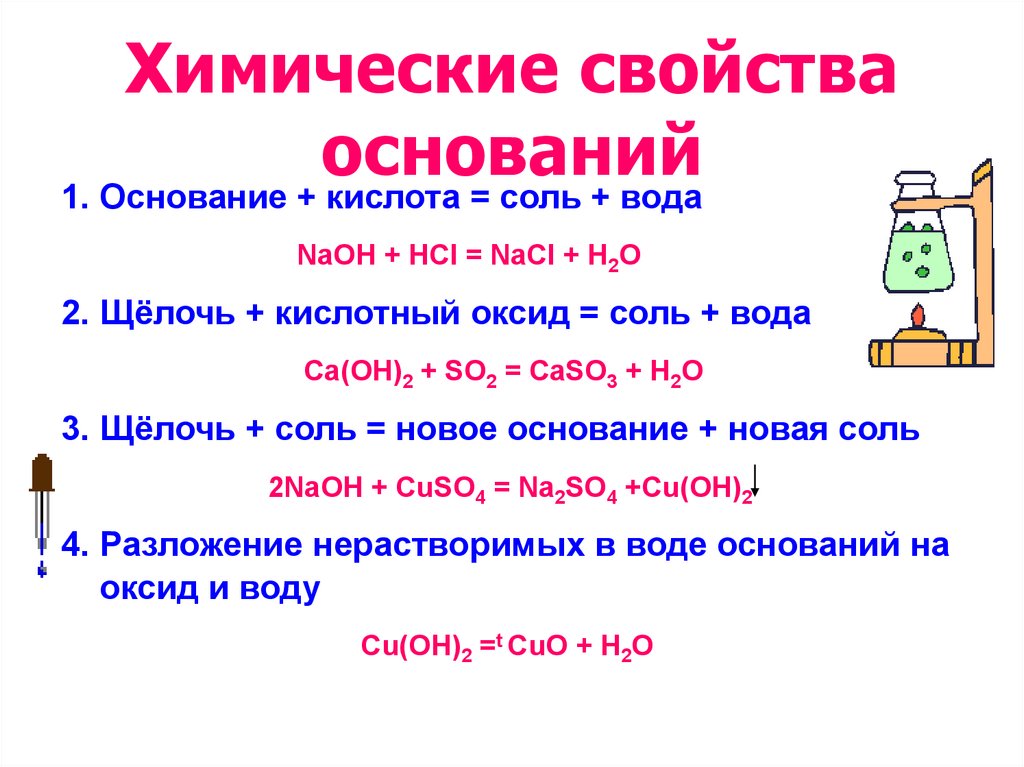
13. Химические свойства оснований
1. Основание + кислота = соль + водаNaOH + HCl = NaCl + H2O
2. Щёлочь + кислотный оксид = соль + вода
Ca(OH)2 + SO2 = CaSO3 + H2O
3. Щёлочь + соль = новое основание + новая соль
2NaOH + CuSO4 = Na2SO4 +Cu(OH)2
4. Разложение нерастворимых в воде оснований на
оксид и воду
Cu(OH)2 =t СuO + H2O
14. Закрепление. Ответы
1. б
2. г
3. а б
4. б г д
5. а б
15. Домашнее задание
• § 39, в 3,5(п)Составьте уравнения реакций, с помощью
которых можно осуществить
превращения
• MgO→MgSO4→Mg(OH)2→MgCI2
16.
Спасибоза внимание!










 Химия
Химия








