Похожие презентации:
Гидроксиды. Основания: способы получения
1. Гидроксиды. Основания: способы получения.
2.
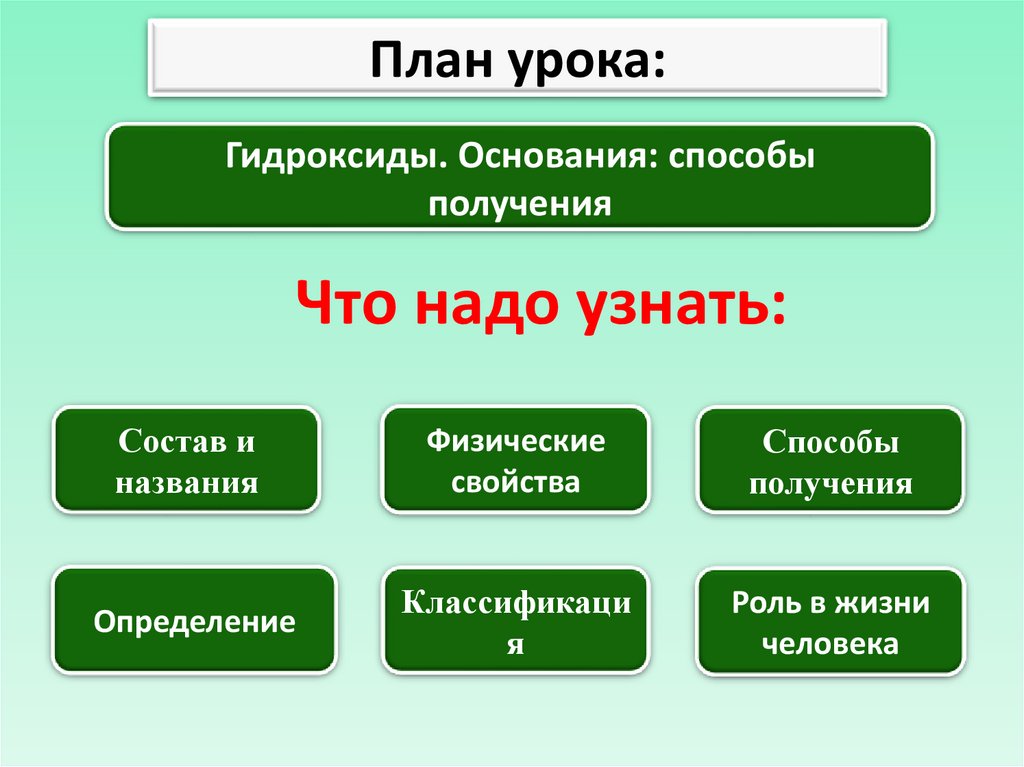
План урока:Гидроксиды. Основания: способы
получения
Что надо узнать:
Состав и
названия
Физические
свойства
Способы
получения
Определение
Классификаци
я
Роль в жизни
человека
3. K2O + H2O → 2KOH
Гидроксиды– это сложные вещества в составкоторых входят атомы металлов и
гидроксогруппы ОН.
!!! Число гидроксогрупп в формуле
гидроксида соответствует валентности металла
Исходя из этого, общую химическую формулу оснований можно изобразить следующим образом:
M(OH)n,
где M — знак металлического химического элемента,
а n — индекс, численно совпадающий с валентностью металла.
4.
Основания - это гидроксиды металлов IА иIIА (кроме Be), а также металлов в
минимальной степени окисления (если она
имеет переменное значение)
• Например: NaOH, LiOH, Mg(OH)2, Ca(OH)2,
Cr(OH)2, Mn(OH)2.
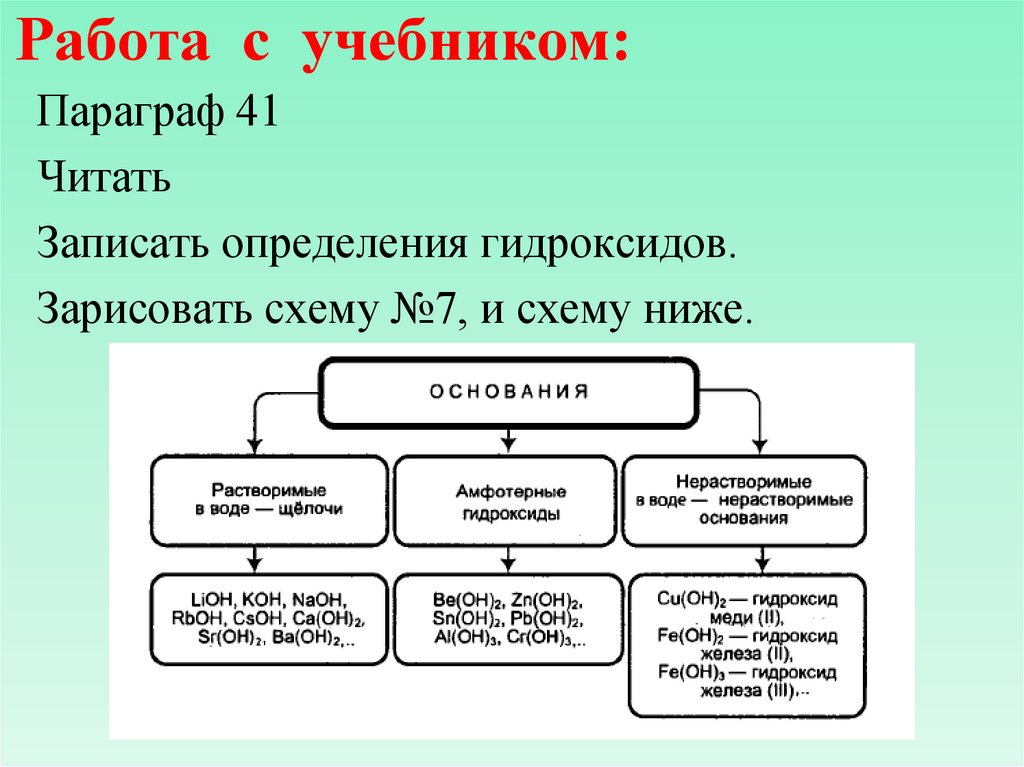
5. Работа с учебником:
Параграф 41Читать
Записать определения гидроксидов.
Зарисовать схему №7, и схему ниже.
6.
7.
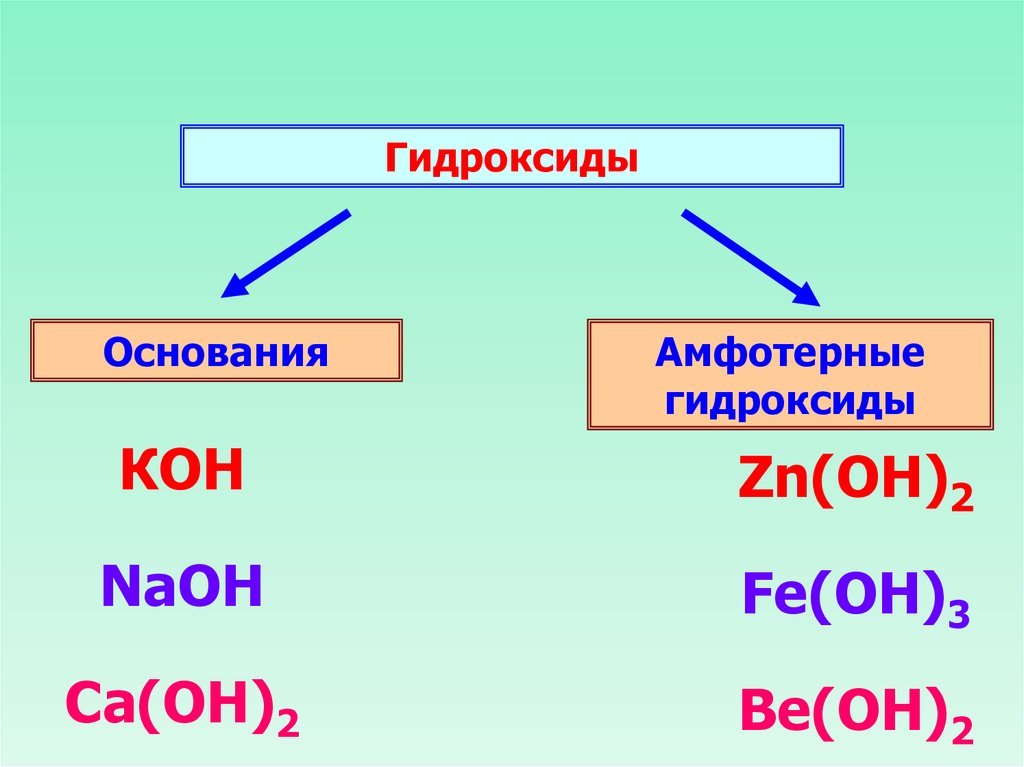
ГидроксидыОснования
Амфотерные
гидроксиды
КОН
Zn(ОН)2
NaOH
Fe(OH)3
Ca(OH)2
Be(OH)2
8.
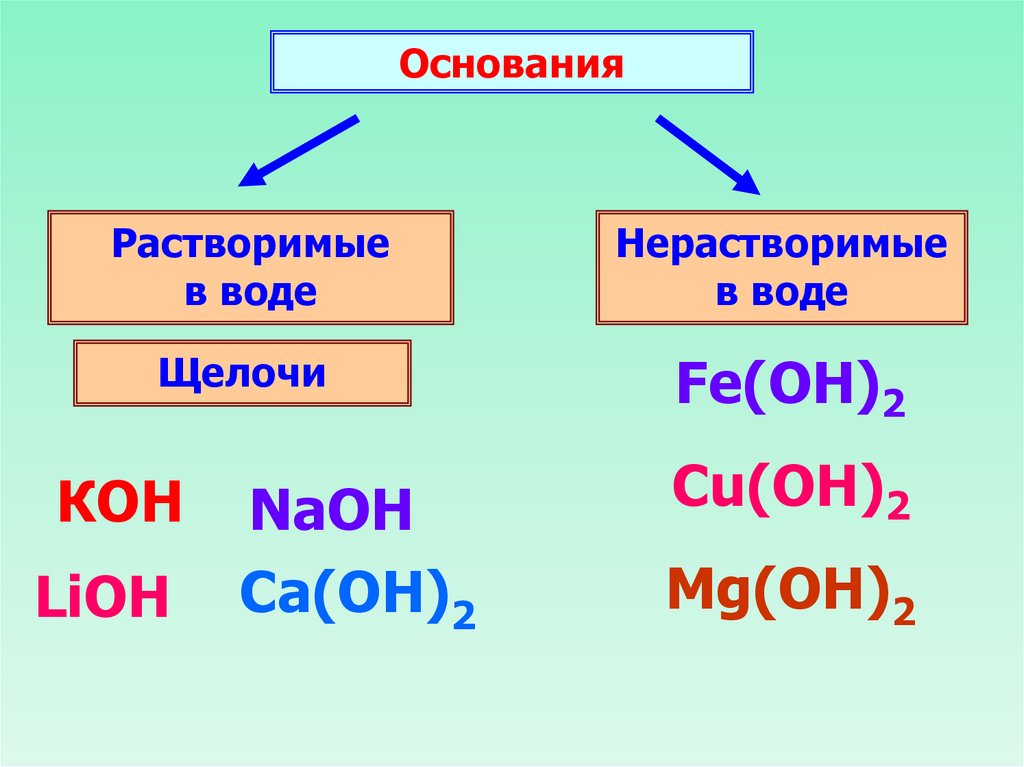
ОснованияРастворимые
в воде
Нерастворимые
в воде
Щелочи
Fe(OH)2
КОН
LiOH
NaOH
Ca(ОН)2
Cu(OH)2
Mg(ОН)2
9. NaOH – гидроксид натрия, едкий натр, каустическая сода
NaOH – гидроксид натрия, едкийкаустическая сода
натр,
10.
• Записать по презентации и учебникустраница 139 получение оснований как
словами так и формулами.
• Выписать физические свойства
оснований (гидроксидов)
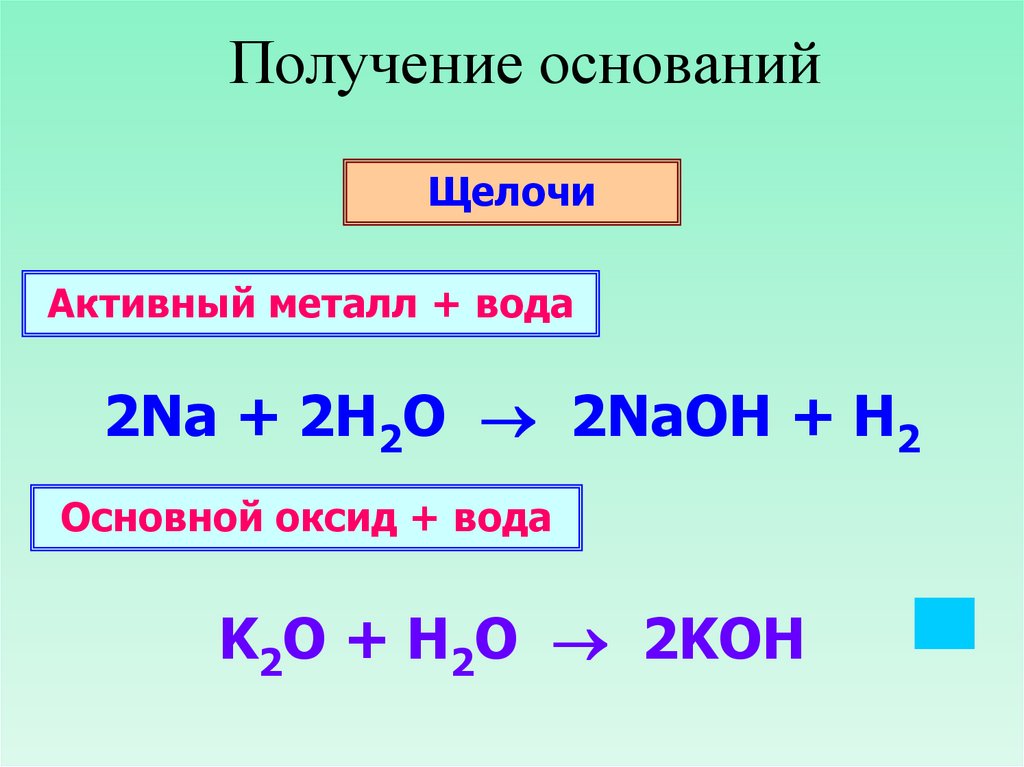
11. Получение оснований
ЩелочиАктивный металл + вода
2Na + 2H2O 2NaOH + H2
Основной оксид + вода
K2O + H2O 2KOH
12. Сильные и слабые основания
Сильные основанияNaOH гидроксид
натрия (едкий натр)
KOH гидроксид калия
(едкое кали)
LiOH гидроксид
лития
Ba(OH)2 гидроксид
бария
Ca(OH)2 гидроксид
кальция
Слабые основания
Mg(OH)2 гидроксид
магния
Fe(OH)2 гидроксид
железа (II)
Zn(OH)2 гидроксид
цинка
NH4OH гидроксид
аммония
Fe(OH)3 гидроксид
железа (III)








 Химия
Химия








