Похожие презентации:
Кінетичні закономірності перебігу біохімічних процесів. Каталіз
1.
КІНЕТИЧНІЗАКОНОМІРНОСТІ
ПЕРЕБІГУ БІОХІМІЧНИХ
ПРОЦЕСІВ. КАТАЛІЗ.
Лектор проф. Фіра
Л.С.
2.
Кінетика – вчення про швидкості та механізми хімічнихреакцій.
концентрації
природи
реагуючих
речовин
наявності
каталізаторів
температури
Швидкість
реакції
залежить
тиску
3.
В залежності від того в одній чи вдекількох фазах знаходяться
компоненти реакції розрізняють
кінетику гомогенних та гетерогенних
реакцій.
За механізмом реакції поділяються на
прості і складні.
Основним поняттям хімічної кінетики
є швидкість реакції, що визначається
кількістю речовини, яка прореагувала
за одиницю часу в одиниці об‘єму
4.
Вплив концентрації реагуючих речовин на швидкістьхімічної реакції визначається основним постулатом
кінетики: швидкість реакції прямо пропорційна
концентрації реагуючих речовин.
Для процесу А↔С швидкість
реакції можна виразити:
dC A
V
kCA
dt
5.
Для процесу А + 2В ↔ Сшвидкість реакції виражається добутком концентрації
реагуючих речовин, піднятих до ступеня, показники
яких рівні стехіометричним коефіцієнтам відповідних
речовин
V = k∙[A] ∙ [B]2
6.
Закон діючих масаА + bB ↔ cC + dD
c
d
k1
C D
kp
a
b
k2
A B
Величина К- коефіцієнт пропорційності між швидкістю та
концентрацією (називається константою швидкості реакції).
Вона чисельно дорівнює швидкості реакції, якщо концентрація
відповідних речовин дорівнює одиниці.
7.
Константа швидкості – це швидкість реакції за умови,що концентрації реагуючих речовин дорівнюють
1 моль/л
Величина Kp залежить від
Температури
Природи реагуючих речовин
8.
Рівняння, що пов‘язує швидкість реакції з концентраціямиреагентів, називають рівнянням швидкості або кінетичним
рівнянням реакції
Утворення продуктів у хімічній реакції відбувається через
ряд проміжних стадій (послідовних чи паралельних). Кожна з
цих реакцій описується своїм кінетичним рівнянням. В таких
випадках залежність швидкості від концентрації може бути
дуже складною. Розв‘язання цієї проблеми спрощується,
коли одна із цих стадій протікає набагато повільніше.
Швидкість складної реакції визначається
щвидкістю найповільнішої (лімітуючої)
елементарної стадії
9.
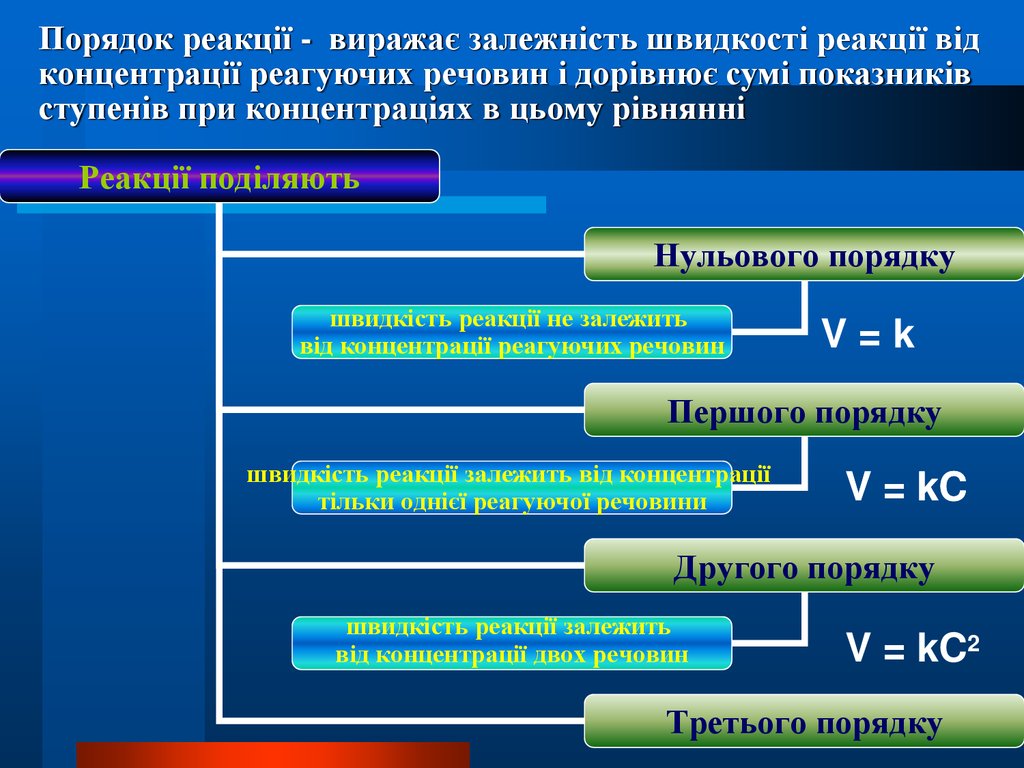
Порядок реакції - виражає залежність швидкості реакції відконцентрації реагуючих речовин і дорівнює сумі показників
ступенів при концентраціях в цьому рівнянні
Реакції поділяють
Нульового порядку
швидкість реакції не залежить
від концентрації реагуючих речовин
V=k
Першого порядку
швидкість реакції залежить від концентрації
тільки однієї реагуючої речовини
V = kC
Другого порядку
швидкість реакції залежить
від концентрації двох речовин
V = kC2
Третього порядку
10.
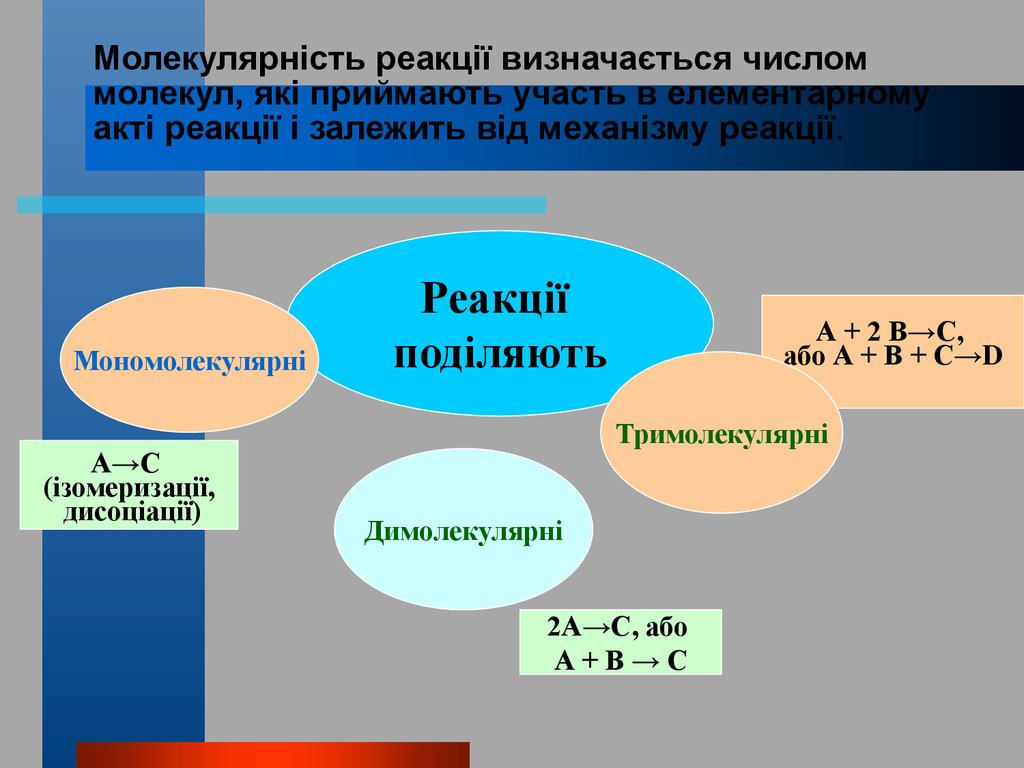
Молекулярність реакції визначається числоммолекул, які приймають участь в елементарному
акті реакції і залежить від механізму реакції.
Мономолекулярні
А→С
(ізомеризації,
дисоціації)
Реакції
поділяють
А + 2 В→С,
або А + В + С→D
Тримолекулярні
Димолекулярні
2А→С, або
А+В→С
11.
Правило Вант-ГоффаШвидкість хімічної реакції зростає в 2-4
рази при підвищені температури на 10 °С
де Vt2 і Vt1 – швидкості реакції за
температур t2 і t1 відповідно;
γ — температурний коефіцієнт реакції.
12.
Теорія хімічної кінетики будується на основі уявлень проактивні молекули. Для теоретичних розрахунків констант
швидкостей використовують два методи: а) метод активних
співударів; б) метод перехідного стану. Для початку хімічної
реакції реагенти повинні мати певний запас енергії. Ця
енергія Еа називається енергією активації, тобто це енергія,
яку повинні мати молекули, що зіштовхуються, щоб
зіткнення привело до хімічного перетворення.
13.
Енергія активації молекул може зменшуватись під дієютемператури, променевої енергії, каталізаторів і проявляється
по-різному: вони можуть проявляти велику швидкість руху,
підвищену енергію коливання атомів в молекулі
14.
Рівняння АрреніусаВстановлює зв’язок між
константою
швидкості
реакції
Енергією
активації
Температурою
15.
Теорія активного комплексу: умовою протікання реакції є утвореннянестійкого проміжного комплексу у результаті перерозподілу зв‘язків
між реагуючими молекулами. Утворення проміжного комплексу
вимагає певної енергії активації, розпад його проходить
самовільно. Тому швидкість реакції рівна числу активних
комплексів, що проходять за одиницю часу через енергетичний бар‘єр
в напрямку ходу реакції.
Для ендотермічної реакції енергія продуктів реакції більша, ніж енергія
вихідних речовин, для екзотермічної, навпаки, енергія продуктів
менша за енергію вихідних речовин.
16.
Каталіз – зміна швидкостіреакції з допомогою
каталізаторів, які беручи
участь у процесі, до кінця
реакції залишаються не
змінними
Аутокаталітичний процес – процес, при
якому хоча б один з продуктів реакції
проявляє каталітичну дію.
Розрізняють каталіз:
➢Гомогенний
➢Гетерогенний
17.
Каталізатори невпливають на величину
константи рівноваги
Речовини, що підсилюють дію
каталізатора називаються
промоторами, ті що пригнічують –
отрутами або інгібіторами.
Каталізатори дуже
чутливі до наявності
сторонніх речовин.
Спільні особливості
для гомо- та гетерогенного
каталізів
Більшість каталізаторів
проявляють селективність
(вибірковість)
Кожний каталізатор,
особливо інтенсивно
прискорює одну яку-небудь
реакцію або групу
реакцій певного типу
Каталізатори в кінці
реакції зберігають свій
склад та кількість
незмінними
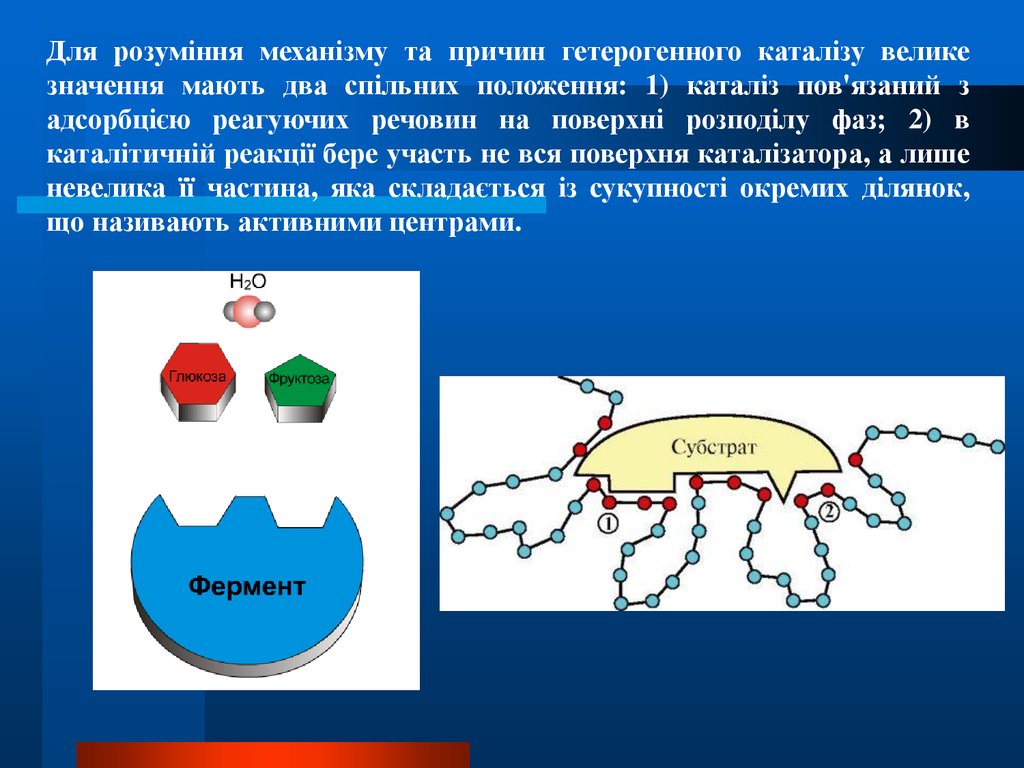
18.
Для розуміння механізму та причин гетерогенного каталізу великезначення мають два спільних положення: 1) каталіз пов'язаний з
адсорбцією реагуючих речовин на поверхні розподілу фаз; 2) в
каталітичній реакції бере участь не вся поверхня каталізатора, а лише
невелика її частина, яка складається із сукупності окремих ділянок,
що називають активними центрами.
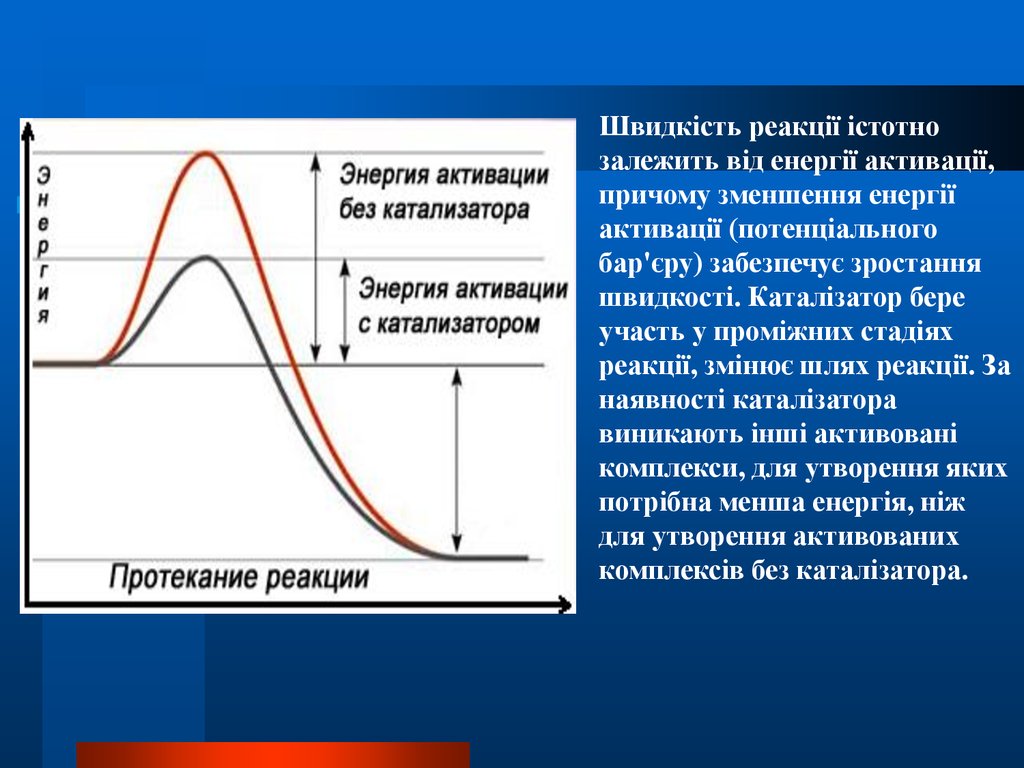
19.
Швидкість реакції істотнозалежить від енергії активації,
причому зменшення енергії
активації (потенціального
бар'єру) забезпечує зростання
швидкості. Каталізатор бере
участь у проміжних стадіях
реакції, змінює шлях реакції. За
наявності каталізатора
виникають інші активовані
комплекси, для утворення яких
потрібна менша енергія, ніж
для утворення активованих
комплексів без каталізатора.
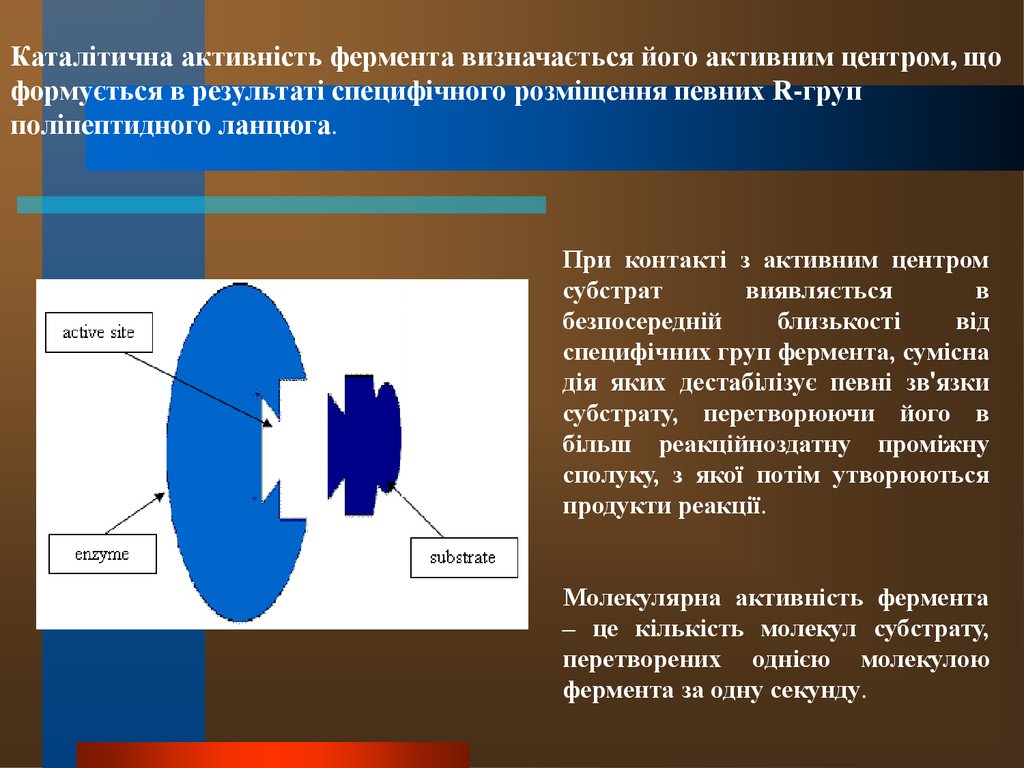
20.
Каталітична активність фермента визначається його активним центром, щоформується в результаті специфічного розміщення певних R-груп
поліпептидного ланцюга.
При контакті з активним центром
субстрат
виявляється
в
безпосередній
близькості
від
специфічних груп фермента, сумісна
дія яких дестабілізує певні зв'язки
субстрату, перетворюючи його в
більш реакційноздатну проміжну
сполуку, з якої потім утворюються
продукти реакції.
Молекулярна активність фермента
– це кількість молекул субстрату,
перетворених однією молекулою
фермента за одну секунду.
21.
Просторова структура активного центру передбачає не тільки вибірсубстрату, будова якого комплементарна цьому центру за типом
"замок-ключ", але і природу наступних перетворень, що призводять
до утворення відповідного продукта.
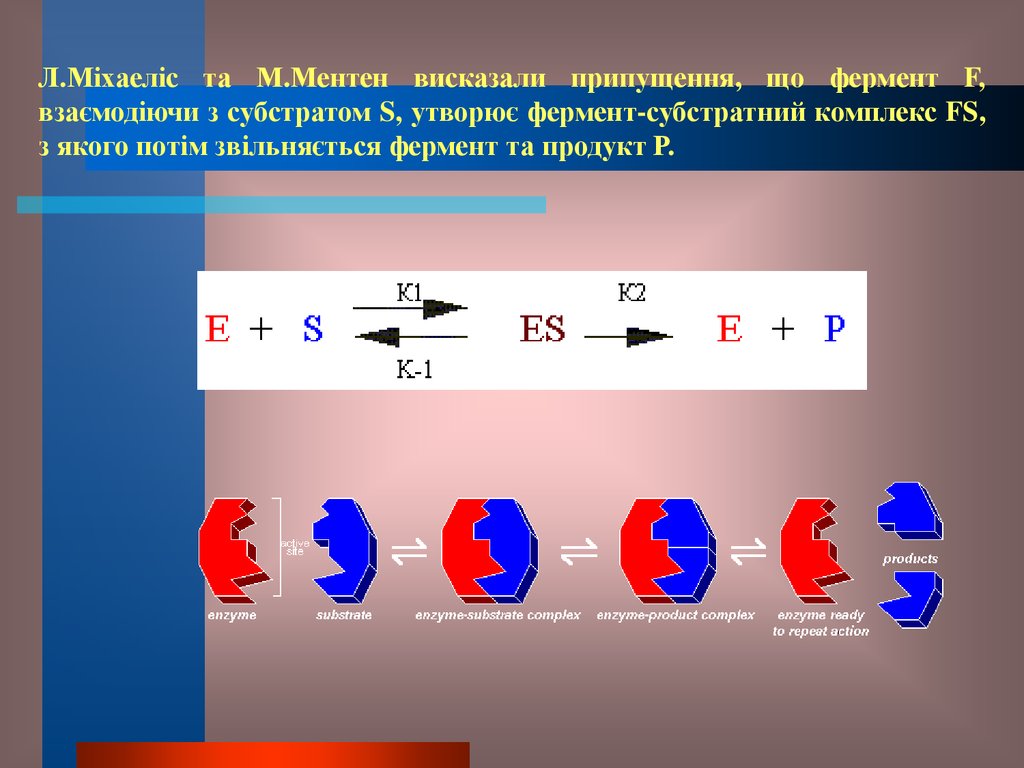
22.
Л.Міхаеліс та М.Ментен висказали припущення, що фермент F,взаємодіючи з субстратом S, утворює фермент-субстратний комплекс FS,
з якого потім звільняється фермент та продукт Р.
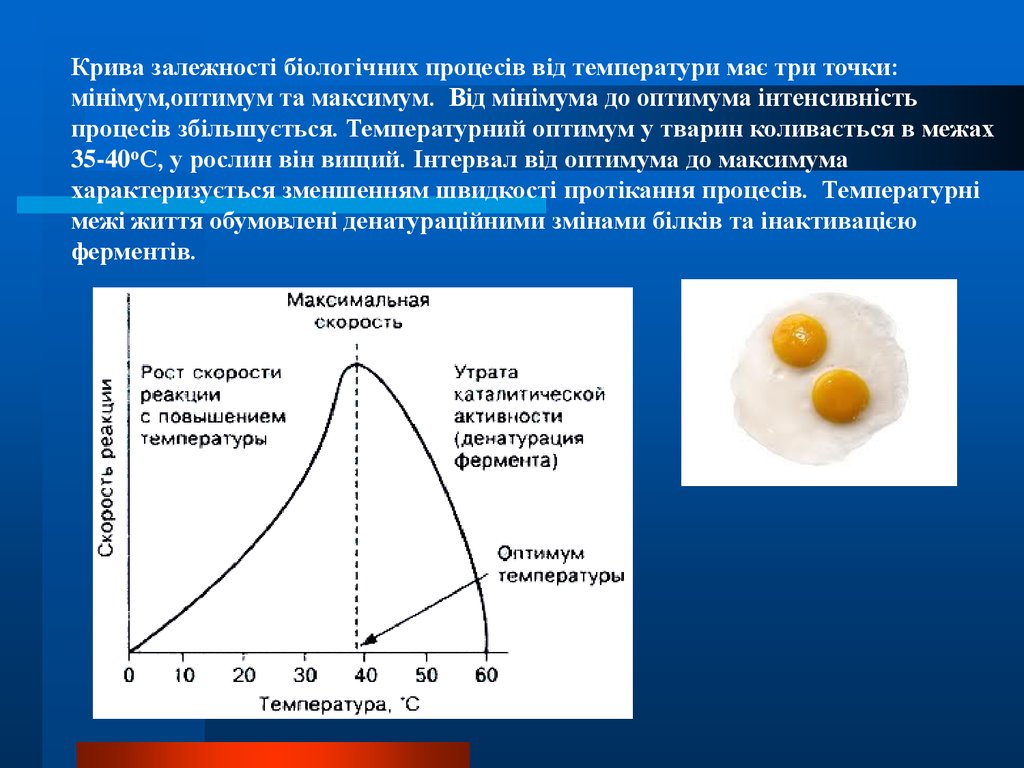
23.
Крива залежності біологічних процесів від температури має три точки:мінімум,оптимум та максимум. Від мінімума до оптимума інтенсивність
процесів збільшується. Температурний оптимум у тварин коливається в межах
35-40оС, у рослин він вищий. Інтервал від оптимума до максимума
характеризується зменшенням швидкості протікання процесів. Температурні
межі життя обумовлені денатураційними змінами білків та інактивацією
ферментів.
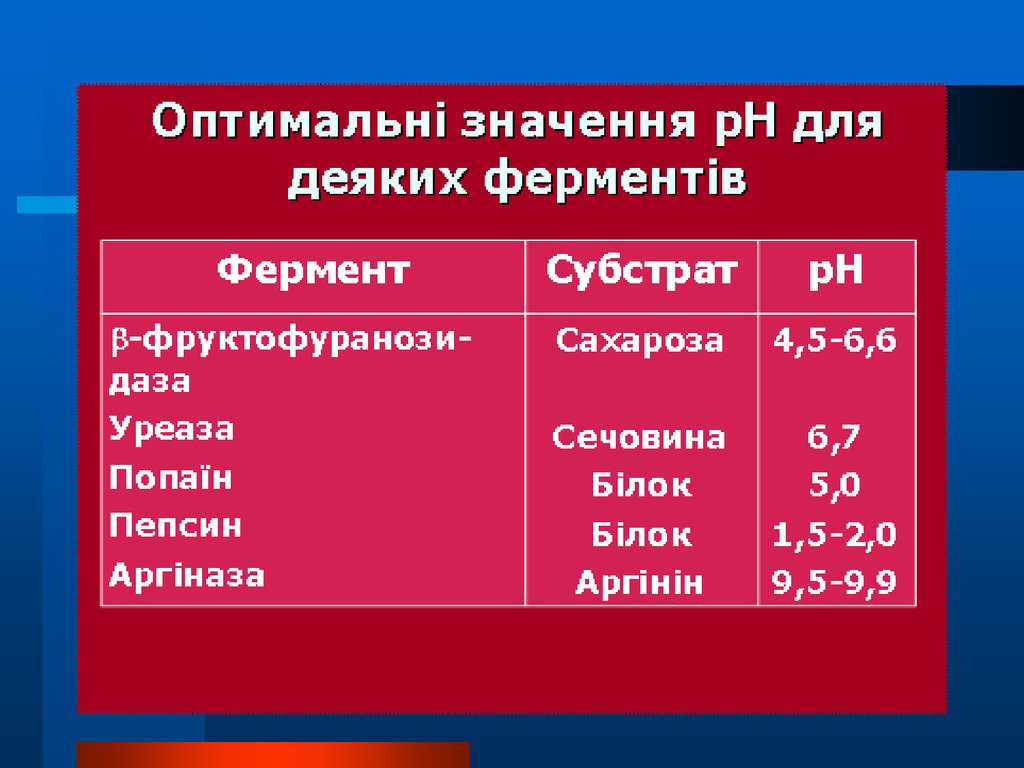
24.
Для кожного ферменту існує певнезначення рН, при якому його активність
оптимальна. Значення оптимуму рН
різне у різних ферментів, наприклад,
для пепсину це кисле середовище, для
лужної фосфатази – лужне. При
проведенні досліджень з використанням
ферментів
необхідно
підтримувати
постійне значення рН з допомогою
відповідних буферних розчинів.
25.
26.
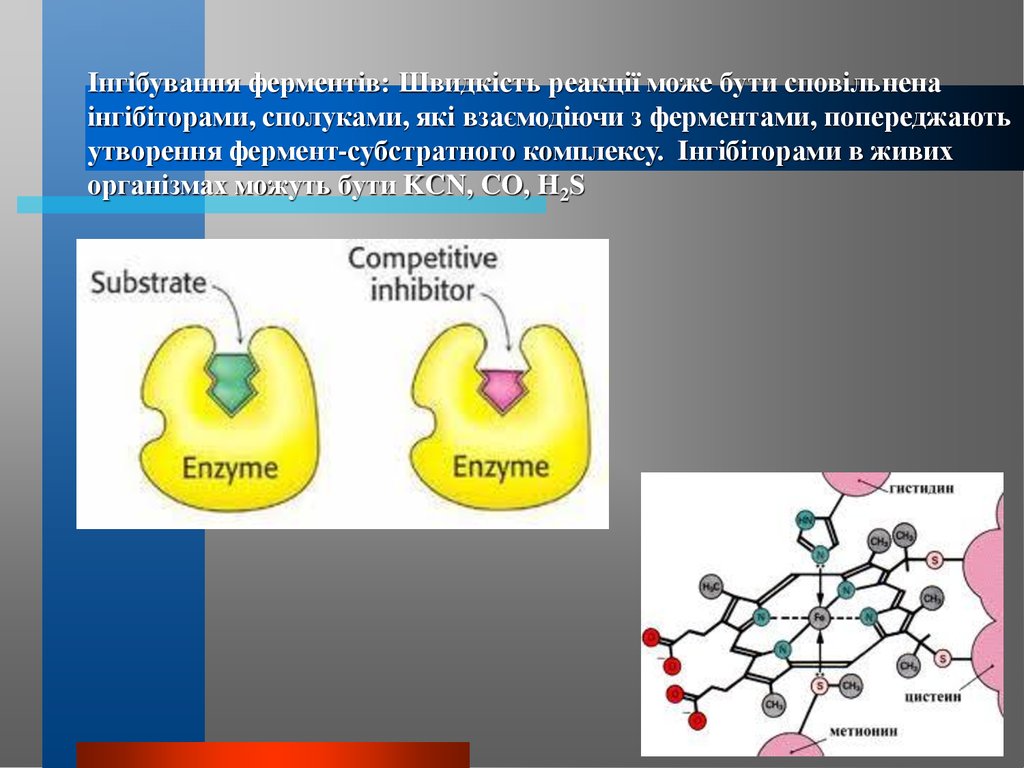
Інгібування ферментів: Швидкість реакції може бути сповільненаінгібіторами, сполуками, які взаємодіючи з ферментами, попереджають
утворення фермент-субстратного комплексу. Інгібіторами в живих
організмах можуть бути KCN, CO, H2S
27.
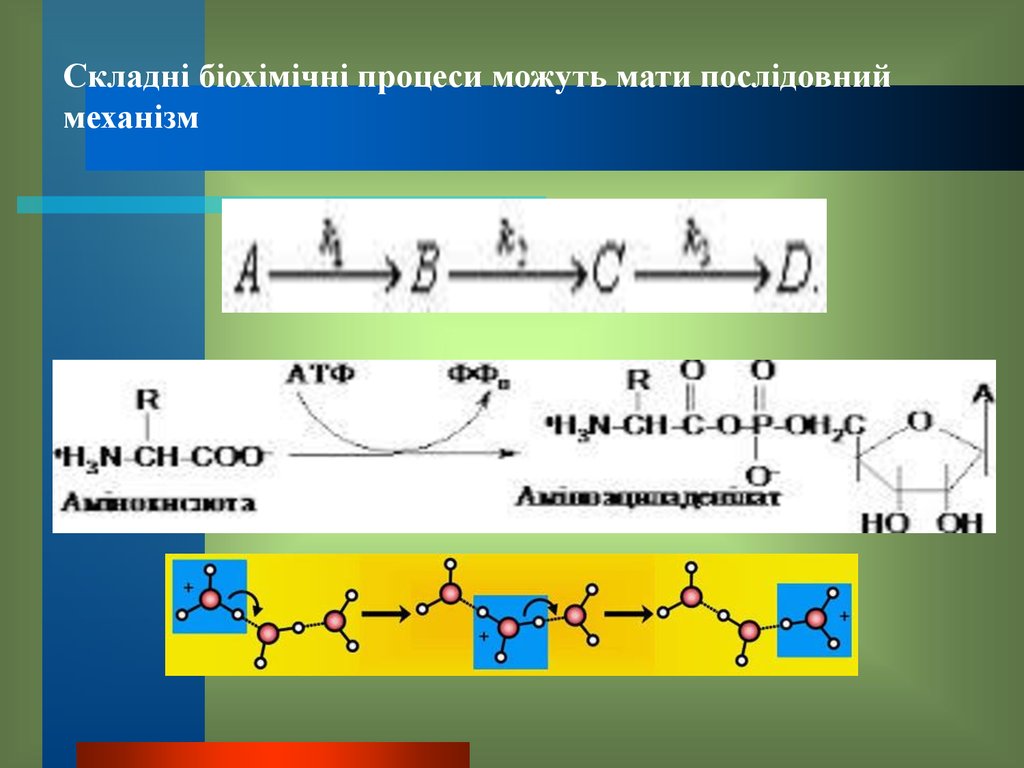
Складні біохімічні процеси можуть мати послідовниймеханізм















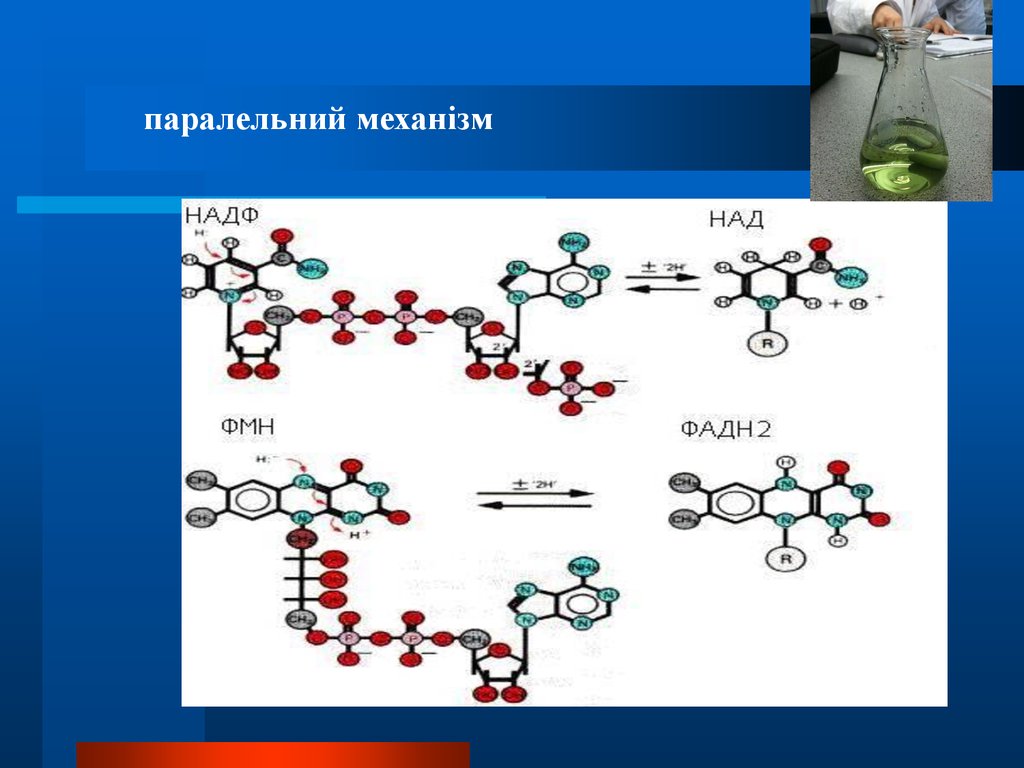
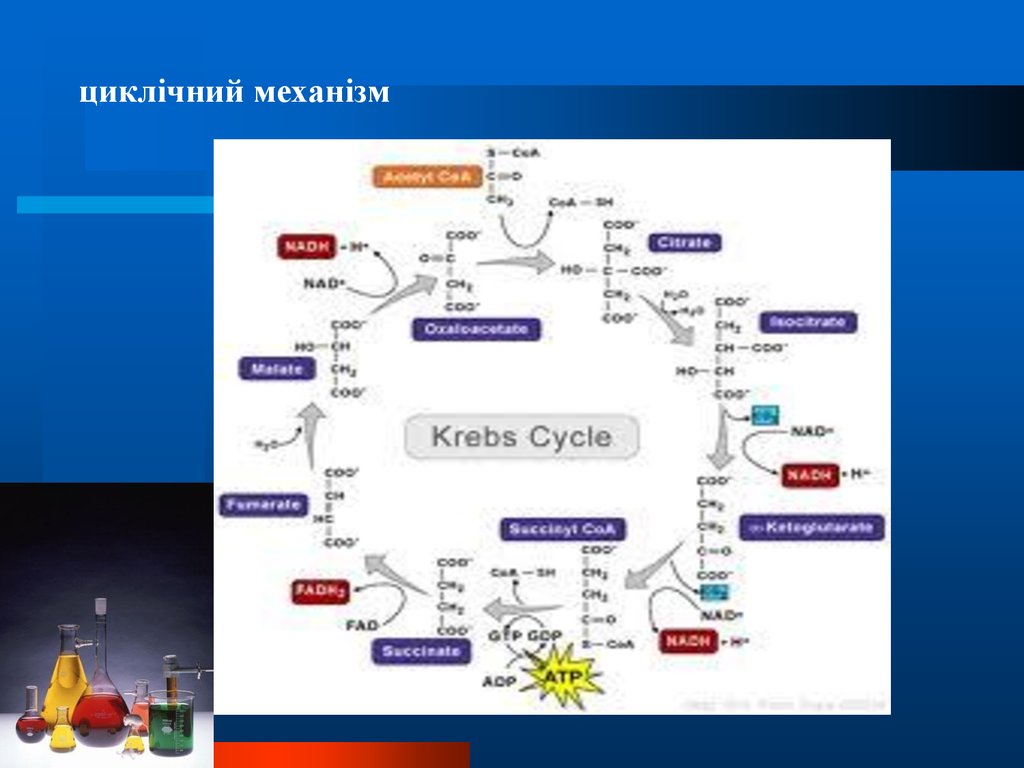

 Химия
Химия








