Похожие презентации:
Хімічна кінетика
1. ЛЕКЦІЯ № 5 ХІМІЧНА КІНЕТИКА
2. План:
1. Предмет і значення хімічної кінетики.2. Вплив факторів на швидкість хімічної
реакції.
3. Порядок реакції
4. Каталіз.
5. Теорія активних комплексів
6. Ферментативний каталіз
3.
КІНЕТИКА - це розділ хімії,який вивчає швидкість
хімічних реакцій і їх
залежність від різних
факторів.
4.
ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ- показує зміну концентрації
реагуючих речовин (С) за
одиницю часу (τ) в одиниці
об’єму:
С 1 С 2 C
2 1
[моль/літр*сек]
5. На швидкість гомогенних (однорідних) хімічних реакцій впливають:
природа реагуючих речовин;
концентрація реагентів;
температура;
тиск;
природа розчинника;
наявність каталізатора.
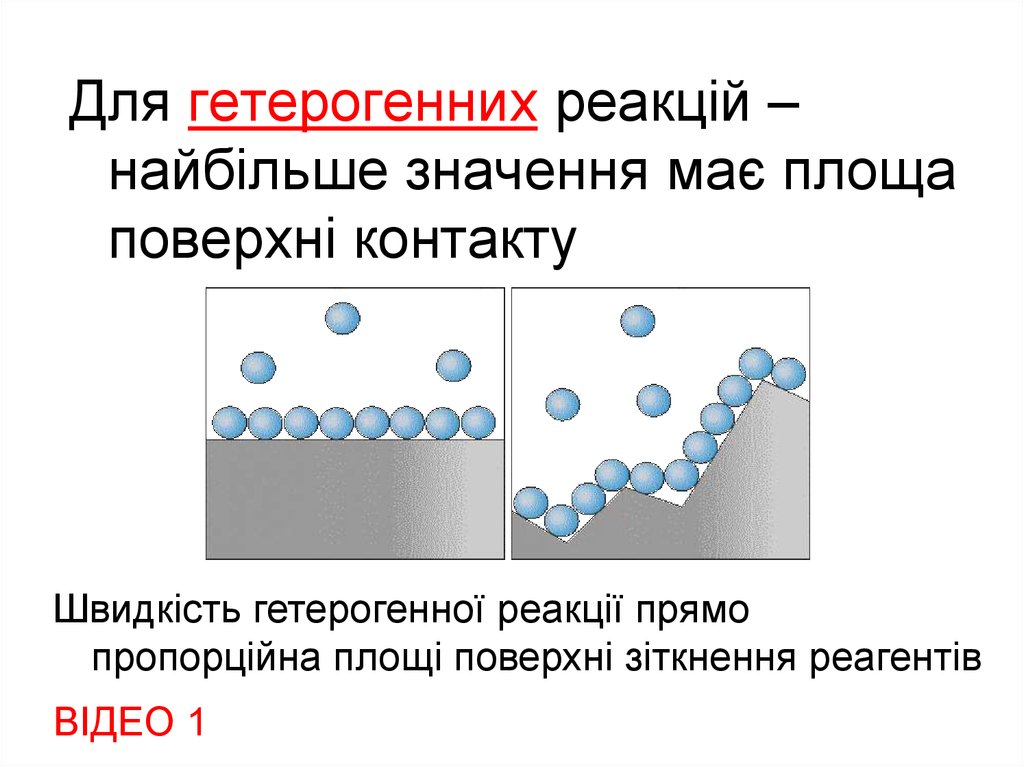
6.
Для гетерогенних реакцій –найбільше значення має площа
поверхні контакту
Швидкість гетерогенної реакції прямо
пропорційна площі поверхні зіткнення реагентів
ВІДЕО 1
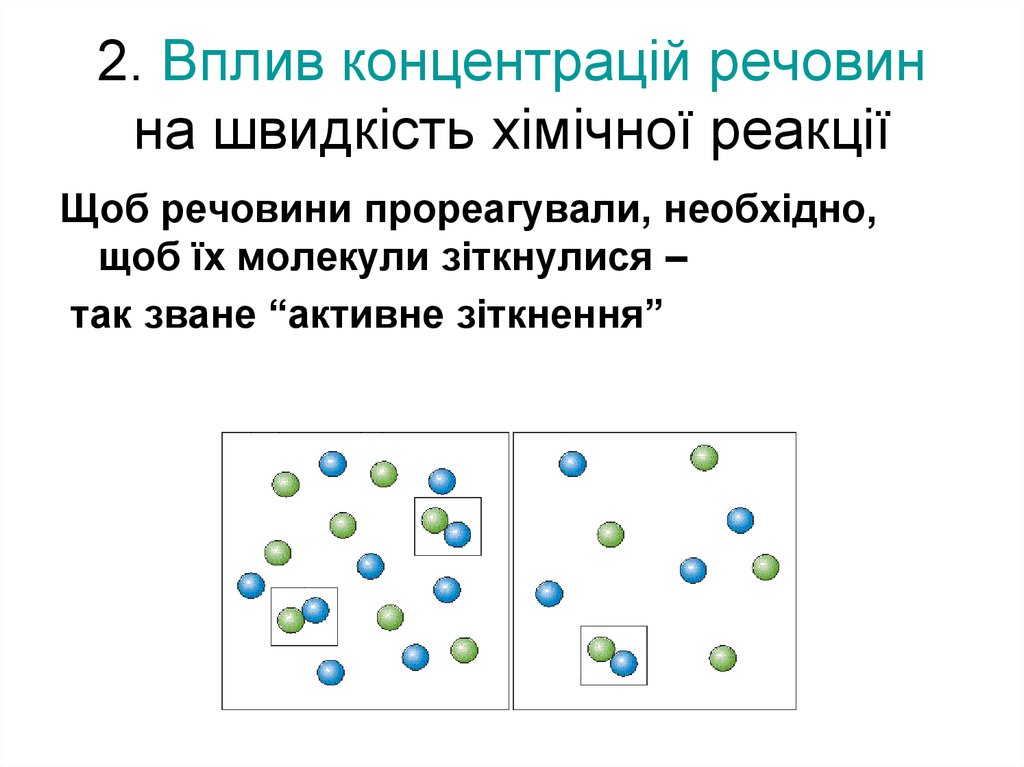
7. 2. Вплив концентрацій речовин на швидкість хімічної реакції
Щоб речовини прореагували, необхідно,щоб їх молекули зіткнулися –
так зване “активне зіткнення”
8. У середині XIX ст. (1865 р. - М. М. Бекетов, 1867 р. - К. Гульдберг, П. Вааге) був сформульований закон діючих мас:
aA + bB cC +dDпр.=k1[A]a•[B]b
зв.=k2[C]c• [D]d
При постійній температурі
швидкість хімічної реакції
прямопропорціональна діючим масам молярним концентраціям реагуючих
речовин, взятих в ступені відповідного
стехіометричного коефіцієнту
9. k1 і k2 - це константи швидкості відповідно прямої і зворотної реакції (вони є сталими для даної реакції при даній температурі)
Фізичний зміст констант відображаєприроду реагуючих речовин, а числове
значення їх відповідає швидкості
реакції, коли концентрація кожного із
вихідних речовин рівна 1 моль/л.
пр.=k1
Відео 2
зв.=k2
10. Вплив природи реагентів на швидкість хімічної реакції
Константа швидкості реакції залежить в першу чергувід природи реагуючих речовин
Під "природою реагуючих речовин" розуміють:
1. Для речовин молекулярної будови - тип хімічних зв'язків у
молекулах реагентів, міцність зв'язків. Щоб молекула
прореагувала, зв'язок в ній необхідно розірвати.
2. Для речовин немолекулярное будови (іонний або атомний
кристал) - будова кристалічної решітки, її міцність.
3. Для речовин, у яких "молекула" складається з одного атома
(наприклад, метали, благородні гази) - будова електронної
оболонки атома, міцність зв'язування зовнішніх електронів.
Відео 3_4
11. Вплив температури на швидкість хімічної реакції
збільшення хаотичості руху молекул приводить дозбільшення кількості зіткнень
Правило Вант-Гоффа
• при підвищенні температури реакції на кожні
10°С швидкість реакції зростає в 2- 4 рази
Для біосистем використовують γ2, γ3, γ5
γ= 7-10 (оскільки температура=36,6-42°С)
відео 5?
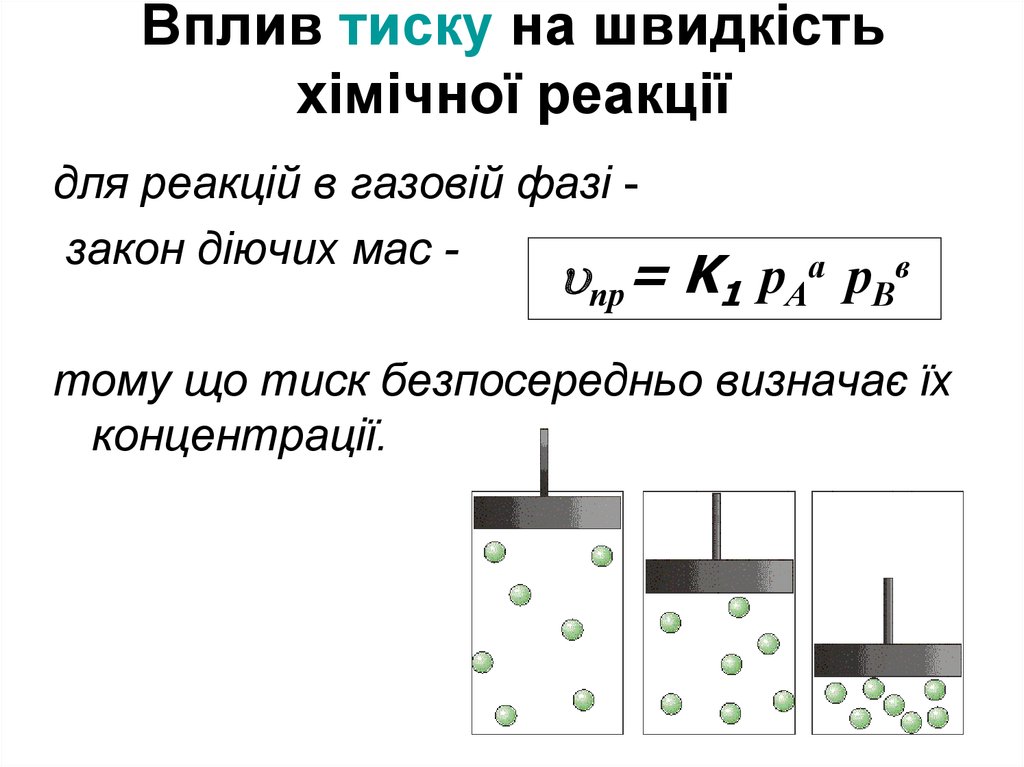
12. Вплив тиску на швидкість хімічної реакції
для реакцій в газовій фазі закон діючих мас -пр= K1 рАа рВв
тому що тиск безпосередньо визначає їх
концентрації.
13. Вплив розчинника на швидкість хімічної реакції
розчинник має значення тількидля рідкофазних реакцій.
14. 3. Молекулярність і порядок реакції
Мономолекулярна реакція - приймаєучасть тільки одна молекула (розклад)
Ca(HCO3)2 CaCO3 + H2O + CO2
Бімолекулярна реакція - приймає участь
дві молекули
J2 + H2 2HJ
• Тримолекулярна реакція – одночасна
взаємодія трьох молекул
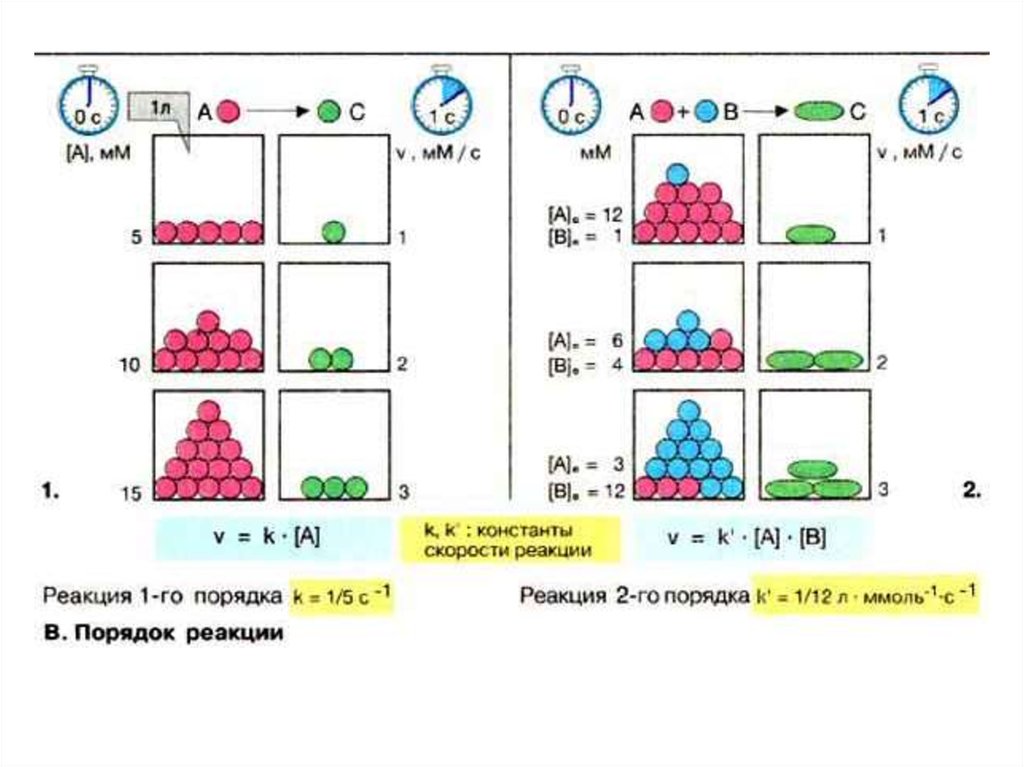
15. ПОРЯДОК РЕАКЦІЇ - число, що рівне сумі показників, що відповідають стехіометричним коефіцієнтам в рівнянні швидкості
aA + bB = cC + dDде пр.=k1[A]a*[B]b
і зв.=k2[C]c*[D]d
n1 = a + b
і
n2 = c + d
нульовий порядок реакції k * c0
• Нап, для реакції нульового порядку
швидкість реакції не залежить від концентрації реагента
k * c0
c0 = 1
• В реакції першого порядку можуть приймати участь
два компоненти, але швидкість реакції залежить тільки
від одного з них – того, якого є менше.
1
k*c
16.
17. Порядок реакції визначають:
1) по графіку залежності концентраціїреагенту від часу;
2) методом підстановки;
3) методом періоду напівперетворень.
18. 4. Вплив каталізатора на швидкість хімічної реакції
КАТАЛІЗАТОРИ –це речовини, якізбільшують швидкість хімічної реакції.
ІНГІБІТОРИ - це речовини які сповільнюють
реакцію.
Вони не беруть безпосередю участі у
реакції і залишаються незмінними
результаті реакції.
19. У хімічну взаємодію вступають тільки молекули з достатньо високим рівнем кінетичної енергії, які називають активними або
реакційноздатнимирівняння Арреніуса:
K=Aе-Еа/RT
K - константа швидкості реакції моль/л*с
А - предекспоненціяльний множник, K, коли всі
молекули активні.
Еа - енергія активації Дж/моль.
R - універсальна газова постійна 8,314 Дж/моль*К.
T - абсолютна температура.
е - основа натурального логарифму.
*
20. ЕНЕРГІЯ АКТИВАЦІЇ (Еа) – це мінімальна енергія, яку повинні мати молекули, щоб їх зіткнення призвело до елементрного акту
ЯкщоЕак 20 кДж/моль - реакція проходить при
температурі до 50 °С
Еак 120 кДж/моль, то t 250 ° C.
ЕНЕРГІЯ АКТИВАЦІЇ (Еа) – це
мінімальна енергія, яку повинні
мати молекули, щоб їх зіткнення
призвело до елементрного акту
взаємодії
21.
22. 5. Теорія “активних комплексів” Каталізаторами називають речовини, які допомагають знижувати енергію активації.
А+В АВЕ1
А+К АК
Е2
АК+В АВ+К
Е3
Е2+Е3 Е1
Де АК – активний
комплекс
некаталітичні реакції
Каталітичні
ферментативні реакції
Еа=45-30 ккал/моль
Е=30-16 ккал/моль
Е=12-8 ккал/моль
23. 6. Ферментативний каталіз
ФЕРМЕ́ НТИ або ензи́ми — органічнікаталізатори білкової або РНК
природи.
Поділяються на:
- прості (тільки білки);
- ко-ферменти (крім білків можуть мати й інші
компоненти, нап. Катіони d-елементів)
Ферменти — це високоефективні катализатори.
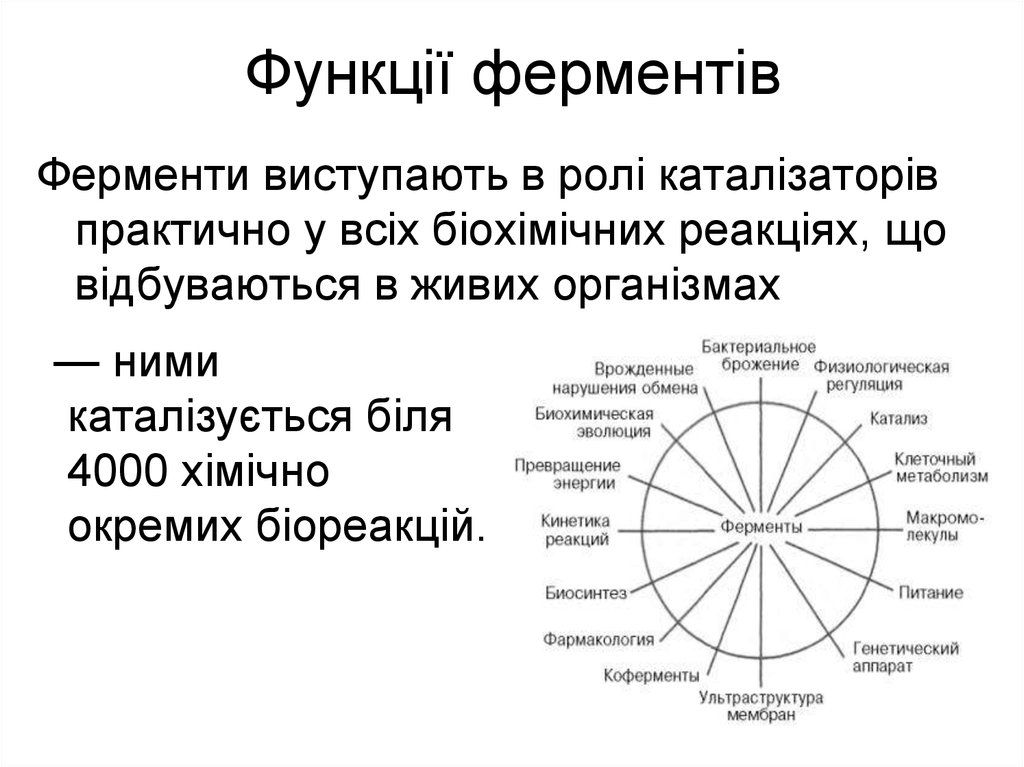
24. Функції ферментів
Ферменти виступають в ролі каталізаторівпрактично у всіх біохімічних реакціях, що
відбуваються в живих організмах
— ними
каталізується біля
4000 хімічно
окремих біореакцій.
25.
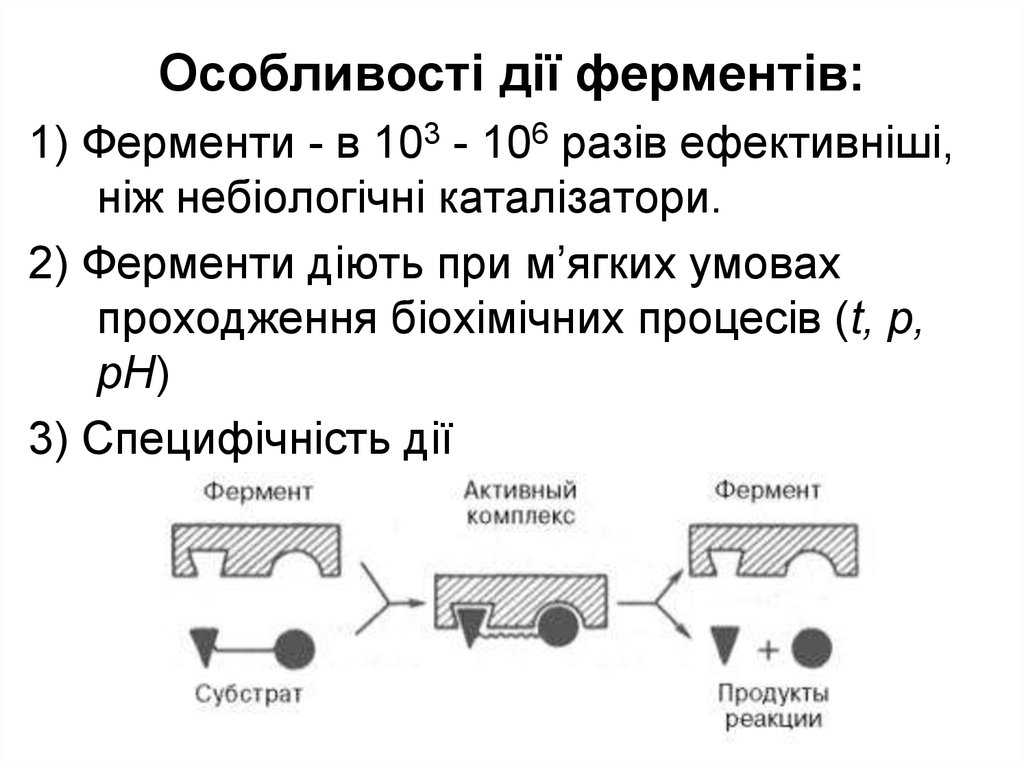
Особливості дії ферментів:1) Ферменти - в 103 - 106 разів ефективніші,
ніж небіологічні каталізатори.
2) Ферменти діють при м’ягких умовах
проходження біохімічних процесів (t, p,
pH)
3) Специфічність дії
26. 4) Швидкість біохімічних реакцій залежать як від концентрації реагуючих речовин (субстрата - S) і від концентрації ферменту (Е)
k1Е +S ЕS
k2
Е – фермент (ензим)
S – субстрат
ЕS – фермент
субстратний
комплекс
[ K ] [S ] k 2
KS
[ ES ]
k1
Де KS - константа
дисоціації
27. Для дальшого протікання реакції:
k1k3
km
Е +S ЕS → ... → Е + Р
k2
де Р - продукт реакції
k1 - константа швидкості утворення
комплексу;
k2 - константа швидкості розпаду
комплексу;
k3- константа швидкості переходу
комплексу в продукт реакції і фермент.
28. Рівняння Міхаеліса-Ментен:
k1 = [E]·[S] = k2·[ES] = (k2 + k3) · [ES]k 3 E0 S
3
K м S
Константу К3 називають числом обертів
ферменту.
max S
νmax = K3 · [E0]
3
K м S
де Кm - константа Міхаеліса
29.
k 2 k3Km
k1
Де k2 – константа розпаду
k3 – константа утворення
• Кm -знаходиться експериментально
V max
K m
2
30.
Рівняння Міхаеліса - Ментена має дваграничних випадки :
коли [S] << Km, то швидкість описується
рівняннями першого порядку відносно
[S]
Vm
0
[S ]
Km
коли [S] >> Km, то швидкість має
нульовий порядок відносно [S]
0 K 2[ E 0 ] max
31.
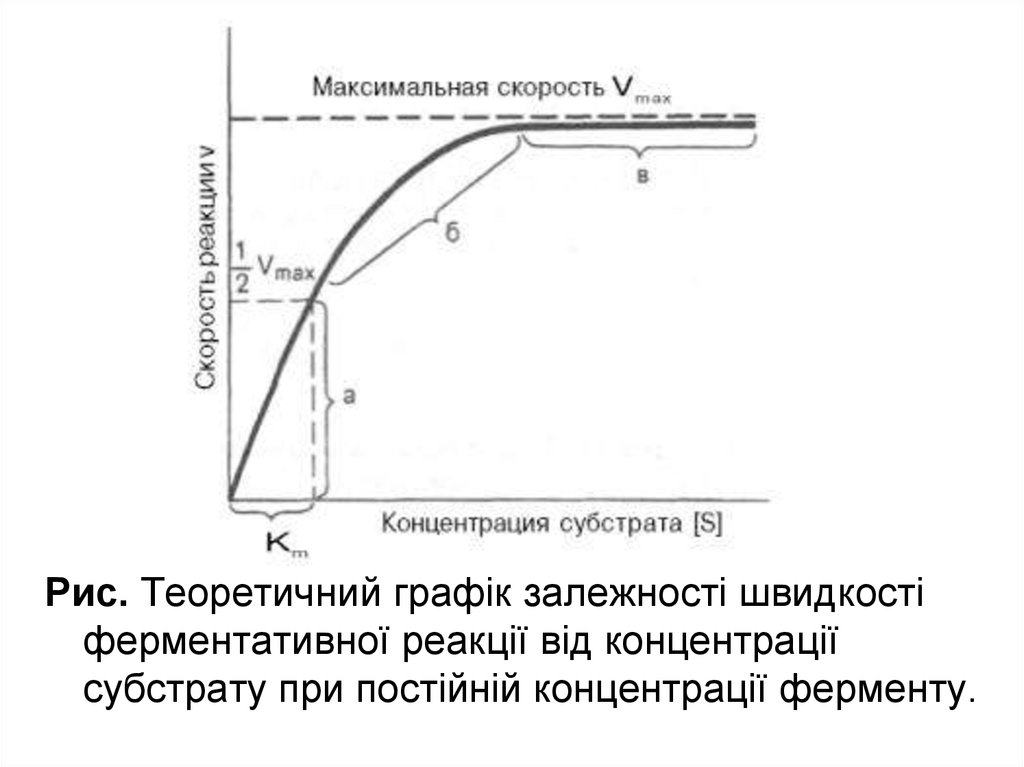
Рис. Теоретичний графік залежності швидкостіферментативної реакції від концентрації
субстрату при постійній концентрації ферменту.
























 Химия
Химия








