Похожие презентации:
Окисно-відновні процеси
1.
Тема:ОКИСНО-ВІДНОВНІ ПРОЦЕСИ
1. Основні положення окисно-відновних реакцій
2. Ступінь окиснення елементів
3. Типи окисно-відновних реакцій. Методи знаходження
коефіцієнтів у окисно-відновних реакціях
4. Залежність перебігу окисно-відновних реакцій
від різних чинників
5. Молярна маса еквівалента окисника та відновника
2.
ОСНОВНІ ПОЛОЖЕННЯ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙУсі без винятку хімічні процеси, які відбуваються у природі,
умовно поділяються на дві основні групи:
1 — реакції невалентних перетворень і
2 — окисно-відновні реакції.
Під час перебігу реакцій першої групи ступені окиснення
атомів елементів, що входять до складу реагуючих речовин,
не змінюються.
3.
Під час перебігу реакцій другої групи атоми елементів(усіх або деяких), що входять до складу реагуючих речовин,
змінюють свій ступінь окиснення.
Отже, окисно-відновними називають ті хімічні реакції,
перебіг яких супроводжується зміною ступеня окиснення
атомів елементів, що входять до складу реагуючих речовин
4.
СТУПІНЬ ОКИСНЕННЯ ЕЛЕМЕНТАЗ двох процесів, які відбуваються між речовинами -
перший процес є обмінним, а другий — окисно-відновним, оскільки Цинк,
Карбон, Оксиген, Калій не змінюють своїх ступенів окиснення, тоді як у
Хрому ступінь окиснення підвищується від +3 до +6, а в Нітрогену,
навпаки, понижується від +5 до +3.
З-поміж двох реакцій, які відбуваються у розчинах за участю
органічних речовин —
так само: перша реакція є обмінною, а друга - окисно-відновною
Отже, для характеристики окисно-відновних реакцій оперують поняттям
ступеня окиснення елемента у сполуці.
Ступінь окиснення — це умовний заряд, який мав би мати атом, якби електрони
усіх хімічних зв'язків, які він утворює з іншими атомами, були зміщені до атома
більш, електронегативного елемента.
5.
Атоми у сполуках можуть мати як позитивний, так і негативнийступені окиснення.
Позитивний ступінь окиснення визначається кількістю електронів,
які формально "відійшли" від заданого атома.
Негативний ступінь окиснення дорівнює кількості електронів,
котрі формально "придбав" заданий атом.
Ступені окиснення позначають арабськими цифрами зі знаком "плюс" або
"мінус" перед цифрою і розміщують над символом елемента, наприклад,
Ступені окиснення часто позначають римськими цифрами в дужках
після символа елемента або після їхньої назви, наприклад, Си(І), Мп(ІІ),
манган (VII), фосфор (V) тощо.
Заряди йонів, на відміну від ступеня окиснення, позначають арабськими
цифрами зі знаком "плюс" або "мінус" після цифри, які розміщують у
правому верхньому куті після символів, наприклад,
6.
Обчислення величини та знака ступеня окиснення елементау сполуках полегшує використання таких правил:
1
2
7.
34
5
6
8.
Наприклад: Визначте ступінь окиснення Р, Cr, Mn, Fe утаких сполуках: Н3РО4, К2Cr2O7; KMnO4; Fe(CO)5; K3[Fe(CN)6]
Беручи до уваги п. 1, 2, 3 і 5 правил, можна скласти рівняння
n1Z1 + n2Z2 + n3Z3 + … niZi = 0,
Де ni – кількість і-го атома в сполуці
Zi – ступінь окиснення і-го атома.
Р2
Підставляючи відомі значення n i Z, знаходимо:
Н3РО4: 3(+1) + 1 · ZP + 4(-2) = 0; ZP = +5
К2Cr2O7: 2(+1) + 2 · ZСr + 4(-2) = 0; ZCr = +6
KMnO4; 1(+1) + 1 · ZMn + 4(-2) = 0; ZMn = +7
Fe(CO)5; 1 · ZFe + 5(+2) + (-2) = 0; ZFe = 0
K3[Fe(CN)6]: 3(+1) + ZFe + 6(-1) = 0; ZFe = +3
9.
• Зв'язок атома Гідрогену з атомом Карбону робить внесок уйого ступінь окиснення – 1;
• Один зв'язок атома Оксигену з атомом Карбону робить
внесок у його ступінь окиснення +1 (два зв'язки — +2);
• Один зв'язок атома Карбону з іншим атомом С робить
нульовий внесок у його ступінь окиснення;
• Один зв'язок атома більш електронегативного елемента з
атомом Карбону робить внесок у його ступінь окиснення +1;
• Один зв'язок атома більш електропозитивного елемента з
атомом Карбону робить внесок у його ступінь окиснення -1.
10.
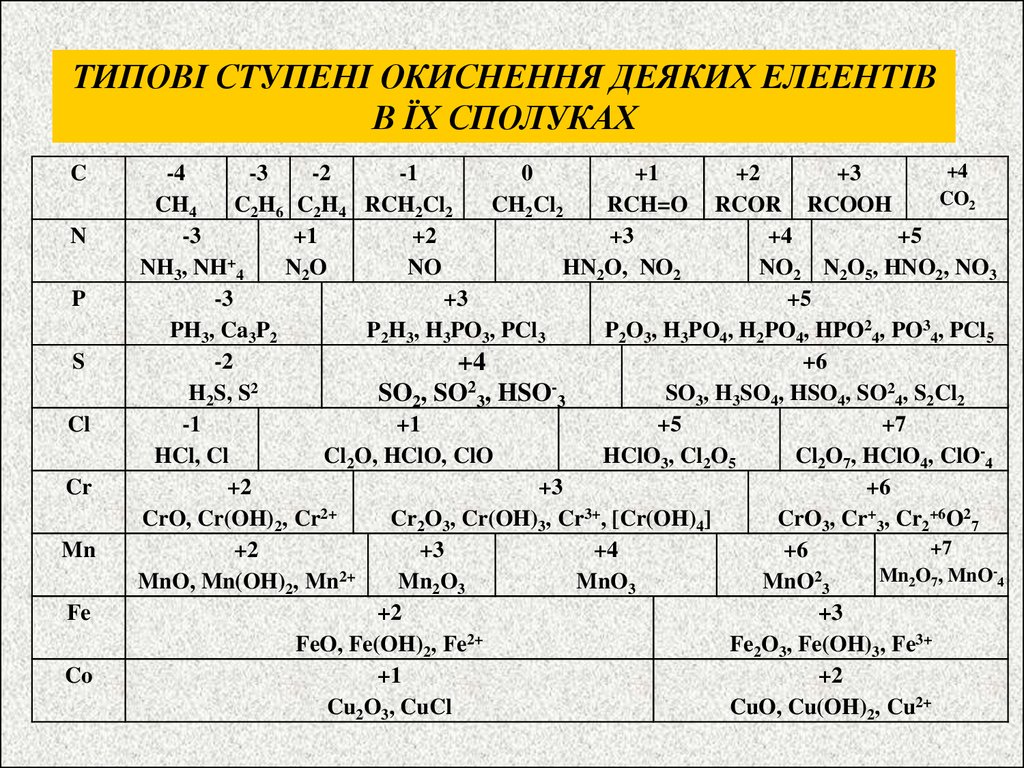
ТИПОВІ СТУПЕНІ ОКИСНЕННЯ ДЕЯКИХ ЕЛЕЕНТІВВ ЇХ СПОЛУКАХ
C
N
P
S
Cl
Cr
Mn
Fe
Co
+4
-4
-3
-2
-1
0
+1
+2
+3
CO2
CH4
C2H6 C2H4 RCH2Cl2
CH2Cl2
RCH=O RCOR RCOOH
-3
+1
+2
+3
+4
+5
NH3, NH+4
N2O
NO
HN2O, NO2
NO2 N2O5, HNO2, NO3
-3
+3
+5
PH3, Ca3P2
P2H3, H3PO3, PCl3
P2O3, H3PO4, H2PO4, HPO24, PO34, PCl5
-2
+6
+4
H2S, S2
SO3, H3SO4, HSO4, SO24, S2Cl2
SO2, SO23, HSO-3
-1
+1
+5
+7
HCl, Cl
Cl2O, HClO, ClO
HClO3, Cl2O5
Cl2O7, HClO4, ClO-4
+2
+3
+6
CrO, Cr(OH)2, Cr2+
Cr2O3, Cr(OH)3, Cr3+, [Cr(OH)4]
CrO3, Cr+3, Cr2+6O27
+7
+2
+3
+4
+6
Mn2O7, MnO-4
MnO, Mn(OH)2, Mn2+
Mn2O3
MnO3
MnO23
+2
+3
FeO, Fe(OH)2, Fe2+
Fe2O3, Fe(OH)3, Fe3+
+1
+2
Cu2O3, CuCl
CuO, Cu(OH)2, Cu2+
11.
ВАЖЛИВІ ОКИСНИКИ (+é)1. Прості речовини: галогени (F2; Cl2: Br2; J2) – посилення
окисної активності від J2 доF2; кисень (О2), озон (О3)
2. Оксиди елементів з високими ступенями окиснення
(Mn2О7; CrO3; SO3; NO2; HgO)
3. Кислоти, які містять елементи з високими ступенями
Р2 3; H2SO4; HJO3)
окиснення (HNO
4. Солі, які містять елементи з високим ступенем
окиснення (KMnO4; K2Cr2O7; KClO3)
5. Йони металів з високим ступенем окиснення
або йони малоактивних металів (Fe3+; Cu2+; Ag+),
а також йон Н+
6. Анод при електролізі
12.
ВАЖЛИВІ ВІДНОВНИКИ (-é )1. Прості речовини: Метали (K, Na, Ca, Cr, Al та
ін.); водень (Н2) та Карбон (С) при нагріванні.
2. Оксиди: СО, SO2.
3. Безоксигеновмісні кислоти, які містять елемент
у від’ємній ступені окиснення (HCl; HF; HBr; H2S).
4. Гідрогеновмісні сполуки (NH3; PH3; CH4 та ін.)
5. Йони металів з низьким ступенем окиснення
(Sn2+; Fe2+; Cr2+), а також гідрид-йон Н6. Органічні речовини (альдегіди, спирти,
аміни та ін.)
7. Катод при електролізі
13.
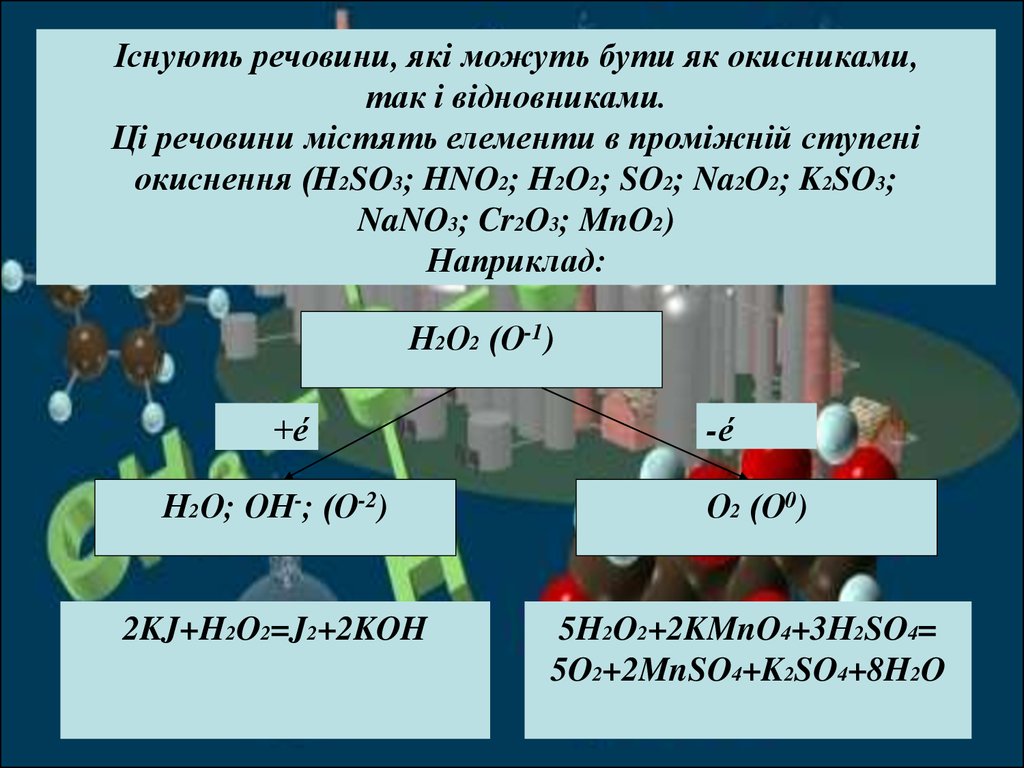
Існують речовини, які можуть бути як окисниками,так і відновниками.
Ці речовини містять елементи в проміжній ступені
окиснення (H2SO3; HNO2; H2O2; SO2; Na2O2; K2SO3;
NaNO3; Cr2O3; MnO2)
Наприклад:
Н2О2 (О-1)
+é
-é
Н2О; ОН-; (О-2)
О2 (О0)
2KJ+H2O2=J2+2KOH
5H2O2+2KMnO4+3Н2SO4=
5O2+2MnSO4+K2SO4+8H2O
14.
Окисно-відновна реакція А + В = АВПроцес відновлення
В + é → В-, де В –
окисник, знижує
ступінь окиснення
Процес відновлення
А – é → А+, де А –
відновник, підвищує
ступінь окиснення
15.
ОКИСНЕННЯ, ЯК ПЕРЕМІЩЕННЯ ЕЛЕКТРОДІВВ окисно-відновних реакціях електрони
переміщуються від одного атома до іншого
16.
ОКИСНЕННЯ МІДІНІТРАТНОЮ КИСЛОТОЮ
Окисно-відновна реакція
В реакції з нітратною
кислотою кожен атом
Купруму віддає 2 електрони,
тобто окиснюється до
Купрум (ІІ). Нітратна
кислота відновлюється до
оксиду нітрогену (IV), при
цьому ступінь окиснення
Нітрогену зменшується з +5
до +4.
17.
РЖАВІННЯ ЗАЛІЗАВплив води та кисню
повітря приводить до
окиснення металічного
заліза до утворення
гідроксиду Феруму (ІІІ)
4
3
Повітря
Дистильована вода
Повітря і вода
18.
ГОРІННЯГоріння – це
окисно-відновна
реакція.
Відбувається
швидка
екзотермічна
реакція
сполучення
речовини з
киснем.
19.
ТИПИ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙІ. Міжмолекулярні окисно-відновні реакції
До міжмолекулярних відносяться реакції,
в яких окисник і відновник знаходяться у складі молекул
або атомів різних речовин.
Наприклад:
Такого типу окисно-відновні реакції можуть відбуватись в
газуватій, твердій фазі та в розчинах, а також в різних
гетерогенних системах
20.
ІІ. Реакції внутрішньомолекулярного окиснення-відновленняДо внутрішньомолекулярних окисно-відновних реакцій
відносяться такі реакції, в яких змінюється ступінь
окиснення елементів, що входять до складу однієї речовини.
Тобто окисник і відновник знаходяться в одній молекулі.
При цьому атом з вищим ступенем окиснення буде
окиснювати атом з нижчим ступенем окиснення.
Наприклад:
21.
ІІІ. Реакції диспропорціонування (самоокиснення-самовідновлення)До такого типу відносяться такі окисно-відновні реакції,
в яких один і той же елемент є одночасно і окисником, і
відновником. При цьому він входить до складу вихідної речовини з
проміжним ступенем окиснення, який виявляється в тих чи інших
випадках нестійким.
Наприклад:
В реакціях диспропорціонування коефіцієнт перед формулою
вихідної речовини дорівнює сумі коефіцієнтів перед окисненою і
відновленою формулою речовини у правій частині.
22.
Можливі також реакції, в яких змінюється ступіньокиснення атомів трьох елементів
23.
МЕТОДИ ЗНАХОДЖЕННЯ КОЕФІЦІЄНТІВУ ОКИСНО-ВІДНОВНИХ РЕАКЦІЯХ
Метод електронного балансу
24.
Метод електронно-іонного балансу (метод напівреакцій)25.
ЗАЛЕЖНІСТЬ ПЕРЕБІГУ ОКИСНО-ВІДНОВНИХРЕАКЦІЙ ВІД РІЗНИХ ЧИННИКІВ
На швидкість перебігу окисно-відновних реакцій істотно
впливає температура, концентрація реагуючих речовин,
наявність каталізатора, а на глибину і напрямок їх перебігу –
кислотність середовища, або значення рН.
1. Температура. З підвищенням температури можливе
утворення різних продуктів. Наприклад:
Cl2 + 2KOH → KCl +KClO = H2O (н.у.)
3Cl + 6 KOH → KClO3 + 5KCl + 3Н2O (підвищення температури)
2. Каталізатор. З додаванням каталізатора у деяких випадках
може змінитись напрямок перебігу окисно-відновної реакції.
Наприклад:
KClO3 → 2KCl + 3О2 (кат. MnO2)
4KClO3 → 3KClO4 + KCl (без каталізатора)
26.
3.Кислотність середовища. Можливість і характерперебігу окисно-відновного процесу іноді залежить
від реакції середовища.
1. Кисле середовище рН < 7
У кислотному середовищі йони Гідрогену спричинюють
сильну деформацію перианганат-йонів, послаблюють
зв’язок між атомами Мангану й Оксигену, здатні
відщеплювати атоми оксигену й утворювати з ними
молекули води. Внаслідок цього відновник
реагує активніше.
27.
2. Нейтральне середовище рН ≈ 7Буре забарвлення
У нейтральному середовищі аніони MnO4- деформуються
значно менше, оскільки поляризаційна дія молекули води
значно слабкіша, ніж Н+.
Гідроксид-йони, навпаки, сприяють зміцненню зв’язку Mn-O
28.
3. Лужне середовище рН > 7Процес окиснення відновлення відбувається легше, оскільки
джерелом атомів оксигену є катіон.
4. Концентрація. На процес окиснення-відновлення значною
мірою впливають концентрація окисника і відновника.
Із збільшенням концентрації окисника або зменшення
концентрації відновника окисника здатність
окисника зростає.
29.
5. Активність металу. Чим легше метал віддає електрони,тим він хімічно активніший.
Якщо розмістити метали у порядку зменшення їхньої
активності, то отримаємо ряд активностей металів.
Кожний метал цього ряду
може витіснити з розчинів
солей всі метали, розміщені
праворуч від нього.
Наприклад:
30.
Визначення молярної маси еквівалентаречовин в окисно-відновних реакціях
Масу одного еквівалента речовини, виражену в грамах,
називають молярною масою еквівалента. Для визначення цієї
величини треба знати число електронів, які в даній реакції
віддає одна молекула відновника або приєднує така сама
кількість окисника, тобто
де п — число електронів, відданих відновником або
приєднаних окисником.
31.
Приклад 1. Визначити молярну масу еквівалента окисника івідновника в реакції взаємодії калій перманганату з ферум (ІІ)
сульфатом у кислому середовищі.
Отже, один моль-еквівалент КМпО4 масою 31,6г прореагує
без залишку з одним моль-еквівалентом ферум (ІІ)
сульфату масою 152 г.
32.
ЛІТЕРАТУРА1.Романова Н.В. Загальна та неорганічна
хімія: - Київ, Ірпінь: ВТФ «Перун», 1998.
– 480 с.
2. Базелюк І.І., Величко Л.П., Титаренко Н.В.
Довідникові матеріали з хімії. – К.: Ірпінь:
ВТФ “Перун”, 1998. – 224 с.
3. Григор’єва В.В., Самійленко В.М., Сич А.М.
Загальна хімія – К.: Вища школа, 1991. – 429 с.






























 Химия
Химия








