Похожие презентации:
Кислотно-основное равновесие в организме
1.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ УКРАИНЫЗапорожский государственный
медицинский университет
Кафедра физколлоидной химии
Кислотно-основное
равновесие в
организме
2.
Электролитическая теорияТеория электролитической диссоциации (ТЭД) создана в
1887 г. Шведским ученым Сванте Аррениусом, согласно
которой:
1. Электролиты при растворении
или расплавлении распадаются
на ионы.
2. В растворе электролитов
сольватированные (гидратированные) ионы движутся хаотически.
Сванте Август Аррениус
3.
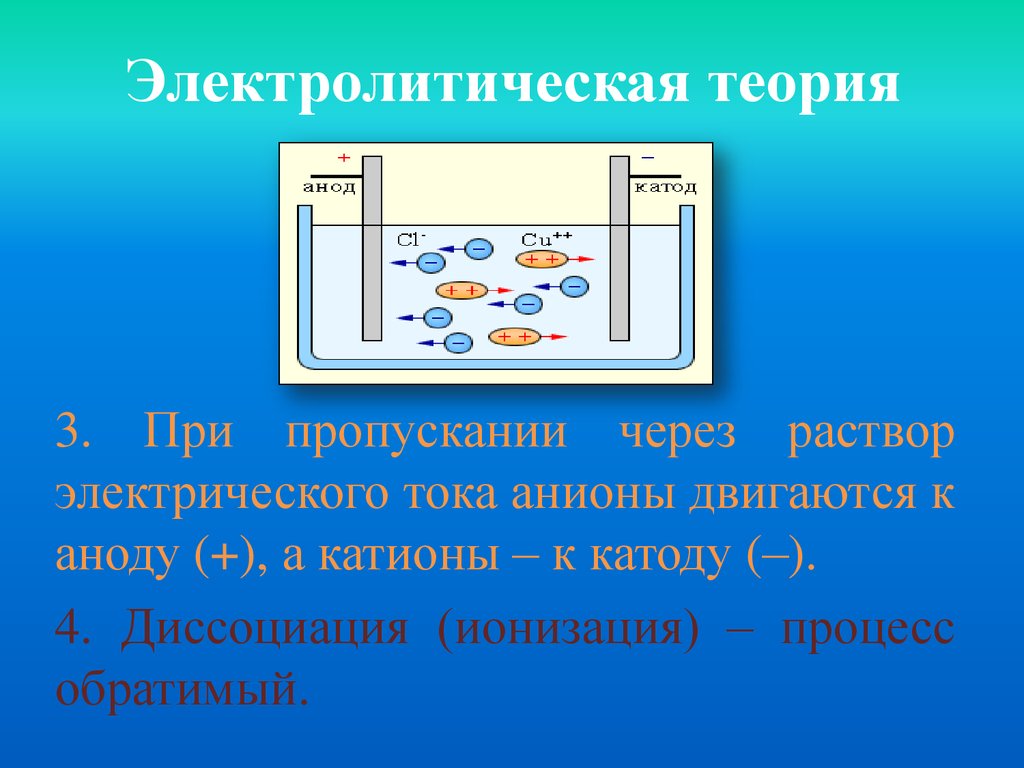
Электролитическая теория3. При пропускании через раствор
электрического тока анионы двигаются к
аноду (+), а катионы – к катоду (–).
4. Диссоциация (ионизация) – процесс
обратимый.
4.
Протолитическая теорияПротолитическая теория кислот и оснований или
протонная теория Бренстеда-Лоури была
предложена в 1923 году независимо друг от
друга датским учёным Й. Бренстедом и
английским учёным Т. Лоури. Согласно этой
теории:
Йоханн Николаус Бренстед
Томас Мартин Лоури
5.
Протолитическая теория6.
Электронная теорияРазработана
американским
физикохимиком
Льюисом в 1923 году. Согласно этой теории:
Кислота Льюиса - молекула или ион,
способные
принимать электронные
пары. Это, например протоны водорода,
ионы металлов (Ag+, Fe3+), оксиды
некоторых неметаллов (SO3, SiO2), ряд
солей (AlCl3), а также такие вещества
как BF3, Al2O3.
Основание Льюиса - молекула или ион,
способные быть донором электронных
пар: все анионы, аммиак, амины, вода,
спирты, галогены.
Гилбертом
Гилберт
Ньютон Льюис
7.
Степень диссоциации8.
Степень диссоциацииСтепень диссоциации зависит от природы электролита и
растворителя, температуры, присутствия в растворе других
ионов и от концентрации.
9.
Константа диссоциации10.
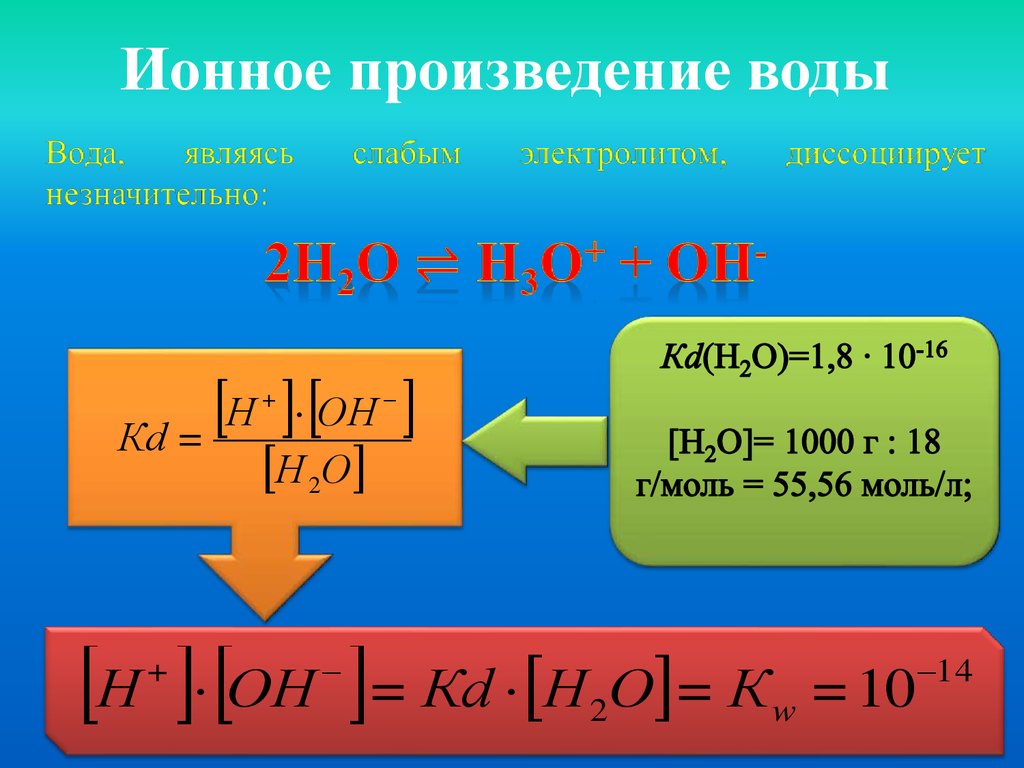
Ионное произведение водыН ОН
Кd =
+
Н 2О
Н ОН = Кd Н О = К
+
2
w
= 10
14
11.
Закон разведения Оствальда«При разведении (разбавлении) раствора
слабого электролита степень его диссоциации увеличивается»
2 См
Кд
1
Для электролитов, в которых α <<1:
Кд См
2
Кд - константа диссоциации, α - степень
диссоциации, См - молярная концентрация
раствора.
Вильгельм
Фридрих Оствальд
(1888 год)
12.
Константы кислотности иосновности
Константы диссоциации кислот и оснований
называют соответственно константами кислотности
(КА) и основности (КВ).
Произведение константы кислотности и константы
основности, сопряженного с этой кислотой
основания равно ионному произведению воды:
Ка Кв Кw
рКа рКв 14
13.
Кислотно-основное состояниеорганизма
Кислотно-основное состояние (КОС) – соотношение концентраций
водородных (Н+) и
гидроксильных (ОН-)
ионов во внутренней
среде организма. Реакцию среды принято
оценивать по концентрации
водородных
или
гидроксильных
ионов.
14.
Нарушение КОСНарушение КОС неизбежно влечет за собой
развитие патологических изменений в организме,
вплоть до его гибели. Сдвиг рН – величины,
характеризующей состояние КОС – даже на 0,1 уже
вызывает выраженные нарушения со стороны
сердечно-сосудистой и дыхательной систем, а
смещение рН плазмы крови выше 7,8 или ниже 6,8
несовместимо с жизнью.
Расстройства КОС могут быть экзогенного и
эндогенного происхождения. По направлению
сдвига кислотно-основного баланса различают две
формы нарушений КОС – ацидоз и алкалоз.
15.
Нарушение КОСАцидоз (от лат. acidus — кислый) —
cмещение
кислотно-щелочного
баланса
организма в сторону увеличения кислотности
(уменьшению рН).
Алкалоз (позднелат. alcali — щелочь, от
арабск. al-qali) — нарушение кислотнощелочного
равновесия
организма,
характеризующееся
абсолютным
или
относительным избытком оснований.













 Медицина
Медицина Физика
Физика Химия
Химия








