Похожие презентации:
Идеальный газ
1. Идеальный газ – это модель в которой
Молекулы принимают за материальныеточки
Между молекулами нет сил
притяжения и отталкивания
Столкновения частиц между собой и со
стенками сосуда абсолютно упругие
2.
• Размеры молекул малы по сравнению с расстояниямимежду ними
• Число молекул очень велико
• Молекулы распределены по всему объему
равномерно
• Молекулы газа движутся хаотично, то есть в любом
направлении движется одинаковое число молекул
• Скорости молекул могут принимать любые
значения
• Силы взаимодействия проявляются только в
момент соударений. Соударения абсолютно
упругие.
• Для отдельно взятой молекулы справедливы законы
Ньютона
3. Реальный газ можно считать идеальным, если он сильно разрежен и хорошо нагрет
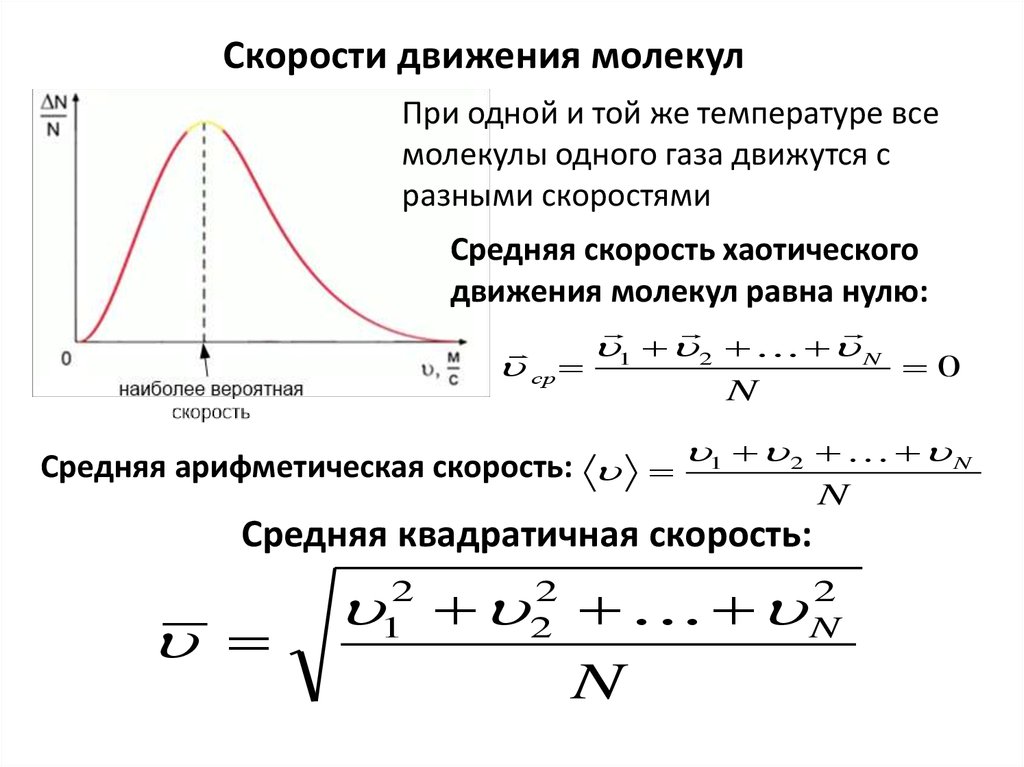
4. Скорости движения молекул
При одной и той же температуре всемолекулы одного газа движутся с
разными скоростями
Средняя скорость хаотического
движения молекул равна нулю:
ср
1 2 N
N
0
Средняя арифметическая скорость: 1 2 N
N
Средняя квадратичная скорость:
2
1
2
2
N
2
N
5.
Микропараметры(характеризуют одну молекулу)
Макропараметры
m0
ЕК
r0
р
m
V
T
p
п
(можно измерить приборами)
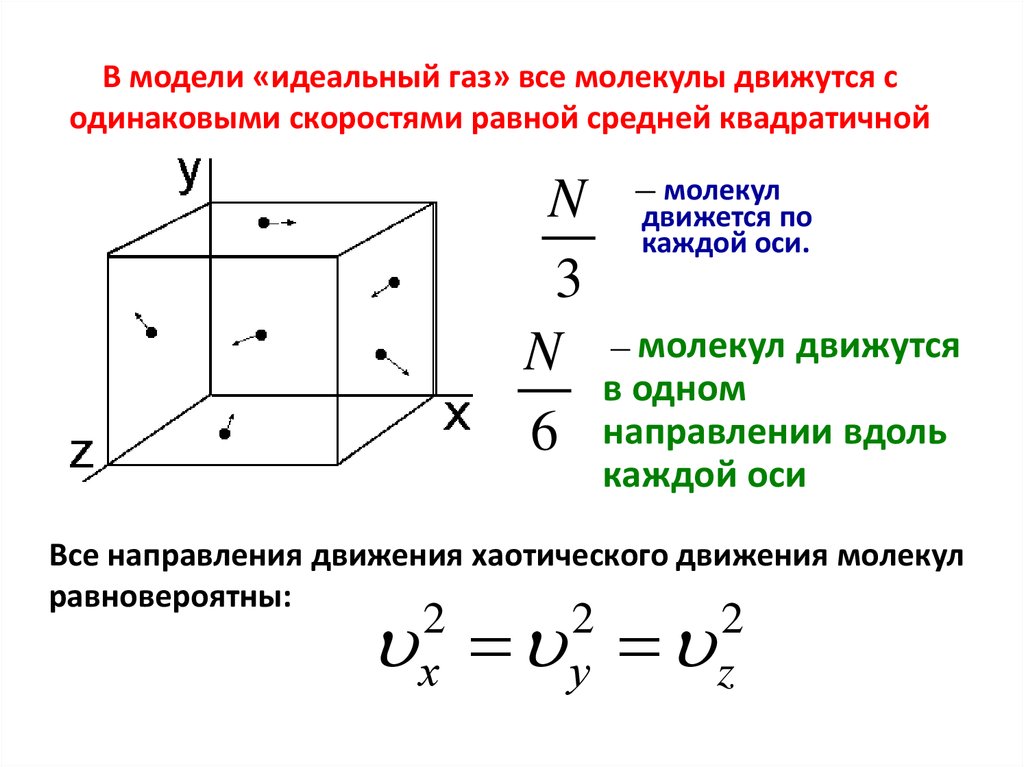
6. В модели «идеальный газ» все молекулы движутся с одинаковыми скоростями равной средней квадратичной
N3
N
6
— молекул
движется по
каждой оси.
— молекул
движутся
в одном
направлении вдоль
каждой оси
Все направления движения хаотического движения молекул
равновероятны:
2
х
2
у
2
z
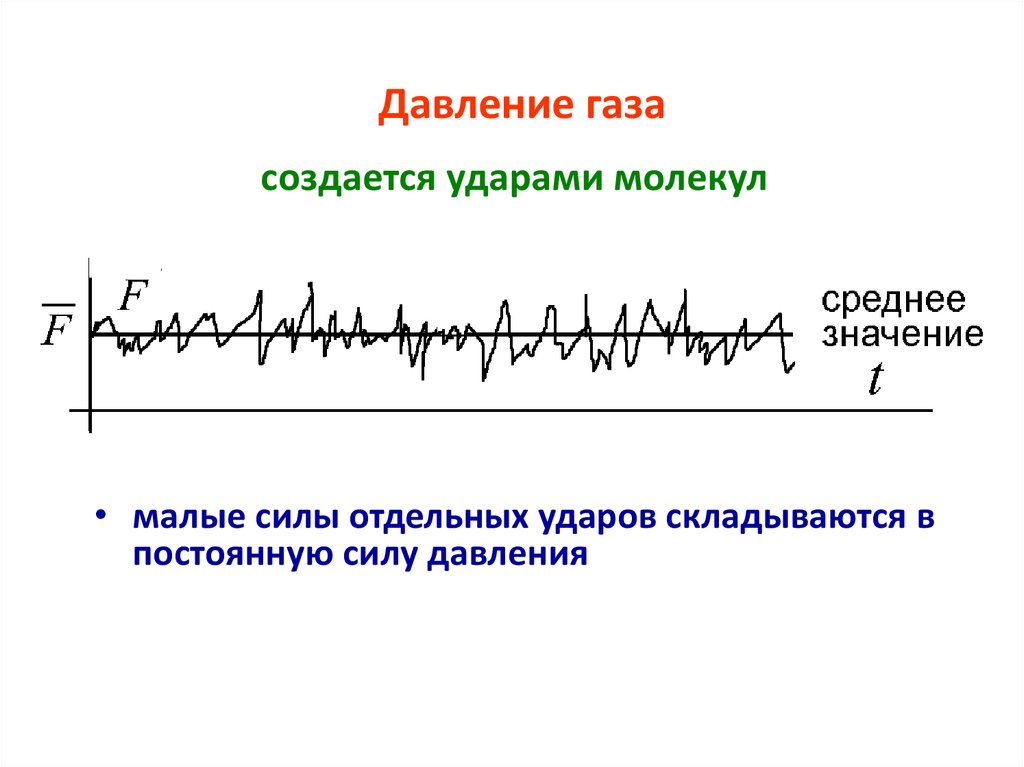
7. Давление газа создается ударами молекул
• малые силы отдельных ударов складываются впостоянную силу давления
8. Основное уравнение МКТ
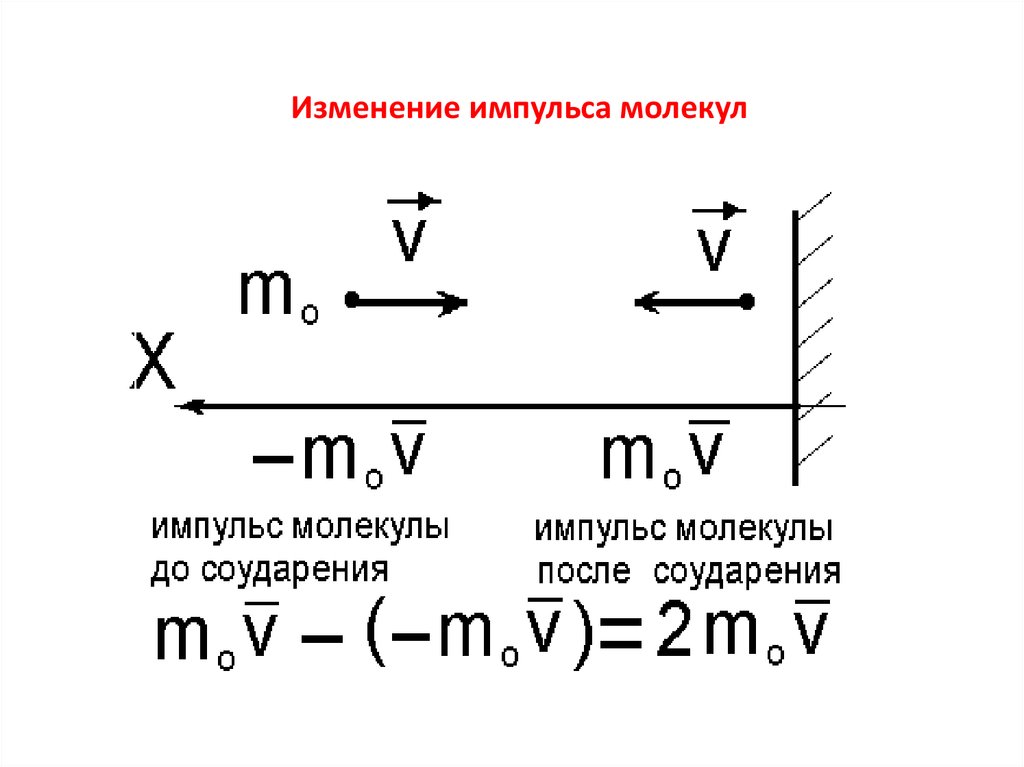
-связывает микро и макро параметры9. Изменение импульса молекул
10.
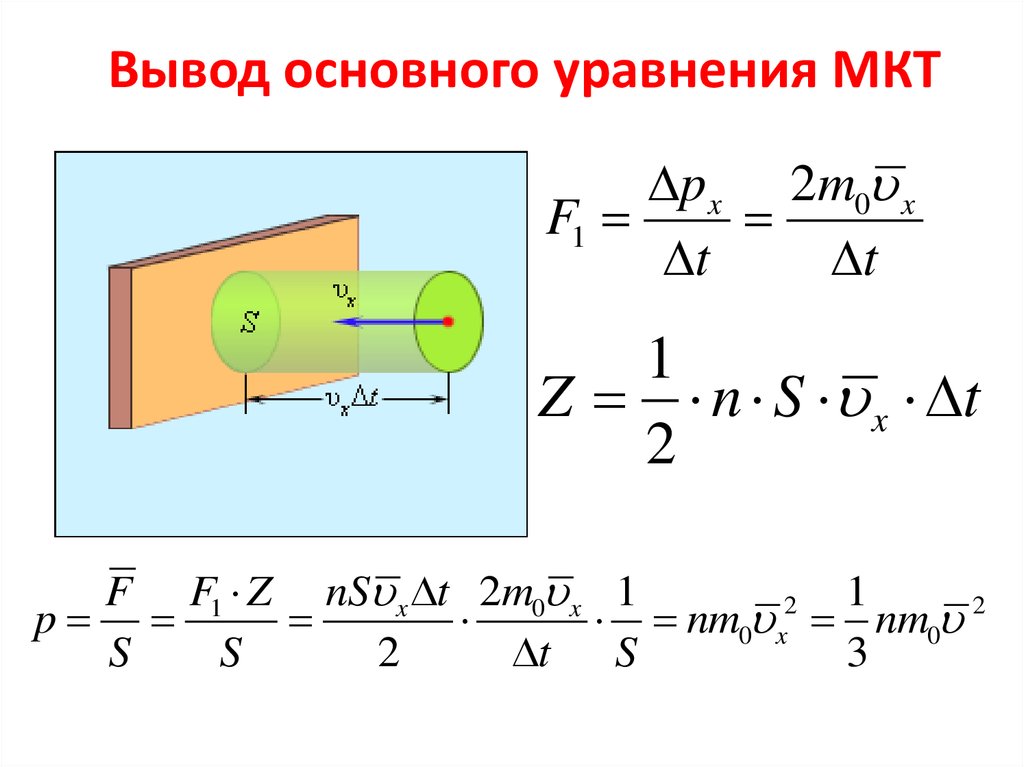
11. Вывод основного уравнения МКТ
p x 2m0 xF1
t
t
1
Z n S x t
2
F F1 Z nS x t 2m0 x 1
1
2
2
p
nm0 x nm0
S
S
2
t S
3
12. Основное уравнение МКТ
12
p nm0
3
1
2
p
3
2
p nЕК
3
13.
14.
Тепловым равновесием называют такоесостояние, при котором все макроскопические
параметры сколь угодно долго остаются
неизменными.
Температура характеризует состояние
теплового равновесия системы тел: все тела
системы, находящиеся друг с другом в
тепловом равновесии, имеют одну и ту же
температуру.
Температура характеризуют степень нагретости тел
(холодное, теплое, горячее).
15.
Можно предположить, чтопри тепловом равновесии именно средние
кинетические энергии молекул всех газов
одинаковы
водород
кислород
2
2N
р nE
E
3
3V
гелий
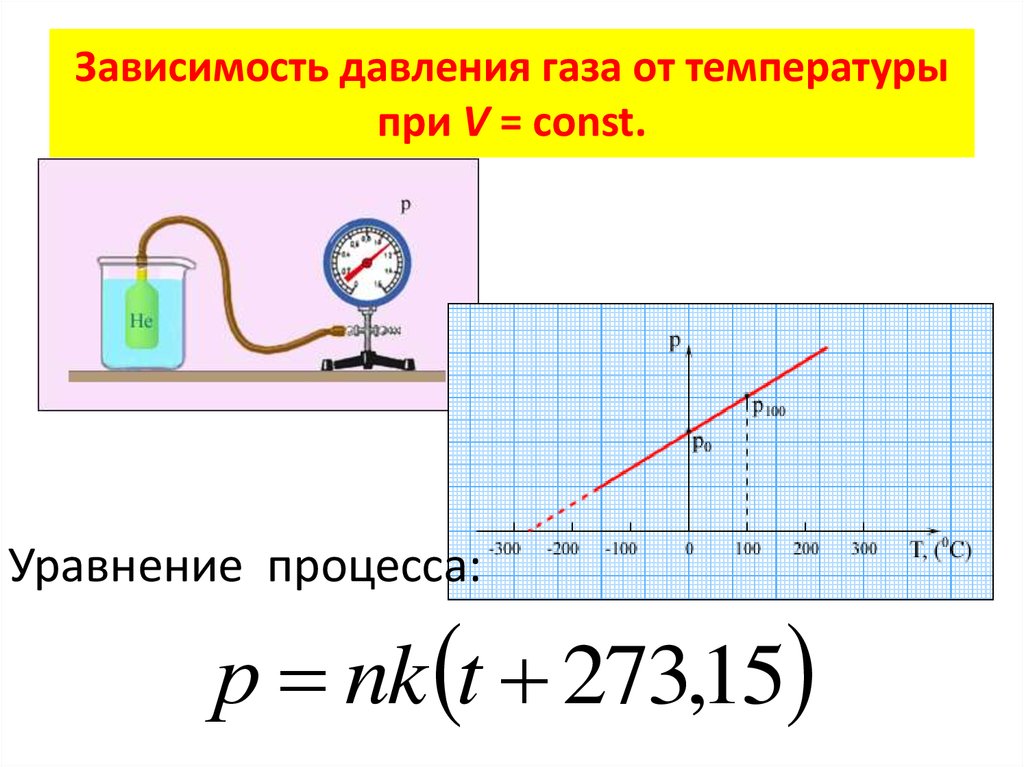
16. Зависимость давления газа от температуры при V = const.
Зависимость давления газа от температурыпри V = const.
Уравнение процесса:
р nk t 273,15
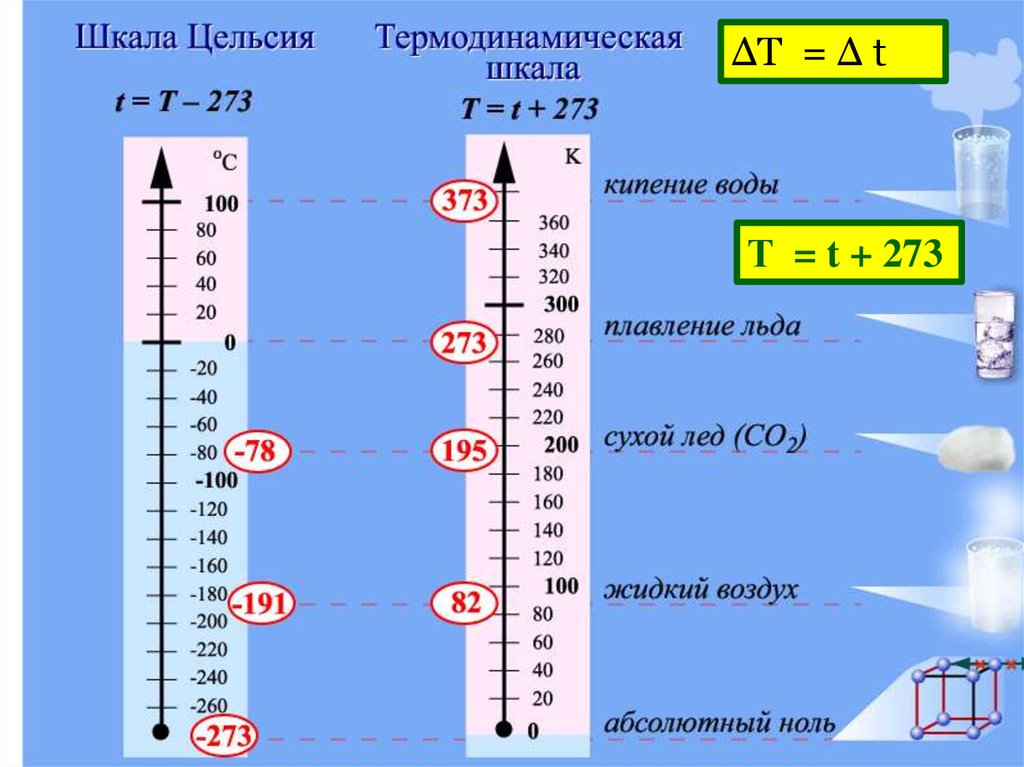
17. ШКАЛА КЕЛЬВИНА
• Английский физик У. Кельвин в 1848 г.предложил использовать точку нулевого
давления газа для построения новой
температурной шкалы (шкала
Кельвина). В этой шкале единица
измерения температуры такая же, как и
в шкале Цельсия, но нулевая точка
сдвинута:
T = t + 273 [K]
18.
р nkТ2
p nЕК
3
3
Е К kT
2
19. Температура – мера средней кинетической энергии молекул
За абсолютный ноль принимаюттемпературу при которой
прекращается поступательное
движение молекул.
20.
ΔТ = Δ tТ = t + 273
21.
- температура в энергетических единицахkT
Т - абсолютная температура [K]
k - постоянная Больцмана, связывает
температуру в энергетических единицах
с температурой в Кельвинах
k 1,38 10
23
Дж
K
22.
При одной и той же температуресредние кинетические энергии
движения молекул всех газов равны
m0
3
ЕК kT
2
2
2
3kT
3k N AT
3RT
m0
M
M
23.
R kNA1,38 10
23
Дж
23
1
6 10 моль
К
Дж
R 8,31
моль К
Универсальная газовая постоянная
24.
Нормальные условияр0 = 100 кПа =
5
10
Т0 = 273 К
Па
25. Следствия:
Приодинаковых
давлениях
и
температурах концентрация молекул
у всех газов одинакова
2. Для смеси газов давление равно
сумме парциальных давлений – закон
Дальтона
1.
р р1 р2 рN
26. Принцип опыта по определению скоростей молекул
Молекул много, ониочень малы.
Следовательно,
мишень не должна
быстро уехать. Как
сделать так, чтобы
мишень всё время
была перед стрелками,
но при этом место
попада-ния зависело
от скорости
«снаряда»?
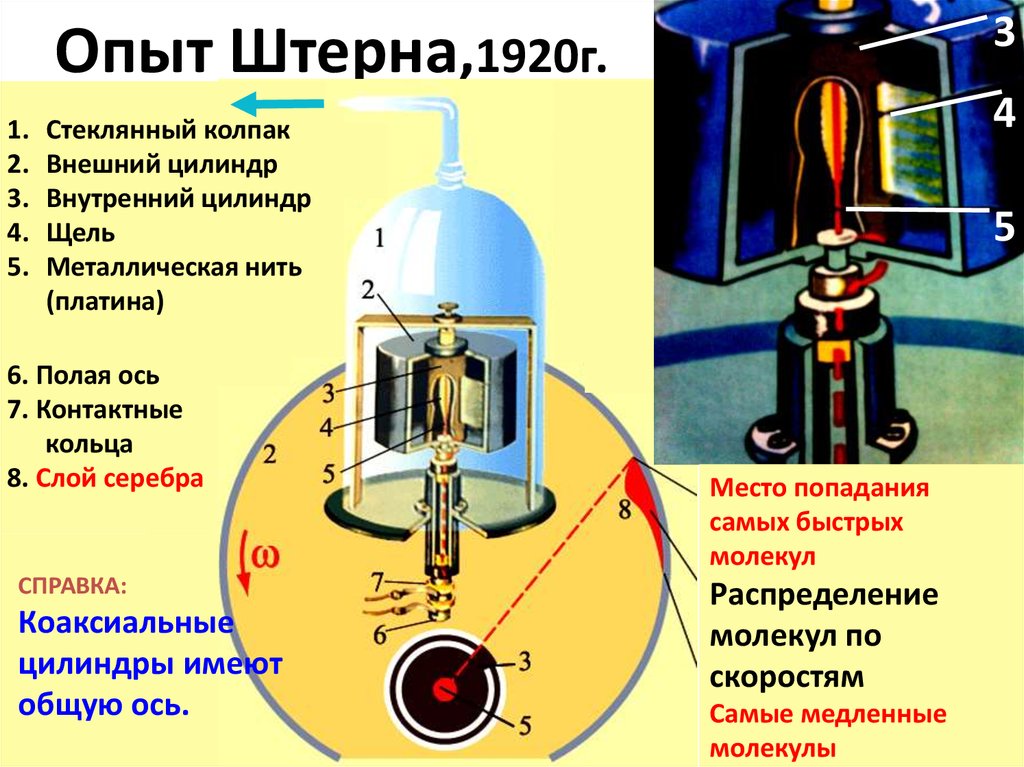
27. Опыт Штерна,1920г.
3Опыт Штерна,1920г.
1.
2.
3.
4.
5.
4
Стеклянный колпак
Внешний цилиндр
Внутренний цилиндр
Щель
Металлическая нить
(платина)
6. Полая ось
7. Контактные
кольца
8. Слой серебра
СПРАВКА:
Коаксиальные
цилиндры имеют
общую ось.
5
Место попадания
самых быстрых
молекул
Распределение
молекул по
скоростям
Самые медленные
молекулы
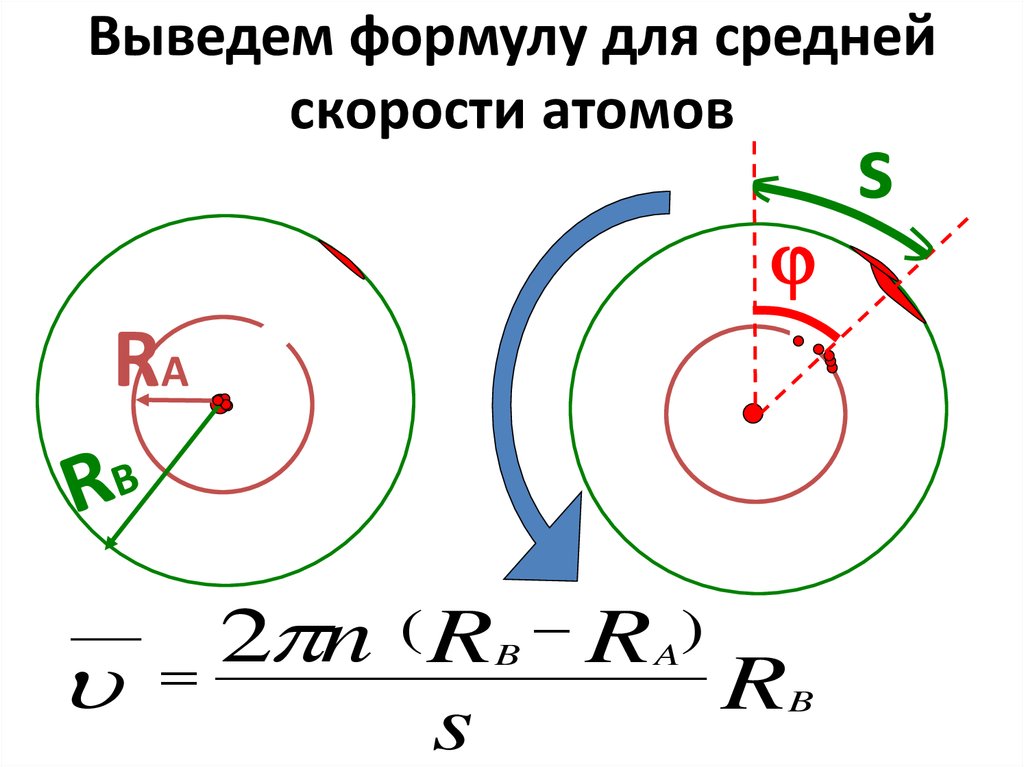
28. Выведем формулу для средней скорости атомов
RА(R
2
n
s
B
R A)
R
B
s
29. Объясните, а как действует эта установка?
Щелиформируют
пучок.
Диски с прорезями
Объясните,
а как
действует
эта
сортируют молекулы по скоростям. Угол между
установка?
прорезями =α.
Через прорези проходят частицы со скоростями
υ+Δυ . Для того чтобы частица попала на
детектор, она должна успеть за время t =α/ω
пройти путь ℓ. υ=ℓ/t=ℓω/α




















 Физика
Физика








