Похожие презентации:
Острые лейкозы
1. ОСТРЫЕ ЛЕЙКОЗЫ
Барях Е.А.2. ОСТРЫЙ ЛЕЙКОЗ
≥20% бластов в крови или костном мозгеКоличество лейкоцитов крови ↑↓ N
При низком количестве лейкоцитов бласты в периферической крови могут не
обнаруживаться
Обычно в гемограмме:
Лейкоцитоз, бластемия
Нейтропения, hiatus keukemicus
Нормохромная анемия
Тромбоцитопения
3. КЛИНИЧЕСКАЯ КАРТИНА
• Пролиферация опухолевого клона• Нейтропения
• Тромбоцитопения
• Анемия
• Инфильтрация органов
• Опухолевая интоксикация
• Лейкостаз
• Геморрагический синдром (ДВС)
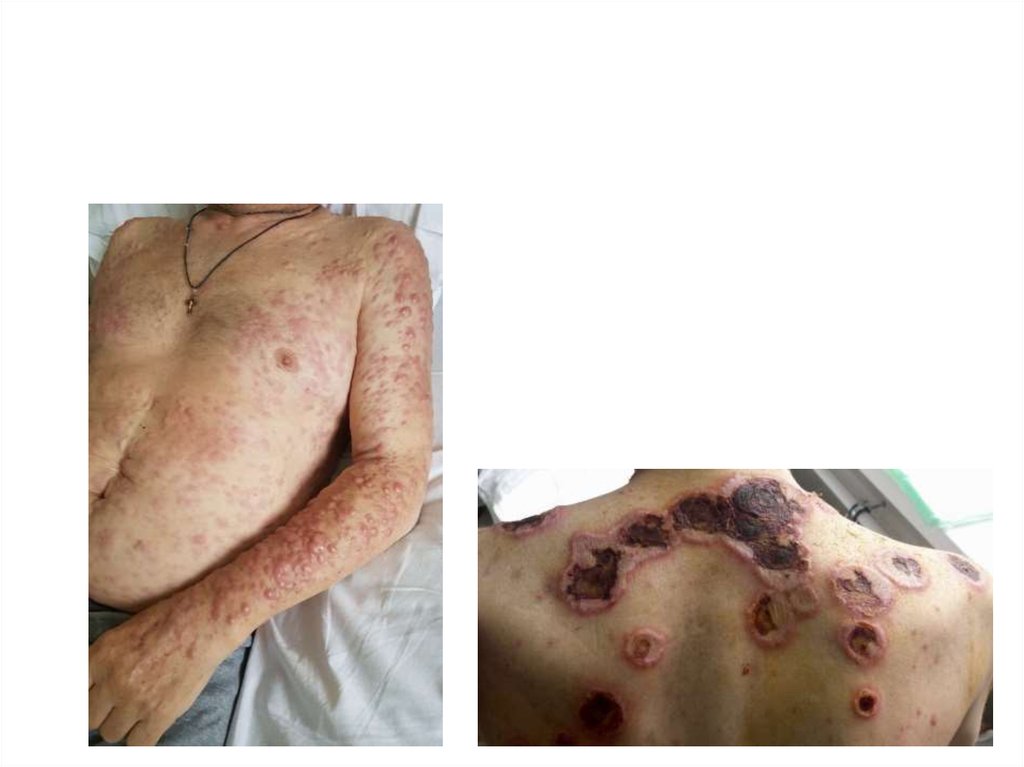
4. ЭКСТРАМЕДУЛЯРНЫЕ ПОРАЖЕНИЯ
По мере развития ОЛ клеткиобретают способность расти
вне органов кроветворения:
в коже, почках, мозговых
оболочках.
• КОЖА
• ДЕСНЫ
• ЦНС
• ДРУГИЕ ОРГАНЫ И ТКАНИ
5.
6.
7. ОСТРЫЕ ЛЕЙКОЗЫ
Миелоидные (нелимфобластные)Лимфобластные
8.
9. КЛИНИЧЕСКИЕ ФАЗЫ И СТАДИИ
• Активная фаза• Ремиссия
• Минимальная остаточная болезнь
• Рецидив
10. ОМЛ
• Одна мутировавшая клетка дает после деления огромноеколичество клеток (за 3 мес 1012 клеток) массой 1 кг и начинаются
клинические проявления
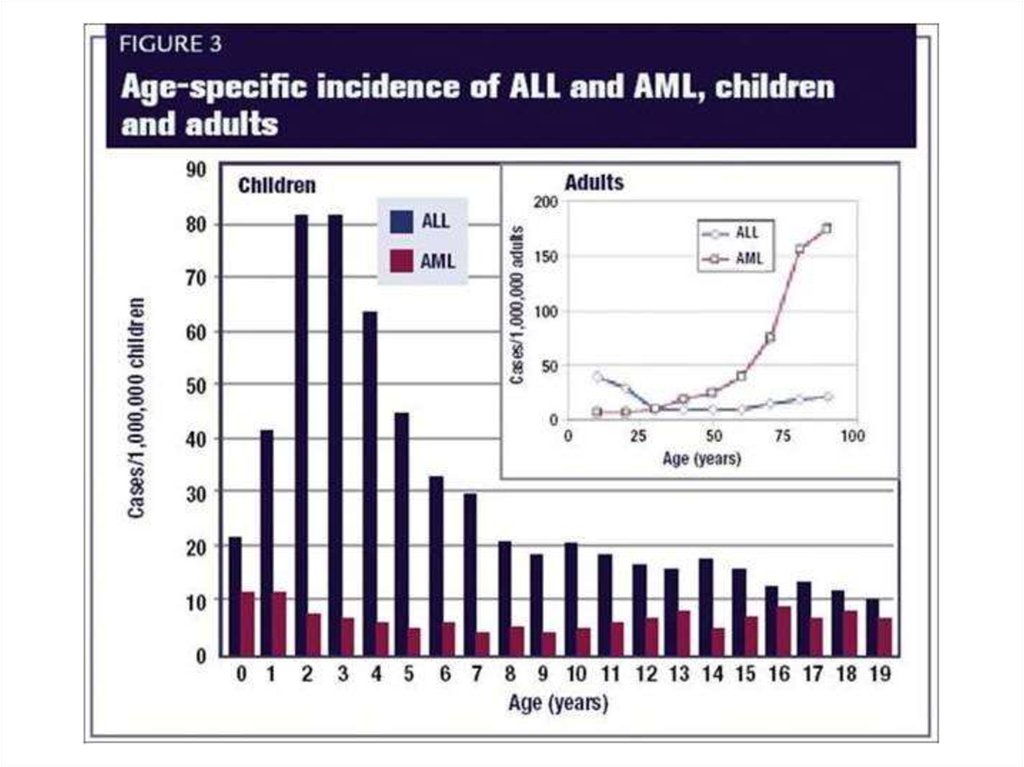
11. ЭПИДЕМИОЛОГИЯ
• Заболеваемость ОЛ составляет в среднем 5 случаев на 100000 населения в год.
• 75% всех случаев диагностируется у взрослых.
• среднее соотношение ОМЛ и ОЛЛ составляет 6:1.
• Встречаемость ОМЛ 2,7 на 100 000 населения и
увеличивается с возрастом:
дети 6-8 случаев на 1 000 000 населения в год
взрослые 12-20 случаев на 1 000 000 населения в год
пожилые 40-60 случаев на 1 000 000 населения в год
• Средний возраст больных данным заболеванием
составляет 65 лет.
Выявлено, что вероятность развития лейкоза
у 50-летнего человека составляет 1 к 50000
у 70-летнего - 1 к 7000.
Острый миелоидный лейкоз наиболее распространен
среди мужчин. У женщин данное заболевание встречается
намного реже.
12. ЭТИОЛОГИЯ
• По всей вероятности, существует комплекс причин, приводящих кразвитию лейкоза.
Хромосомные изменения - приблизительно у 60-70 % больных.
Предполагается, что они возникают под влиянием неблагоприятных
факторов внешней среды:
• ионизирующего излучения
• электромагнитного поля
• химических веществ (бензин, пестициды, гербециды)
• химио- и радиотерапии по поводу других опухолей
• курение (Ряд исследователей предполагает, что около 20% ОМЛ являются
следствием курения)
Генетические заболевания: синдром Дауна, анемия Фанкони, атаксиятелеангиоэктазия, синдром Вискотта-Олдрича, нейрофиброматоз, синдром
Кляйнфельтера, синдром Патау, синдром Швахмана, синдром Костмана.
13. ПАТОГЕНЕЗ
Воздействие неблагоприятных факторовмутации
снижение колониеобразующей способности,
асинхронизм процессов пролиферации и дифференцировки (чаще блок)
удлинение митотического цикла, продолжительности жизни клеток.
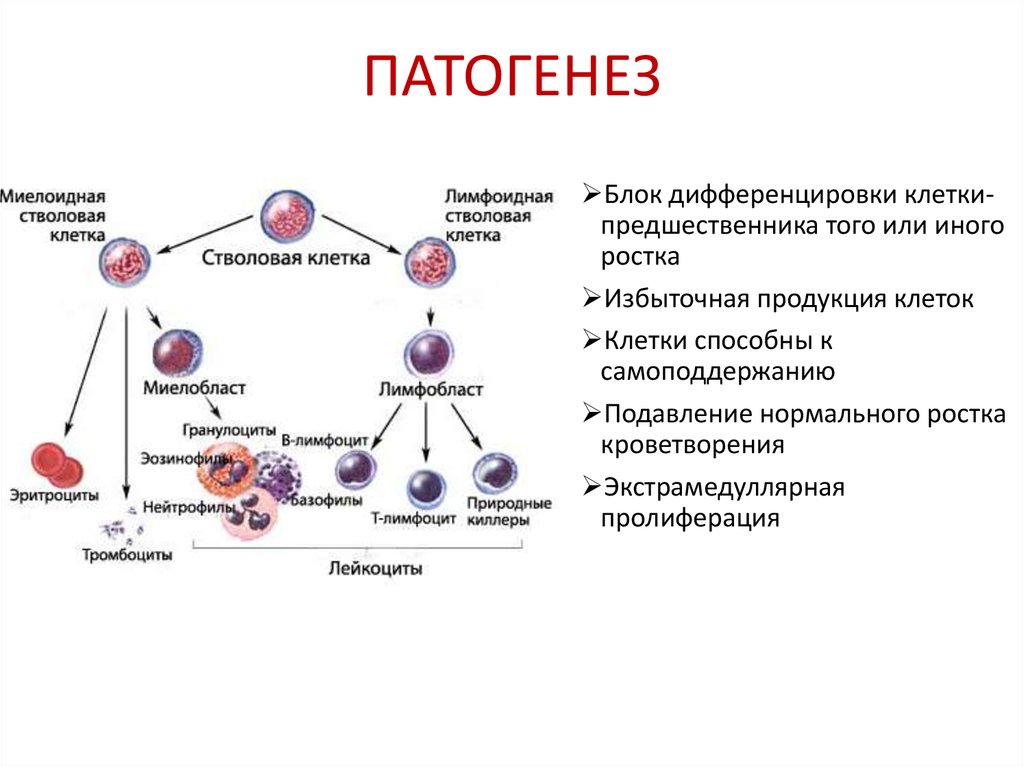
14. ПАТОГЕНЕЗ
Блок дифференцировки клеткипредшественника того или иногоростка
Избыточная продукция клеток
Клетки способны к
самоподдержанию
Подавление нормального ростка
кроветворения
Экстрамедуллярная
пролиферация
15.
группа острых миелобластных лейкозов возникшихиз клетки-предшественницы миелопоэза
различаются между собой
морфологическими
цитохимическими
иммунофенотипическими
цитогенетическими
молекулярно-биологическими характеристиками.
16. КЛАССИФИКАЦИЯ
ОМЛoFAB
oВОЗ
17. FAB классификация 1976
основана на:
морфологии
цитохимических характеристиках
( % бластов, степень созревания)
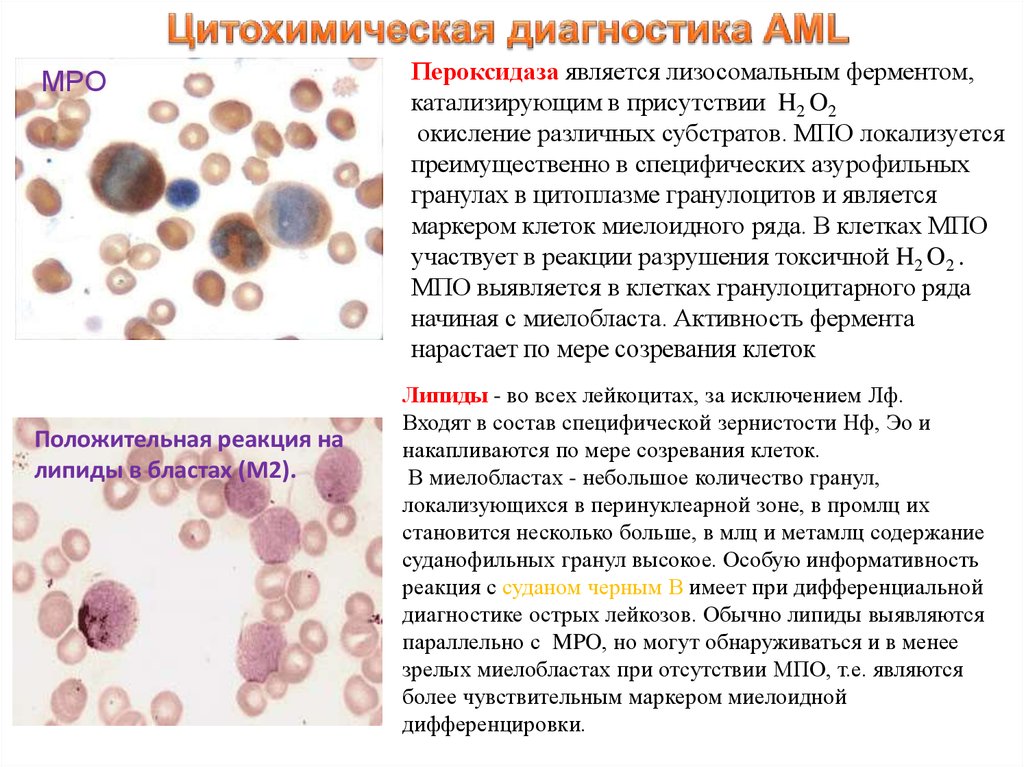
18.
MPOПоложительная реакция на
липиды в бластах (М2).
Пероксидаза является лизосомальным ферментом,
катализирующим в присутствии H2 O2
окисление различных субстратов. МПО локализуется
преимущественно в специфических азурофильных
гранулах в цитоплазме гранулоцитов и является
маркером клеток миелоидного ряда. В клетках МПО
участвует в реакции разрушения токсичной H2 O2 .
МПО выявляется в клетках гранулоцитарного ряда
начиная с миелобласта. Активность фермента
нарастает по мере созревания клеток
Липиды - во всех лейкоцитах, за исключением Лф.
Входят в состав специфической зернистости Нф, Эо и
накапливаются по мере созревания клеток.
В миелобластах - небольшое количество гранул,
локализующихся в перинуклеарной зоне, в промлц их
становится несколько больше, в млц и метамлц содержание
суданофильных гранул высокое. Особую информативность
реакция с суданом черным В имеет при дифференциальной
диагностике острых лейкозов. Обычно липиды выявляются
параллельно с MPO, но могут обнаруживаться и в менее
зрелых миелобластах при отсутствии МПО, т.е. являются
более чувствительным маркером миелоидной
дифференцировки.
19.
РАS-реакция основана на окислении йодной кислотой гликолевыхДиффузно-гранулярная PAS-реакция в
групп до альдегидов., которые взаимодействуя с реактивом Шиффа
бластах (М5).
образуют продукт красного цвета (метод Mc Manus). Гликозамингликаны
определяются во всех клетках гранулоцитарного ряда. Концентрация
PAS-положительного материала нарастает по мере созревания клеток.
Диффузное окрашивание - наиболее молодые клетки (миелобласты,
промиелоциты, миелоциты).
Миелобласты могут быть либо PAS-отрицательными, либо обнаруживать
слабодиффузное окрашивание .
Яркое диффузное окрашивание цитоплазмы наблюдается только при
остром промиелоцитарном лейкозе. В монобластах реакция может быть
отрицательной, слабо положительной в диффузной или диффузногранулярной форме
Naphtol-As-D-acetate esterase
-naphthyl acetate esterase
Неспецифические эстеразы –
группа лизосомальных ферментов.
Используется для идентификации лейкозных моноцитарных предшественников.
Эти клетки проявляют высокую активность неспецифической эстеразы с
субстратами бутират, ацетат и AS-D-ацетат, которая в значительной степени
ингибируется фторидом натрия. Реакция на нафтол-AS-D-хлорацетатэстеразу по
своей надежности выявления гранулоцитарной направленности
дифференцировки сравнима с МПО. Реакция на a-нафтилацетатэстеразу является
наиболее достоверной для идентификации монобластного и моноцитарного
типов лейкозов.
Положительная реакция на неспецифическую эстеразу в бластах (костный мозг) –
М4.
Частичное подавление неспецифической эстеразы в бластах фторидом Na
(костный мозг) – М4.
20. МОРФОЛОГИЯ
• Для диагностики ОМЛ необходимо выявление 20% и более бластов в костноммозге или периферической крови
• Исключение: ОМЛ с t(15;17), t(8;21), inv(16) и некоторых случаев
эритролейкемии. В этих случаях диагноз ОМЛ устанавливается на основании
данных цитогенетики
• Миелобласты, монобласты и мегакариобласты включаются в подсчет бластов.
• В ОМЛ с моноцитоидной или миеломоноцитоидной дифференцировкой,
монобласты и промоноциты считаются как эквивалент бластов.
• Эритробласты не подсчитываются как бласты, кроме редких случаев эритроидной
лейкемии.
• Перерасчет процента бластов в костном мозге на неэритроидные
ядросодержащие клетки производится, если процент ядросодержащих
неэритроидных клеток достигает 50 или более.
21. ЦИТОХИМИЯ
М0М1-М2
М3
М4-М5
М6-М7
МРО
-
+/++
+++
+
-
Судан черный
-
+/++
+++
+
-
Неспецифическая
эстераза
-
-
-
++
+
PAS-реакция
-
-
+++
+/++
++
Кислая фосфатаза
-
-
-
+
(диффузная)
+
(очаговая)
Не подавляется NaF
Частично или
полностью
подавляется NaF
22. Цитохимия
ВариантМорфологические критерии
(по данным миелограммы)
Цитохимические
характеристики
МПO, Судан В
М0 Острый миелобластный
лейкоз с минимальной дифференцировкой
20% миелобластов без гранул
Палочки Ауэра (-).
М1 Острый миелобластный
лейкоз без созревания
20% миелобластов с отсутствием или скудными гранулами,
10% созревающих гранулоцитарных клеток.
Палочки Ауэра ( )
М2 Острый миелобластный
лейкоз с созреванием
20% миелобластов с гранулами,
10% промиелоцитов или созревающих гранулоцитарных клеток.
20% моноцитов.
Палочки Ауэра (+)
20% миелобластов и промиелоцитов,
10% созревающих гранулоцитарных клеток.
Палочки Ауэра (++)
М3
Острый
промиелоцитарный лейкоз
М4
Острый
миеломоноцитарный лейкоз
20% миелобластов,
монобластов, промиелоцитов,
20% моноцитарных клеток.
Палочки Ауэра ( )
М5а
Острый монобластный
лейкоз без дифференцировки
80% крупных монобластов с
выраженной цитоплазмой.
Палочки Ауэра (-)
М5в
Острый монобластный
лейкоз с дифференцировкой
80% моноцитарных клеток с преобладанием промоноцитов
и моноцитов. Палочки Ауэра ( )
М6
Миелобласты 20% от неэритроидных клеток.
Эритроидные предшественники с мегалобластами 50%.
Палочки Ауэра (+) в эритроидных предшественниках
Острая эритролейкемия
М7
Острый
мегакариобластный лейкоз
Бласты с «лимфоидной»
морфологией и отшнуровкой
цитоплазмы, мегакариобласты 30%, диспластические
НЭ
23. FAB классификация 1982
• При внедрении в диагностику ИФТ FAB классификация былаобновлена
• Основана на:
- морфологии
- цитохимии
- иммунофенотипирование
24. Классификация ОМЛ (FAB 1976-85 гг.)
M0 - острый недифференцированный лейкозМ1 - острый миелобластный лейкоз без признаков созревания, >90% бластов
М2 -острый миелобластный лейкоз с признаками созревания, >10% зрелых, <20%
моноцитов
M2baso – базофильно-клеточный
М3 - острый промиелоцитарный лейкоз
гранулярный вариант (М3)
гипогранулярный вариант (М3v)
М4 - острый миеломонобластный лейкоз моноцитов - >20% но <80%
M4eos – с >5% эзинофилией
М5 - острый монобластный лейкоз, монобластов >50%
М5а - монобластный без признаков созревания
М5b – монобластный с признаками созревания
М6 - острый эритробластный лейкоз (эритробласты ≥50% и миелобласты ≥30% от
неэритроидных клеток)
М7 - острый мегакариобластный лейкоз
25. WHO 2008 г
• Основана на:- морфологии
- цитохимии
- иммунофенотипе
- ЦГ
-предшествующей истории
-молекулярной биологии
26. WHO классификация 2008 г
27. ГРУППЫ РИСКА
ОМЛ1) Цитогенетические поломки
2) Мутации
3) Ответ на лечение
4) Вторичный ОЛ
ОЛЛ
1) возраст
2) гиперлейкоцитоз
3) Иммунофенотип
4) цитогенетика
5) ответ на лечение
6) коэкспрессия миелоидных маркеров
7) нейролейкоз
28. ГРУППЫ ЦИТОГЕНЕТИЧЕСКОГО РИСКА
Цитогенетическаягруппа прогноза
благоприятная
промежуточная-I
промежуточная-II
неблагоприятная
Варианты
t(8;21)(q22;q22); RUNX1-RUNX1T1
inv(16)(p13.1q22 или t(16;16)(p13.1;q22); CBFB-MYH11
мутация NPM1 без FLT3-ITD (нормальный кариотип)
мутация CEBPA (нормальный кариотип)
мутация NPM1 + FLT3-ITD (нормальный кариотип)
Wild-type NPM1 + FLT3-ITD (нормальный кариотип)
Wild-type NPM1 без FLT3-ITD (нормальный кариотип)
t(9;11)(p22;q23); MLLT3-MLL
Цитогенетические аномалии, не классифицируемые как
благоприятные или неблагоприятные.
inv(3)(q21q26.2) или t(3;3)(q21;q26.2); RPN1-EVI1
t(6;9)(p23;q34); DEK-NUP214
t(v;11)(v;q23);
MLL реаранжировки
-5 или del(5q);
-7;
abnl(17p);
комплексный кариотип
Recommendations from an international expert panel on behalf of the European LeukemiaNet BLOOD, 21 JANUARY 2010 VOLUME 115, NUMBER 3
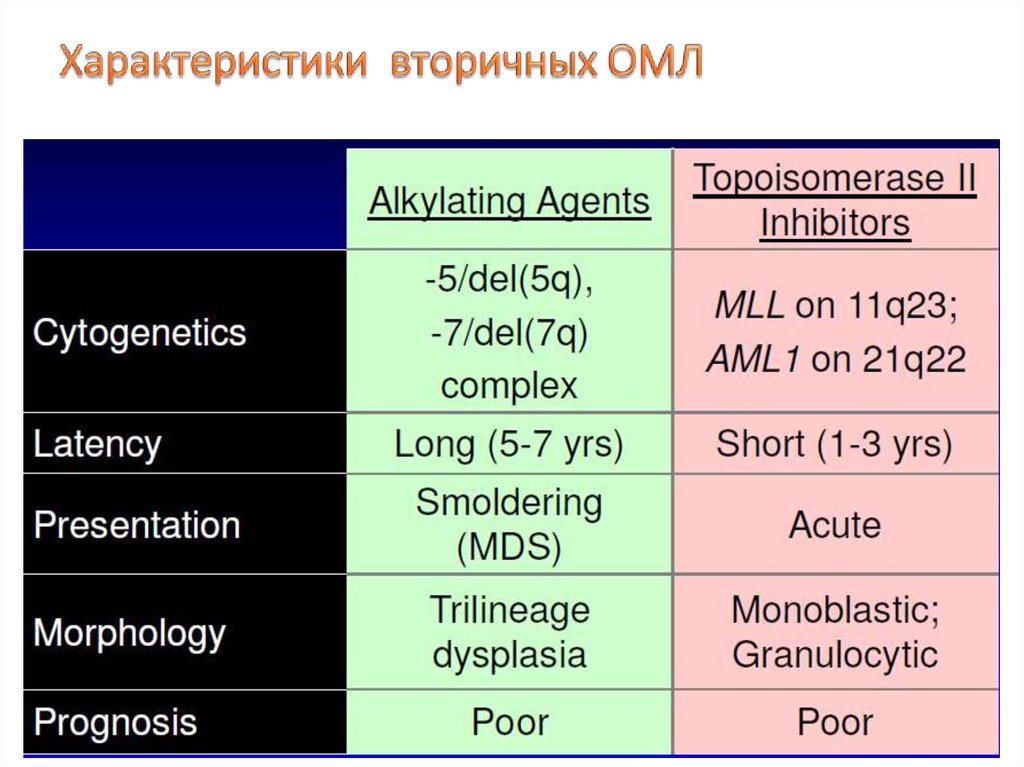
29. Характеристики вторичных ОМЛ
30. Лабораторно - инструментальные исследования перед началом лечения ОМЛ
• Миелограмма (+ клеточность). В случае невозможности получения аспирата костного мозга («сухой пунктат») –выполнение трепанобиопсии.
• Цитохимическое исследование костного мозга (пероксидаза, гликоген, альфа- нафтилэстераза, PAS реакция)
• Цитогенетическое исследование костного мозга
• Молекулярно-генетическое исследование
• Иммунофенотипирование костного мозга
• Клинический анализ крови + Ретикулоциты, СОЭ
• Биохимическое исследование
• Коагулограмма
• Микробиологическое, вирусологическое , серологическое исследование
• 12-канальное ЭКГ, ЭХО – КГ
• УЗИ органов брюшной полости
• Рентгенограмма грудной клетки\ КТ органов грудной клетки
• Общий анализ мочи
• Анализ крови на Ф-50, RW, HBs Ag, antiHCV
• Группа крови, Rh, определение аутоантител к эритроцитам
• Для женщин детородного возраста – тест на беременность.
• Диагностическая люмбальная пункция. (гиперлейкоцитоз, М4-М5 варианты ОМЛ по FAB- классификации – лечебнодиагностическая)
• Оценка ECOG-статуса, индекса коморбидности.
• УЗДГ сосудов шеи и подключичных сосудов (при наличии в анамнезе катетеризации центральных вен или указаний на
анатомические особенности)
• HLA-типирование
31. ТЕРАПЕВТИЧЕСКАЯ ТАКТИКА
• Индукция ремиссии• Постремиссионный этап
Консолидация ремиссии
Поддерживающая терапия
Терапия рецидива
терапия молекулярного рецидива
32. ПРИНЦИПЫ ТЕРАПИИ
• Комбинация Ara-C и даунорубицина• Высокие дозы Ara-C
• Аллогенная трансплантация костного мозга
Максимальная эрадикация- залог успеха
Контроль- количественный PCR
33. ВОЗРАСТ
≤60ОМЛ
>60
34. Oбщая выживаемость пациентов с de novo ОМЛ в различных возрастных группах
THOMAS BÜCHNER, WOLFGANG HIDDEMANN Haematologica 2004; 89(9):September 200435. ОСТРЫЕ ЛИМФОБЛАСТНЫЕ ЛЕЙКОЗЫ
36.
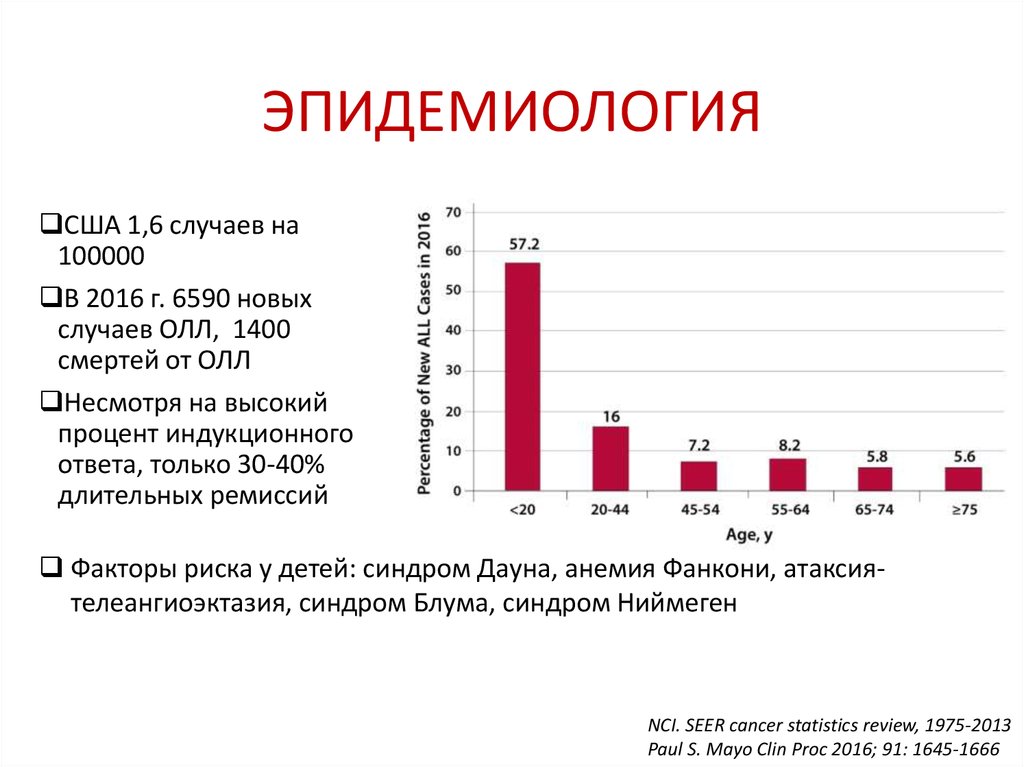
37. ЭПИДЕМИОЛОГИЯ
США 1,6 случаев на100000
В 2016 г. 6590 новых
случаев ОЛЛ, 1400
смертей от ОЛЛ
Несмотря на высокий
процент индукционного
ответа, только 30-40%
длительных ремиссий
Факторы риска у детей: синдром Дауна, анемия Фанкони, атаксиятелеангиоэктазия, синдром Блума, синдром Ниймеген
NCI. SEER cancer statistics review, 1975-2013
Paul S. Mayo Clin Proc 2016; 91: 1645-1666
38. КЛИНИЧЕСКАЯ КАРТИНА
• Лейкоцитоз (лейкопения), тромбоцитопения, анемия• В-симптомы
• Инфекционные осложнения, геморрагический синдром
• Лимфаденопатия
• Спленомегалия и /или гепатомегалия (20%)
• Нейролейкемия (оболочки, реже ЧМН) 5-8%
• Вовлечение медиастинальных лимфоузлов, синдром ВПВ
(Т-ОЛЛ)
• Яички
39. ДИАГНОСТИКА ОЛЛ
Морфологическое и цитохимическое исследованияИммунофенотипирование бластных клеток
Цитогенетическое исследование
Молекулярно-генетическое исследование
Определение маркеров минимальной резидуальной болезни
(МРБ)
40. КЛАССИФИКАЦИЯ
• FAB, 1976 г. – морфологические критерии (L1, L2, L3)• WHO, 1997 г. – морфология, ИФТ, цитогенетика (В-ОЛЛ, ТОЛЛ, лейкоз Беркитта)
• WHO, 2008 г. – В-ОЛЛ
- В-ОЛЛ с доп хромосомными
аномалиями
- Лейкоз Беркитта перенесен в
лимфома/лейкоз Беркитта
Bennet J.M. Br J Haematol 1976;33: 451-458
Harris N. J Clin Oncol 1999; 17: 3835-3849
Vardiman J.W. Blood 2009; 114: 937-951
Arber D.A. Blood 2016; 127: 2391-2405
41. КЛАССИФИКАЦИЯ ВОЗ, 2016
42. МОРФОЛОГИЧЕСКИЕ ВАРИАНТЫ В-ОЛЛ
L1-вариантL2-вариант
L3-вариант
43. ИММУНОФЕНОТИП
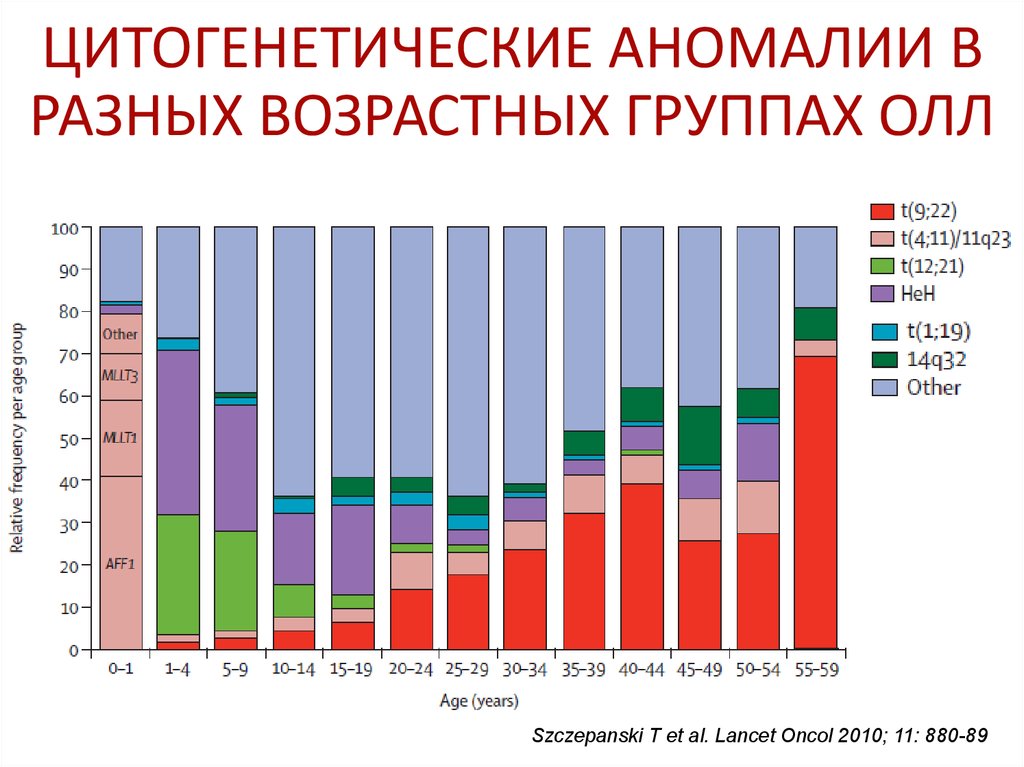
Соотношение В-ОЛЛ/ Т-ОЛЛ - 3/144. ЦИТОГЕНЕТИЧЕСКИЕ АНОМАЛИИ В РАЗНЫХ ВОЗРАСТНЫХ ГРУППАХ ОЛЛ
Szczepanski T et al. Lancet Oncol 2010; 11: 880-8945. ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ СТРАТИФИКАЦИЯ НА ГРУППЫ РИСКА
Группа рискаиммунофенотип
лейкоциты В-ОЛЛ
лейкоциты Т-ОЛЛ
ЛДГ
t (9;22), t (4;11)
% бластов в КМ / 7д
ремиссия
стандартный
common-В-ОЛЛ
пре-В-ОЛЛ,
тимический Т-ОЛЛ
< 30 х 109/л
< 100 х 109/л
< 960 ед
< 25%
35 день
высокий
пре-пре-В,
ранний Т-ОЛЛ,
зрелый Т-ОЛЛ,
билинейный
> 30 x 109/л
>100 х 109/л
> 960 ед
+
> 25%
> 35 дня
46. СТРАТЕГИЯ ТЕРАПИИ ОЛЛ
47. ТЕРАПИЯ ОЛЛ
Химиотерапевтическоевоздействие
Мониторинг минимальной резидуальной болезни
(МРБ)
Трансплантация стволовых клеток крови
Тагетная терапия (моноклональные антитела)
Новые цитостатические препараты
Дифференцированные подходы лечения
48. ПОЛИХИМИОТЕРАПИЯ ОЛЛ
исторически 3 основных принципаИндукция
Консолидация
Поддерживающая
терапия
КУРСЫ РЕИНДУКЦИИ
повтор модифицированной индукционной терапии
49.
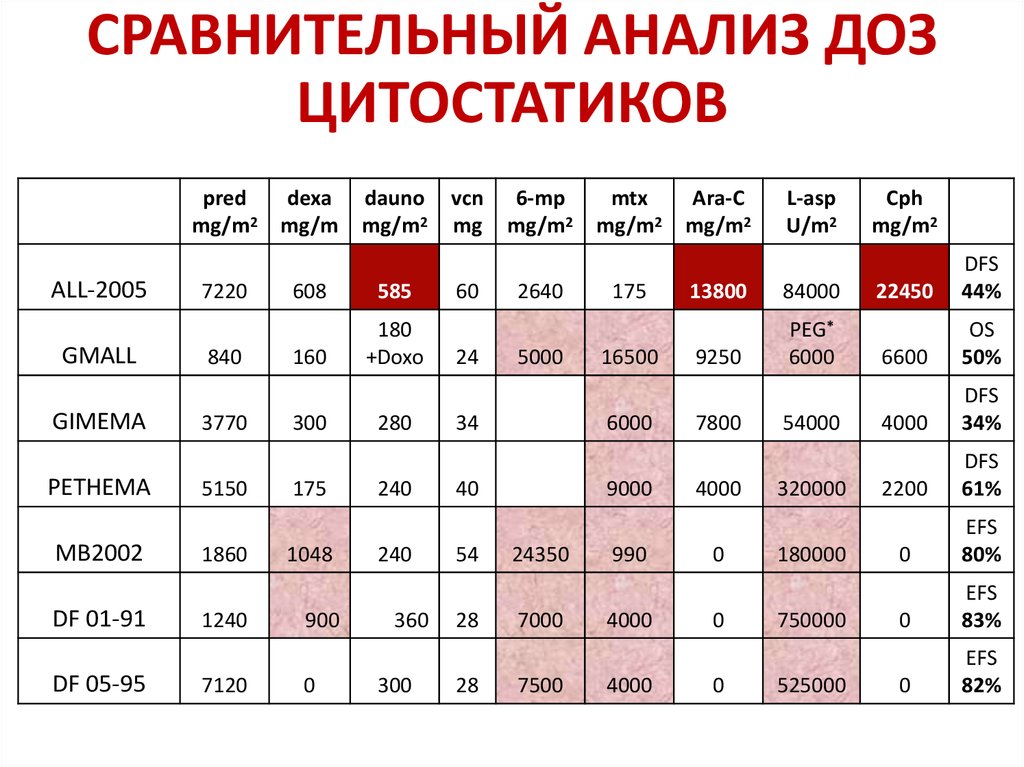
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ДОЗЦИТОСТАТИКОВ
pred
mg/m2
ALL-2005
GMALL
GIMEMA
PETHEMA
MB2002
DF 01-91
DF 05-95
7220
840
3770
5150
1860
1240
7120
dexa
mg/m
dauno
mg/m2
608
585
160
180
+Doxo
300
175
1048
900
0
280
240
240
360
300
vcn
mg
60
24
6-mp
mg/m2
2640
5000
34
28
28
175
16500
6000
40
54
mtx
mg/m2
9000
24350
7000
7500
990
4000
4000
Ara-C
mg/m2
L-asp
U/m2
13800
84000
9250
PEG*
6000
7800
4000
0
0
0
54000
320000
180000
750000
525000
Cph
mg/m2
22450
DFS
44%
6600
OS
50%
4000
DFS
34%
2200
DFS
61%
0
EFS
80%
0
EFS
83%
0
EFS
82%
50.
ПРИНЦИПЫ ТЕРАПИИ ОЛЛОсновной принцип терапии ОЛЛ – непрерывность
лечения с модификацией доз цитостатических
препаратов в зависимости от миелосупрессии
Интенсивное применение L-аспаргиназы,
дексаметазона, винкристина, метотрексата, пуринетола (6-МР)
51. ИНДУКЦИЯ
гормональная терапияот 28 до 36 дней доза
Dexa 6-10 мг/м2
антрациклины
3-4 введения
винкристин
3-6 введений
ПЭГ-аспарагиназа
2 введения
смена глюкокортикостероидной терапии в зависимости от
чувствительности опухолевых клеток. Низкая чувствительность
опухолевых клеток к преднизолону определяется у 77% взрослых больных
и у 50% подростков с ОЛЛ (ГНЦ МЗ РФ)
ХТ воздействие во время восстановления КМ после
агранулоцитоза с помощью ГКС + Аспарагиназы.
52. КОНСОЛИДАЦИЯ И РЕИНДУКЦИЯ
общая продолжительность лечения с момента началаиндукции и до поддерживающей терапии рекомендована 1922 недель
низкодозное ежедневное воздействие на опухолевый клон
важна непрерывность терапии вместо агрессивной
консолидации
фоновым препаратом является 6-МР с необходимой
модифакации его дозы в зависимости от миелосупрессии
эффективность курсов реиндукции = необходимо на этапе
постремиссионной терапии повторить курс терапии с ГКС,
антрациклинами и винкристином
53. Консолидация и Реиндукция
КонсолидацияКОНСОЛИДАЦИЯиИРеиндукция
РЕИНДУКЦИЯ
основы курсов химиотерапии:
курс с Метотрексатом в высоких дозах на фоне
Пуринетола
курс с Цитарабином в высоких дозах ?
курс с Циклофосфаном и Цитарабином
(невысокодозным) на фоне Пуринетола
в течение всей консолидации около 6 введений ПЭГаспарагиназы
Желательно в первой линии терапии использование ПЭГаспарагиназы для уменьшения вероятности развития
аллергической реакции
54. ПОДДЕРЖИВАЮЩАЯ ТЕРАПИЯ
непрерывная терапия антиметаболитами с короткимипульсами дексаметазона
еженедельное применение метотрексата для облегчения
метаболической активации меркаптопурина в клетках
импульсное применение L-аспаргиназы, использование
синергизма Аспарагиназы с Метотрексатом на фоне пуринетола
длительная терапия Аспарагиназой для накопительной
суммарной дозы
продолжительность поддерживающей терапии 2 года
55. ПРОФИЛАКТИКА НЕЙРОЛЕЙКЕМИИ
на протяжении всей терапии (2,5 года) необходимопредусмотреть 15-16 интратекальных пункций
во время индукционной терапии профилактика
нейролейкемии каждую неделю
во время поддерживающей терапии профилактика
нейролейкемии каждые 3 месяца
включать ли в профилактику нейролейкемии краниальное
облучение? => Необходим анализ случаев нейрорецидивов
При использовании курсов с Метотрексатом и Цитарабином
в высоких дозах от краниального облучения можно
отказаться
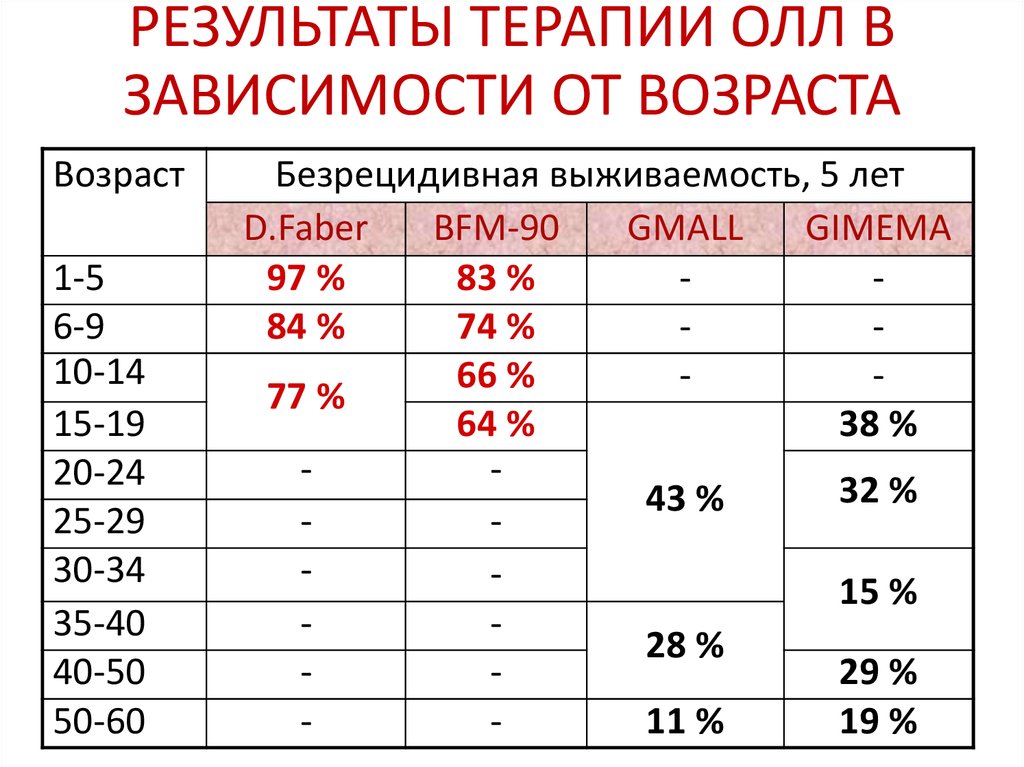
56. РЕЗУЛЬТАТЫ ТЕРАПИИ ОЛЛ В ЗАВИСИМОСТИ ОТ ВОЗРАСТА
Возраст1-5
6-9
10-14
15-19
20-24
25-29
30-34
35-40
40-50
50-60
Безрецидивная выживаемость, 5 лет
D.Faber
BFM-90
GMALL
GIMEMA
97 %
83 %
84 %
74 %
66 %
77 %
64 %
38 %
32 %
43 %
15 %
28 %
29 %
11 %
19 %
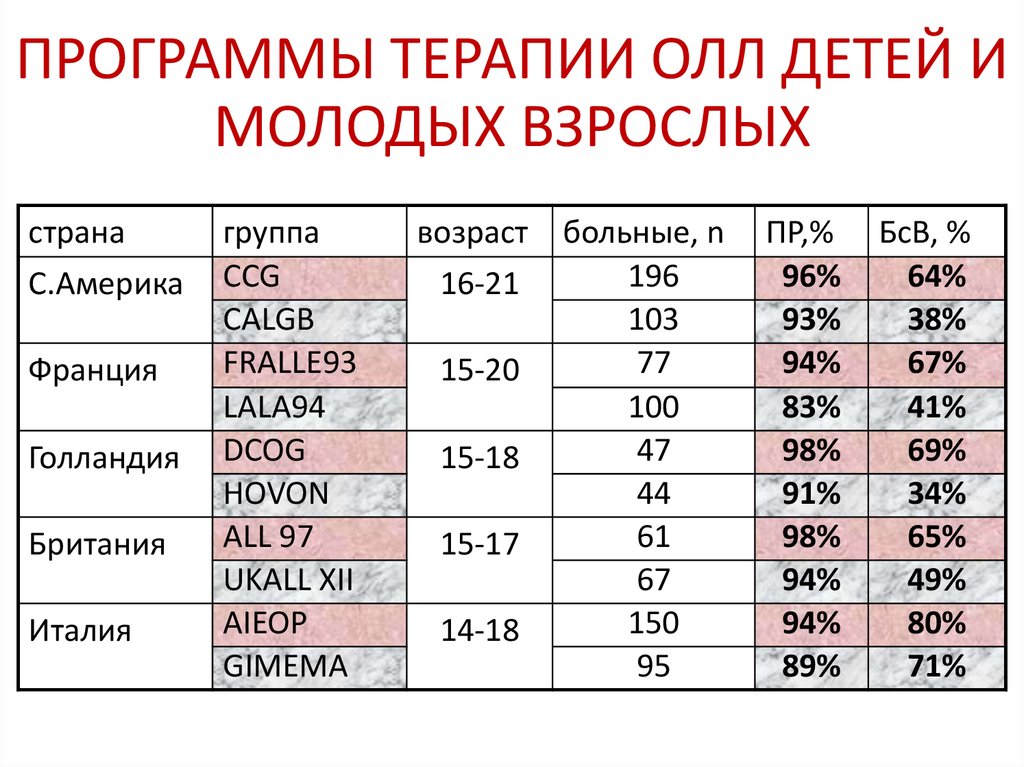
57. ПРОГРАММЫ ТЕРАПИИ ОЛЛ ДЕТЕЙ И МОЛОДЫХ ВЗРОСЛЫХ
странаС.Америка
Франция
Голландия
Британия
Италия
группа
CCG
CALGB
FRALLE93
LALA94
DCOG
HOVON
ALL 97
UKALL XII
AIEOP
GIMEMA
возраст
16-21
15-20
15-18
15-17
14-18
больные, n
196
103
77
100
47
44
61
67
150
95
ПР,%
96%
93%
94%
83%
98%
91%
98%
94%
94%
89%
БсВ, %
64%
38%
67%
41%
69%
34%
65%
49%
80%
71%
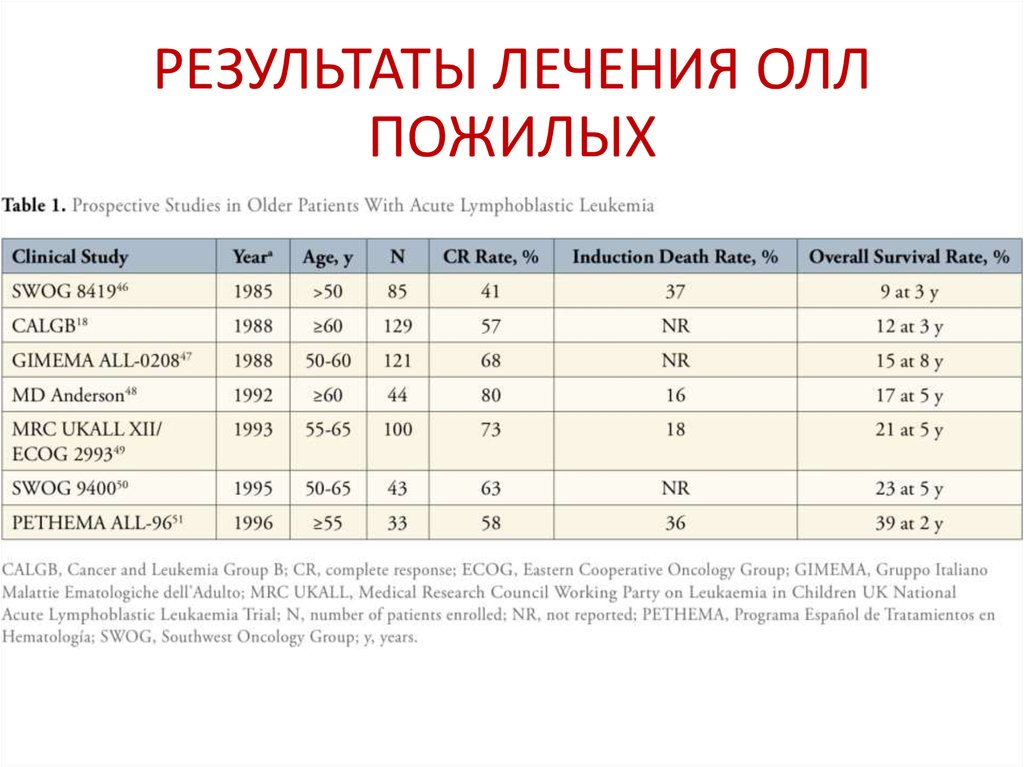
58. РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ ОЛЛ ПОЖИЛЫХ
59. Ph+ ОСТРЫЕ ЛИМФОБЛАСТНЫЕ ЛЕЙКОЗЫ
60. ЦИТОГЕНЕТИЧЕСКИЕ АНОМАЛИИ В РАЗНЫХ ВОЗРАСТНЫХ ГРУППАХ ОЛЛ
Szczepanski T et al. Lancet Oncol 2010; 11: 880-8961. РЕЗУЛЬТАТЫ ТЕРАПИИ Ph+ ОЛЛ ДО ЭРЫ ИМАТИНИБА
Полная ремиссия ≈ 70%Общая 5-летняя выживаемость при
использовании только ХТ ≈ 10%
Общая выживаемость при выполнении ТКМ ≈
30-35%
62. РЕЗУЛЬТАТЫ ТЕРАПИИ Ph+ ОЛЛ ПРИ ИСПОЛЬОВАНИИ ПХТ
ИсследованиеПациенты,
n
ПР, %
Медиана ПР, мес
Медиана ОВ,
мес
Bloomfield et al
29
46
7
11
Gotz et al
25
76
-
8
Larsen et al
30
70
7
11
GFCH
127
59
5
-
Secker-Walker et al
40
83
13
11
Wetzler et al
67
79
11
16
Faderl et al
67
90
10,8
16,5
Dombret et al
154
67
-
3-л ОВ 19%
Arico et al
326
82
5-л БРВ 28%
5-л ОВ 40%
Schrappe et al
61
75
5-л БРВ 38%
5-л ОВ 49%
Stock W., Wetzler M. Recent Progress in the treatment of ALL. Oct.2009
63. ИМАТИНИБ В ТЕРАПИИ Ph+ ОЛЛ
Увеличение ПР с 65-75% до 95%Повышение количества молекулярных ремиссий с
5% до ≈50%
Снижение смертности в индукции
Смертность в ПР 5-16%
Как ТГСК изменяет результаты терапии?
64. ИМАТИНИБ В ТЕРАПИИ Ph+ ОЛЛ
65. ВЛИЯНИЕ ТГСК НА РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ Ph+ ОЛЛ
Частота ТГСКТГСК
Алло
-родств.
- неродств.
Ауто
KOREA
Lee
2005
(n = 20)
GMALL
Wassmann
2006
(n=92)
JALSG
Yanada
2006
(n = 80)
GRAALL
De Labarthe
2007
(n=45)
MD Anderson
Thomas
2008
(n = 54)
PETHEMA
Ribera
2009
(n=32)
NILG
Bassan
2010
(n=59)
75%
77%
71%
48%
33%
78%
72%
85%
78%
26%
52%
2%
49%
23%
26%
51%
33%
54%
27%
27%
15%
20%
14%
7%
Смерть в
ремиссии
10%
5%
27%
11%
-
35%
18%
ОВ
60%
2,5 года
36-43%
2 года
61%
1 год
65%
1,5 года
49-66%
3 года
30%
4 года
38%
5 лет





















































 Медицина
Медицина








