Похожие презентации:
Коррозия металлов
1. Коррозия металлов
2.
СОДЕРЖАНИЕОсновные понятия
Виды коррозии
Скорость коррозии
Химическая коррозия
Электрохимическая коррозия
Анодный процесс
Катодный процесс
Деполяризаторы
Коррозия с водородной деполяризацией
Коррозия с кислородной деполяризацией
Поляризация электродных процессов
Пассивация
Литература
3.
4.
Основные понятиясодержание
Коррозия металлов самопроизвольное разрушение
металлов и сплавов в результате
химического и электрохимического
взаимодействия с агрессивной
средой.
5.
Виды коррозиисодержание
Атмосферная коррозия – коррозия металлов в естественных атмосферных условиях
(около 80% металлических конструкций эксплуатируются в атмосфере воздуха).
Коррозия в электролитах (солевая, кислотная, щелочная) – коррозия металлов в
проводящих электрический ток средах.
Грунтовая (почвенная) коррозия –коррозия металлов в почвах и грунтах.
Контактная коррозия – электрохимическая коррозия, вызванная контактом металлов,
имеющих разные электродные потенциалы в данной коррозионной среде.
Коррозия под напряжением – коррозия металла при одновременном воздействии
коррозионной среды и постоянных или переменных механических напряжений
(статических или меняющихся по величине и знаку).
Коррозия при трении (фретинг-коррозия) – при одновременном воздействии
коррозионной среды и сил трения.
Коррозия при кавитации – коррозия при ударном воздействии коррозионной среды.
Электрокоррозия – коррозия под действием токов рассеивания (блуждающих токов) и
тока от внешних источников.
Щелевая коррозия – коррозия, протекающая в узких щелях и зазорах между двумя
металлами или в местах неплотного контакта металла с неметаллическим
коррозионно- инертным материалом.
6.
7.
8.
Химическая коррозиясодержание
Это взаимодействие металлов с коррозионной
средой, при котором окисление металла и
восстановление окислительного компонента
коррозионной среды протекает без
пространственного разделения процессов
окисления и восстановления:
nMe + m/2 O2 = MenOm
9.
10.
11.
12.
Виды коррозииСплошная (общая)
Равномерная коррозия
Неравномерная коррозия
Избирательная коррозия
Местная (локальная коррозия)
Коррозия пятнами
Коррозия язвами
Точечная коррозия (питтинг)
Межкристаллитная коррозия
Коррозионное растрескивание
содержание
13.
Примеры геометрических видов коррозииН.
К
.
Н
.
К.
сплошная
Н
.К.
язвенная
Н
.
К.
межкристаллическая
точечная
14. По виду коррозионной среды
ПочвеннаяГазовая
Жидкостная
Атмосферная
Кислотная
Щелочная
Солевая
Морская
Речная
15.
16.
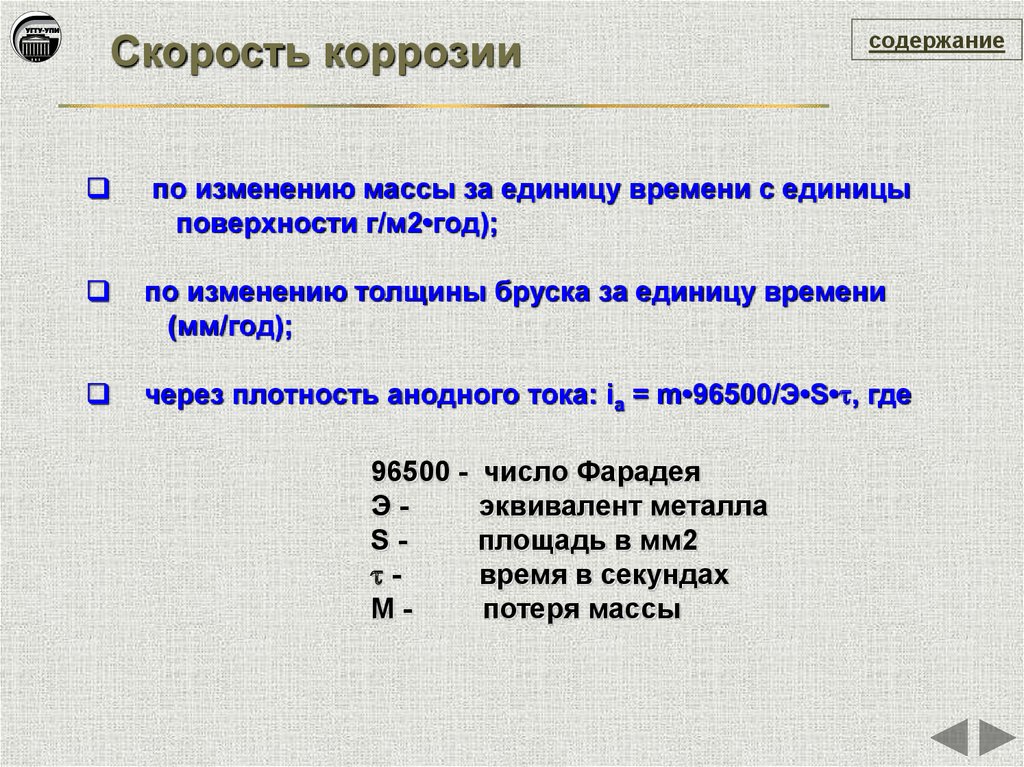
Скорость коррозиисодержание
по изменению массы за единицу времени с единицы
поверхности г/м2•год);
по изменению толщины бруска за единицу времени
(мм/год);
через плотность анодного тока: ia = m•96500/Э•S• , где
96500 ЭS M-
число Фарадея
эквивалент металла
площадь в мм2
время в секундах
потеря массы
17.
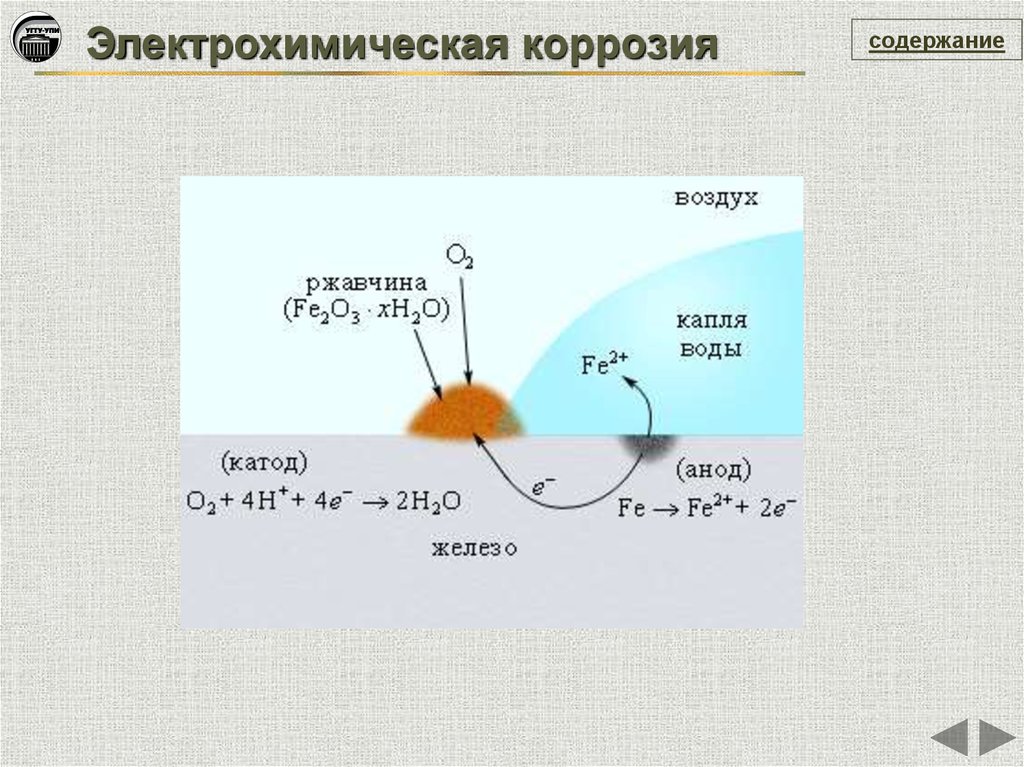
Электрохимическая коррозиясодержание
Это самопроизвольное разрушение металлов в
присутствии электролитически проводящих сред
(раствор или расплав электролита), при котором
окисление (ионизация) металла и восстановление
окислительного компонента коррозионной среды
пространственно разделены и представляют собой
различные стадии сопряженного процесса
окисления-восстановления
Me - ne = Men+
Анодный процесс
Ox + ne = Red
Катодный процесс
18.
Электрохимическая коррозиясодержание
19.
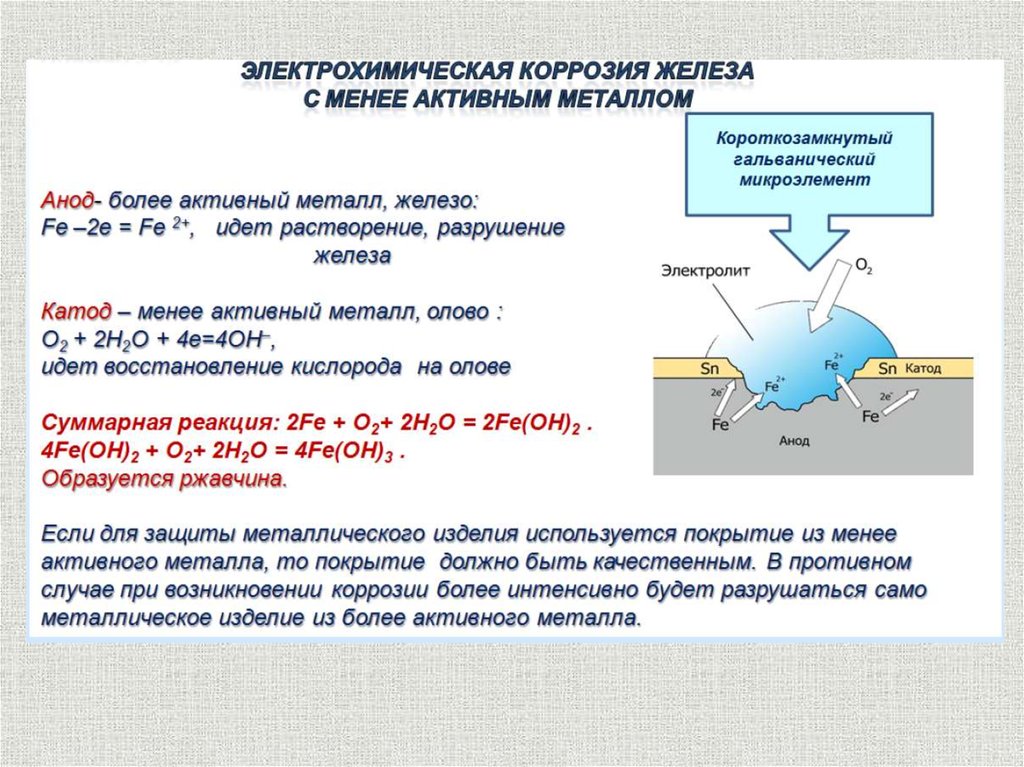
Электрохимическая коррозиясодержание
Причины электрохимической гетерогенности
Контакт двух и более металлов с различными
потенциалами
Контакт металла с различными средами
Наличие на поверхности металла оксидных пленок
Структурная неоднородность металла
Неоднородность внутренних напряжений в металле
Разность температур на различных участках металла
20.
Анодный процесссодержание
Me - ne = Men+
Gо = – ЕоnF
G <0, когда E > 0
Самопроизвольный процесс
E oок ля E oв ля
21.
Катодный процесссодержание
Уравнения катодного процесса
в отсутствие растворенного
кислорода (с водородной
деполяризацией)
в присутствии растворенного
кислорода (с кислородной
деполяризацией)
кислая среда
2H 2O 2e H 2 2OH (1) O2 4H 4e 2H 2O (3)
нейтральная и щелочная среда
2H 2e H 2
(2)
O2 4H 4e 2H 2O (4)
22.
ДеполяризаторыДля реакций:
содержание
2H+ +2e = 2H2
E 2H /H E o2H /H 0,059pH
O2 + 4e + 4H+ = 2H2O
E0O2/2H2O 1,23 0,059pH.
2
2
23.
24.
Катодный процесссодержание
Коррозия металлов с водородной деполяризацией
Металл
5
Н2
6
Раствор
7
8
К
3
9
2
1 H+
δ
П
Схема катодного процесса с водородной деполяризацией
25.
Катодный процесссодержание
Коррозия металлов с водородной деполяризацией
0
E 2H /H
2
= - 0,059рН
Для кислой среды
E 02H /H 0В
Для нейтральной среды
E 02H 2O/H 0,414 B.
Для щелочной среды
E 02H 2O/H 0,827B.
2
2
2
Коррозия с водородной деполяризацией возможна, если:
E 02H /H E 0Me2 /Me
2
26.
Катодный процесссодержание
Коррозия металлов с водородной
деполяризацией протекает в следующих
условиях:
для большинства металлов в растворах кислот
для активных металлов в нейтральных растворах
для амфотерных металлов в растворах щелочей
27.
Катодный процесссодержание
Коррозия металлов с кислородной деполяризацией
Металл
O2
6
2
5O2 2H 2O 4e 4OH
К
4
δ
3
П
Схема катодного процесса с кислородной деполяризацией
28.
Катодный процесссодержание
Коррозия металлов с кислородной деполяризацией
O2 2H 2O 4e 4OH
E0O2/2H2O 1,23 0,059pH.
E0O2 /2H2O 1,23B.
Для кислой среды
Для нейтральной среды
E0O
Для щелочной среды
E0O
/4OH
2
/4OH
2
0,81B.
0,40B.
Коррозия с кислородной деполяризацией возможна, если:
E 0O
2 /4OH
E 0Me n /Me
29.
Поляризация электродных процессовИзменение потенциала электрода при
прохождении тока называется
поляризацией:
ΔЕ = Еi – EР
где ΔЕ – поляризация;
Еi - потенциал электрода под током;
ЕР – равновесный потенциал
содержание
30.
31.
32.
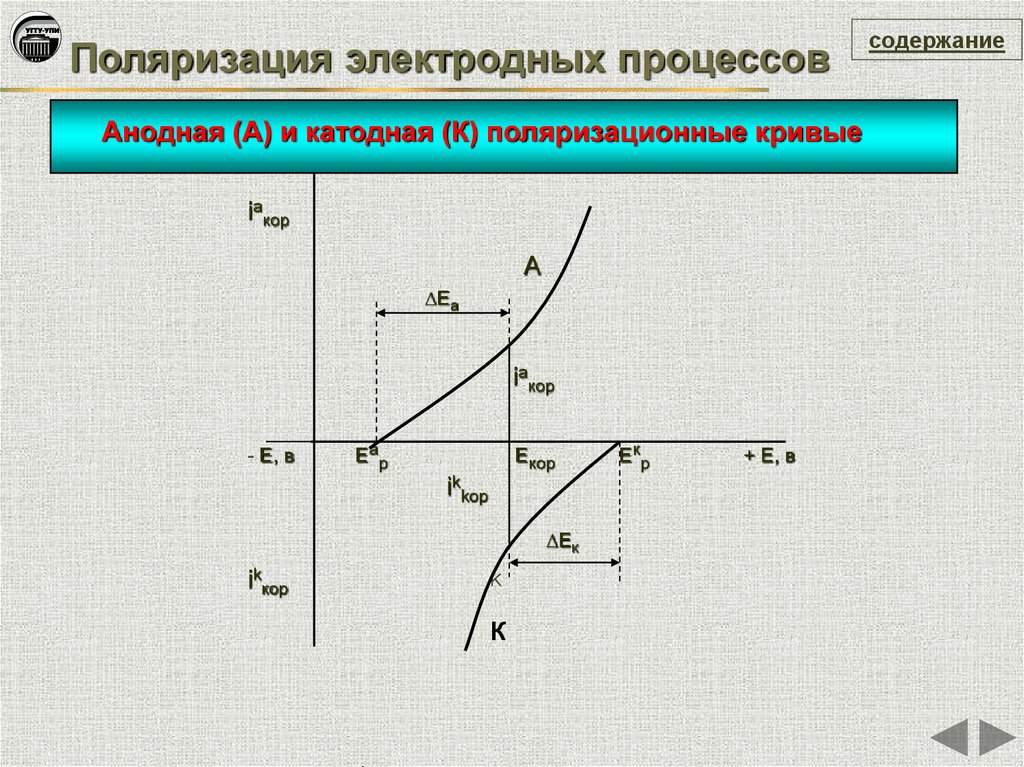
Поляризация электродных процессовАнодная (А) и катодная (К) поляризационные кривые
iaкор
A
ΔЕа
iaкор
- Е, в
Е ар
Екор
ikkop
ΔЕк
ikкор
K
К
Екр
+ Е, в
содержание
33.
Пассивациясодержание
I – активное растворение; II – переход в пассивное состояние;
III – пассивность; IV – перепассивация; V – выделение кислорода.
34.
Выводы и заключениясодержание
Электрохимическая коррозия протекает
через сопряженные процессы анодного
растворения металла и катодного
восстановления окислителя.
35.
Список литературысодержание
1. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа.
2002.
2. О.М. Полторак, Л.М. Ковба. «Физико-химические основы
неорганической химии». М.: МГУ, 1994.
3. В.И. Горшков, И.А. Кузнецов. «Физическая химия». М.: МГУ,
1993.
4. А. Джонсон. Термодинамические аспекты в курсе
неорганической химии. М.: Мир. 1985.
5. Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984. Т.1. 6.
Хьюи Дж. Неорганическая химия. Строение вещества и
реакционная способность. М., Химия, 1987.
7. Фичини Ж., Ламброзо-Бадер Н., Депезе Ж.-К. Основы
физической химии. М. Мир. 1972. стр.276-283.
8. Дж. Кемпбел. Современная общая химия. М.:Мир. 1975г. Т.2.
стр.90. гл.20., Т3.
9. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. М.:
Мир,1982. Т. 2.
10. Б.Б.Дамаскин, О.А.Петрий. Электрохимия. М: Высшая школа,
1987.
11. CRC Hand book of Chemistry and Physics. 82 издание. 2001-2002.































 Химия
Химия








