Похожие презентации:
Комплексные соединения
1. Комплексные соединения
2. УМК «ХИМИЯ»
Тема лекции:Комплексные
соединения
Лектор – Иванов М.Г.
3.
СОДЕРЖАНИЕОсновные понятия
Классификация
Номенклатура
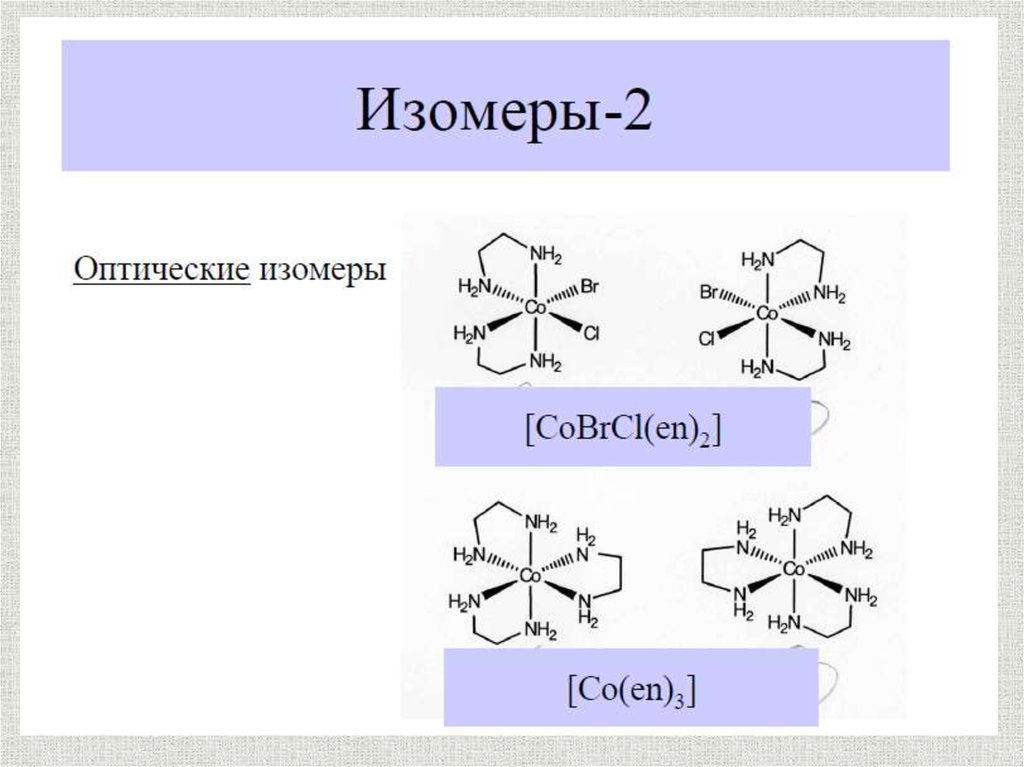
Изомерия
Геометрическая
Оптическая
Связевые изомеры
Гидратные и ионизационные изомеры
Конформационные изомеры
Лиганды
Хелатные комплексы
Макроциклические
Сэндвичевые комплексы
Многоядерные комплексы
Строение комплексов
Метод ВС
Теория кристаллического поля
Расщепление d-орбиталей
Сильное и слабое поле
Устойчивость комплексов
Литература
4.
5.
6.
Классификациясодержание
А. Вернер (1866-1919)
Согласно теории Вернера – Миолати
существует три типа классических
комплексов:
Координационные ацидосоединения, во внутренней
сфере которых содержатся только кислотные остатки;
Молекулярные координационные соединения, во
внутренней сфере которых содержатся только лиганды
в молекулярной форме;
Смешанные ацидо-молекулярные координационные
соединения.
7.
8.
9.
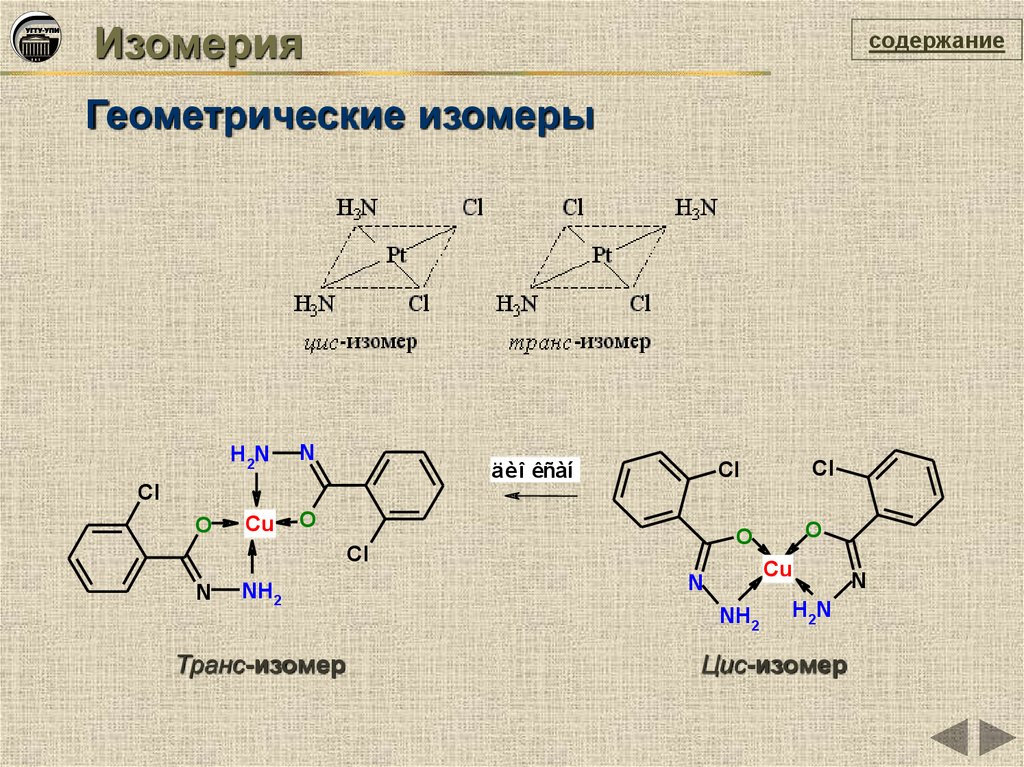
Изомериясодержание
Геометрические изомеры
H2N
N
Cu
O
Cl
Cl
äèî êñàí
Cl
O
Cl
N
NH2
Транс-изомер
O
O
Cu
N
NH2
H2N
Цис-изомер
N
10.
11.
12.
13.
14.
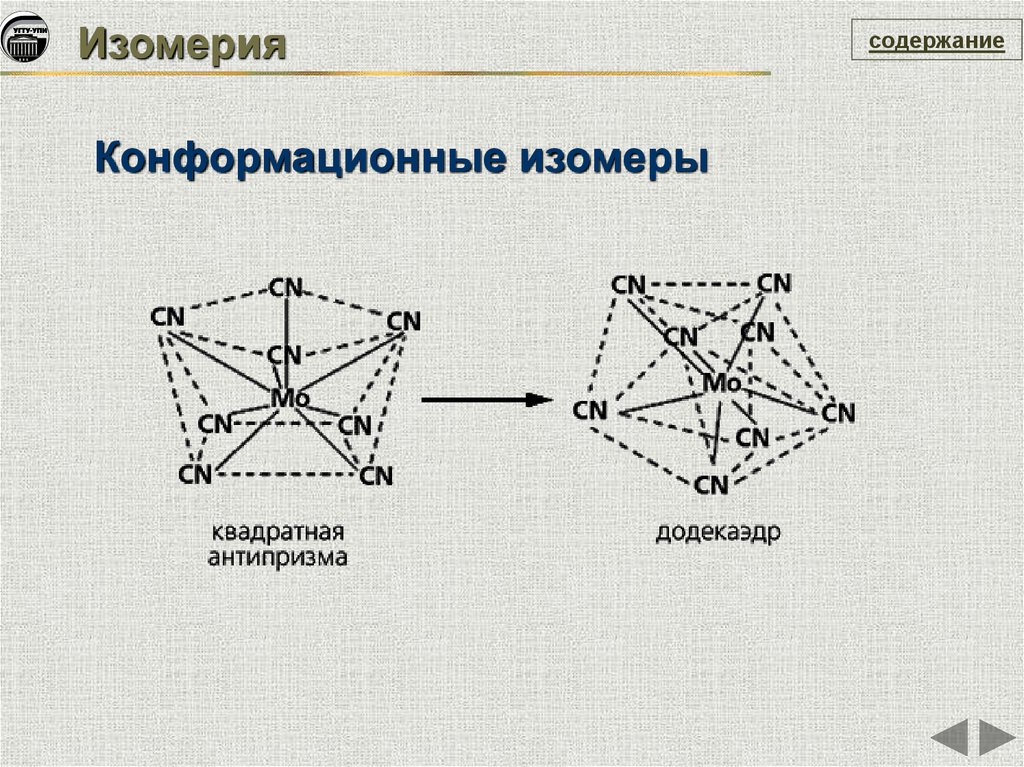
ИзомерияКонформационные изомеры
содержание
15.
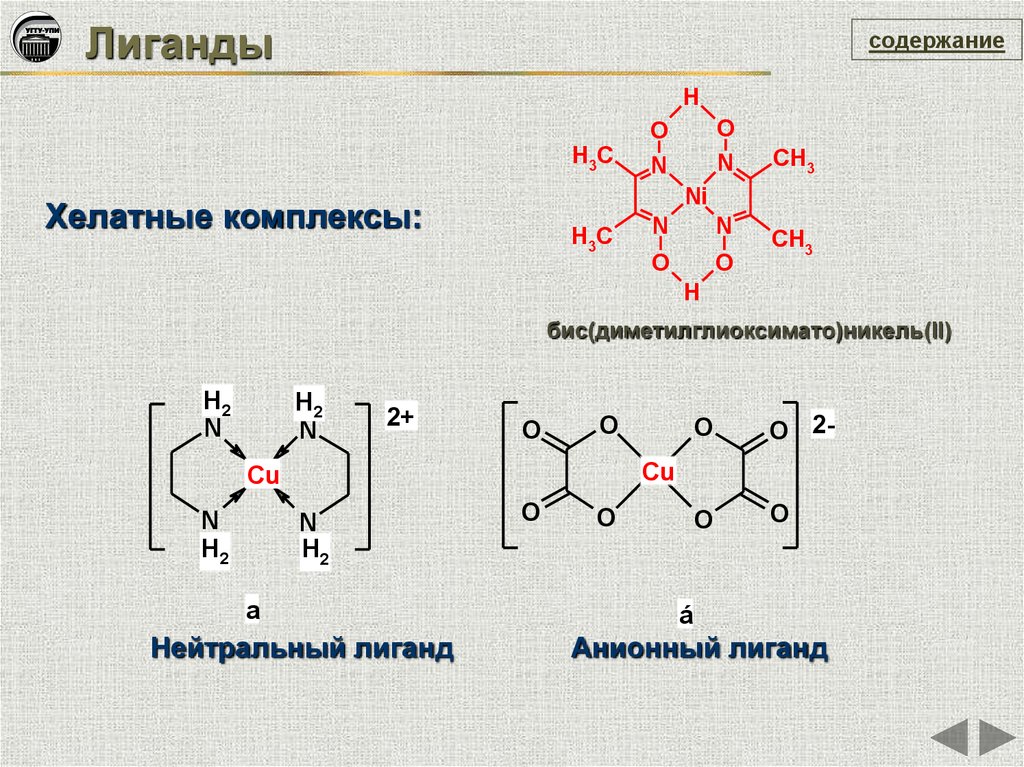
Лигандысодержание
Типы:
нейтральные: H2O, NH3, CO, Н2N-CH2-CH2-NH2
анионы:
Cl-, OH-, CN-, F-, оксалат-ион- С2O42-
Дентатность:
Монодентатные:
H2O, NH3, CO, Cl-, OH-, CN-, F-
Полидентатные:
Н2N-CH2-CH2-NH2, С2O42-
16.
Лигандысодержание
H
O
N
O
H3C
N
CH3
Ni
Хелатные комплексы:
H3C
N
N
O
O
CH3
H
бис(диметилглиоксимато)никель(II)
H2
N
H2
N
2+
O
O
O 2-
O
O
Cu
Cu
N
H2
O
N
H2
a
Нейтральный лиганд
O
O
á
Анионный лиганд
17.
ЛигандыNH3
содержание
NH2
H2N
Макроциклический
(en)
2-3-2
H2N
NH HN
H
N
N
H
NH2
NH HN
(trien)
[Ni(H2O)6]2+ + n L
L=
NH3
n=
4
lg n=
8,12
[Ni(L)n(H2O)2]2+ + 4H2O
en
2
13,5
trien
2-3-2
1
1
13,8
14,6
18.
Лигандысодержание
Макроциклические
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
12-краун-4
15-краун-5
18-краун-6
19.
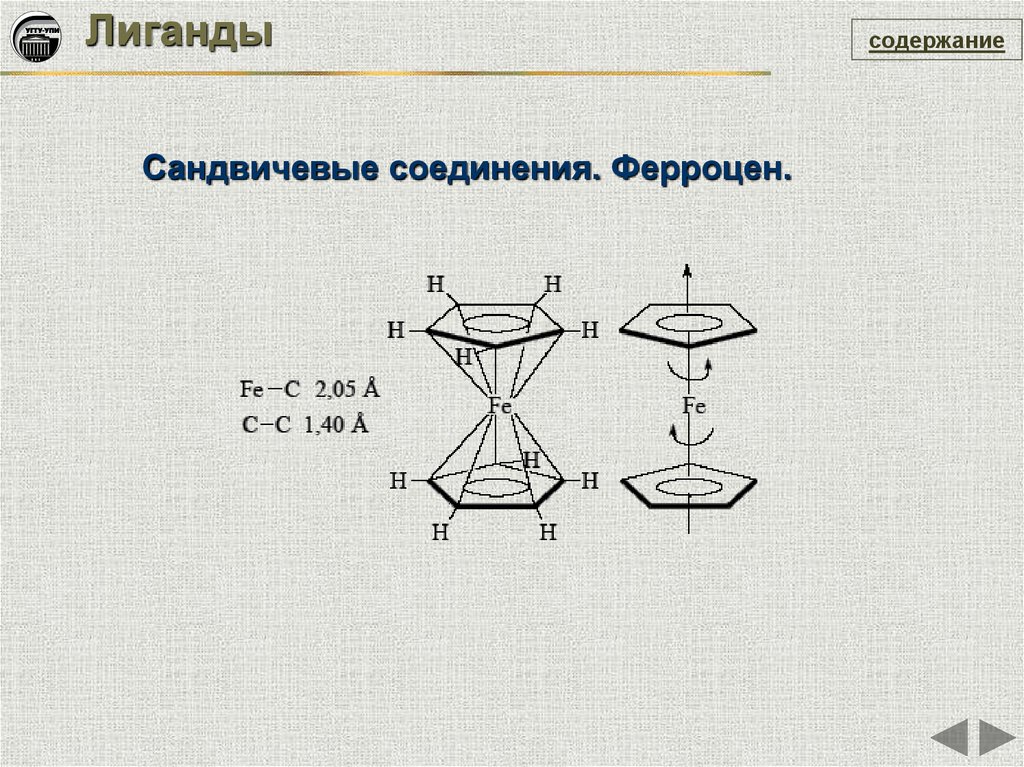
ЛигандыСандвичевые соединения. Ферроцен.
содержание
20.
Лигандысодержание
Комплексоны
Этилендиаминтетрауксусная
кислота (ЭДТА) - H4edta
Оксиэтилендифосфоновая
кислота (ОЭДФ)
21.
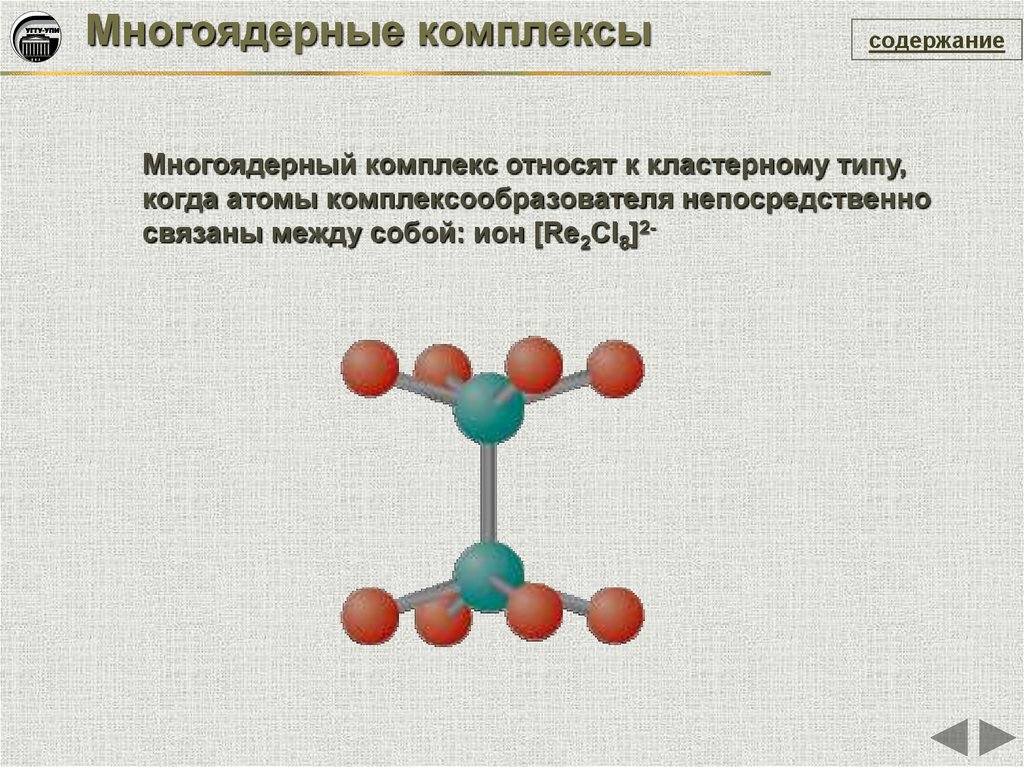
Многоядерные комплексысодержание
Многоядерный комплекс относят к кластерному типу,
когда атомы комплексообразователя непосредственно
связаны между собой: ион [Re2Cl8]2-
22.
Многоядерные комплексысодержание
Карбонильные кластеры:
CO (окись углерода), имеет свободные π* орбиты,
является важнейшим из лигандов π – акцепторов.
Os3(CO)12
Ir4(CO)12
[Os6(CO)18]2-
23.
Строение комплексовсодержание
Метод ВС
Донорно-акцепторное
взаимодействие :
центральный атомакцептор;
лиганд- донор
NH3
Геометрическая форма
молекулы – тетраэдр
Zn
NH3
NH3
NH3
24.
25.
26.
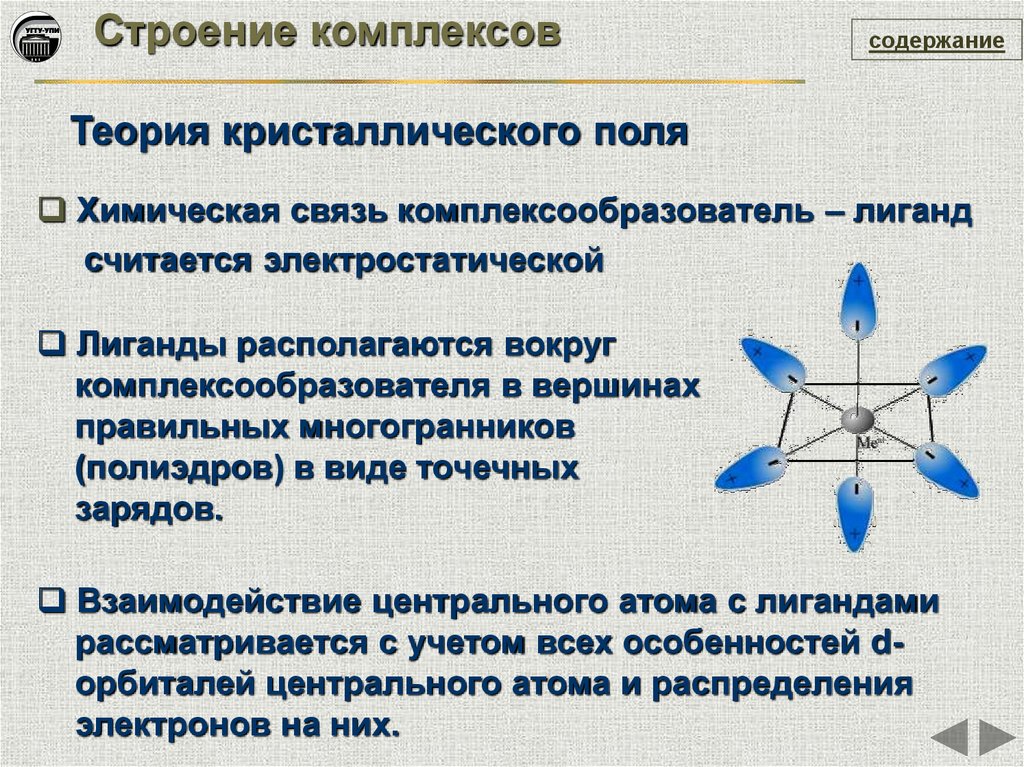
Строение комплексовсодержание
Теория кристаллического поля
Химическая связь комплексообразователь – лиганд
считается электростатической
Лиганды располагаются вокруг
комплексообразователя в вершинах
правильных многогранников
(полиэдров) в виде точечных
зарядов.
Взаимодействие центрального атома с лигандами
рассматривается с учетом всех особенностей dорбиталей центрального атома и распределения
электронов на них.
27.
28.
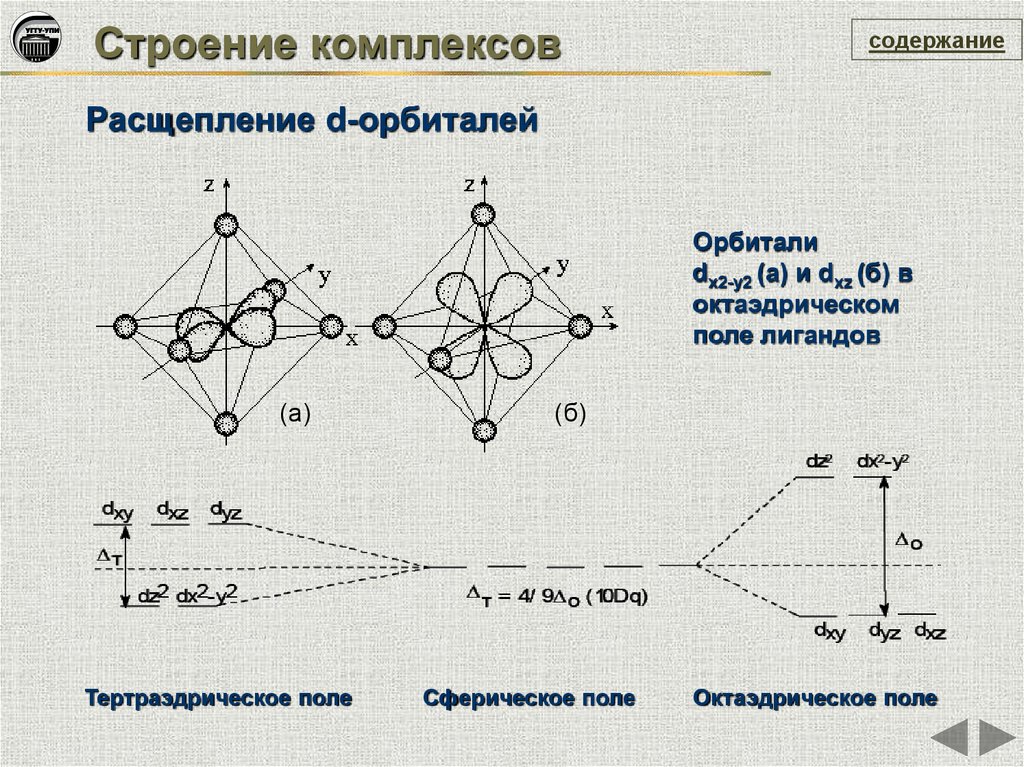
Строение комплексовсодержание
Расщепление d-орбиталей
Орбитали
dх2-у2 (а) и dxz (б) в
октаэдрическом
поле лигандов
(а)
Тертраэдрическое поле
(б)
Сферическое поле
Октаэдрическое поле
29.
Строение комплексовсодержание
Энергия расщепления октаэдрическим полем
3/5ΔO
ΔO
2/5Δ
O
ΔO –
энергия расщепления октаэдрическим полем
30.
Строение комплексовсодержание
Значения величин расщепления кристаллическим полем (Δ0) и
энергии спаривания (P)
31.
Строение комплексовсодержание
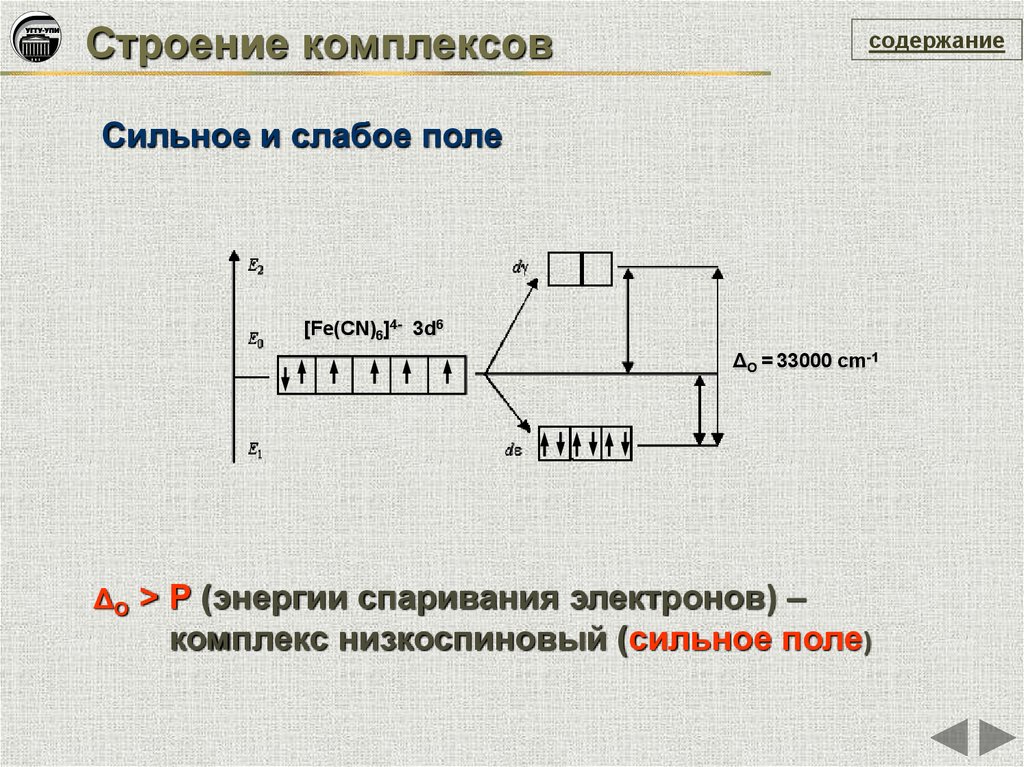
Сильное и слабое поле
[Fe(CN)6]4- 3d6
ΔO = 33000 cm-1
ΔO > P (энергии спаривания электронов) –
комплекс низкоспиновый (сильное поле)
32.
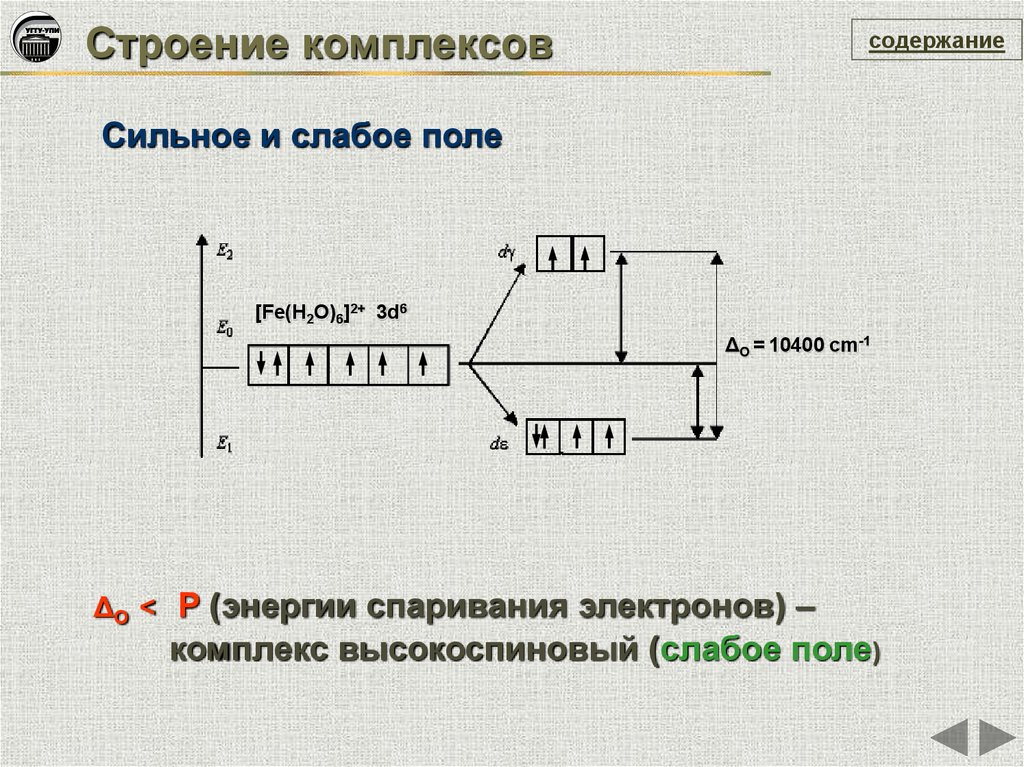
Строение комплексовсодержание
Сильное и слабое поле
[Fe(H2O)6]2+ 3d6
ΔO = 10400 cm-1
ΔO < P (энергии спаривания электронов) –
комплекс высокоспиновый (слабое поле)
33.
34.
35.
36.
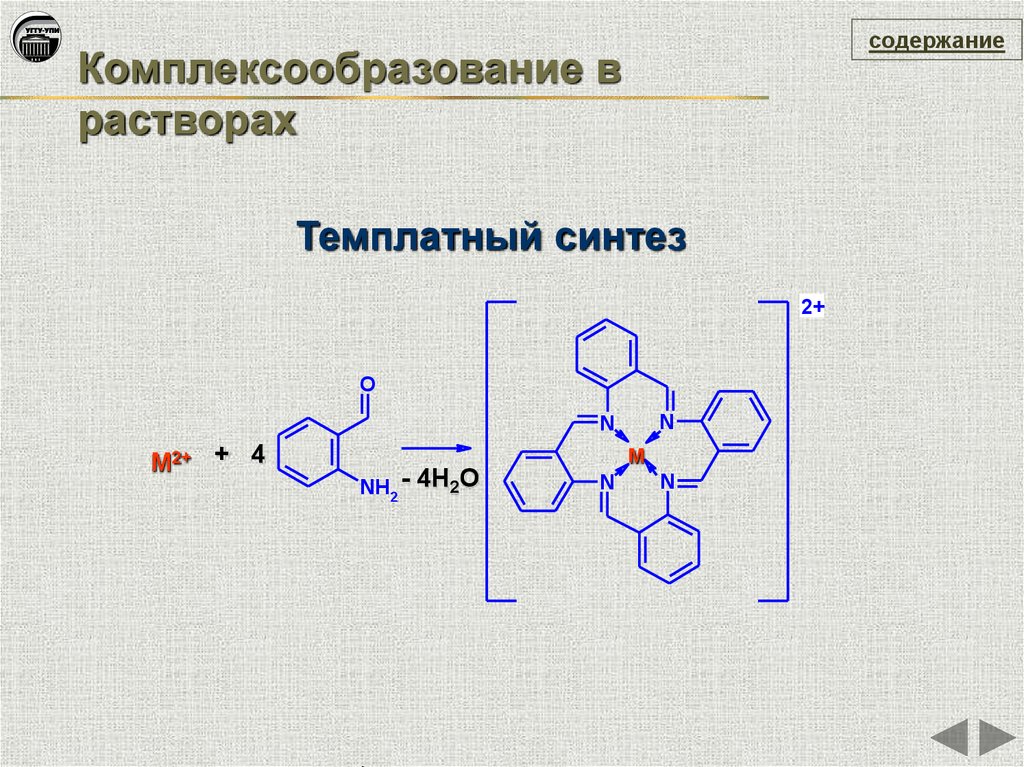
содержаниеКомплексообразование в
растворах
Темплатный синтез
2+
O
N
N
M2+ + 4
M
NH2 -
4H2O
N
N
37.
38.
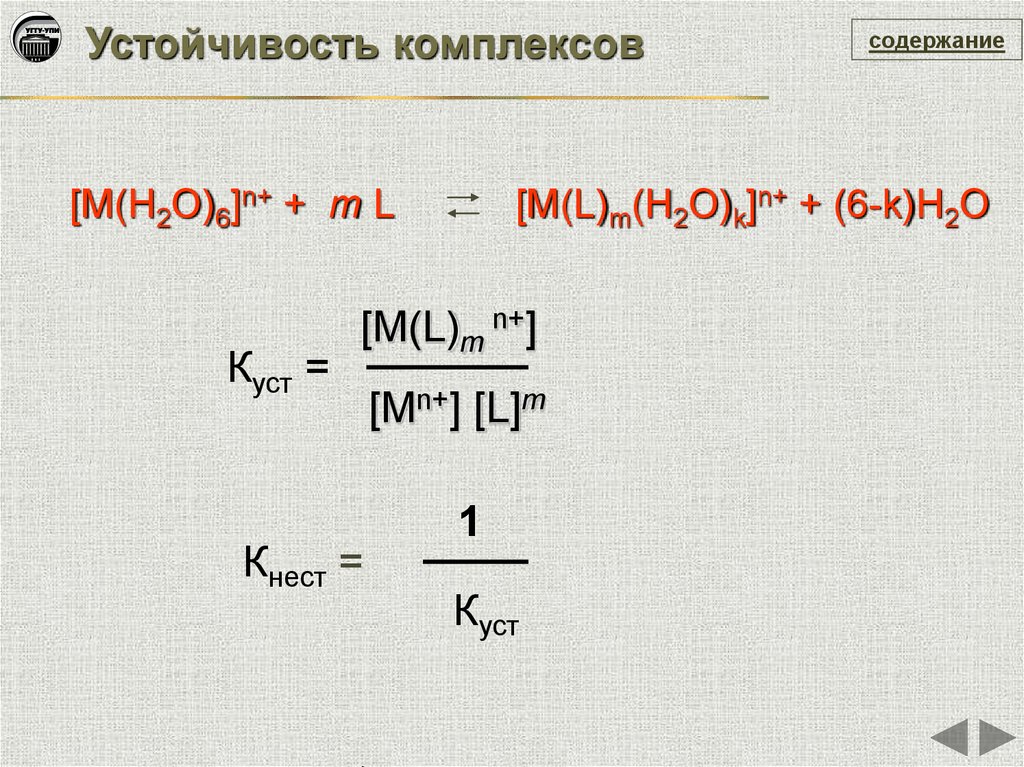
Устойчивость комплексов[М(H2O)6]n+ + m L
Куст =
[M(L)m(H2O)k]n+ + (6-k)H2O
[M(L)m n+]
Кнест =
содержание
[Mn+] [L]m
1
Куст
39.
Устойчивость комплексов[М]n+ + L
содержание
[ML]n+ ; [МL] n+ + L
К1 =
К2 =
[MLn+]
[Mn+] [L]
[ML2n+]
[MLn+] [L]
[ML2]n+
= К1К2…Km
ΔG0
= –RT ln(β)
40.
Разрушение комплексов[Cu(NH3)4]2+
содержание
4NH3 + Cu2++ S2–
2+
β [Cu(NH3)4] = 2∙10
-13
CuS↓ + 4NH3
ПРCuS = 6∙10
–36
При добавлении S2-
[Сu(NH3)4]2+ Cu2+ + 4NH3 + 4H+
β [Cu(NH3)4]2+ = 2∙10-13
При избытке Н+
4NH4+ + Cu2+
β [NH4]+ = 6∙10-10
41.
Устойчивость комплексовсодержание
Константы нестойкости некоторых комплексов
Комплексный
ион
Kнест
Комплексный
ион
Kнест
[Co(NH3)6]2+
7,75 • 10–6
[Zn(OH)4]2–
3,6 • 10–16
[Ag(NH3)2]+
1,07 • 10–7
[Fe(CN)6]3–
1,0 • 10–31
[Cu(NH3)4]2+
2,14 • 10–13
[Fe(CN)6]4–
1,0 • 10–36
42.
43.
Выводы и заключениясодержание
Химия комплексных соединений
важнейшей является частью
неорганической химии.
Знание о природе взаимодействия
атомов металла и лигандов в
комплексе, позволяет представить
механизм образования, строение и
реакционную способность комплексных
соединений.
44.
Список литературысодержание
Кукушкин Ю.Н. Химия координационных соединений. М.:
Высшая школа, 1985.
Гринберг А.А. Введение в химию комплексных соединений.
М.; Л.: Химия, 1966.
Вернер А. Новые воззрения в области неорганической
химии. Л.: ОНТИ, 1936.
Коттон Ф., Уилкинсон Дж. Современная неорганическая
химия. М.: Мир, 1969.
Дятлова Н.М., Темкина В.Я., Попов К.И. Комплексоны и
комплексонаты металлов. М.: Химия, 1988.
О.В. Михайлов. Многоликая изомерия координационных
соединений //Природа, 2002, №5.
О.В. Михайлов. Что такое темплатный синтез// Соросвский
образовательный журнал, 1999, № 10.
































 Химия
Химия








