Похожие презентации:
Комплексные соединения
1. Лекция 13
Комплексныесоединения
2.
ПЛАН13.1 Основные понятия
химии комплексных
соединений(КС).
13.2 Строение КС.
13.3 Металло-лигандное
равновесие в растворах.
13.4 Биологическая роль КС.
3.
13.1 Комплексными(координационными)
соединениями называют
вещества, в структурных
единицах которых число связей,
образованных центральным
атомом, превышает его высшую
валентность.
4.
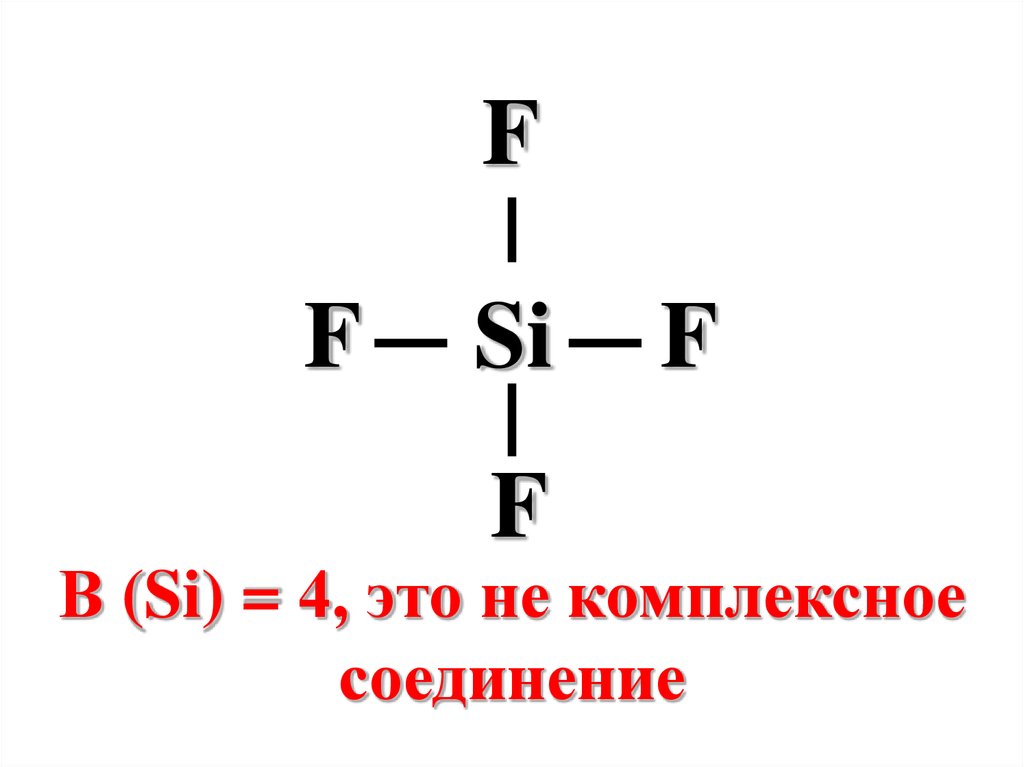
FF
Si
F
F
В (Si) = 4, это не комплексное
соединение
5.
2-F
F
F
Si
F
F
F
В (Si) = 6, это комплексное
соединение
6.
ClCl
Fe
Cl
В (Fe) = 3, это не комплексное
соединение
7.
ClCl
3-
Cl
Fe
Cl
Cl
Cl
В (Fe) = 6, это комплексное
соединение
8.
Комплексные соединениясостоят из:
• комплексообразователей
(Ме, реже неметаллы: Si, P и
др.);
• лигандов (ионов или полярных молекул);
• ионов внешней сферы (могут
отсутствовать).
9.
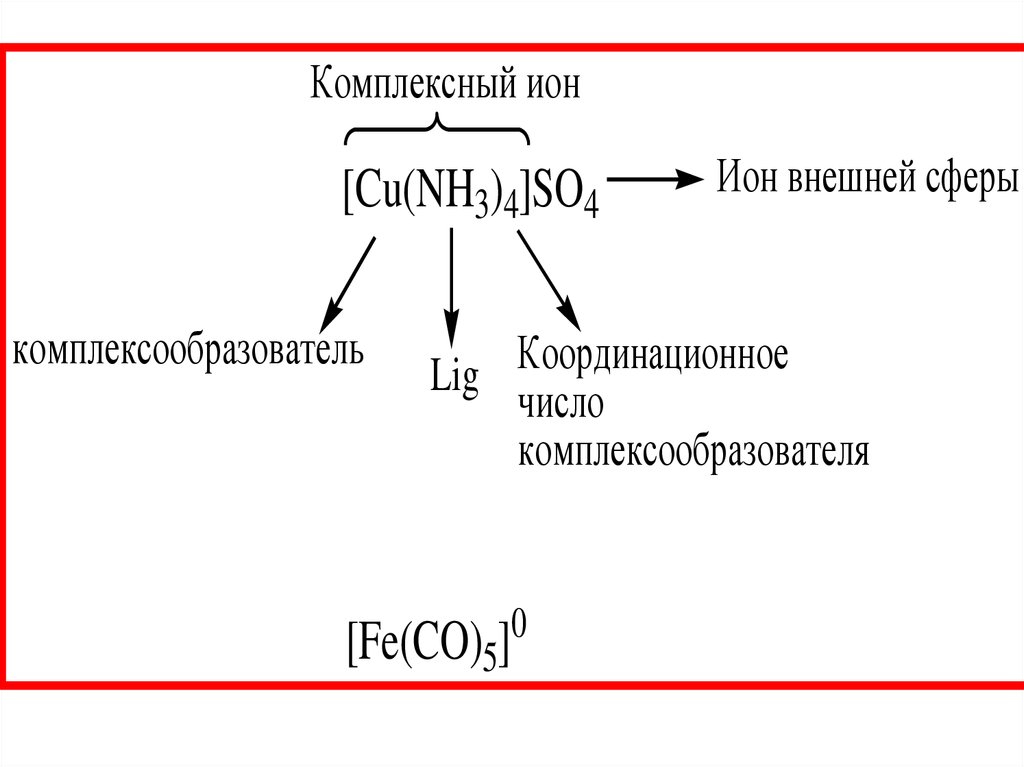
Комплексный ион[Cu(NH3)4]SO4
комплексообразователь
Ион внешней сферы
Координационное
Lig
число
комплексообразователя
[Fe(CO)5]
0
10.
В природе комплексныхсоединений больше, чем
простых. Их изучение
началось ~ 200 лет назад.
Первой теорией КС была
теория А. Вернера (1893).
11.
Швейцарскийхимик,
выдвинувший и
развивший
координационную
теорию строения
комплексных
соединений.
Лауреат
Нобелевской
премии 1913 г.
Альфред Вернер
1866-1919
12.
Важнейшей характеристикой комплексообразователя является егокоординационное число
(к.ч.), т.е. число связей,
образованных им с
лигандами.
13.
Степеньокисления Ме
+1
+2
+3
+4
к.ч.
2
4, 6
4, 6
6, 8
14.
Важнейшейхарактеристикой
лиганда является его
дентантность – число
связей, образованных с
комплексообразователем.
15.
Классификация лигандов•монодентантные лиганды:
а) анионы: OH‾, H‾, F‾, Cl‾,
Br‾, I‾, CN‾, CNS‾, NO2‾,
NO3‾;
б) молекулы: NH3, H2O, CO;
+
в) катионы: NH2NH3 .
16.
• бидентантные лиганды2
2
а)анионы: SO4 ‾, C2O4 ‾,
2
CO3 ‾;
б)молекулы:
NH2 – CH2 – CH2 – NH2
(этилендиамин)
NH2 – CH2 – COOH(глицин)
17.
•полидентантные лиганды. Важнейшими изних являются
комплексоны –
аминополикарбоновые
кислоты и их соли.
18.
Этилендиаминтетрауксуснаякислота (ЭДТА)
HOOCH2C
НOOCH2C
N H2C CH2 N
CH2COOН
CH2COOH
19.
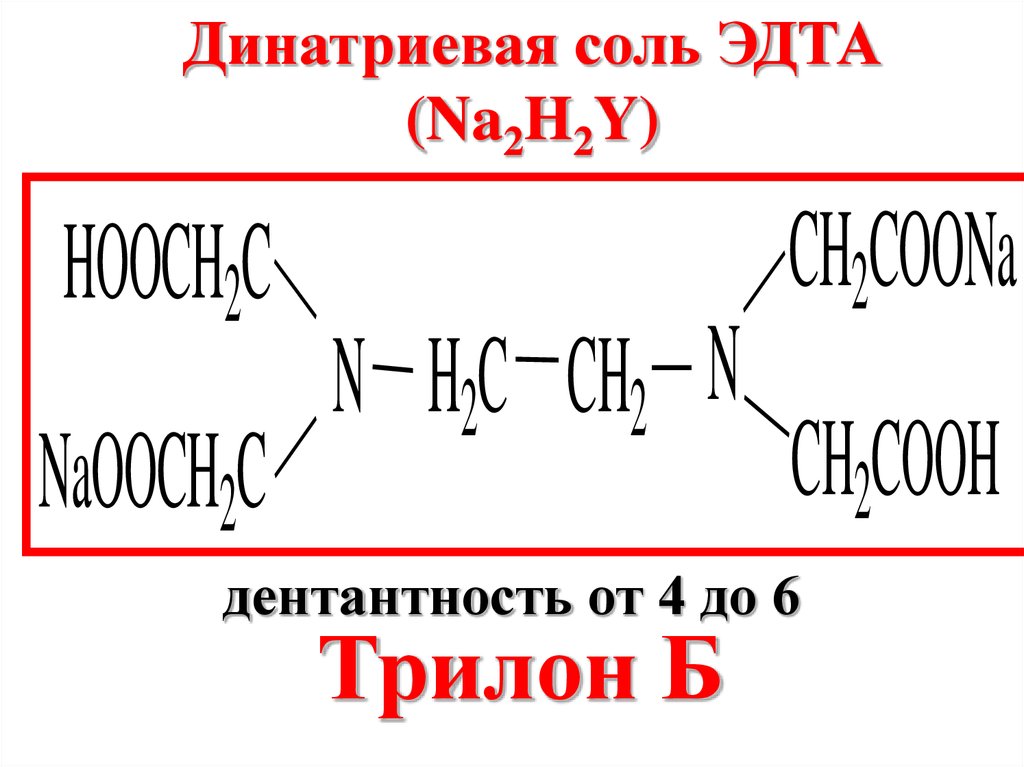
Динатриевая соль ЭДТА(Na2H2Y)
HOOCH2C
NaOOCH2C
N H2C CH2 N
CH2COONa
CH2COOH
дентантность от 4 до 6
Трилон Б
20.
Комплексоны находятприменение в медицине для
лечения мочекаменной болезни:
CaC2O4 + Na2H2Y ↔
2
↔[CaY] ‾
+ Na2C2O4 +
+
+2H
21.
Метод комплексонометрииявляется одним из методов
объемного анализа, в основе
которого лежит реакция
комплексообразования:
+ Na2H2Y ↔
2
+
+
↔MeY ‾ + 2 Na + 2 H
2+
Me
22.
Метод комплексонометриипозволяет определять
содержание катионов
2+
2+
2+
металлов Ca , Mg , Fe ,
3+
Fe и др. в растворах и
биологических жидкостях.
23.
Классификация комплексных соединений1) по природе лигандов
А)КС с монодентантными лигандами:
• аммиакаты
[Cu(NH3)4]Cl2
• аквакомплексы
[Cu(H2O)4]SO4
• гидроксокомплексы Na Al(OH)4
• ацидокомплексы
Na Ag(CN)2
• со смешанными
[Pt(NH3)2Cl2
лигандами
24.
Б) КСс би- и полидентантными
лигадами
Особую группу составляют
хелатные (клешневидные)
комплексы, содержащие
полидентантные лиганды,
образующие замкнутые
циклы
25.
H2C NH2NH2
CH2
NH2
CH2
Cu
H2C NH2
26.
Наиболее устойчивымиявляются
внутрикомплексные КС,
в которых часть связей
Me-Lig образованы по
обменному, а часть – по
донорно-акцепторному
механизму
27.
Сu(Гли)2O
H2C NH2
C=O
Cu
O=C O
CH
NH2 2
28.
Na2 CaYH 2C
H2C
NaOOCH2C
N
N
Ca
CH2
O=C O
CH2COONa
H 2C
O
Тетацин
C=O
29.
Тетацин применяется вмедицине как
лекарственный препарат
для детоксификации
организма при отравлении
тяжелыми металлами):
Hg2+ + [CaY]2‾ ↔ Ca2+ + [HgY]2‾
30.
Классификация комплексныхсоединений
2) По скорости
образования
комплексов:
лабильные
инертные
31.
НОМЕНКЛАТУРА КС(1960, ИЮПАК)
1) вначале называют
катионы, затем анионы.
Названия комплексных
анионов заканчиваются
суффиксом –ат;
32.
2) В комплексном ионесначала называют лигандыанионы, затем лигандымолекулы, затем лигандыкатионы:
NH3 – аммин
H2O – аква
СО – карбонил
33.
Названия лигандов-анионовзаканчиваются на – о:
OH‾ –гидроксо CN‾ – циано
NO2‾ – нитро
СNS‾ – родано
NO3‾ –нитрато SO42‾ –сульфато
Катион-лиганд гидразиниум
+
NH2NH3
34.
Названиянекоторых
комплексообразователей зависит от
их положения в КС
35.
МеFe
Hg
Au
Ag
Cu
Sn
Названия
В комплексном В комплексном
катионе
анионе
Железо
Ртуть
Золото
Серебро
Медь
Олово
Феррат
Меркурат
Аурат
Аргентат
Купрат
Станат
36.
Степень окислениякомплексообразователя
указывают, если у
металла их несколько.
37.
Na[Al(OH)4]натрий тетрагидроксоалюминат
[Cu(NH3)4]SO4
тетраамминмедь(II) сульфат
NH4[Co(NH3)2(NO2)4]
аммоний
тетранитродиамминкобальтат(III)
[Pt(NH3)2Cl2
дихлородиамминплатина
38.
13.2 Строение КСописывается либо в
рамках метода ВС,
либо с позиций теории
кристаллического
поля.
39.
С позиций метода ВСсвязи металл-лиганд
являются ковалентными
полярными,
образованными по
донорно-акцепторному
механизму.
40.
Лиганды выступают вроли доноров
электронных пар, а
комплексообразователи
– в роли их акцепторов.
41.
NH
Донор
Men+
+
Акцептор
H
N
H
H
●
H
.●
H
Схема взаимодействия
металлов и лигандов
Men+
Аддукт
42.
Конфигурациякомплексного иона
определяется типом
гибридизации АО
комплексообразователя.
43.
К.ч. Тип гибридизации Конфигурация2
sp
Lig
Примеры
Ag(NH3)2 +
Lig
Линейная
Lig
4
sp3
Lig
Zn(NH3)4 2
Lig
+
Lig
Тетраэдрическая
Lig
Lig
dsp2
AuCl4
Lig
Lig
Квадратно-плоскостная
44.
К.ч. Тип гибридизации6
3
2
sp d
Конфигурация
Lig
Lig
Примеры
CoF6 3Lig
Lig
Lig
Lig
Co(NH3)6 3+
Октаэдрическая
45.
Теория кристаллическогополя исходит из того, что
металлы и лиганды
связаны между собой
силами
электростатического
притяжения.
46.
Эта теориярассматривает
воздействие лигандов
на d-орбитали ионакомплексообразователя.
47.
Если катион металланаходится в симметричном
магнитном поле, его
d-орбитали имеют
одинаковый запас энергии
(являются
вырожденными).
48.
Если ион находится воктаэдрическом,
тетраэдрическом или другом
несимметричном поле
лигандов, то происходит
расщепление его dподуровня.
49.
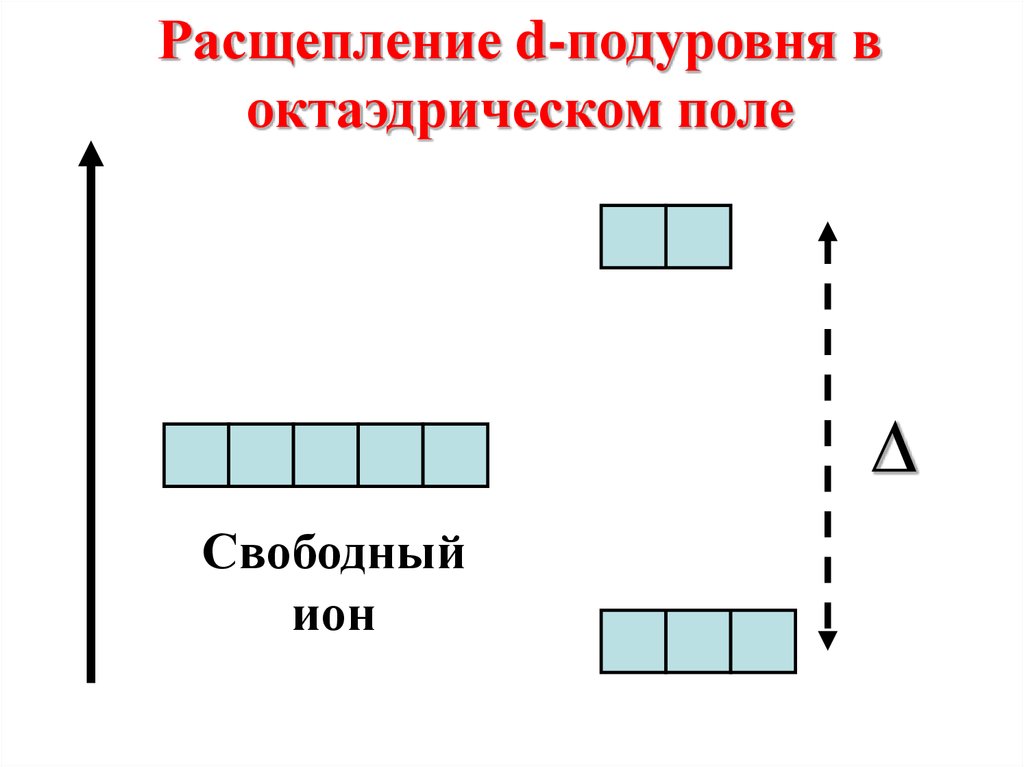
Расщепление d-подуровня воктаэдрическом поле
∆
Свободный
ион
50.
Расщепление d-подуровня втетраэдрическом поле
∆
Свободный
ион
51.
Величина энергиирасщепления (∆)
зависит от
конфигурации
комплекса и природы
лиганда.
52.
Спектрохимический рядлигандов
I‾,Cl‾,F‾, OH‾,H2O,CNS‾, NH3,NO2‾, CN‾
Слабые Lig
Сильные Lig
Увеличение энергии расщепления
∆
53.
В поле слабых лигандовэнергия расщепления (∆)
не велика, поэтому
распределение электронов
на d-орбиталях
соответствует правилу
Гунда
54.
В поле сильных лигандовэнергия расщепления (∆) имеет
большое значение, в следствие
чего первыми заполняются
d-орбитали нижнего подуровня
(распределение электронов
происходит против правила
Гунда).
55.
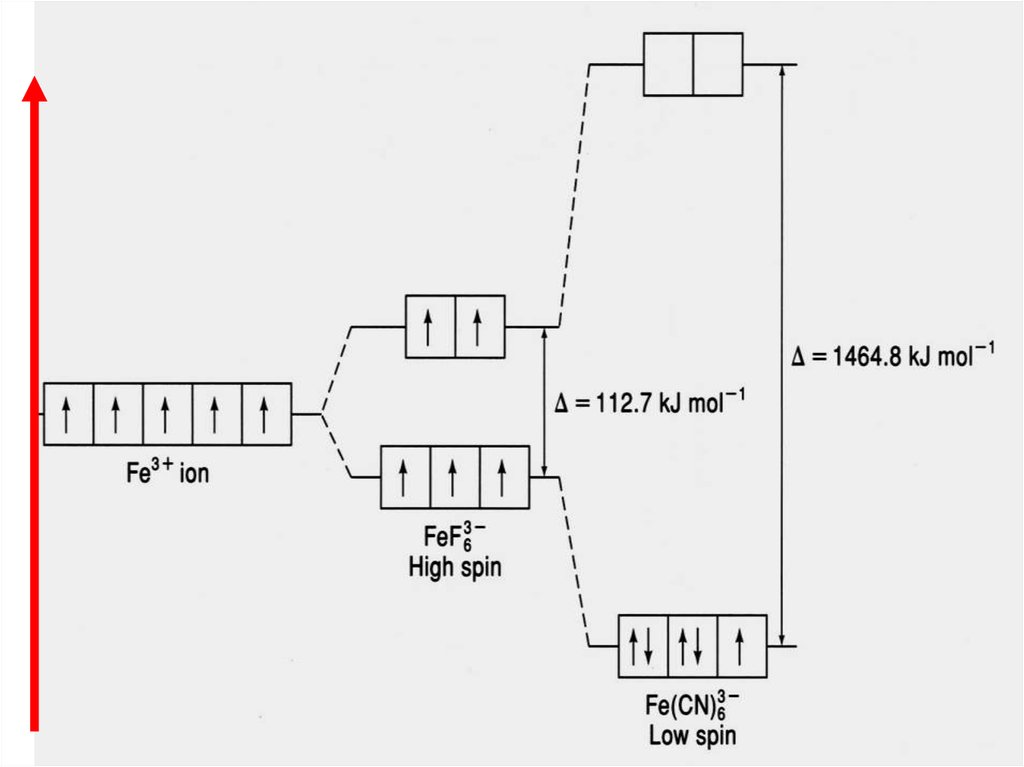
Рассмотрим строение КС:х
-1
[FeF6
3
]‾
х
-1
[Fe(CN)6
х–6=–3
х=+3
3
]‾
56.
Координационное3+
число катиона Fe
равно 6, так как он
связан с шестью
монодентантными
лигандами
57.
Электроннаяконфигурация атома и
иона
Fe
2
6
4s 3d
3+
Fe
0
5
4s 3d
58.
Оба комплексных ионаимеют октаэдрическую
конфигурацию, что
обуславливает
одинаковый характер
расщепления dорбиталей
59.
F является «слабымлигандом»
(∆ = 112,7 кДж/моль),
поэтому распределение
3+
электронов катиона Fe
происходит в соответствии
с правилом Гунда
60.
CN является «сильнымлигандом»
(∆ = 1464,8 кДж/моль),
поэтому распределение
3+
электронов катиона Fe
происходит против
правила Гунда
61.
62.
Ион FeF6парамагнитен, так как
содержит неспаренные
электроны на внешнем
уровне
(высокоспиновый
комплекс).
3]
63.
Ион Fe(СN)6диамагнитен,
(низкоспиновый
комплекс).
3]
64.
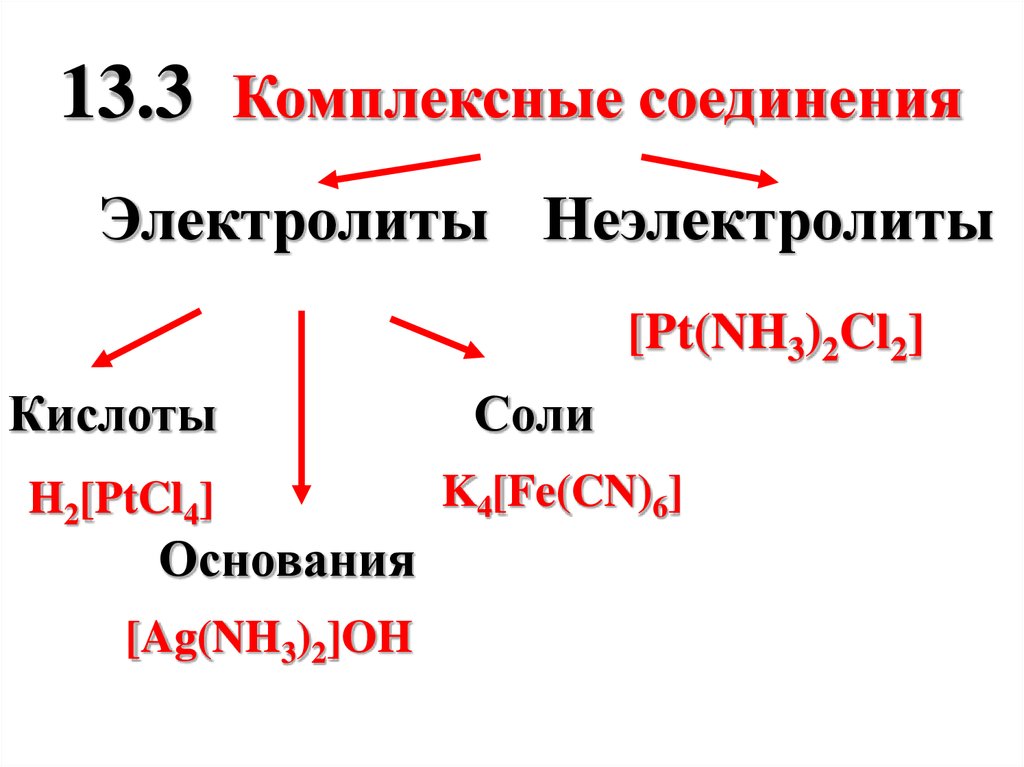
13.3 Комплексные соединенияЭлектролиты Неэлектролиты
[Pt(NH3)2Cl2]
Кислоты
H2[PtCl4]
Основания
[Ag(NH3)2]OH
Соли
K4[Fe(CN)6]
65.
Различают первичную (необратимую)диссоциацию:
K4[Fe(CN)6] → 4 K+ + [Fe(CN)6]4‾
и вторичную (обратимую)
диссоциацию КС:
[Fe(CN)6
4
]‾
⇄
2+
Fe
+ 6 CN‾
66.
Константа равновесия,описывающая вторичную
диссоциацию КС, называется
константой нестойкости (Кн):
2
6
[ Fe ][CN ]
Ê нí
К
4
[[ Fe(CN ) 6 ] ]
67.
Чем меньше Кн, тем устойчивеекомплексное соединение
[Ag(NO2)2]‾ [Ag(NH3)2]+ [Ag(CN)2]‾
1,3∙10‾3
1,0∙10‾21
6,8·10‾8
увеличение устойчивости КС
68.
Устойчивость комплексов можноохарактеризовать при помощи
константы устойчивости (Ку):
Ку =
1
Кн
69.
Причины устойчивости КСлежат в их строении:
а) чем меньше ионный
радиус
комплексообразователя и
больше его заряд, тем
сильнее притяжение
лигандов и устойчивее КС.
70.
s-Mep-Me
d-Me
увеличение
комплексообразующей
способности
71.
б) чем выше дентантностьлиганда, тем устойчивее
КС:
КC
Кн
2+
5
[Co(NH3)4]
1,0·10‾
9
[Co(Гли)2]
3,3∙10‾
2
16
[CoY] ‾
1,0∙10‾
72.
Самыми устойчивымикомплексными
соединениями являются
хелатные КС. Это явление
получило название
эффекта хелатирования.
73.
13.4 В организме человека всеметаллы, кроме щелочных и,
частично, щелочноземельных
находятся в виде прочных
хелатных КС с биолигандами:
белками, аминокислотами,
витаминами, гормонами и
другими биоактивными
соединениями.
74.
Важнейшими являютсякомплексы с белками.
К ним относятся
многочисленные
металлоферменты, а так же
гемоглобин (комплекс железа с
порфином), хлорофилл
(комплекс магния).
75.
NN
H
H
N
N
Порфин – биолиганд, входящий в
состав гемоглобина, хлорофилла,
цитохромов С и некоторых других
биосоединений
76.
Сбалансированныепотоки металлов и
лигандов в биосистемах
обуславливают
металло-лигандный
гомеостаз.
77.
Его нарушение приводит кразличным заболеваниям:
При недостатке железа
– анемия, при его
избытке – сидероз.
78.
По данным ВОЗ дефицит железа ворганизме человека является одной
из наиболее серьезных проблем
современности. На земном шаре от
дефицита железа страдает 4-5
миллиардов человек (66-80%
населения Земли). Недостаток
железа - один из десяти глобальных
факторов риска, являющийся
причиной смерти 800 000 человек в
год.
79.
Недостаток кальцияприводит к остеопорозу, а его
избыток в организме
человека способствует
развитию катаракты,
атеросклероза, а также
обызвествлению костной
ткани.
80.
Для коррекции металлолигандного гомеостазаиспользуются:
• комплексоны,
связывающие токсичные
металлы, и выводящие их
из организма человека;
81.
• комплексныесоединения:
А)комплексы Pt –
противоопухолевые
препараты, например, соль
Пейроне [Pt(NH3)2Cl2]
(синтезирована в 1850,
используется как препарат
с 1969 года);
82.
Б) комплексы Au –лечение артритов и
туберкулеза:
Na3[Au(S2O3)2];
B)тетацин–при отравлениях тяжелыми Ме.
83.
Строение, свойства ибиологическая роль КС
металлов с биолигандами
является объектом изучения
бионеорганической химии,
возникшей в середине 50-х
годов, на стыке неорганической
химии, биологии и медицины.
84.
Достижениябионеорганики
широко
внедряются в
медицину.
85.
Благодаримза
внимание!!!















































































 Химия
Химия








