Похожие презентации:
Химическое равновесие
1. Химическое равновесие
Термодинамические параметры: T; P; i; Сi – const1. Термодинамическое условие равновесия 2. Кинетическое условие равновесия реакция
rG = 0
v v
аA + bB сC + dD
a
b
c
d
v k СA СB
v k СC СD
a
b
k СA СB k СC c СD d
c
d
(С
)
(С
)
k
C р
D р
K
a
b
k (С A ) р (С B ) р
Константа равновесия[f(T)]
(кинетические условия)
2.
Энергия Гиббса реакции в нестандартных условияхреакция
аA + bB = сC + dD
rG0 = ( c fG0C + d fG0D ) – ( a fG0A + b fG0B ) С0 =1 моль/л
С С0
rGi = rG0i + R T lnCi
p
с
i
i
С
X
– безразмерная концентрация
i
i
0
0
p с
i
Xi
Сi – [ моль/л ]
i – мольная доля;
pi
– относительное парциальное давление [атм], p0 =1,013.105 Па
0
p
rG = ( c fG0C+ d fG0D ) – ( a fG0A+ b fG0B) + R T ( c lnСC+ d lnCD– a lnCA–
b lnCB)
c
d
С
С
0
C D
G
G
R
T
ln
r
r
v
v
a
b
С
С
A B
v
v
3.
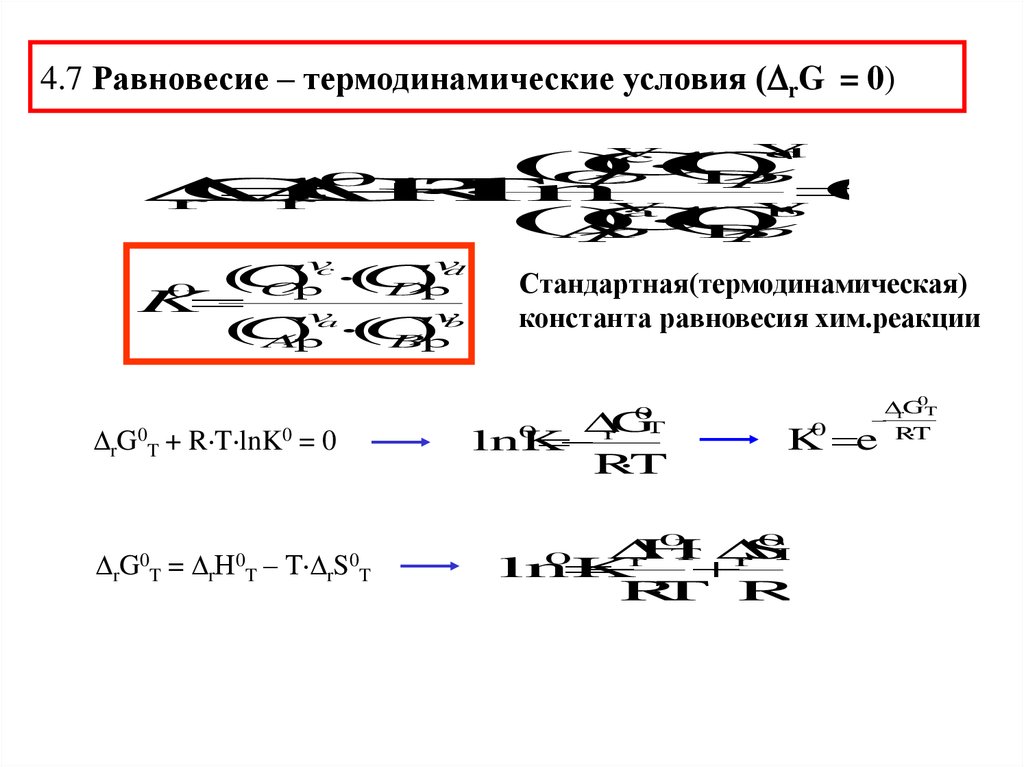
4.7 Равновесие – термодинамические условия ( rG = 0)v
d
c
(С
)
(
С
)
C
р
D
р
0
G
G
R
T
ln
0
r
r
v
v
a
b
(С
)
(
С
)
A
р
B
р
v
c
d
(
С
)
(
С
)
Cр
Dр
0
K
v
v
a
b
(
С
)
(
С
)
Aр
Bр
v
r
G0
T+
R T lnK0
=0
rG0T = rН0T – Т rS0T
v
Стандартная(термодинамическая)
константа равновесия хим.реакции
rG
lnK
R
T
0
0
Т
G0T
r
R T
K0 e
0
0
H
S
Т
Т
0
lnK
r
r
R
T R
4. Константа равновесия К, её размерность. Связь между К (кинетич.) и стандартной К 0 (термодинам.)
Kd
b
(С C ) р c (С D ) р
(С A ) р a (С B ) р
К≡KX - концентрации задаются мольными долями [безразмерная величина]
К≡Kp - концентрации задаются парциальными давлениями - [(Па) ]
= ( c+ d) - ( a+ b)
К≡KC – концентрации задаются молярной концентрацией - [(моль/л) ]
p
K X K ( 0 )
p
0
0
K p K (p )
0
R T
KC K ( 0 )
p
p/p 0 ~p физ.атм., относит.давл. р0 = 1,013 105 Па
стандарт.давление
0
5.
Сдвиг равновесияс
d
(С
)
(С
)
Cр
Dр
0
К
v
c
a
b
(С
)
(С
)
Aр
Bр
v
Изобара реакции
Р-const
0
0
dlnK
H
r 2
dT R
T
H
S
0
lnK
R
T R
0
r Т
v
0
r Т
rН0 0 (экзотерм.реакция) – K0(T) убывающая функция(↑Т, К0↓)
rН0 0 (эндотерм.реакция) – K0(T) возрастающая функция(↑Т, К0↑)
Изотерма реакции T-const
c
d
С
С
0
C
D
rG0T = – R T lnK0
G
G
R
T
ln
0
r
r
v
v
a
b
С
С
A B
v
v
G<0
c
d
r
С
С
0
C D
rG>0
G
R
T
(
ln
lnK
)
r
a
b
С
С
rG=0
A
B
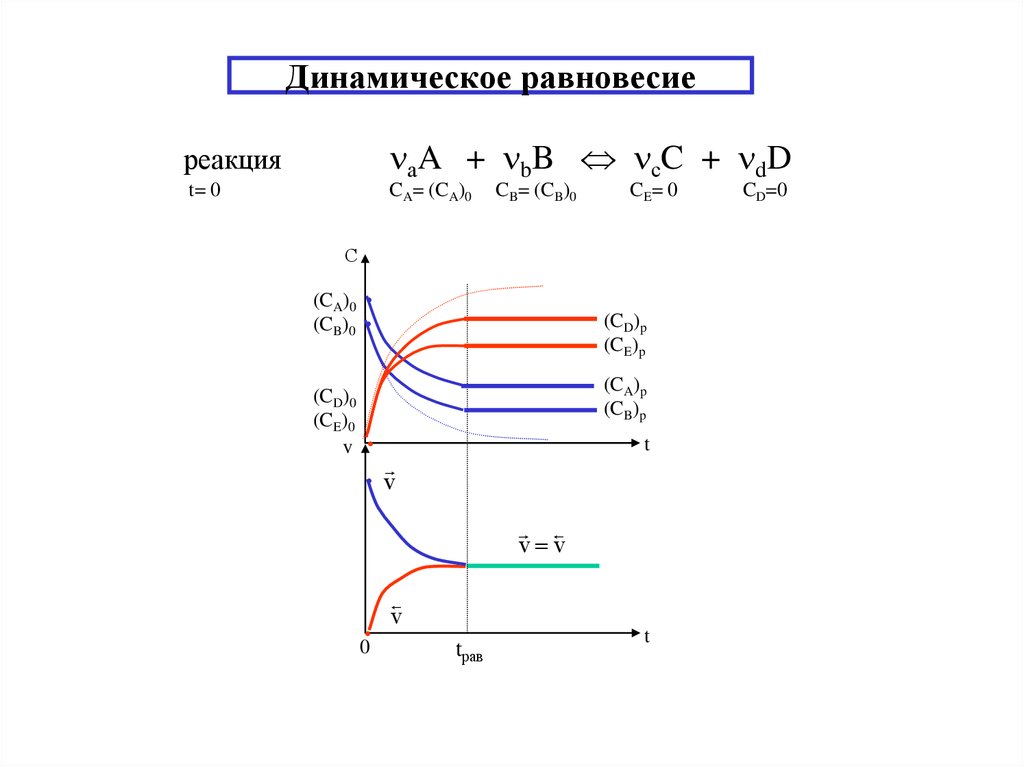
6. Динамическое равновесие
реакцияаA + bB сC + dD
t= 0
CA= (CA)0
CB= (CB)0
CE= 0
С
(CA)0
(CB)0
(CD)0
(CE)0
v
(CD)p
(CE)p
(CA)p
(CB)p
t
• v
v v
0
v
tрав
t
CD=0
7. Расчет равновесного состава(концентраций) газовой смеси
1. Расчет К0(Т) Для определенной Т рассчитываютrG0(T)= rH0(T) –Т· rS0(T). Затем
K 0 (T) e
G 0 (T)
R T
2. Расчет КX или Кр
КX Xi
при Р –const
(р0 = 1,013 105 Па-стандартн.давление)
K X (T, p) K 0 (T) (
p
)
0
p
Кр рi - при V - const
K p (T) K0 (T) (p0 )
8. Пример. Диссоциация АВ при Р -const и температуре Т
АВА
+
В
САВ
0
0
ni
САВ-z
z
z
Xi
С АВ z
С АВ z
z
z
С АВ z
С АВ z
t=0
равновесие
=
ni
Xi
ni
n i (САВ z) ( z) ( z) САВ z
z z (САВ z )
z2
KX
2
(САВ z ) (САВ z ) (САВ z ) САВ z 2
KX С
2
АВ
KX z z
2
2
z
K X С 2АВ
K X 1
9. Равновесие в растворах(дисперсных системах)
Раствор - гомогенная однофазная многокомпонентная система,образованная двумя или более веществами. По агрегатному состоянию - газовые,
жидкие и твёрдые растворы. Основн. способ получения жидк.р-ров - растворение
А - растворенное вещество-твёрдое, жидкое, газ
(дисперсная фаза)
А+В
В – растворитель (дисперсионная среда)
А+В – раствор (дисперсная система)
Концентрация раствора – важная характеристика раствора
(относительное соотношение количеств растворенного вещества и растворителя)
•массовая доля %
mA
100%
m A B
• мольная доля X %
•молярная концентрация С М А [ моль ]
VA B
л
•нормальная концентр.
моль
•моляльная концентрация С m А [
]
m
кг
•массовая конц. (г/л), процент.конц. B
A
100%
A B
10. Электролитическая диссоциация
АВA+
+
B-
A+ + B- AB
АВ A+ + B-
С0 - общая концентрация
СД - конц.молекул в виде ионов
СД = [A+]=[B-]=αС0
Степень диссоциации α>50%, <5%, 5<α<50%
[AB]=С0-αС0
Сд
С0
Сильные, слабые, средней силы электролиты
[ A ][ B ]
Константа диссоциации(равновесия) – K д
[ AB]
Вместо [Ai] = ai = γi Ci ,
где ai – активность, γi – коэфф. активности
[ A ][ B ] С0 С0 2 С0
Kд
[ AB]
С0 С0
1
1
КД
0
К д = α 2С0
КД
С0
11. Ионное произведение воды
H2O H+ + OH-[H ] [OH ]
Kд
[H 2 O]
Kw = [H+] [OH–] = 1.0 10-14 [(моль/л)2]
0
[H2O]-const
[H2O]=1000/18 [моль/л]
КД = 1.8 10-16
Kw - ионное произведение воды
Нейтральная среда [H+] = [OH–] = 10-7 [моль/л]
Кислая среда [H+] > 10-7(10-6,-5,-4 …); [OH–] <10-7(10-8,-9,-10 …)
[моль/л]
Щелочная среда [H+] < 10-7
[OH–] > 10-7 [моль/л]
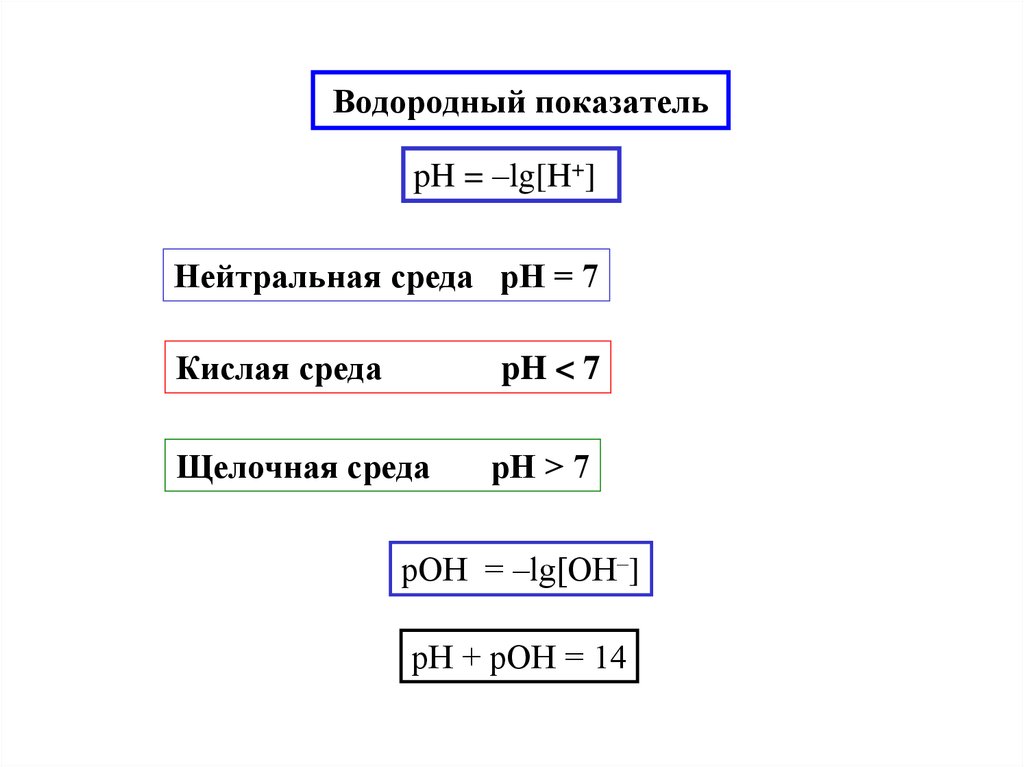
12. Водородный показатель
pH = –lg[H+]Нейтральная среда pH = 7
Кислая среда
pH < 7
Щелочная среда
pH > 7
pОH = –lg[ОH–]
pH + pОH = 14
13. Растворы кислот и оснований
HAn H+ + An-МеOH Ме+ + OH-
[Ме ][OH ]
[H ][An ]
Kb
Kа
[МеOH]
[HAn]
Слабые электролиты 0
[H ]2
Kа
[HAn]
[H ] K a Скисл
pH lg[ K a Cкисл ]
[OH ]2
Kb
[МеOH]
[OH ] Kb Сосн
pH 14 lg[ K b Cосн ]
Сильные электролиты 1
рН = –lg[ Скисл]
pH = 14 + lg[ Cосн]
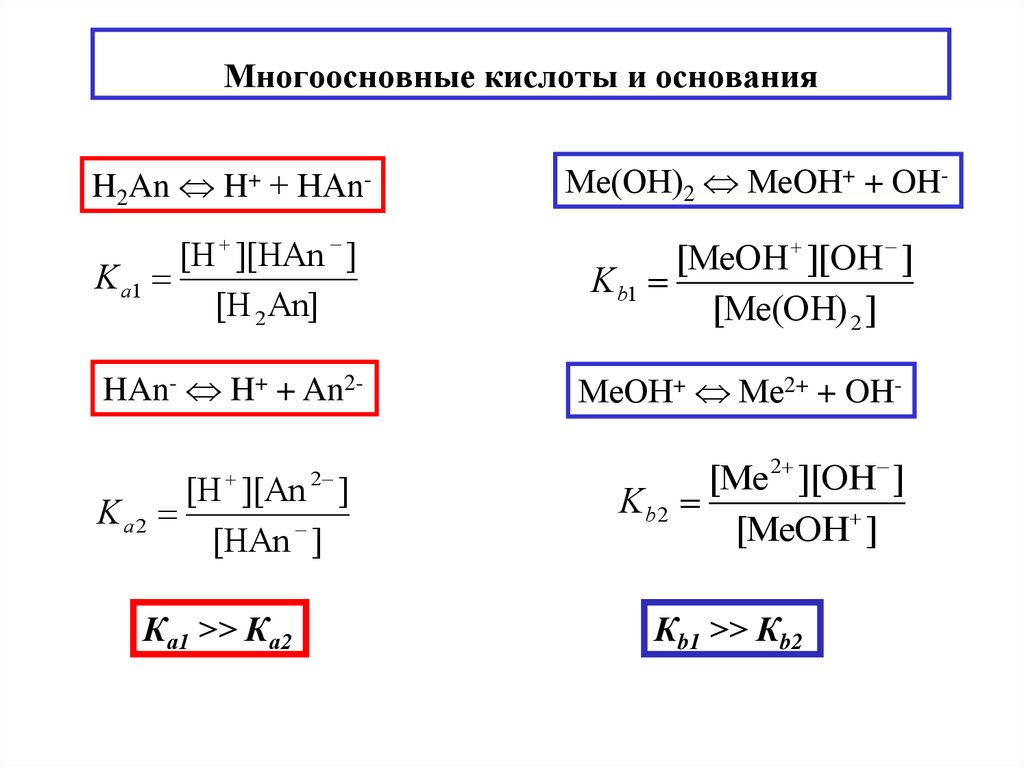
14. Многоосновные кислоты и основания
H2An H+ + НAn-Ме(OH)2 МеOH+ + OH-
[H ][НAn ]
K а1
[H 2 An]
[МеОН ][OH ]
K b1
[Ме(OH) 2 ]
HAn- H+ + An2
Kа2
2
[H ][An ]
[HAn ]
Ка1 >> Ка2
МеOH+ Ме2+ + OH-
[Ме 2 ][OH ]
Kb 2
[МеOH ]
Кb1 >> Кb2
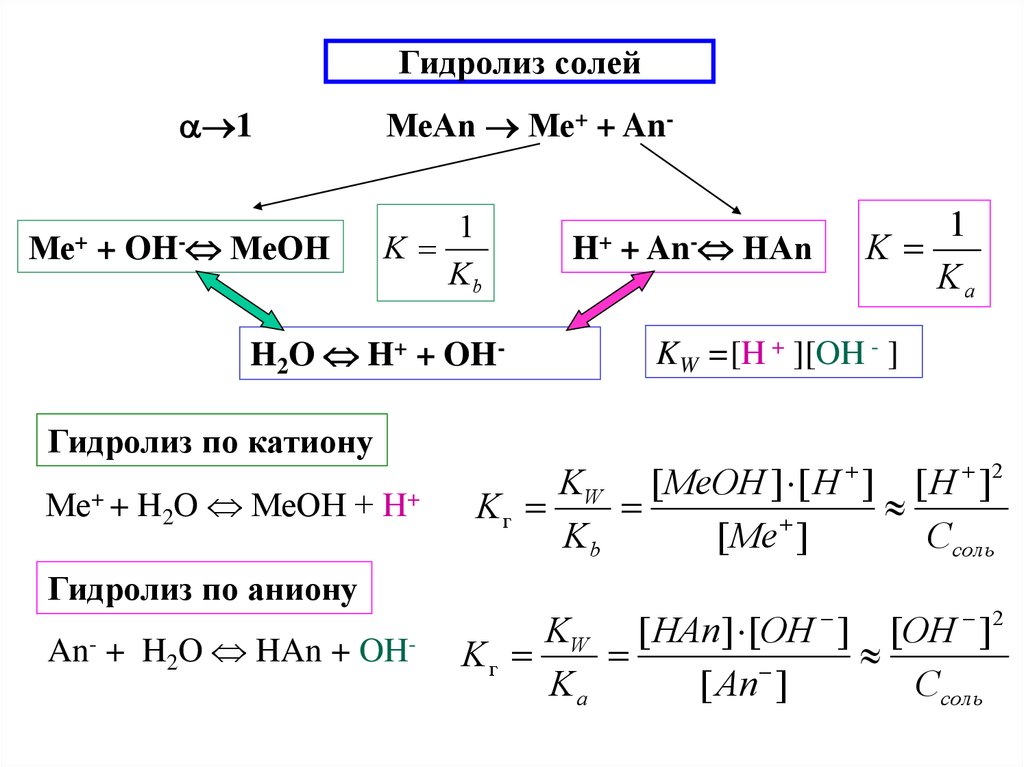
15. Гидролиз солей
1Ме+
+
OH-
МеOH
МеAn Ме+ + An1
K
Kb
H2O H+ + OHГидролиз по катиону
Ме+ + H2O МеOH + H+
Гидролиз по аниону
An- + H2O HAn + OH-
H+
+ An-
HАn
1
K
Ka
KW =[H + ][OH - ]
KW [ MeOH ] [ H ] [ H ]2
Kг
Kb
[ Me ]
Cсоль
KW [ HAn] [OH ] [OH ]2
Kг
Ka
[ An ]
Cсоль
16. Примеры гидролиза солей
1) Kb 0; KaCuSO4 Cu2+ + SO42-
Cu2+ + H2O CuOH+ + H+
pH <7
2 CuSO4+ 2 H2O [CuOH]2 SO4 + H2 SO4
2) Ka 0; Kb
Na3РO4 3Na+ + РO43-
РO43- + H2O HРO42-+ OH-
pH >7
Na3РO4+ H2O Na2HРO4+ NaOH
NH4NO2 NH4+ + NO23) Ka 0; Kb 0
NH4+ + H2O NH4OH + H+
pH 7
NO2- + H2O НNO2 + OH4) Ka ; Kb Гидролиза нет
(Na++Cl-)
pH=7
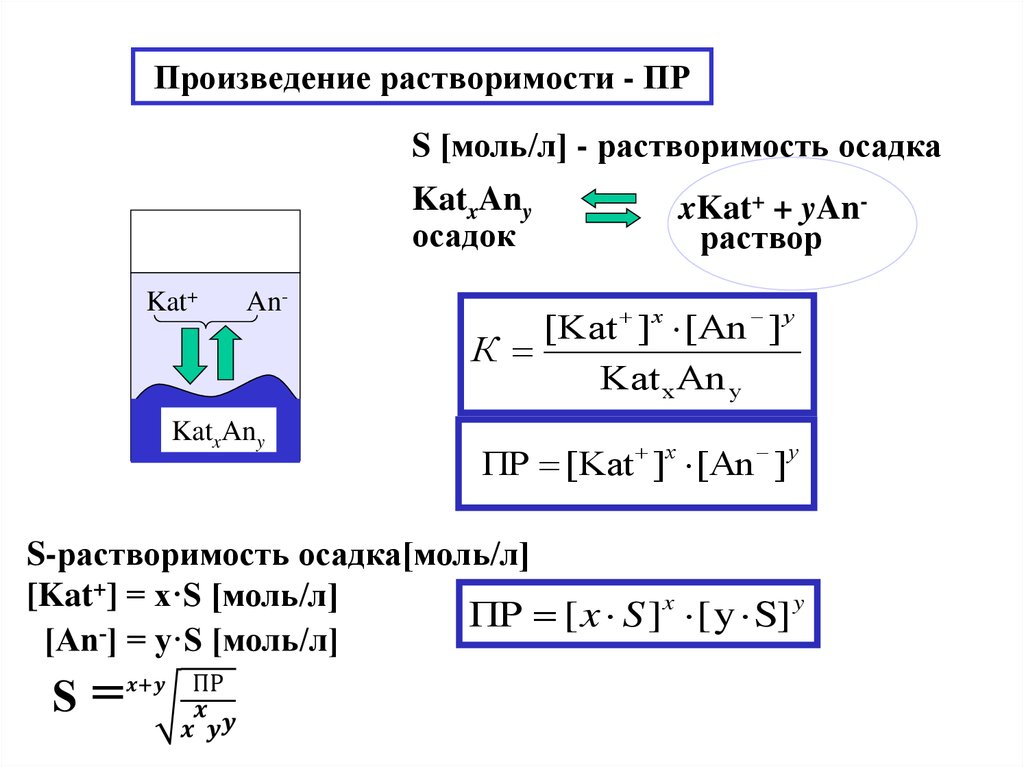
17. Произведение растворимости - ПР
S [моль/л] - растворимость осадкаKatxAny
осадок
Kat+
An-
KatxAny
xKat+ + yAnраствор
[Kat ] x [An ] y
К
Kat x An y
ПР [Kat ]x [An ] y
S-растворимость осадка[моль/л]
[Kat+] = x·S [моль/л]
ПР [ x S ]x [ y S] y
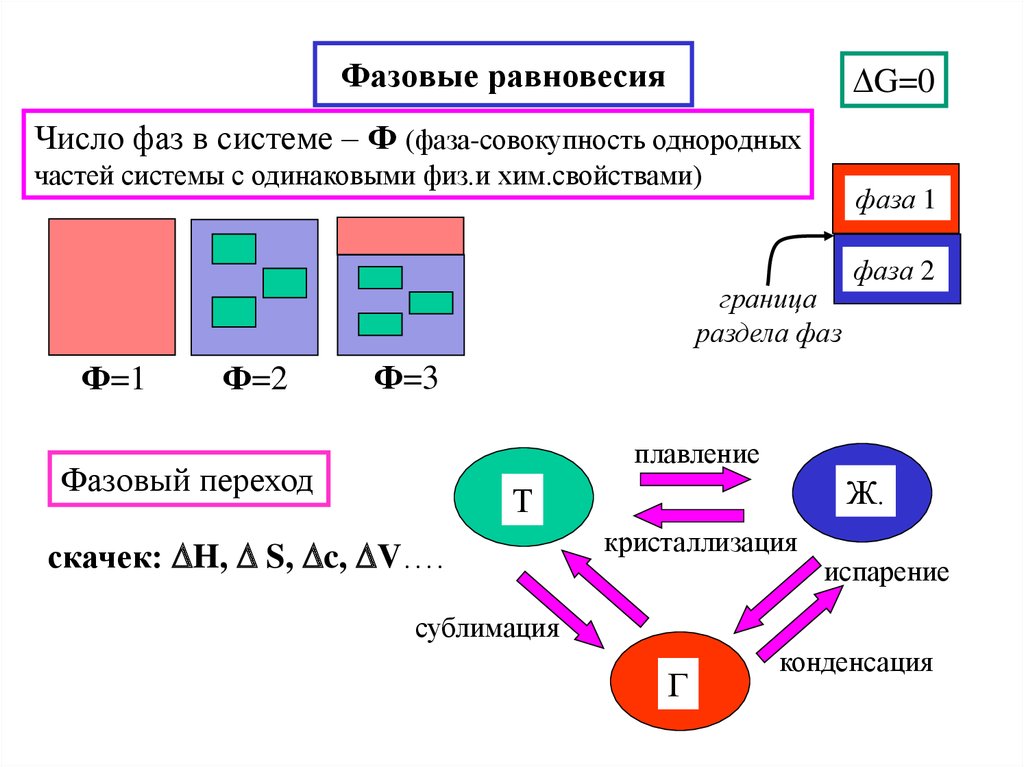
18. Фазовые равновесия
G=0Число фаз в системе – Ф (фаза-совокупность однородных
частей системы с одинаковыми физ.и хим.свойствами)
фаза 1
граница
раздела фаз
Ф=1
Ф=2
фаза 2
Ф=3
плавление
Фазовый переход
Ж.
Т
скачек: H, S, c, V….
кристаллизация
испарение
сублимация
Г
конденсация
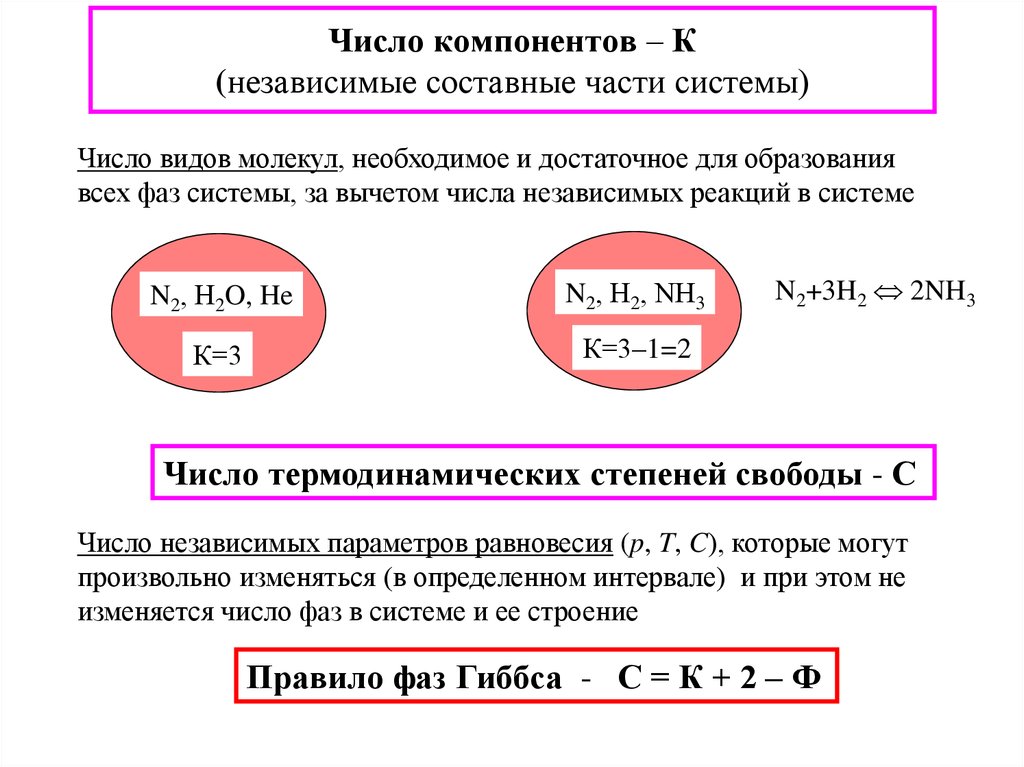
19. Число компонентов – К (независимые составные части системы)
Число видов молекул, необходимое и достаточное для образованиявсех фаз системы, за вычетом числа независимых реакций в системе
N2, Н2O, He
N2, Н2, NН3
К=3
К=3–1=2
N2+3H2 2NH3
Число термодинамических степеней свободы - С
Число независимых параметров равновесия (p, T, C), которые могут
произвольно изменяться (в определенном интервале) и при этом не
изменяется число фаз в системе и ее строение
Правило фаз Гиббса - С = К + 2 – Ф
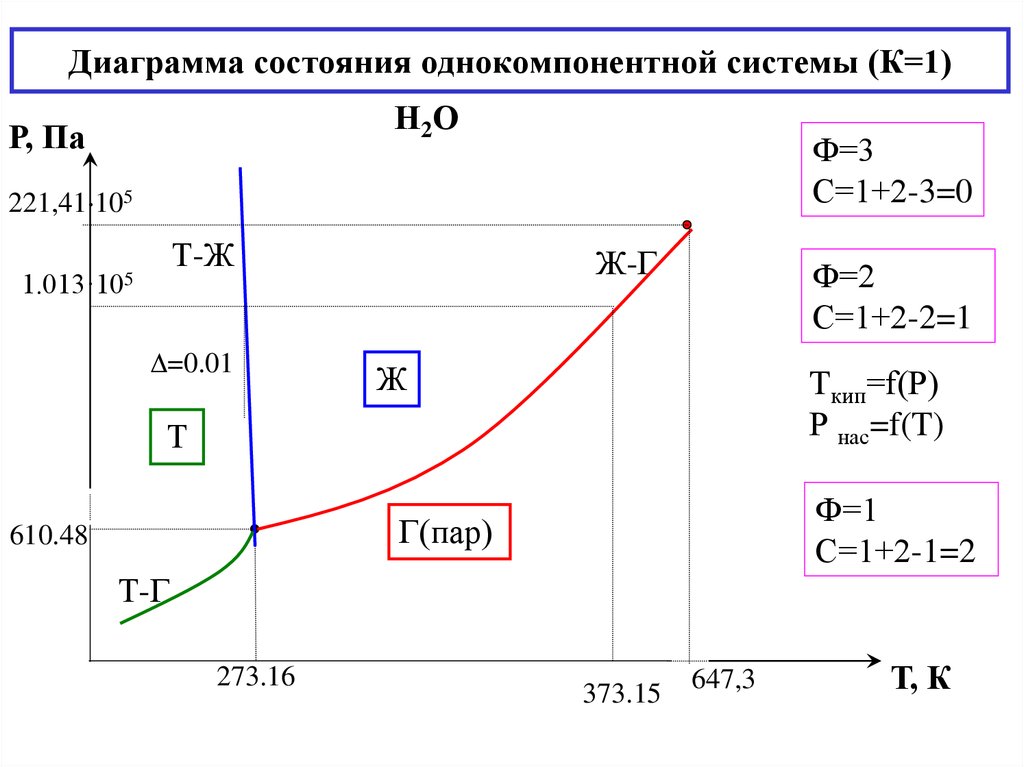
20. Диаграмма состояния однокомпонентной системы (К=1)
Н2ОР, Па
Ф=3
С=1+2-3=0
221,41 105
Т-Ж
1.013·105
=0.01
Ж-Г
Ф=2
С=1+2-2=1
Ж
Tкип=f(Р)
Р нас=f(T)
Т
Ф=1
С=1+2-1=2
Г(пар)
610.48
Т-Г
273.16
373.15
647,3
Т, К
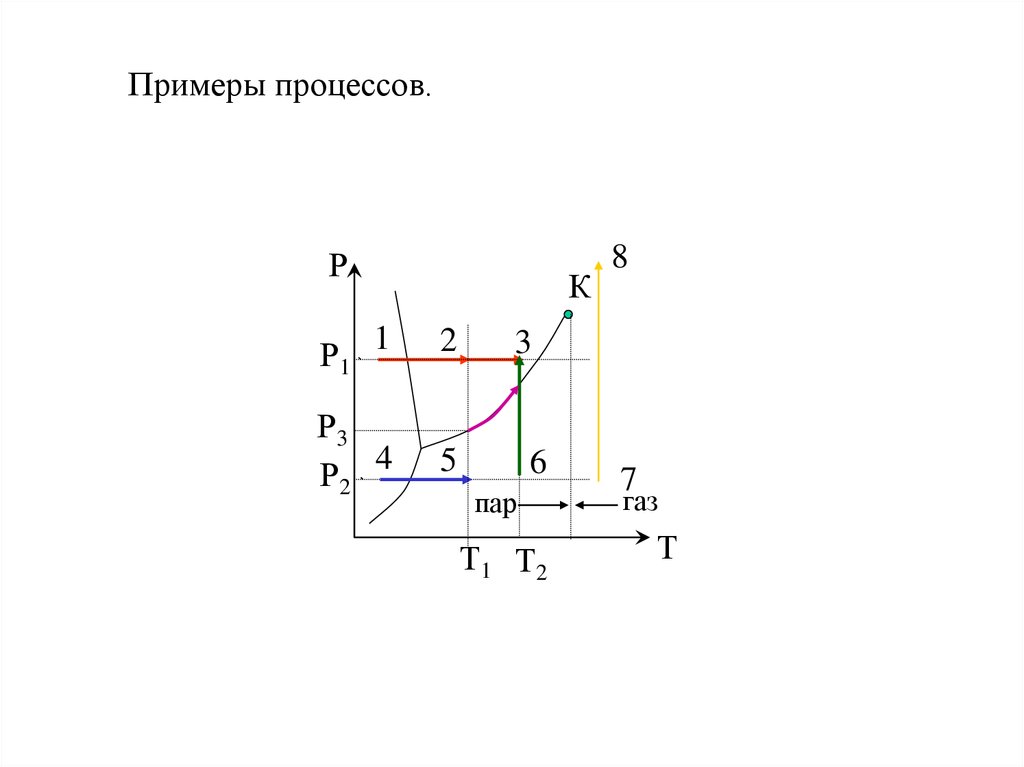
21. Примеры процессов.
РК
Р1 1
2
Р3
Р2 4
5
8
3
6
пар
Т1 Т2
7
газ
Т
22. Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор.
0p0 –давление насыщенного
Н2Опар
пара (Н2Опар ) над
растворителем Н2О
рА –давление (Н2Опар )
над раствором(Н2О+А)
Н2О + А
p
XA
p0
Закон Рауля
p0 p А
A
p0
A p
Двухфазное равновесие
1) Т Ж; Ж Г
С=2+2–2=2
Tпл=f(р,СА)
Tкип=f(р,СА)
2) Т Г
Ф=3
С=2+2–3=1
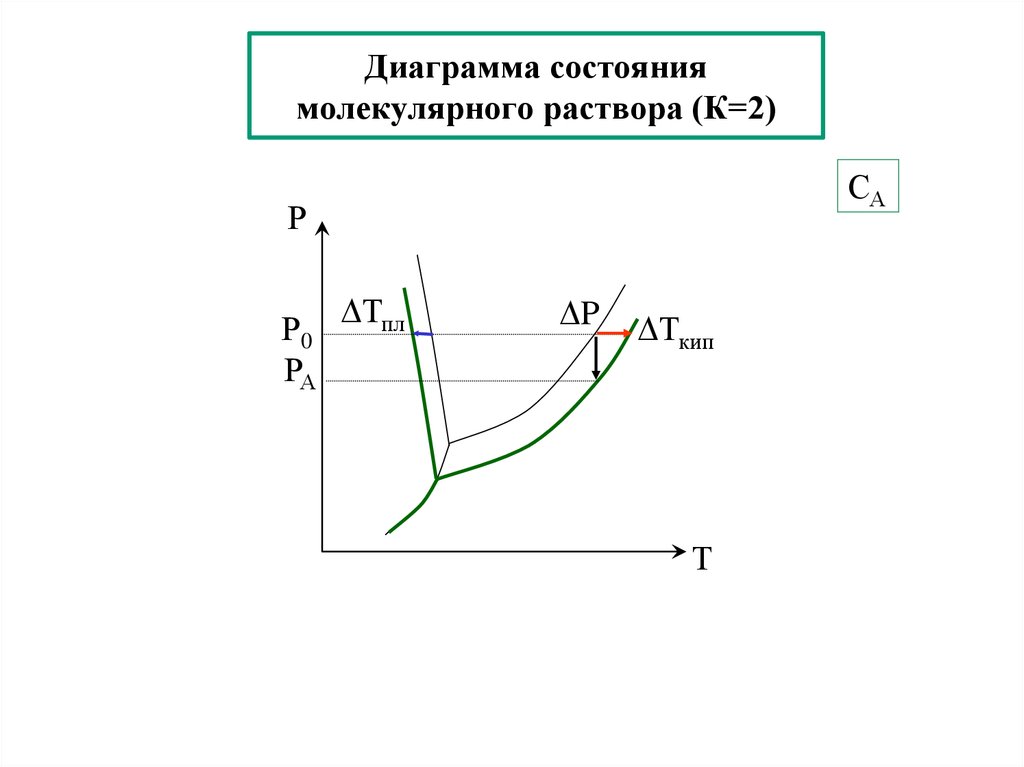
23. Диаграмма состояния молекулярного раствора (К=2)
САР
Р0
РА
Тпл
P
Ткип
Т
24. Кипение и кристаллизация растворов
• Повышение температуры кипения раствора по сравнению с чистымрастворителем ( Ткип) прямо пропорционально концентрации
растворенного вещества
Ткип = Kэб См
См [моль/кг] – моляльная концентрация
Kэб [К кг/моль]– эбуллиоскопическая постоянная растворителя
• Понижение температуры кристаллизации раствора по сравнению с
чистым растворителем прямо пропорционально концентрации
растворенного вещества
Ткр = Kкр См
Kкр [К кг/моль]– криоскопическая постоянная растворителя
R (Tкип ) 2 M
K эб
1000 v H
vH - [Дж /кг]
mH
K кр
R (Tкр ) 2 M
1000 m H
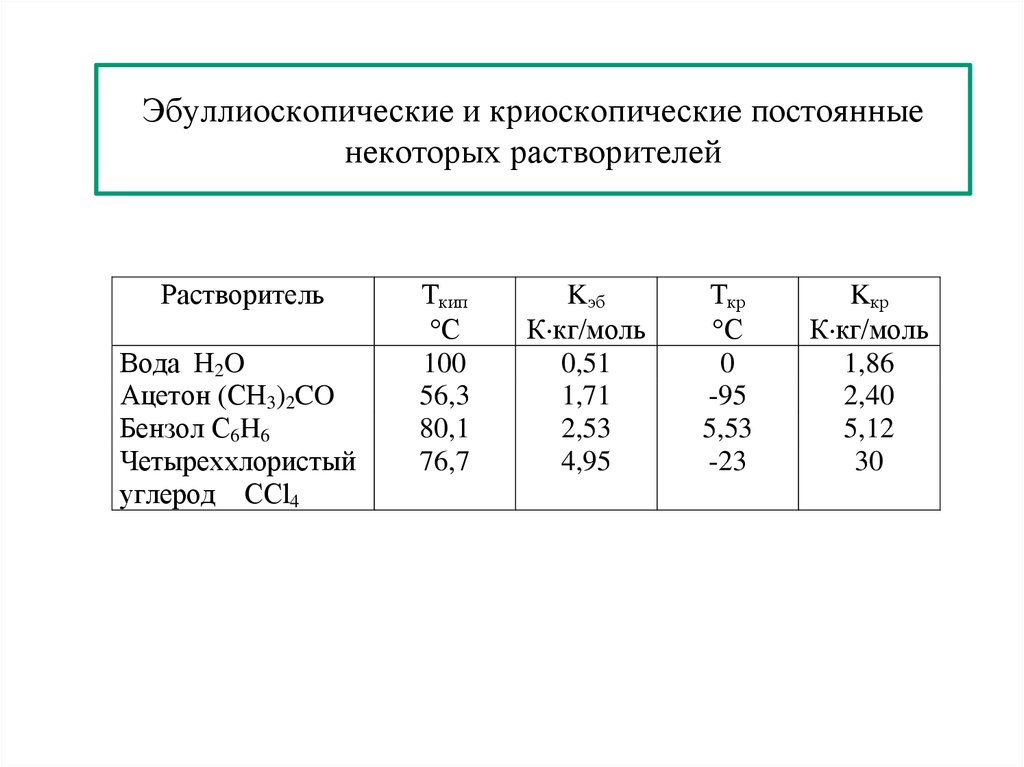
25. Эбуллиоскопические и криоскопические постоянные некоторых растворителей
РастворительВода H2O
Ацетон (CH3)2CO
Бензол C6H6
Четыреххлористый
углерод CCl4
Ткип
С
100
56,3
80,1
76,7
Kэб
К кг/моль
0,51
1,71
2,53
4,95
Ткр
С
0
-95
5,53
-23
Kкр
К кг/моль
1,86
2,40
5,12
30
26. Изотонический коэффициент – i (растворы электролитов)
- показывает увеличение числа частиц в растворе электролита по сравнениюс раствором не электролита той же концентрации(изменение коллигативных
свойств)
АxВy x А+ + y В-
N0 - число молекул растворенного вещества; N0 (x + y )+(N0 - N0 ) суммарное число частиц (ионов и недиссоциированных молекул)
- степень диссоциации
m=x+y
i
N 0 (x y) (N 0 N 0 )
1
N0
m 1 (m - 1) 1
i=m
Ткип = i Kэб См
Ткр = i Kкр См
P
i XA
P0











![Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор. Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор.](https://cf.ppt-online.org/files1/slide/m/MLiW0eGRZYl2wdhsHnBF5goyxbamrfTDU8JcQ73jz/slide-21.jpg)


 Химия
Химия








