Похожие презентации:
Основания и их свойства
1. ОСНОВАНИЯ
2.
Основания-это сложные вещества, состоящие из
ионов металлов и гидроксильных групп
(-ОН).
Me(OH)n
Общая формула
оснований
n - число ОН- групп, численно равное
значению заряда иона (степени
окисления) металла.
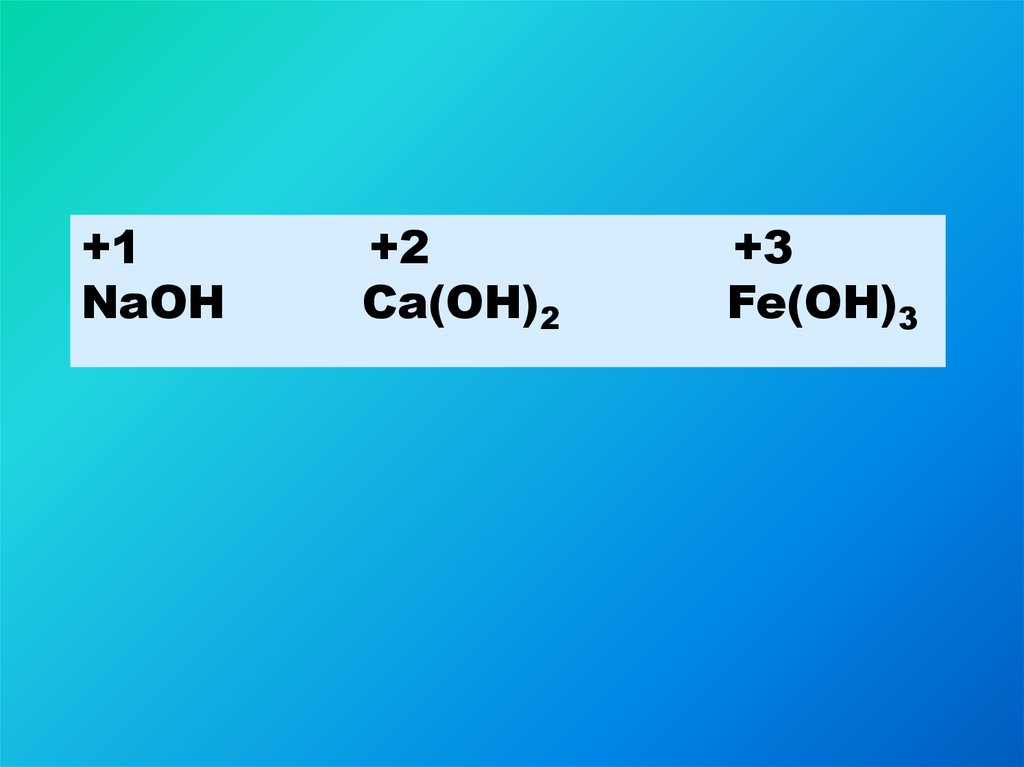
3.
+1NaOH
+2
Ca(OH)2
+3
Fe(OH)3
4.
Названия основанийNaОН
гидроксид
натрия
Ca(OH)2
гидроксид
кальция
Fe(OH)3
гидроксид
железа (III)
5.
Тривиальные названияКОН
едкое кали
NaOH
едкий натр
Ca(OH)2 гашеная известь,
в растворе - известковая
вода
6.
Основаниям соответствуют оксидыметаллов в той же степени
окисления.
Например:
NaOH – Na2O
Ca(OH)2 – CaO
Fe(OH)3 – Fe2O3
Fe(OH)2 - FeO
7.
Классификация основанийОснования
Растворимые
(Щелочи)
NaOH, КОН, Ba(OH)2
Нерастворимые
Cr(OH)2, Mn(OH)2,
Fe(OH)3
8.
Физические свойстваоснований
Основания - твердые вещества, различной
растворимости в воде и различного цвета.
Ba(OH)2
NaOH
Ca(OH)2
Cu(OH)2
LiOH
Co(OH)2
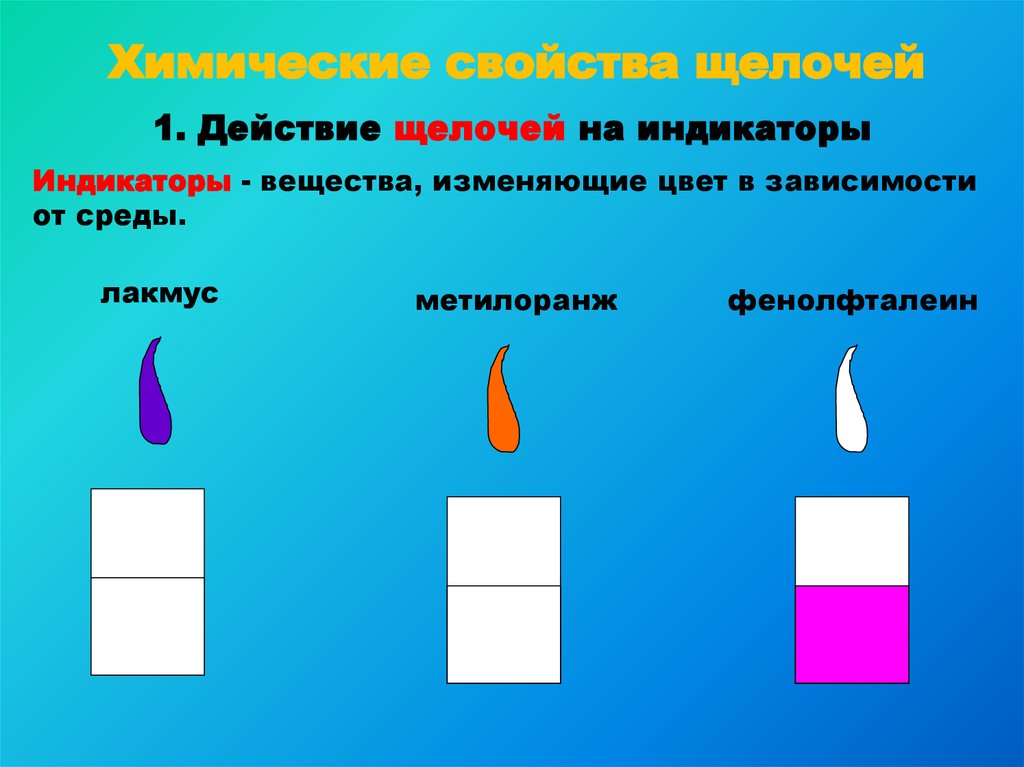
9. Химические свойства щелочей
1. Действие щелочей на индикаторыИндикаторы - вещества, изменяющие цвет в зависимости
от среды.
лакмус
метилоранж
фенолфталеин
10.
Диссоциация оснований.1) NaOH ↔ Na+ + OH2) Ba(OH)2 ↔ Ba2+ + 2OHOH- определяют щелочную
среду раствора.
11.
2. Взаимодействие с кислотами.NaOH + HCl = NaCl + H2O
реакция нейтрализации взаимодействие щелочей с кислотами
12.
3. Взаимодействие щелочей скислотными оксидами.
2NaOH + SO3 = Na2SO4 + H2O
Ca(OH)2 + CO2 = CaCO3↓ + H2O
13.
3. Разложение нерастворимыхоснований при нагревании.
t
Cu(OH)2 = CuO + H2O
14.
Качественная реакция на СО2 известковая вода мутнеет припропускании углекислого газа:
Са(ОН)2 + СО2 = СаСО3↓ + Н2О
15.
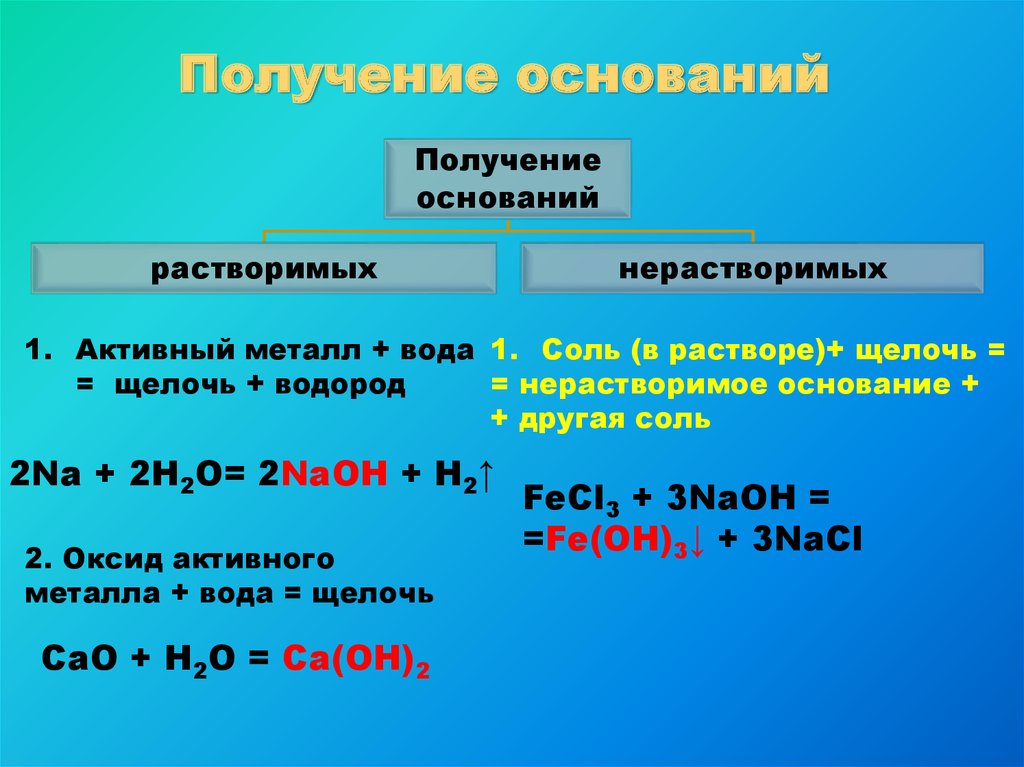
Получение основанийПолучение
оснований
растворимых
нерастворимых
1. Активный металл + вода 1. Соль (в растворе)+ щелочь =
= щелочь + водород
= нерастворимое основание +
+ другая соль
2Na + 2H2O= 2NaOH + H2↑
2. Оксид активного
металла + вода = щелочь
CaO + H2O = Ca(OH)2
FeCl3 + 3NaOH =
=Fe(OH)3↓ + 3NaCl












 Химия
Химия








