Похожие презентации:
Стратегия успеха 2 (ЕГЭ). Органическая химия
1. Стратегия успеха 2 (ЕГЭ) органическая химия
Санкт-Петербургскийгосударственный университет
Стратегия успеха 2
(ЕГЭ)
органическая химия
Карцова Анна Алексеевна
профессор СПбГУ,
доктор химических наук
Санкт-Петербург
2017
2.
«…Знание принциповкомпенсирует незнание
фактов»
Гельвеций
2
3.
ФАКТЫ3
4.
Условия реакций – полезная«подсказка»
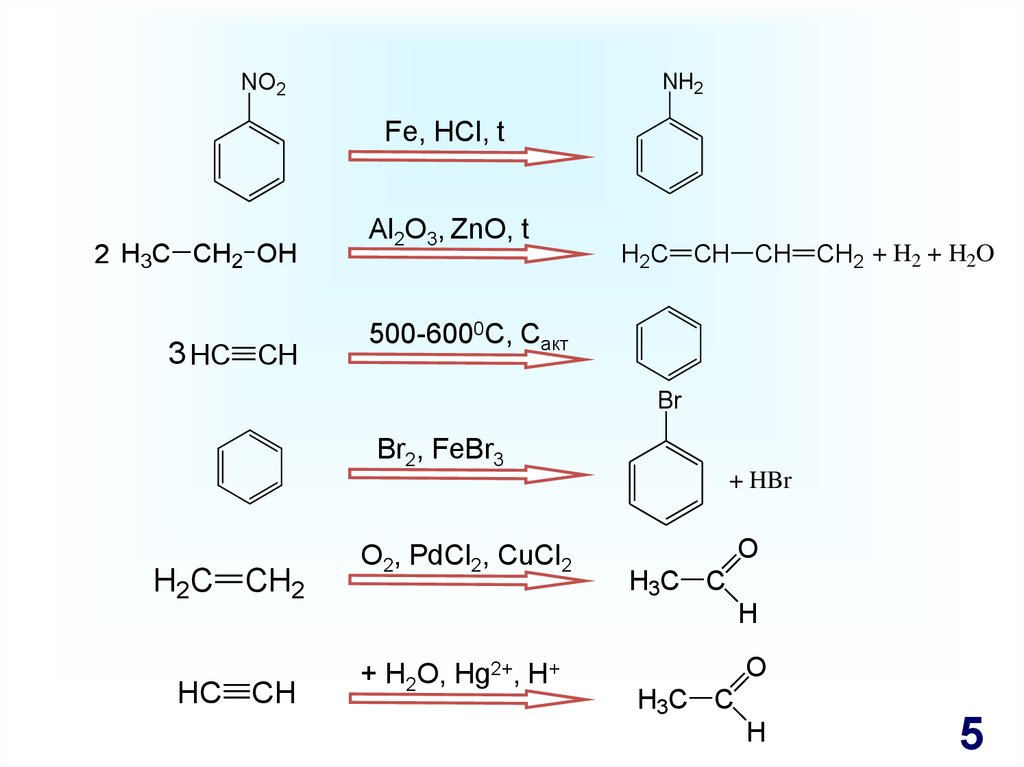
5.
NH2NO2
Fe, HCl, t
2 H3C CH2 OH
3 HC CH
Al2O3, ZnO, t
H2C CH CH CH2 + H2 + H2O
500-6000C, Cакт
Br
Br2, FeBr3
+ HBr
H2C CH2
HC CH
O2, PdCl2, CuCl2
O
H3C C
H
+ H2O, Hg2+, H+
O
H3C C
H
5
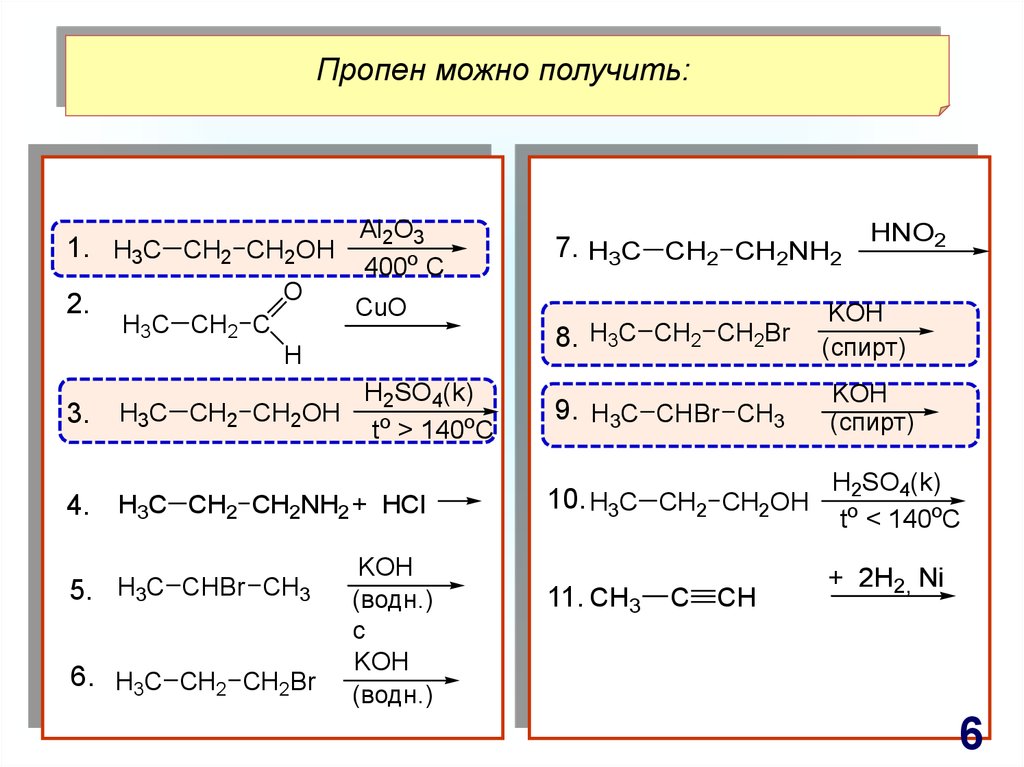
6.
Пропен можно получить:1. H3C CH2 CH2OH
2.
O
H3C CH2 C
Al2O3
400o C
CuO
8. H3C CH2 CH2Br
H
3.
H2SO4(k)
H3C CH2 CH2OH o
t > 140oC
4. H3C CH2 CH2NH2 + HCI
5. H3C CHBr CH3
6. H3C CH2 CH2Br
7. H3C CH2 CH2NH2
KOH
(водн.)
c
KOH
(водн.)
9. H3C CHBr CH3
10. H3C CH2 CH2OH
11. CH3
C
CH
HNO2
KOH
(спирт)
KOH
(спирт)
H2SO4(k)
to < 140oC
+ 2H2, Ni
6
7.
Качественные реакции исвойства веществ
8. Свойства
Установить соответствие между реагирующимивеществами и признаком протекающей реакции:
Признак реакции
Реагирующие вещества
1) Образование осадка
А) этиленгликоль и Na
2) Обесцвечивание раствора
Б) пропин и [Ag(NH3)2]OH
3) Выделение газа
В) глицерин и Cu(OH)2
4) Образование синего раствора
Г) пропанол и Br2 (H2O)
5) Признаков реакции не
наблюдается
А
Б
В
Г
3
1
4
5
8
9. Свойства
Установить соответствие между двумя веществами иреагентом, позволяющим их отличить:
Органические соединения
Реагенты
А) фенол и м-аминофенол
1) [Ag(NH3)2]OH
Б) нитробензол и анилин
2) HCI
В) нитробензол и фенол
3) HNO2
4) FeCI3
Г) пропиламин и метилэтиламин
А
Б
В
Г
2
2
4
3
9
10. Свойства
Установить соответствие между двумя веществами иреагентом, позволяющим их отличить:
Реагенты
Органические соединения
А) муравьиная и уксусная кислоты
1) [Ag(NH3)2]OH
Б) метилформиат и пропановая к-та
2) HCI
В) фенол и бензиловый спирт
3) NaOH
4) FeCI3
Г) анилин и толуол
А
Б
В
Г
1
1
4
2
10
11. Свойства
В отличие от триметиламина анилин1. Реагирует с НСI
2. Взаимодействует с СН3СI
3. Образует с бромной водой желтый осадок
4. Является жидкостью
5. При горении образуются N2, CO2, H2O
6. Способен образовывать межмолекулярные
водородные связи
11
12.
СвойстваH3C C
C H реагирует с каждым из веществ:
1. [Cu(NH3)2]Cl, H2O, H2
2. CuSO4, C, Br2
3. Na2O, HCl, O2
4. [Ag(NH3)2]OH, HBr, Cl2
5. CO2, H2O, HCl
6. KMnO4, H2, Br2
12
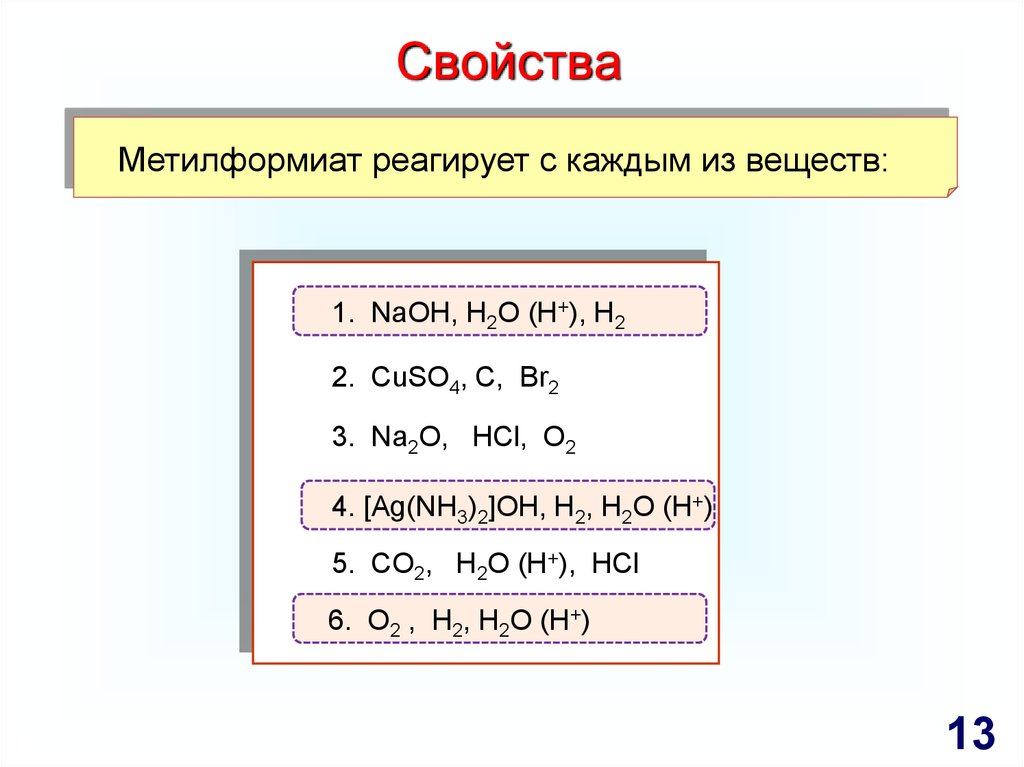
13.
СвойстваМетилформиат реагирует с каждым из веществ:
1. NaOH, H2O (H+), H2
2. CuSO4, C, Br2
3. Na2O, HCl, O2
4. [Ag(NH3)2]OH, H2, H2O (H+)
5. CO2, H2O (H+), HCl
6. O2 , H2, H2O (H+)
13
14.
H C C H+ O2, t0
CuCl, NH4Cl
O
H3Х
C3 C
OH
H 2C
NH3
CH
Х1 C
CH
изб. H2
CH3 CH
Х 2 CH2 CH3
2
O
H3C ХC
4
ONH4
14
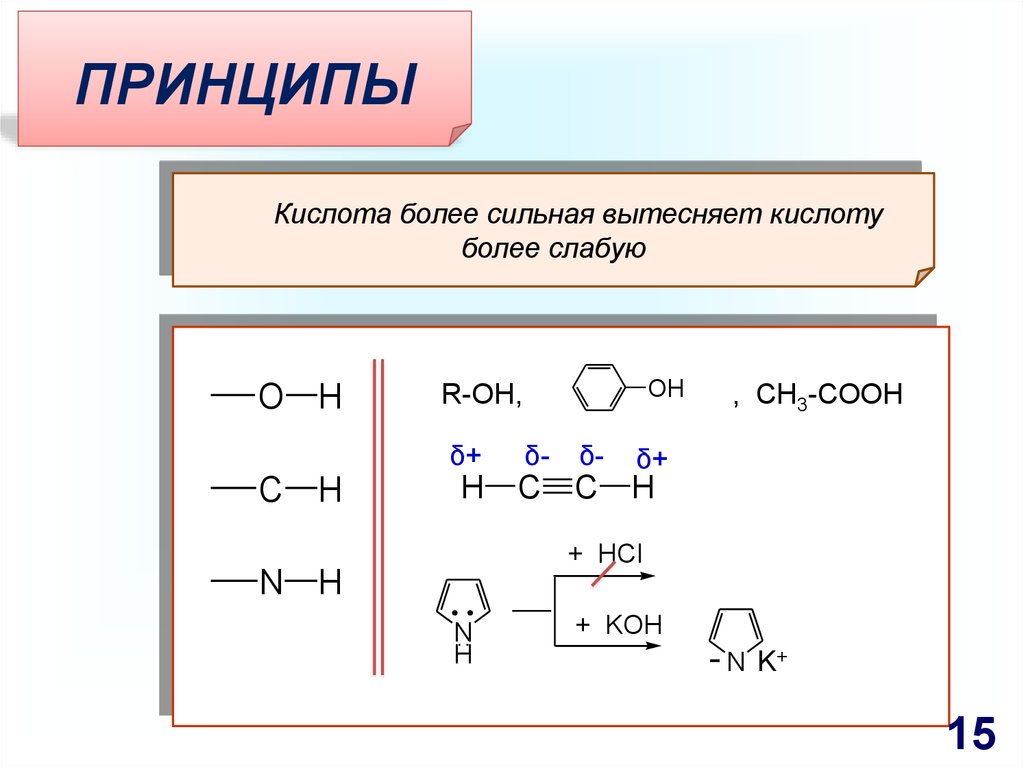
15.
ПРИНЦИПЫКислота более сильная вытесняет кислоту
более слабую
O H
C
H
OH
R-OH,
δ+
δ-
δ-
δ+
H
C
C
H
, CH3-COOH
+ HCI
N
H
N
H
+ KOH
- N K+
15
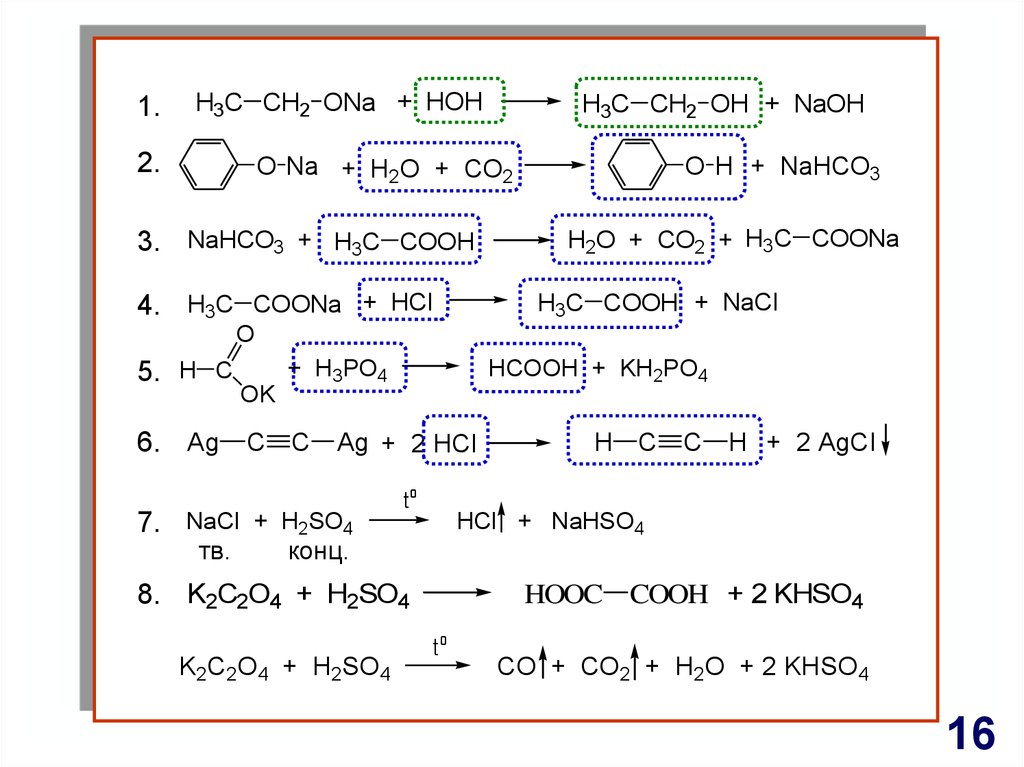
16.
1.H3C CH2 ONa + HOH
2.
H3C CH2 OH + NaOH
O Na + H2O + CO2
3. NaHCO3 + H3C COOH
4. H3C COONa + HCI
O H + NaHCO3
H2O + CO2 + H3C COONa
H3C COOH + NaCI
O
5. H C
OK
+ H3PO4
HCOOH + KH2PO4
6. Ag C C Ag + 2 HCI
7. NaCI + H2SO4
тв.
to
C
H + 2 AgCI
HCI + NaHSO4
конц.
8. K2C2O4 + H2SO4
K2C2O4 + H2SO4
H C
HOOC COOH + 2 KHSO4
to
CO + CO2 + H2O + 2 KHSO4
16
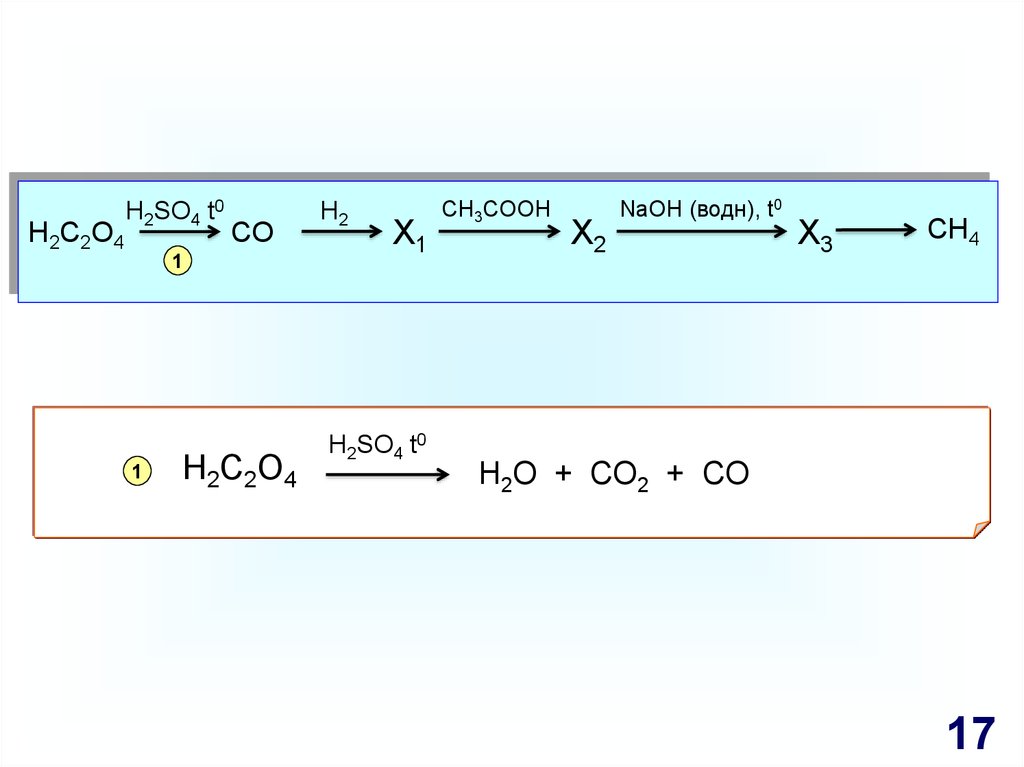
17.
H2C2O4H2SO4 t0
CO
1
1
H2C2O4
H2
X1
H2SO4 t0
CH3COOH
X2
NaOH (водн), t0
X3
CH4
H2O + CO2 + CO
17
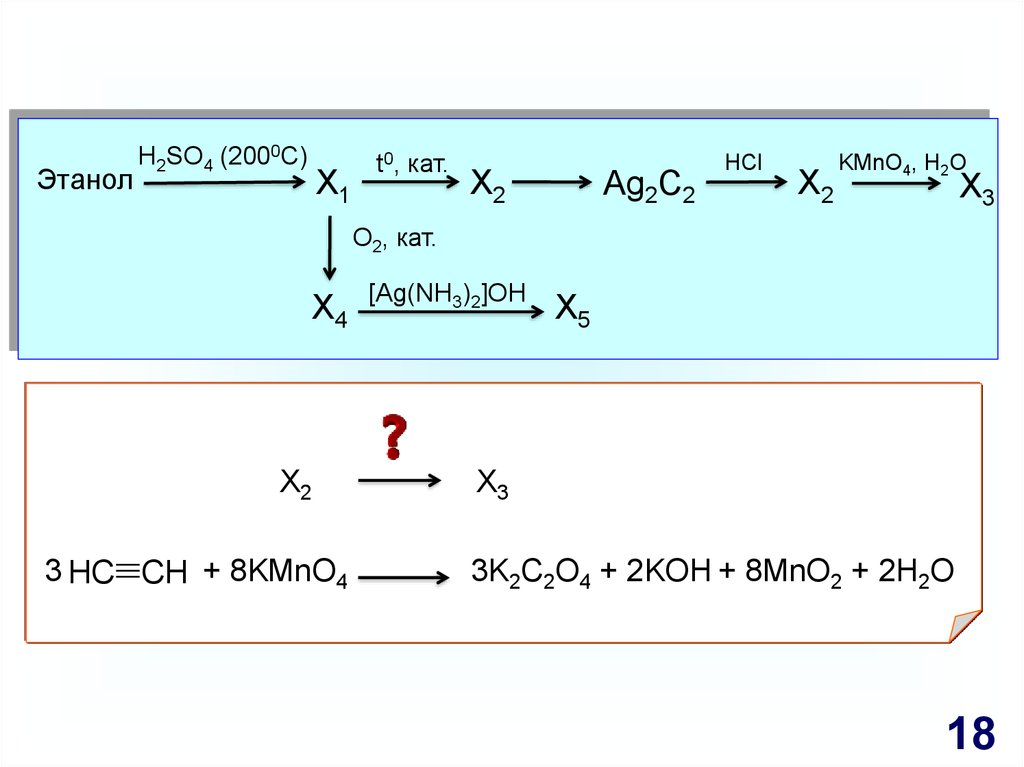
18.
ЭтанолH2SO4 (2000C)
X1
t0, кат.
X2
Ag2C2
HCl
X2
KMnO4, H2O
X3
O2, кат.
X4
Х2
3 HC CH + 8KMnO4
[Ag(NH3)2]OH
X5
X3
3K2C2O4 + 2KOH + 8MnO2 + 2H2O
18
19.
Основность увеличивается в ряду:1. Этиламин, аммиак, аналин, диэтиламин
2. Аммиак, этиламин, анилин, диэтиламин
3. Анилин, аммиак, этиламин, диэтиламин
4. Диэтиламин, этиламин, анилин, аммиак
19
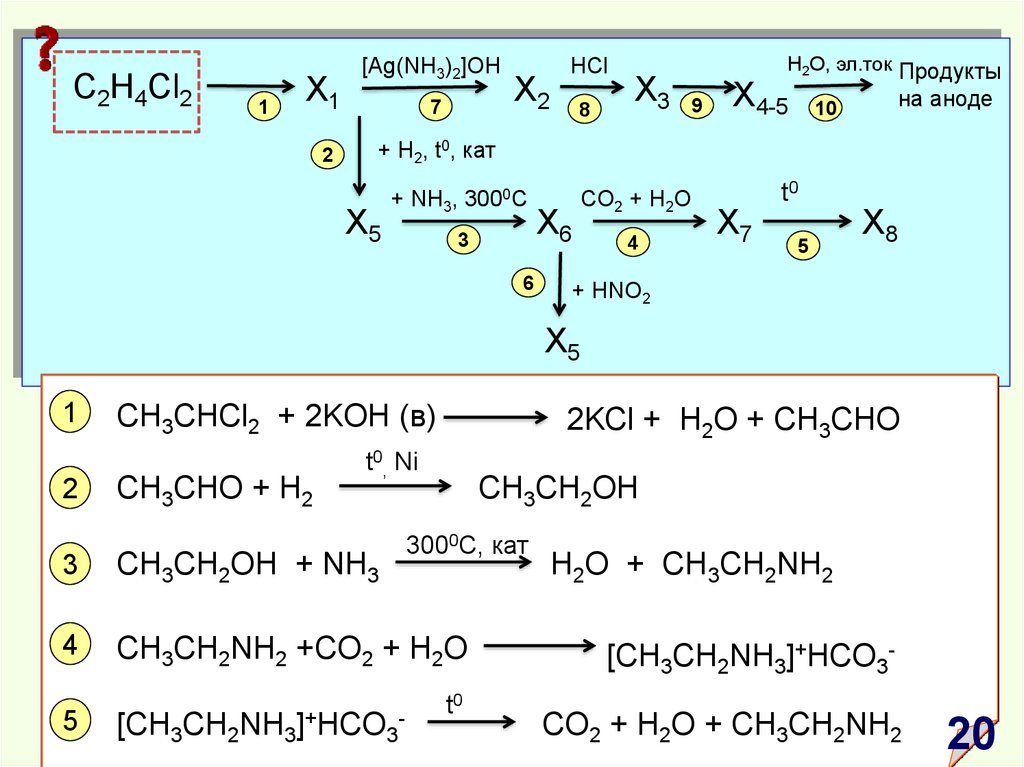
20.
С2H4Cl21
X1
2
[Ag(NH3)2]OH
7
X2
HСl
8
Х3
H2O, эл.ток Продукты
9
Х4-5
на аноде
10
+ H2, t0, кат
X5
+ NH3, 3000C
3
6
X6
CO2 + H2O
4
t0
X7
5
X8
+ HNO2
X5
1
2
CH3CHCl2 + 2KOH (в)
CH3CHO + H2
2KCl + H2O + CH3CHO
t0, Ni
CH3CH2OH
3000C, кат
3
CH3CH2OH + NH3
4
CH3CH2NH2 +CO2 + H2O
5
[CH3CH2NH3]+HCO3-
t0
H2O + CH3CH2NH2
[CH3CH2NH3]+HCO3CO2 + H2O + CH3CH2NH2
20
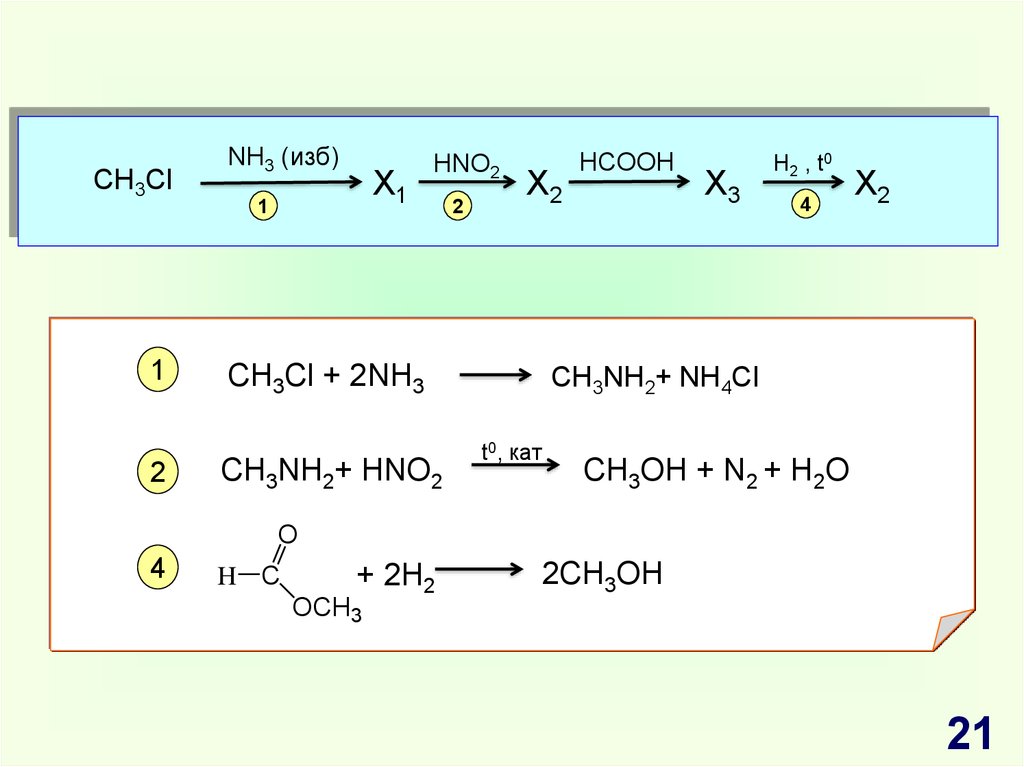
21.
CH3Cl1
2
NH3 (изб)
X1
1
HNO2
2
X2
CH3Cl + 2NH3
CH3NH2+ HNO2
HCOOH
X3
H2 , t0
4
X2
CH3NH2+ NH4Cl
t0, кат
CH3OH + N2 + H2O
O
4
H C
+ 2H2
2CH3OH
OCH3
21
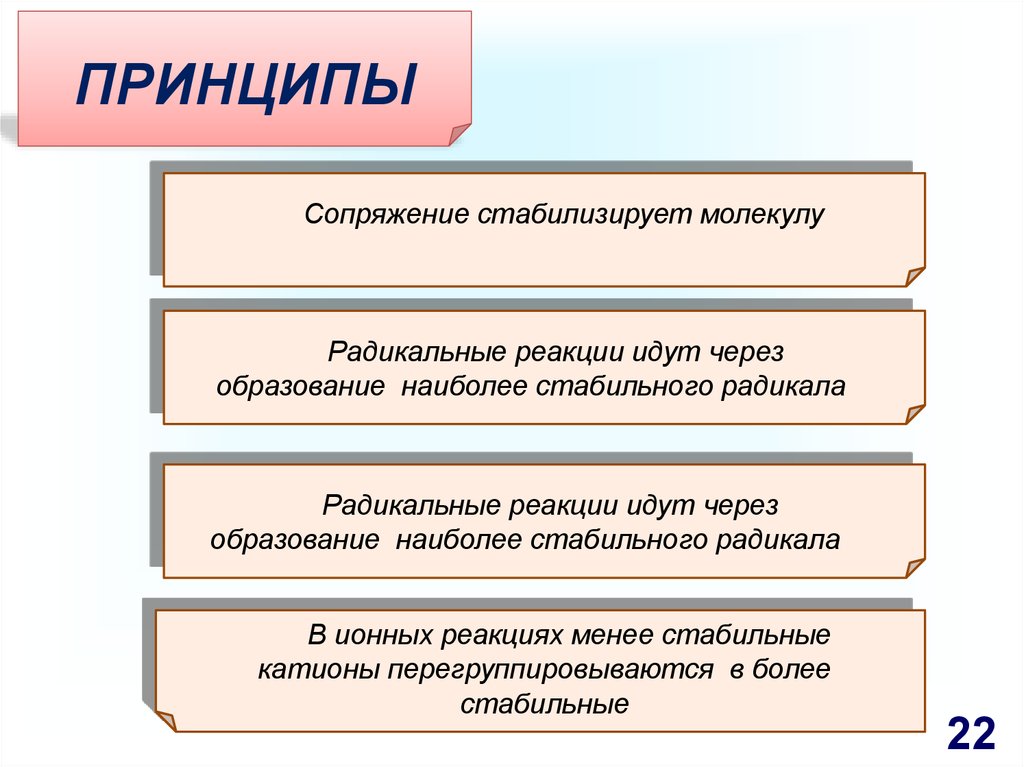
22.
ПРИНЦИПЫСопряжение стабилизирует молекулу
Радикальные реакции идут через
образование наиболее стабильного радикала
Радикальные реакции идут через
образование наиболее стабильного радикала
В ионных реакциях менее стабильные
катионы перегруппировываются в более
стабильные
22
23. Свойства
Установить соответствие между исходнымивеществами и продуктами взаимодействия с бромом:
Исходные вещества
Продукты взаимодействия с бромом
1) 2-бром-2-метилпропан
2) 1-бромпропан
3) 2-бромпропан
4) 1,3-дибромпропан
5) 1,2-дибромциклогексан
6) 1,4-дибромпентен-2
7) 1,4-дибромпентен-1
8) Бензилбромид
9) п- и о-бромтолуол
10) 1,2,4,5-тетрабромпентан
11) бромциклогексан
А) пропан
Б) изобутан
В) толуол
hγ
Г) пентадиен-1,3
Д) пентадиен-1,4
Е) циклогексан
Ж) циклопропан
А
Б
В
Г
Д
Е
Ж
3
1
8
6 10 11
4
23
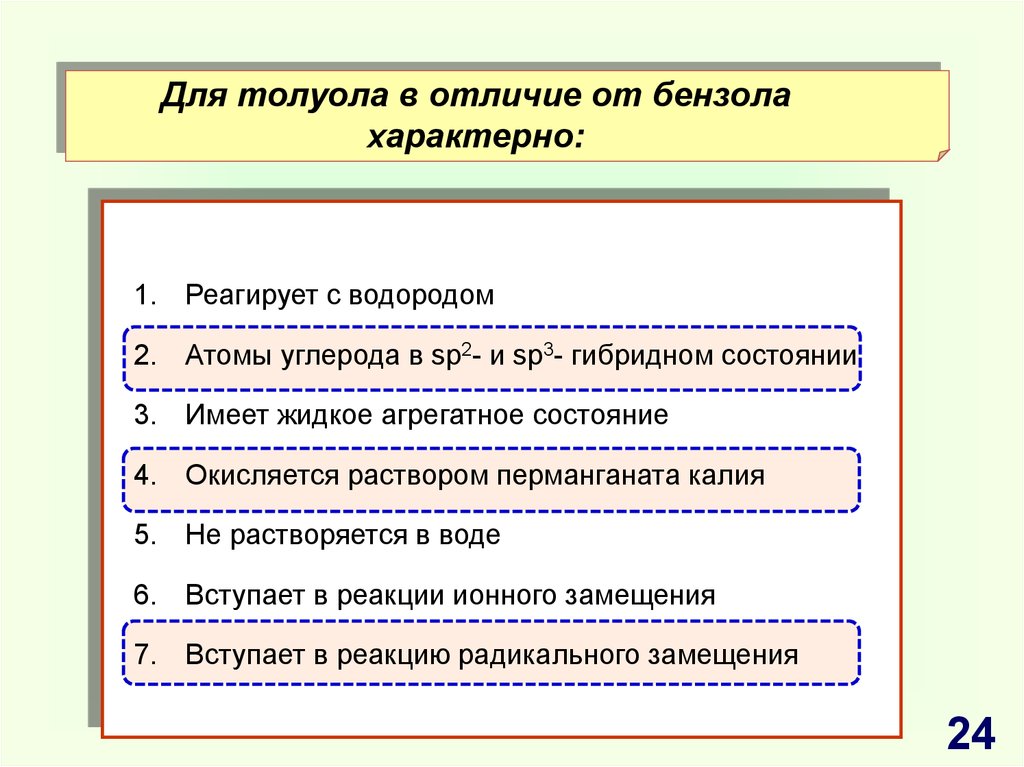
24.
Для толуола в отличие от бензолахарактерно:
1. Реагирует с водородом
2. Атомы углерода в sp2- и sp3- гибридном состоянии
3. Имеет жидкое агрегатное состояние
4. Окисляется раствором перманганата калия
5. Не растворяется в воде
6. Вступает в реакции ионного замещения
7. Вступает в реакцию радикального замещения
24
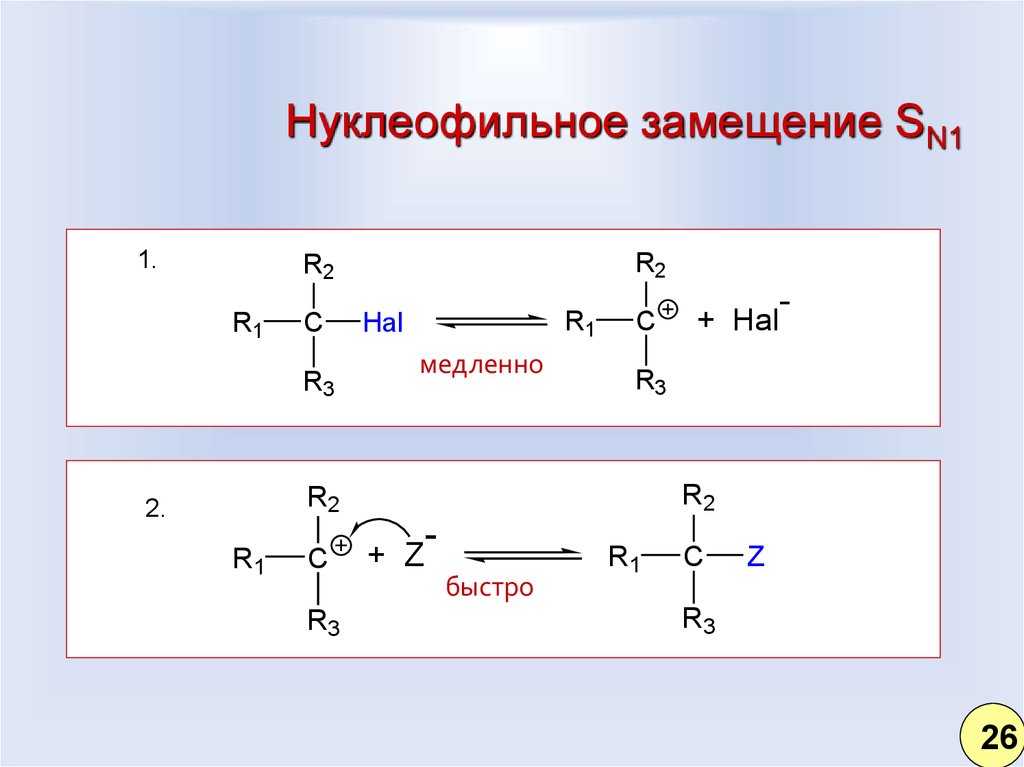
25. Нуклеофильное замещение SN1
1.R2
R2
R1
C
R3
R1
Hal
медленно
C
R3
R2
R2
2.
R1
C
-
+ Z
быстро
R3
+ Hal
-
R1
C
Z
R3
26
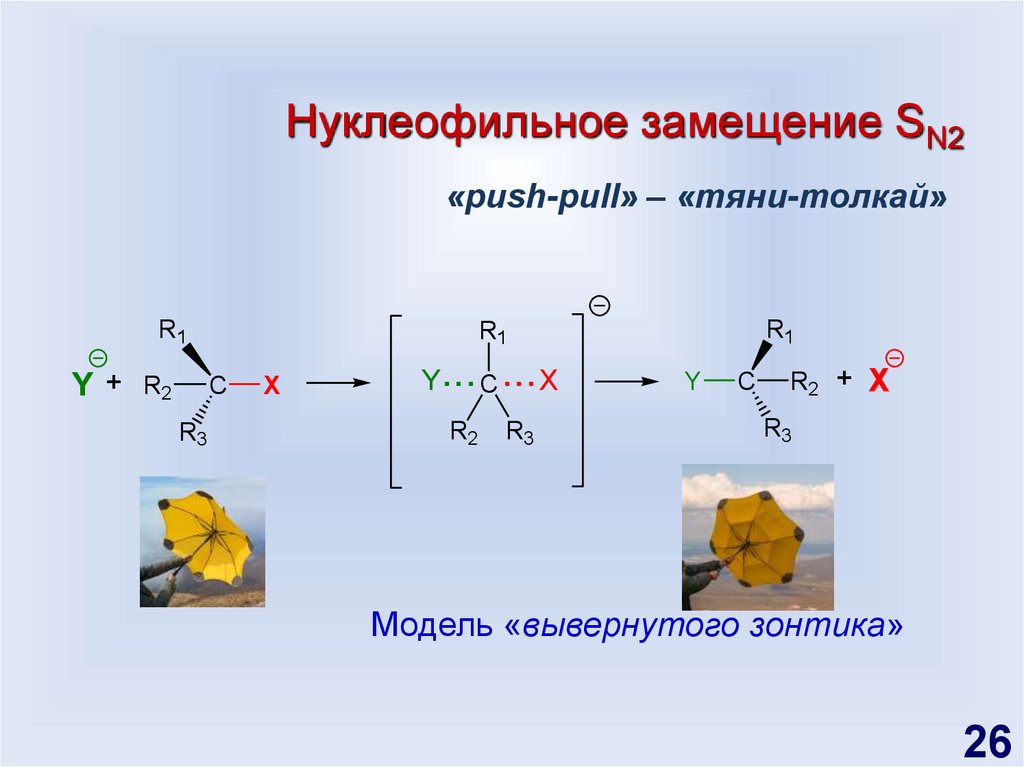
26.
Нуклеофильное замещение SN2«push-pull» – «тяни-толкай»
R1
Y+
R2
C
R3
R1
R1
X
Y... C ... X
R2
R3
Y
C
R2 +
X
R3
Модель «вывернутого зонтика»
26
27.
21
H3C CH2 CHCI2
1 H3C CH2
2
3
X
Y
X
и Y
OH
+ 2KOH (водн.)
CHCI2
H3C CH2 CH
- 2KCI
OH
O
+ 2H2
H3C CH2 C
Ni, to
CH3 CH CH2
O
- H2 O
H3C CH2 C
H
H3C CH2 CH2OH
H
3
H3C CH2 CH2OH
H2SO4(k)
CH3 CH CH2
to > 140oC
27
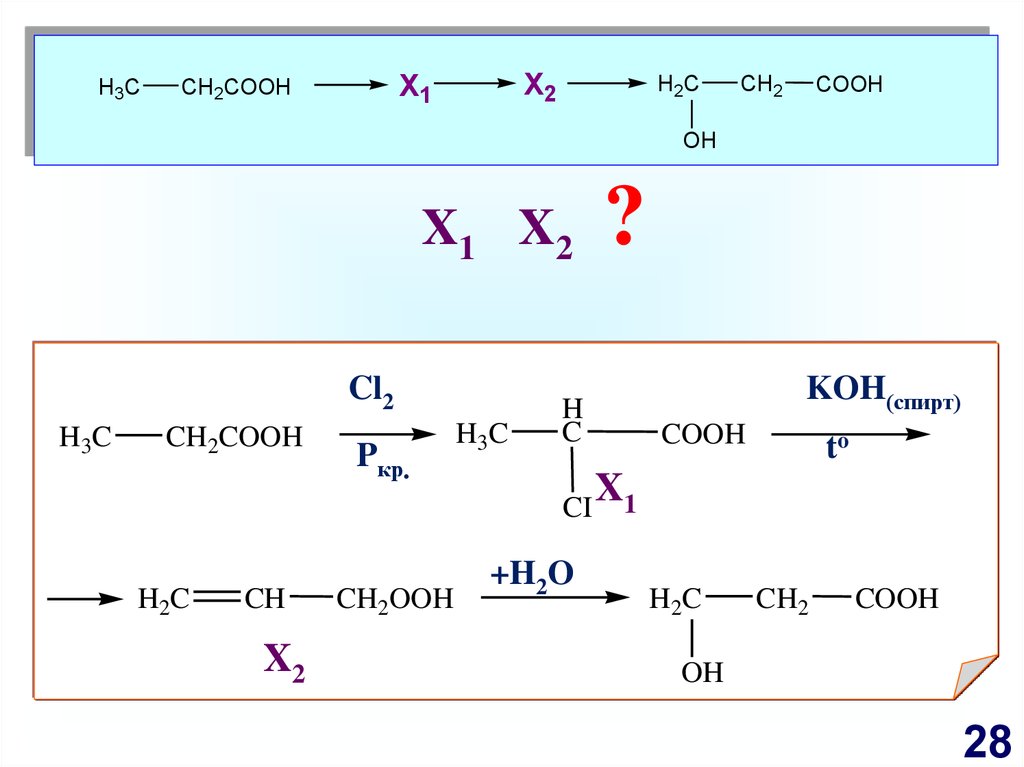
28.
H3CX2
X1
CH2COOH
H2C
CH2
COOH
OH
X1 X2
Cl2
H3C
CH2COOH
Pкр.
H3C
CH
X2
CH2OOH
KOH(спирт)
H
C
CI
H 2C
?
+H2O
COOH
to
X1
H2C
CH2
COOH
OH
28
29.
CH3CH3
KOH
CH3 C CH2
Cl
(водн.)
CH3 C CH2
CH3
OH
CH3
OH
KOH
(водн.)
CH3 C CH2 CH3
CH3
CH3
CH3
CH3 C CH2
Cl
CH3 C
CH3
CH2
CH3
менее стабильный
катион
OHCH3 C
CH2 CH3
CH3
более стабильный
катион
CH3
CH3 C CH2 CH3
CH3
29
30.
OHCH3
CH3
H2SO4
CH3
H3C
H3 C
HO
CH3
CH3
OH2
CH3 ~ СH3
CH3
- H2O
H3C
H3 C
CH3
CH3
H+
H3C
~ СH3
CH3
H3C
вторичный
катион
H 3C
H
CH3
H3 C
третичный
катион
CH3
H3 C
30
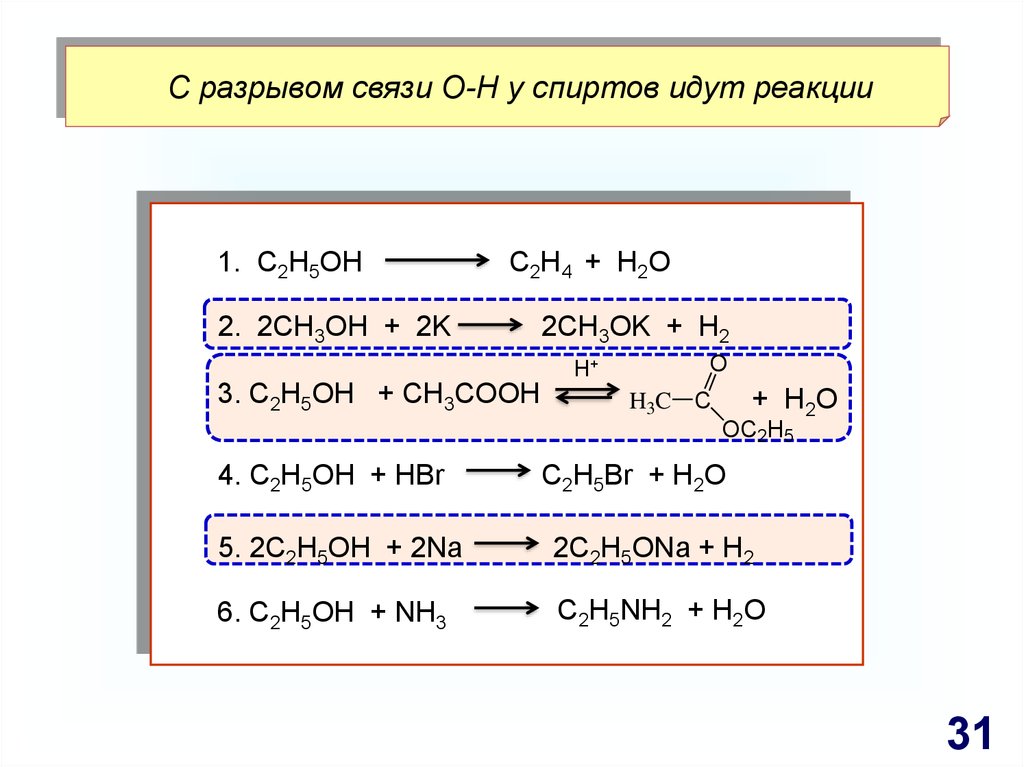
31.
С разрывом связи О-Н у спиртов идут реакции1. С2H5OH
С 2 H 4 + H2 O
2. 2CH3OH + 2K
3. С2H5OH + СH3COOH
2CH3OK + H2
H+
O
+ H2O
H3C C
OC2H5
4. С2H5OH + HBr
С2H5Br + H2O
5. 2С2H5OH + 2Na
2С2H5ONa + H2
6. С2H5OH + NH3
С2H5NH2 + H2O
31
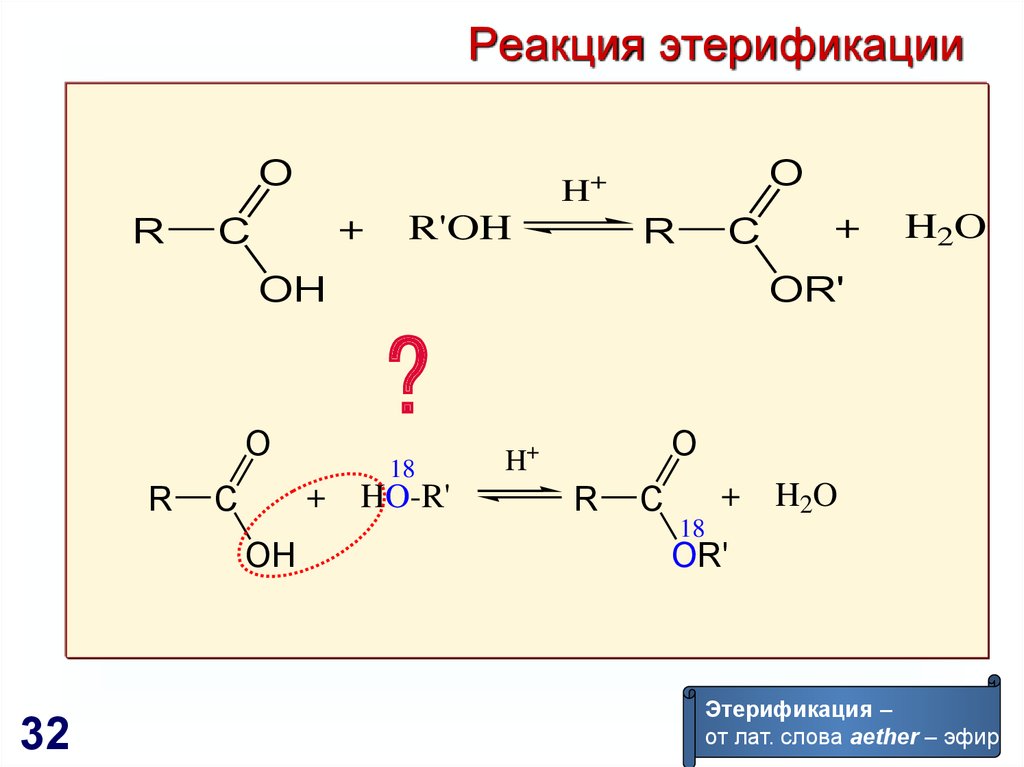
32.
Реакция этерификацииO
R
O
H+
+
C
R'OH
R
C
OH
+
H2O
OR'
?
O
R
+
C
OH
32
18
HO-R'
O
H+
R
+
C
H2O
18
OR'
Этерификация –
от лат. слова aether – эфир.
33.
Вопреки правилу Марковникова идут реакции :1. H2C
CH CH2
2. F3C
CH
3. H3C C
CH3 + HBr
CH2 + H2O
CH2 + HBr
CH3
4. CH2 CH COOH + HBr
5. H3C
CH CH2 + BrOH
6. CH2
CH
7. CH2
CH
C
N + HBr
CH3 + HBr
H2O2
33
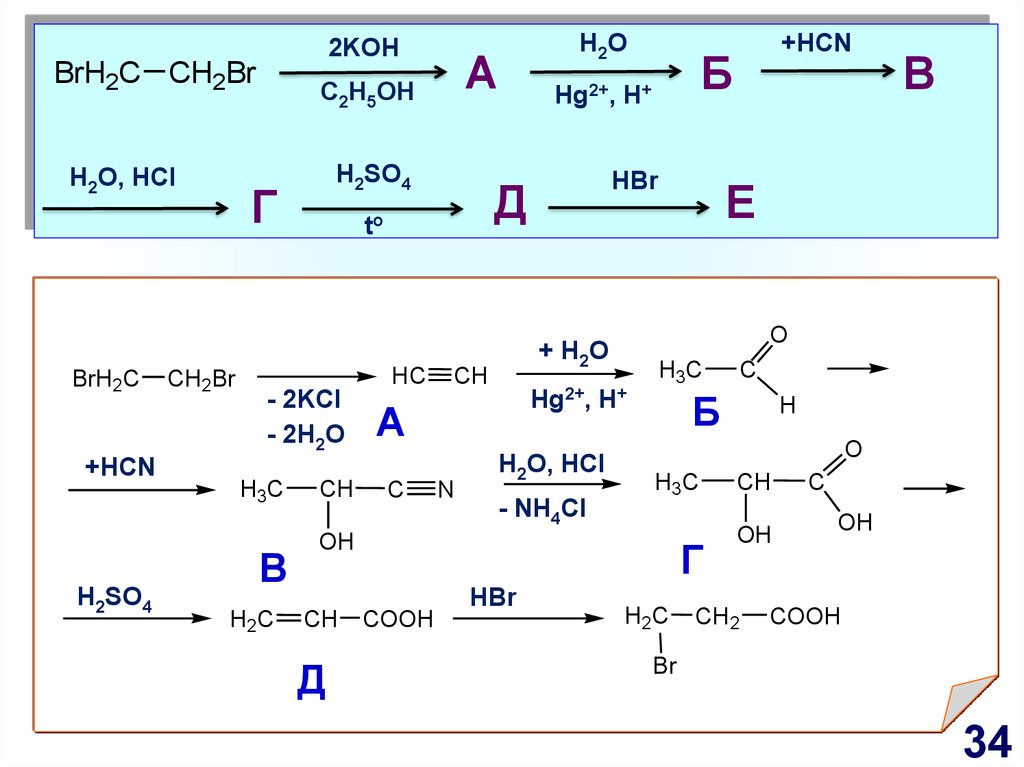
34.
2KOHBrH2C CH2Br
H2O, HCl
BrH2C
+HCN
H2SO4
H2SO4
Г
CH2Br
А
C2H5OH
- 2KCl
- 2H2O
H3C
В
H2 C
CH
N
H2O, HCl
- NH4Cl
O
H3C
CH
Д
COOH
C
Б
H
O
H3 C
CH
Г
OH
OH
HBr
В
Е
Hg2+, H+
А
C
HBr
+ H2O
CH
+HCN
Б
Hg2+, H+
Д
to
HC
H2O
H2C
CH2
C
OH
COOH
Br
34
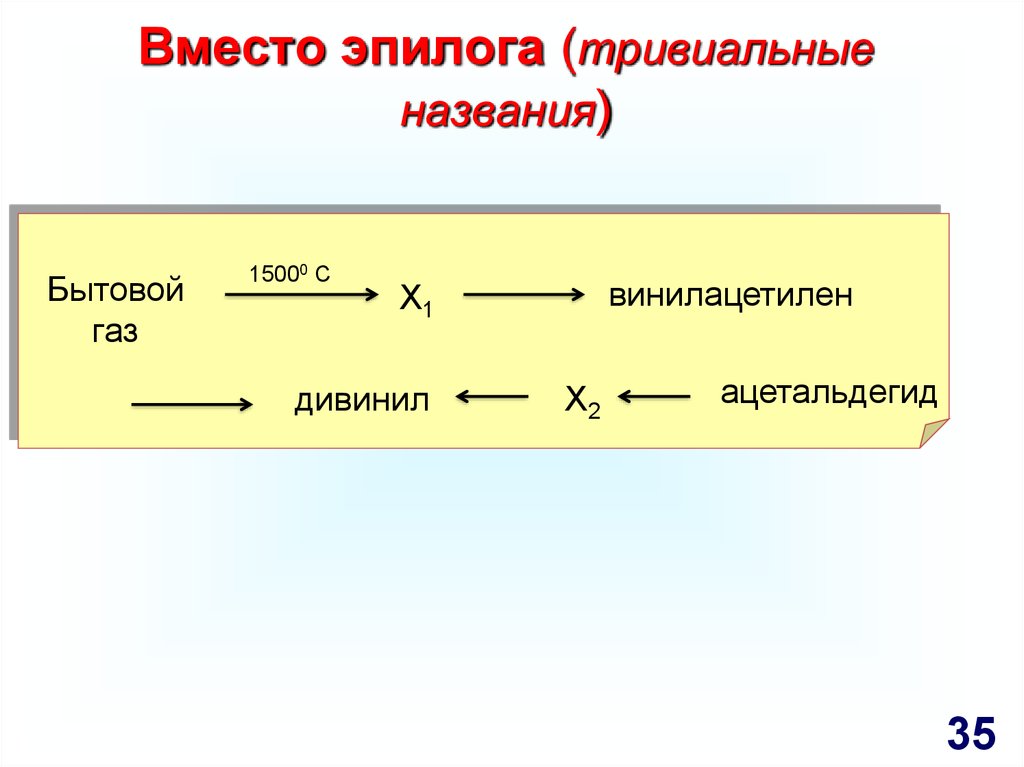
35.
Вместо эпилога (тривиальныеназвания)
Бытовой
газ
15000 С
винилацетилен
X1
дивинил
X2
ацетальдегид
35
36.
Разделение нефти на фракциипроисходит в процессе
1.Коксование
2. риформинг
3. ректификация
4. Крекинг
36
37.
Как бензол, так и его гомологи можно получить,осуществляя
1. Изомеризацию алканов
2. Платформинг циклоалканов
3. Тримеризацию алкенов
4. Риформинг алканов
5. Димеризацию диенов
6. Тримеризацию алкинов
37
38.
В реакцию полимеризации могут вступать :1. Фенол и формальдегид
2. Бензол и стирол
3. Изопрен и этилен
4. Дивинил и хлоропрен
5. Винихлорид и кумол
38
39. Хлоропрен
3940.
Каучук, формула которогополучают при сополимеризации
1. Дивинила и изопрена
2. Стирола и изопрена
3. Хлоропрена и этилена
4. Стирола и дивинила
40
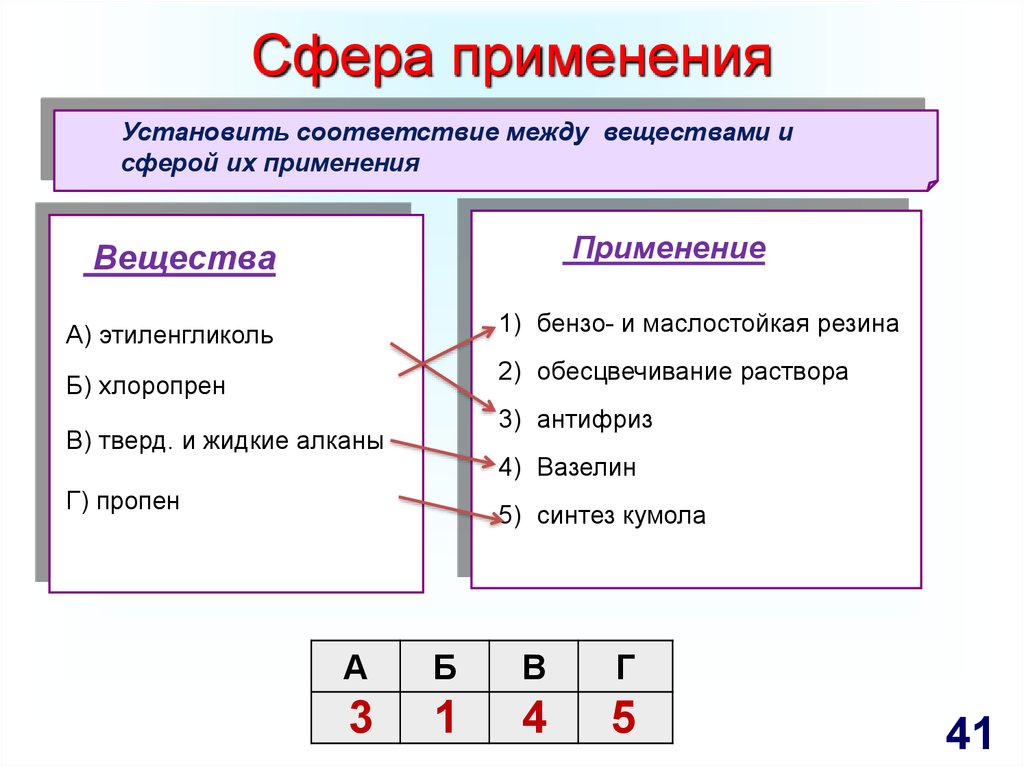
41. Сфера применения
Установить соответствие между веществами исферой их применения
Применение
Вещества
1) бензо- и маслостойкая резина
А) этиленгликоль
2) обесцвечивание раствора
Б) хлоропрен
3) антифриз
В) тверд. и жидкие алканы
4) Вазелин
Г) пропен
5) синтез кумола
А
Б
В
Г
3
1
4
5
41
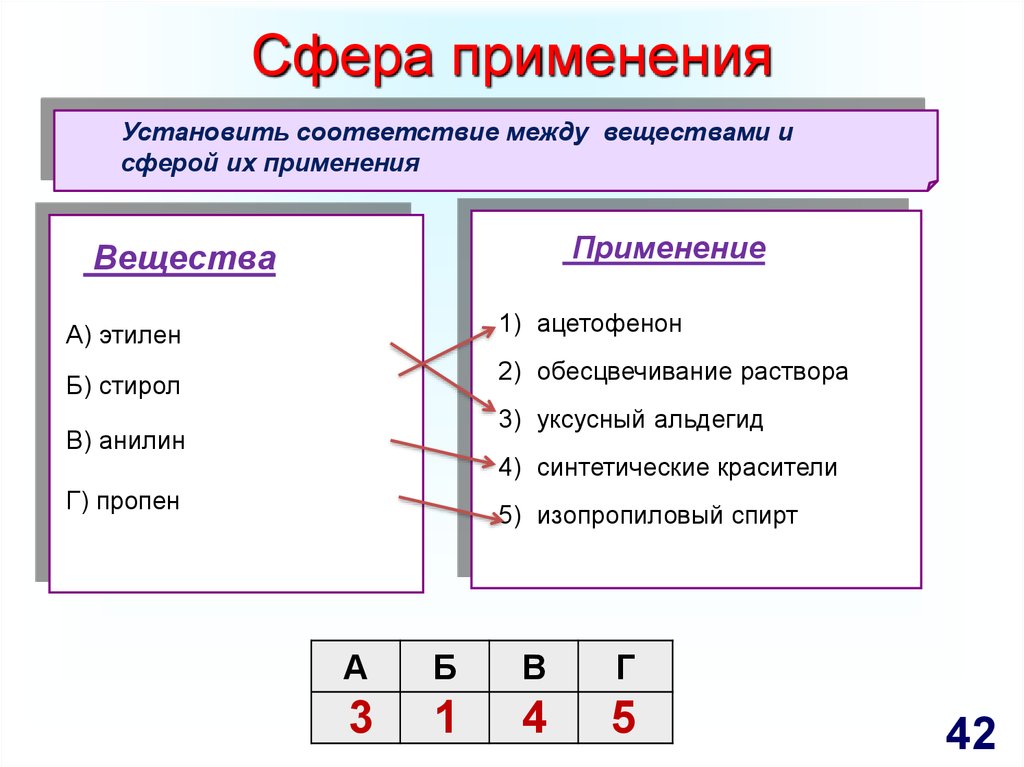
42. Сфера применения
Установить соответствие между веществами исферой их применения
Применение
Вещества
1) ацетофенон
А) этилен
2) обесцвечивание раствора
Б) стирол
3) уксусный альдегид
В) анилин
4) синтетические красители
Г) пропен
5) изопропиловый спирт
А
Б
В
Г
3
1
4
5
42
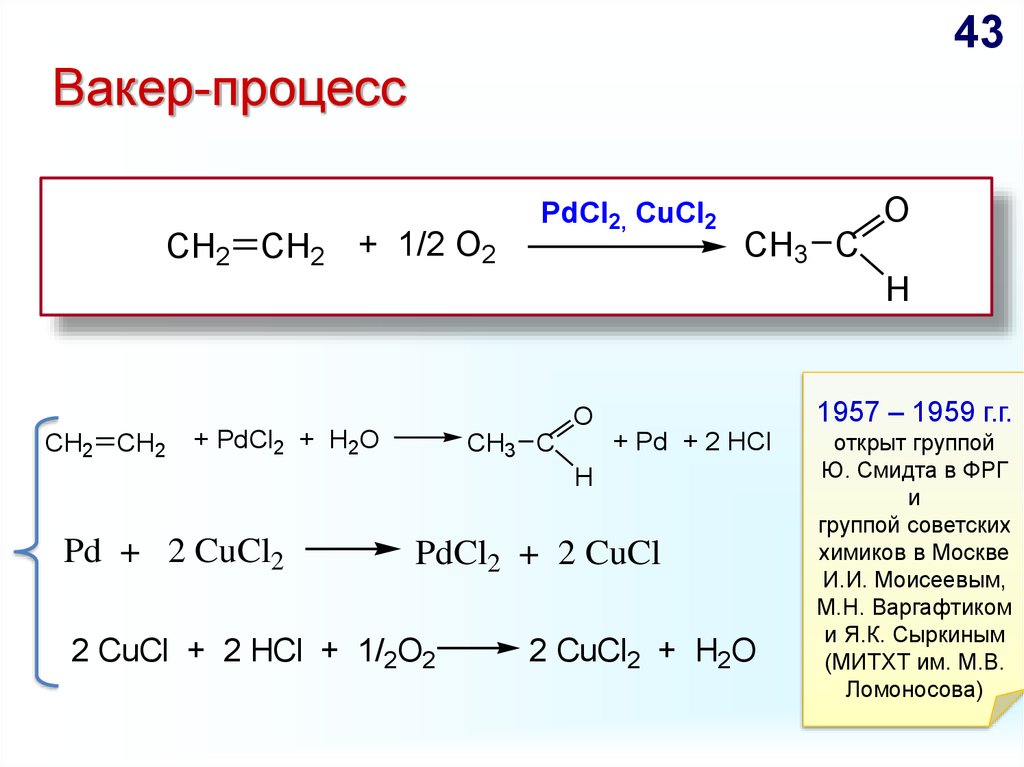
43. 1957 – 1959 г.г. открыт группой Ю. Смидта в ФРГ и группой советских химиков в Москве И.И. Моисеевым, М.Н. Варгафтиком и Я.К.
43Вакер-процесс
CH2 CH2 + 1/2 O2
PdCl2, CuCl2
O
CH3 C
H
CH2 CH2
1957 – 1959 г.г.
O
+ PdCl2 + H2O
+ Pd + 2 HCl
CH3 C
H
Pd + 2 CuCl2
PdCl2 + 2 CuCl
2 CuCl + 2 HCl + 1/2O2
2 CuCl2 + H2O
открыт группой
Ю. Смидта в ФРГ
и
группой советских
химиков в Москве
И.И. Моисеевым,
М.Н. Варгафтиком
и Я.К. Сыркиным
(МИТХТ им. М.В.
Ломоносова)
44.
В реакцию полимеризации могут вступать обасоединения
1.
2.
3.
и
и
и
и
4.
5.
и
44
45.
Какие из следующих утверждений верны?1. При риформинге н-гептана образуется бензол.
2. Винилацетилен получают димеризацией ацетилена.
3. Ацетилен можно получить в результате термического
разложения метана.
4. Карбидный способ получения ацетилена заключается в
обработке карбида алюминия водой.
5. Стереорегулярные каучуки получают при
полимеризации 1,3-диеновых углеводородов в
присутствии металлического натрия.
45
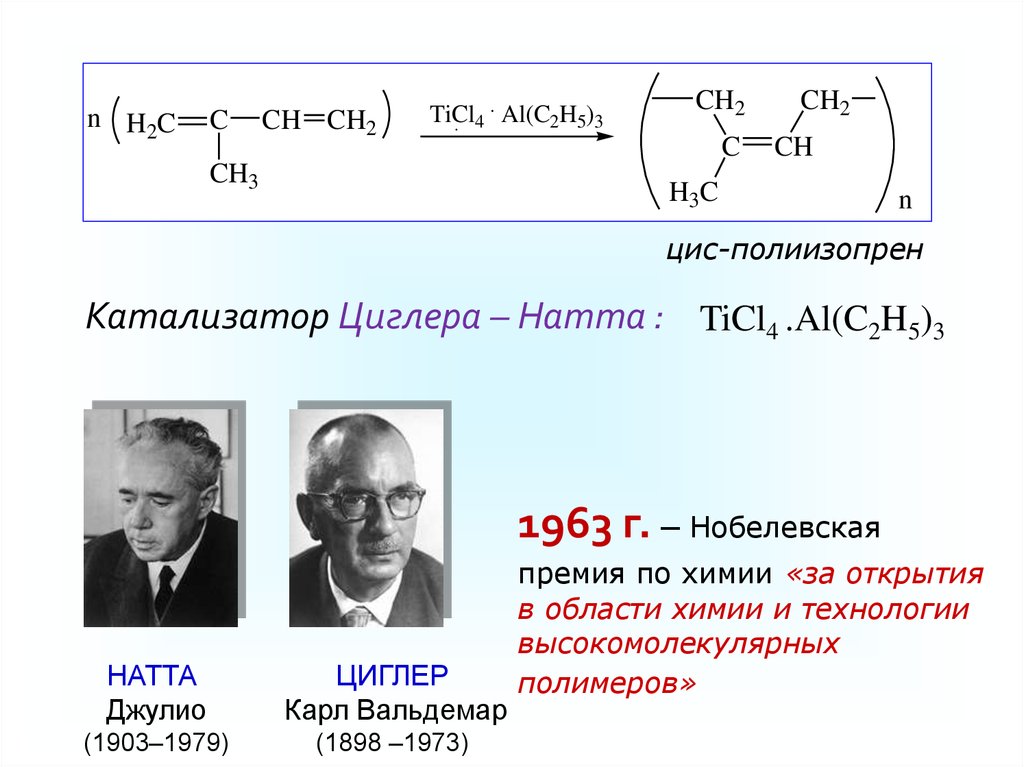
46.
n H2CC
CH CH2
TiCl4 . Al(C2H5)3
CH3
CH2
C
CH2
CH
H3C
n
цис-полиизопрен
Катализатор Циглера – Натта : TiCl4 .Al(C2H5)3
1963 г. – Нобелевская
НАТТА
Джулио
ЦИГЛЕР
Карл Вальдемар
(1903–1979)
(1898 –1973)
премия по химии «за открытия
в области химии и технологии
высокомолекулярных
полимеров»
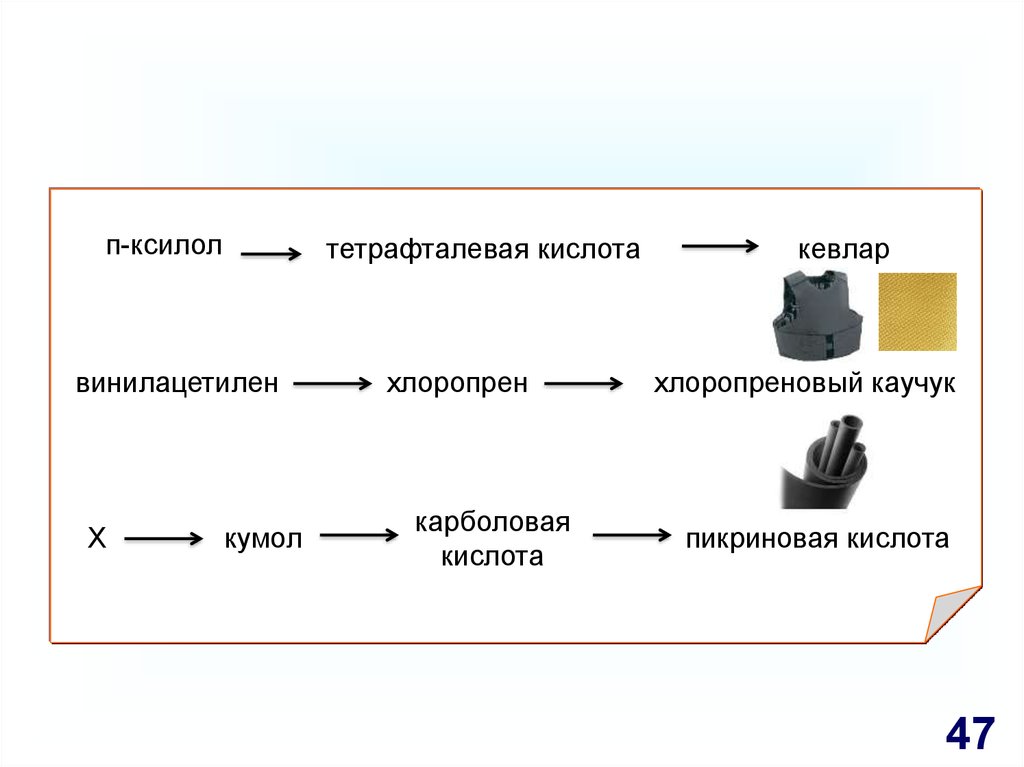
47.
п-ксилолтетрафталевая кислота
винилацетилен
Х
кумол
хлоропрен
карболовая
кислота
кевлар
хлоропреновый каучук
пикриновая кислота
47


























 Химия
Химия








