Похожие презентации:
Органическая химия. Альдегиды и кетоны
1. Министерство науки и высшего образования РФ ФГБОУ ВО «Самарский государственный технический университет» Химико-технологический
факультетКафедра органической химии
Направление
подготовки
Органическая химия
Тема: Альдегиды и кетоны.
Преподаватель: д.х.н., профессор Климочкин Ю.Н
1
2.
По природе радикала:Классификация
1. На альдегиды и кетоны
Альдегиды и кетоны относятся к карбонильным
соединениям (содержат группу >С=О) и имеют
общую формулу:
O
R C
R1
для альдегидов - R1=Н, R=Alk, для кетонов - R=R1=Alk
1.1. Жирного ряда (предельные и непредельные):
H
O
H3C
H
H3C
O
2
3.
1.2. Ароматические:O
O
H
O
O
1.3. Жирноароматические:
CH3
H
O
1.4. Ряда циклопарафинов:
O
H
O
S
1.5. Гетероциклические :
O
H
O
3
4.
2. По количеству С=О – групп:O
H
2.1. Моно2.2. Ди-
H
O
O
H
O
2.3. Поли-
H
O
H
H
O
3. По взаимному расположению С=О – групп:
3.1. α- (1,2-)
O
3.2. β- (1,3-)
O
CH3
O
H
O
4
5.
Альдегиды и кетоны жирного ряда (предельные)O
CnH2n+1 H
O
CnH2n+1
CmH2m+1
Тривиальные названия альдегидов производят от тривиальных названий тех кислот,
в которые альдегиды превращаются при окислении.
По рациональной номенклатуре названия альдегидов строятся с использованием в
качестве основы названия уксусного альдегида. Более сложные альдегиды
рассматриваются как производные с замещением атомов водорода в метильной группе
уксусного альдегида на более сложные радикалы.
По номенклатуре ИЮПАК алифатические альдегиды
называют по самой длинной углеродной цепи, прибавляя к
названию алифатического углеводорода суффикс -аль.
Наличие в соединении двух альдегидных групп
обозначается –диаль:
H
O
O
H
этандиаль
5
6.
5H3C
4
3
CH 2 CH 2
2
CH 2
1
C
O валериановый альдегид,
пропилуксусный альдегид
H
4
H3C
3
CH
2
CH 2
1
C
O
H3C
пентаналь
изовалериановый альдегид,
CH
3
CH 2
2
CH
1
C
CH3
3 2
1
H2C C
C
CH3
O
H
C
H
бромвалериановый альдегид
3-метилбутаналь
O
H
CH3
CH 2
Br
O
H3C
4
H3C
CH 2
изопропилуксусный альдегид,
H
CH3
O
метилэтилуксусный альдегид,
2-метилбутаналь
триметилуксусный альдегид,
2,2-диметилпропаналь
CH
OH
CH 2
C
H
гидроксимасляный альдегид
7.
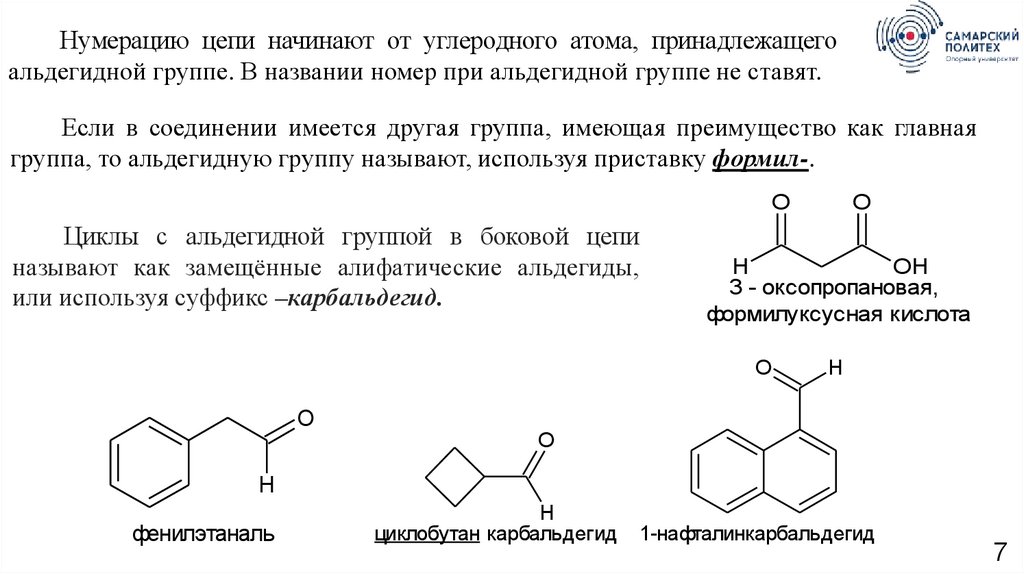
Нумерацию цепи начинают от углеродного атома, принадлежащегоальдегидной группе. В названии номер при альдегидной группе не ставят.
Если в соединении имеется другая группа, имеющая преимущество как главная
группа, то альдегидную группу называют, используя приставку формил-.
O
Циклы с альдегидной группой в боковой цепи
называют как замещённые алифатические альдегиды,
или используя суффикс –карбальдегид.
O
H
OH
3 - оксопропановая,
формилуксусная кислота
O
H
O
O
H
фенилэтаналь
H
циклобутан карбальдегид
1-нафталинкарбальдегид
7
8.
H CO
H
Муравьиный альдегид, метаналь
формальдегид.
Уксусный альдегид, этаналь,
ацетальдегид
Пропионовый альдегид, пропаналь,
метилуксусный альдегид
Масляный альдегид, бутаналь,
этилуксусный альдегид
Изомасляный альдгид, 2метилпропаналь,
диметилуксусный альдегид
8
9.
Для кетонов тривиальное название используется для первогопредставителя – ацетона (СН3СОСН3).
По рациональной номенклатуре названия строятся путем перечисления
радикалов, связанных с карбонильной группой, и добавлением основы «-кетон»
(например, метилэтилкетон — CH3-CO-CH2-CH3).
В соответствии с номенклатурой ИЮПАК названия алифатических и
алициклических кетонов образуют, прибавляя суффикс –он или –дион (для
дикетонов).
H3C
O
O
CH3
2,3-бутандион
O
O
H3C
H
3-оксобутаналь
Если в соединении имеется другая группа, имеющая преимущество как главная,
то для обозначения карбонильной группы используется приставка оксо-.
9
10.
Циклические кетоны с кето- группой в боковой цепи называют порадикалам. Кроме того, допускаются названия по алифатическому кетону
или по циклической структуре. В последнем случае боковая цепь
называется как ацильный радикал. Суффиксы -фенон, нафтон
допустимы только для бензола и нафталина соответственно.
O
O
O
CH3
CH3
ацетил
CH3
C CH3
O
Диметилкетон,
ацетон, пропанон
CH3
ацетофенон
CH3
HO
O
4-ацетилбензойная кислота
C CH2 CH3
O
Метилэтилкетон, бутанон-2
CH3
CH
CH3
C CH2 CH2 CH3
O
Пропилизопропилкетон,
2-метилгексанон-3
10
11.
Изомерия альдегидовИзомерия углеродного скелета,
начиная с С4
Межклассовая изомерия:
- с кетонами, начиная с С3
- циклическими оксидами (с С2)
- непредельными спиртами и
простыми эфирами (с С3)
11
12.
Изомерия кетоновУглеродного скелета (c C5)
Положения карбонильной группы (c C5)
Межклассовая изомерия аналогична альдегидам
12
13.
Способы получения1. Окисление спиртов:
в качестве окислителей применяют
K2Cr2O7/разб. H2SO4, CrO3/разб. H2SO4,
CrO3 в пиридине, MnO2.
OH
OH
первичный
спирт
O
[O]
- H 2O
H
альдегид
O
[O]
- H 2O
вторичный
спирт
o
кетон
2. Дегидрирование спиртов:
в настоящее время процесс сохранил
свое значение только для получения
формальдегида (катализатор – Cu,
300o C):
O
OH 100-180 C
kat
OH
Kat
+
H
H2
+ H2
O
13
14.
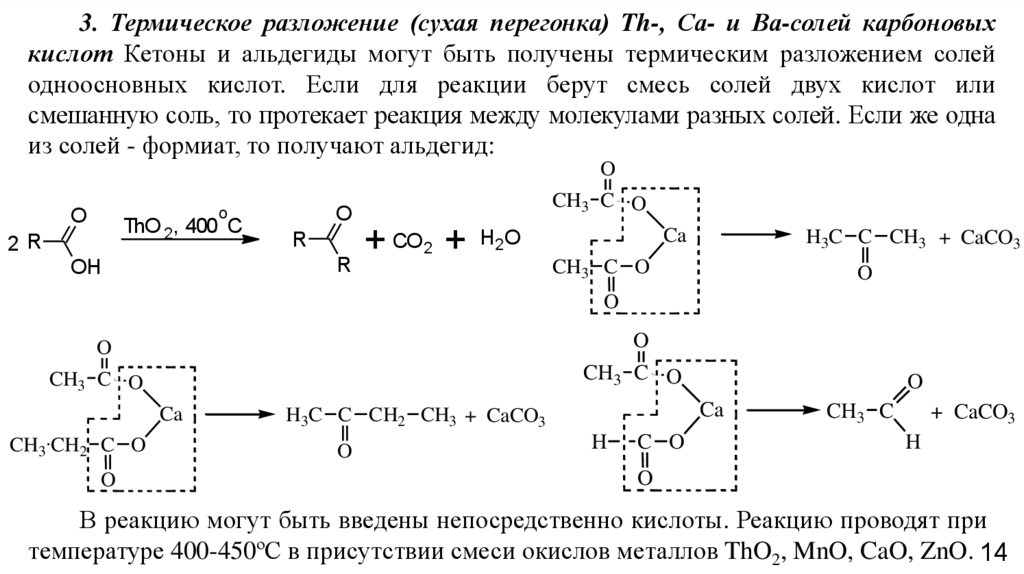
3. Термическое разложение (сухая перегонка) Th-, Са- и Ва-солей карбоновыхкислот Кетоны и альдегиды могут быть получены термическим разложением солей
одноосновных кислот. Если для реакции берут смесь солей двух кислот или
смешанную соль, то протекает реакция между молекулами разных солей. Если же одна
из солей - формиат, то получают альдегид:
O
ThO 2, 400 C
2R
R
R
OH
CH3 C O
O
o
O
+ CO 2 +
Ca
H2O
H3C C CH3 + CaCO3
CH3 C O
O
O
O
O
CH3 C O
CH3 C O
Ca
CH3 CH2 C O
O
Ca
H3C C CH2 CH3 + CaCO3
O
O
H
C O
CH3 C
+ CaCO3
H
O
В реакцию могут быть введены непосредственно кислоты. Реакцию проводят при
температуре 400-450ºС в присутствии смеси окислов металлов ThO2, MnO, CaO, ZnO. 14
15.
4. Промышленный способ, гидратация алкинов:5. Гидролиз гем-дигалогенпроизводных:
H3C CHCl 2
H3C
H3C
CCl 2
O
2 H 2O, 2 KOH
- 2 КCl, H 2O
H3C
H
2 H 2O, 2 KOH
H3C
O
- 2 КCl, H 2O
CH3
15
16.
6. Оксосинтез (промышленный):реакция открыта Реленом в 1938 г. (100-200оС, 100-250 атм СО, катализатор). Процесс
(оксосинтез, гидроформилирование) катализируется дикобальтоктакарбонилом
[Co(CО)4]2. Лучше – Rh–Ph3P, давление ниже.
CH3 CH
CH2 + CO + H2
[Co(CO)4]2
t C
O
CH3 CH2 CH2 C
+
H
бутаналь
(основной продукт)
CH3 CH CH3
C
H
O
2-метилпропаналь
Практическое значение имеют пропионовый, н- и изо- масляные альдегиды,
получаемые гидроформилированием этилена и пропилена.
16
17.
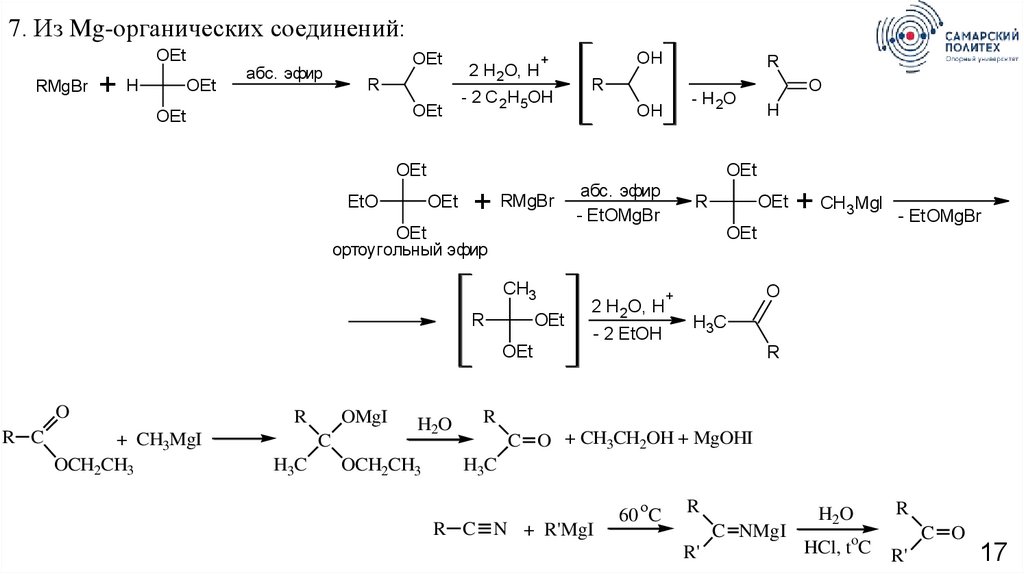
7. Из Mg-органических соединений:OEt
RMgBr
+H
OEt
абс. эфир
OEt
R
OEt
OEt
2 H 2O, H
OH
+
- 2 C 2H5OH
R
R
- H 2O
OH
OEt
EtO
OEt
+ RMgBr
R
OEt
R
OEt
2 H 2O, H
+ CH3MgI
OCH2CH3
OMgI
C
H3C
H2O
OCH2CH3
- EtOMgBr
- 2 EtOH
O
+
H3C
OEt
R
+ CH 3MgI
OEt
CH3
R C
H
OEt
абс. эфир
- EtOMgBr
OEt
ортоугольный эфир
O
O
R
R
C O + CH3CH2OH + MgOHI
H3C
R C N + R'MgI
60 C
R
C NMgI
R'
H2O
R
HCl, toC
R'
C O
17
18.
8. «Вакер-процесс»: основным современным методом получения уксусногоальдегида является каталитическое окисление этилена. Этилен окисляют в водном
растворе, содержащем хлориды палладия (II) и меди (II). Катализатор
регенирируют при действии кислорода в условиях непрерывного синтеза:
H
H
H
H
+
1/2 O 2
CuCl 2/PdCl 2
O
H3C
H2C
CH2 + PdCl 2 + H2O
CH 3CHO + Pd + 2 HCl
H
Pd + 2 CuCl 2
PdCl 2 + Cu 2Cl 2
2 Cu 2Cl 2 + O2 + 4 HCl
4 CuCl 2 + 2 H2O
9. Окисление кумола – получение ацетона:
+ O2
OOH
kat
+
[H ]
гидроперекись
изопропилбензола
OH
+
O
CH3
CH3
18
19.
10. Окисление и восстановление:O
O2
H2
Kat
OH
Pd, Ni
11.Реакция Нефа:
R'
O
OH
-
R'
R
O
R
+
HO
R'
OH
+
N
-
R
H
H2O
OH
OH
N
R'
O
+
H
+
N
N
R
OH
R
OH
- H 2O, H
+
R
N
R'
HO
O
O + N 2O + H 2O
R'
19
20.
12. Озонирование алкенов:13. Окислительное расщепление виц-гликолей:
R
HO
14. Восстановление ацилгалогенидов
(хлорангидридов карбоновых кислот).
Реакция Розенмунда:
O
H3C C
Cl
R
OsO 4
H
2
OH
Pd / BaSO4
+ H2
80-100oC
O
R
O
H3C C
+ HCl
H
20
21.
Строение карбонильной группы C=Osp2-гибридизация, l = 1,2 Ǻ, µ = 2,7 D
H
C
O
:
H : C :: O
.. :
H
формула Льюиса
H
Связь углерод-кислород является одновременно более прочной и более
реакционноспособной, чем двойная углерод – углеродная связь.
Повышенная реакционная способность связи С=О вызвана различием
электроотрицательности углерода и кислорода.
В связи с появлением частичного положительного заряда на атоме углерода
альдегиды и кетоны проявляют склонность к реакциям с нуклеофильными
21
реагентами.
22.
Альдегиды и кетоны имеют несколько реакционных центров. Особенностиэлектронного строения служат причиной: протонирования карбонильной группы, СН –
кислотности при наличии водородных атомов у α-углеродного атома.
СН-кислотность проявляется в повышенной подвижности атома водорода в αположении по отношению к карбонильной группе, вызванной сильным –I-эффектом
последней:
основный центр - атом О с неподелённой парой
+
электронов - присоединение Н
+
+
H
CH 2O
CH 2OH
O
H
H
C
H
СН-кислотный центр - реакции
конденсации, галогенирования и т. д.
CH 2COR
CH 3COR
+
-H
C
H
электрофильный центр - атом С с частичным
, участвует в реакциях нуклеофильного присоединения
OH
O
Nu
R C H
R C
H
Nu
связь С-Н разрывается в реакциях окисления
[O]
RCOOH
RCOH
22
23.
Физические свойства альдегидов и кетоновФормальдегид – газ с резким запахом, растворим в воде.
Водный раствор формальдегида (40%) называют формалином.
Низшие альдегиды и кетоны – жидкости, легко растворимые в воде. Растворимость резко
уменьшается с увеличением углеводородного.
Низшие альдегиды имеют резки запах, который при сильном разведении напоминает запах
плодов. Высшие гомологи имеют запах цветов и фруктов. Кетоны также обладают сильным запахом.
Плотность альдегидов и кетонов меньше единицы.
При одном и том же составе и строении углеродной цепи кетоны кипят при более высоких
температурах, чем альдегиды.
Температуры кипения альдегидов и кетонов с нормальным строением углеродной цепи выше,
чем у соединений изостроения.
Альдегиды и кетоны кипят при гораздо более низкой температуре, чем спирты того же состава.
Это свидетельствует об отсутствии межмолекулярных водородных связей.
Температуры кипения карбонильных соединений значительно выше температур кипения
углеводородов с той же молекулярной массой.
23
24.
Физические свойства альдегидов и кетоновАльдегиды
Кетоны
Формула
Т. пл.
Т. кип.
Формула
Т. пл.
Т. кип.
НСНО
-92
-21
-
-
-
СН3СНО
-123.5
21
-
-
-
С2Н5СНО
-81
49
СН3СОСН3
-95
56
С3Н7СНО
-99
76
СН3СОС2Н5
-86
80
С4Н9СНО
-92
103
СН3СОС3Н7
-78
102
24
25.
Химические свойства1. Окисление: альдегиды легко окисляются практически любыми
окислителями, даже кислородом воздуха. Окисление альдегидов протекает значительно
легче, чем окисление спиртов. Превращение альдегидов в карбоновые кислоты можно
осуществить действием многих окислителей: HNO3, H2O2, KМnO4, NaClO2, Ag2O,
щелочным раствором йода, соединениями хрома (VI).
O
O
[O]
R
R
H
OH
Реакция «серебряного зеркала»: используют для качественного обнаружения восстановлением одновалентного серебра в аммиачном растворе:
O
R
+
H
Ag2O
NH 3 р-р
[Ag(NH 3)2]OH
O
R
+ 2 Ag
OH
25
26.
Кетоны окисляются с трудом и не дают реакцию «серебряного зеркала»: вкислой и щелочной среде кетоны окисляются с расщеплением углерод – углеродной
связи, при этом образуется смесь продуктов:
R1
O
C O +
R
R2
R1
C C R3
HO
H
R2
R1
R C
C
C R3
H
O
H
R2
O
R C C
H
+ O C
OH
R3
O
H3C
O
CH3
2 [O]
- H 2O
H3C
O
CH3
[O] + H 2O
2 H3C
OH
O
диацетил
R
O
По Байеру-Виллигеру:
O
H2O 2
+
R'
H
R'
R
O
26
27.
2. Присоединение2.1 Восстановление: пригодны все металлические катализаторы.
R
O
H
H2 / kat
или NaBH 4, LiAlH 4
OH
R
Восстановление альдегидов и кетонов водородом в момент выделения приводит к
образованию первичных и вторичных спиртов:
O
R C
[H]
R CH2 OH
H
R1
C O
R
[H]
R1
CH OH
R
27
28.
2.2 ДиспропорционированиеА) Реакция Канниццаро (кетоны не реагируют):
O
(CH3)3С
H OH
H
O
KOH
O
(CH3)3С
+
(CH3)3С
OH
(CH3)3С
OH
H
Б) Реакция Тищенко:
O
O
+ H3C
H3C
H
H
O
Al(OEt) 3 б/водн
O
CH3
CH3
28
29.
2.3 Реакции нуклеофильного присоединенияРеакционная способность С=О-группы определяется величиной положительного
заряда на атоме С. В связи с появлением частичного положительного заряда на атоме
углерода альдегиды и кетоны вступают в реакции с нуклеофильными реагентами.
R
H
O
O
H
H
H
R'
O
O
O
O
Ar
Ar
R
Ar
R
Ar
Алкильные радикалы проявляют +I-эффект, атомы Hal и полярные функциональные
группы проявляют –I-эффект и увеличивают реакционную способность С=О-группы.
29
30.
В кислой среде:+
O
OH
+
R
+
H
R
H
R
H
+
OH
H
Nu
O
+
-
Nu
H
+ Nu -
OH
В нейтральной и щелочной среде:
NuH
O
медленно
+
Nu H
-
O
Nu
быстро
OH
30
31.
А) Кислородсодержащие нуклеофилы:1. Гидратация: вода присоединяется к альдегидам и кетонам, образуя
неустойчивые гем-диолы:
H
H
O
+
C
+
+H
OH
OH
-
OH
H
H
H
OH
pH = 5
H
Содержание карбонильной формы и гем-диола в водных растворах
альдегидов и кетонов
Соединение
Карбонильная форма, %
Гем-диол, %
0.05
99.95
43
57
СН3С(О)СН3
99.8
0.2
СlСН2СН=О
3
97
Н2С=О
СН3СН=О
31
32.
2. Присоединение спиртов: спирты, как и вода, обратимо присоединяются:Ацетали:
(cухой HCl)
O
H
С
R
OH
+
R
+ C2H5OH
H
C
OC 2H5
полуацеталь
H
OH
R
C
H
OC 2H5 + C2H5OH
OC 2H5
+
R
C
OC 2H5 + H2O
H
H
ацеталь
Образуются соединения, содержащие один алкоксильный остаток -OR’ (полуацетали,
полукетали) или два – ацетали, кетали. Катализируется и кислотами, и основаниями:
кетали
H3C
O
CH3
+
+
HC(OEt) 3
H
H5C2
O
H5C2 O
CH3
CH3
+
H
O
OEt
32
33.
Ацилали:Ac = CH3-CO-
O
+
H3C
Ac2O
H3C CH(OAc) 2
диацилаль
H
Б) Реакции с S-нуклеофилами:
Et
1. Образование тиоацеталей:
Et = C2H5-
H
+
+ 2 EtSH
O
Et
H
- H 2O
OH
OH
O
С
+
H
S Et
тиоацеталь
2. Присоединение NaHSO3: хорошо растворимые в воде соли
α-гидроксиалкансульфоновых кислот
R
H
S Et
S
O
-
O Na
+
R
C
-
SO 3 Na
+
H
33
34.
В) Реакции с галогеннуклеофилами (PCl5, PBr5):O
+
H3C
OPCl 4
H
ClPCl 4
Cl
H3C
H
- POCl 3
CH 3CHCl 2
+ H2C
CHCl
побочный
Г) Реакции с азотсодержащими нуклеофилами (присоединения – отщепления):
большинство реакций присоединения - отщепления - взаимодействию карбонильной
группы с N-нуклеофилами. К N-нуклеофилам относят аммиак и его производные:
R-NH2 где R = H, Alk, Ar, OH(гидроксиламин), NH2(гидразин), NHC6H5, NHCONH2,
NHCSNH2
Механизм:
H
O
+
H
N R
O
-
OH
+
NH 2 R
+
NHR
- H 2O [H ]
N
R
34
35.
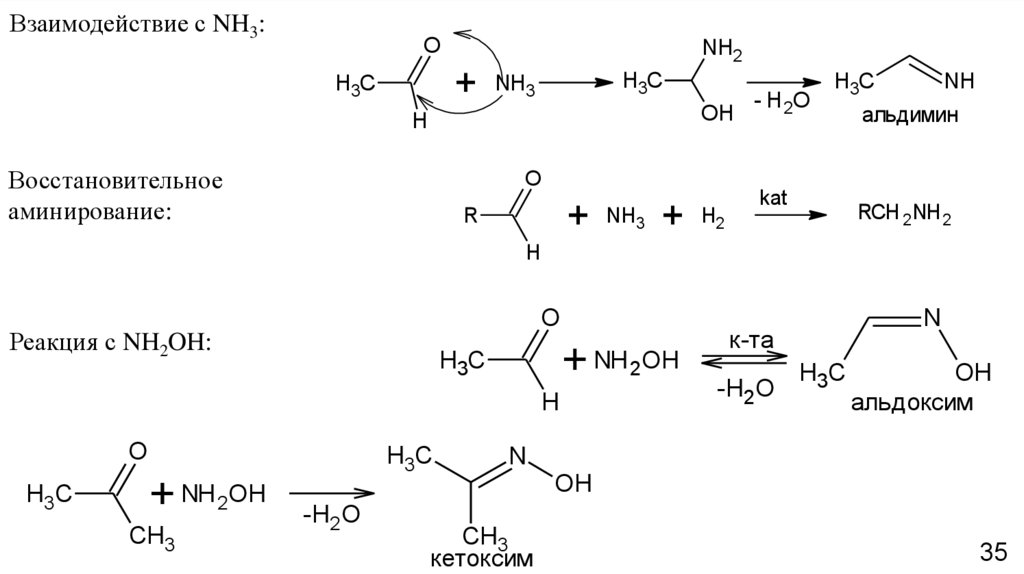
Взаимодействие с NH3:O
NH2
+
H3C
H3C
NH3
OH
H
Восстановительное
аминирование:
O
+
R
NH3
+
H2
- H 2O
H3C
kat
NH
альдимин
RCH 2NH 2
H
O
Реакция с NH2OH:
+
H3C
H
O
H3C
H3C
+ NH 2OH
CH3
-Н2О
NH 2OH
N
к-та
-Н2О
H3C
OH
альдоксим
N
CH3
кетоксим
OH
35
36.
Взаимодействие с N2H4 (гидразин) и PhNHNH2:O
+ H3C
O
+
H3C
NH 2NH 2
H
H
NH2
-Н2О
H3C
N
гидразон
ацетальдегида
-Н2О
N
H3C
CH3
N
альдазин
O
CH3
O
H3C
+
CH3
NH 2NH 2
-Н2О
NH2
H3C
CH3
+ H 3C
N
гидразон ацетона
CH3
-Н2О
H3C
N
CH3
N
кетазин
CH3
Большинство из них представляют собой кристаллические вещества, обладающие
четкими температурой плавления. Эти производные используются для идентификации
альдегидов и кетонов.
36
37.
Д)Присоединение
С-нуклеофилов:
синильная
кислота
присоединяется к карбонильным соединениям с образованием гемцианоксидов (циангидринов).
O
Альдегиды:
+
R
R
HCN
OH
циангидрин
H
R'
O
Кетоны:
+
R
R'
CN
HCN
R
OH
2 H 2O
NH 3
2 H 2O
CN NH
3
R
R'
R
COOH
OH
OH
COOH
37
38.
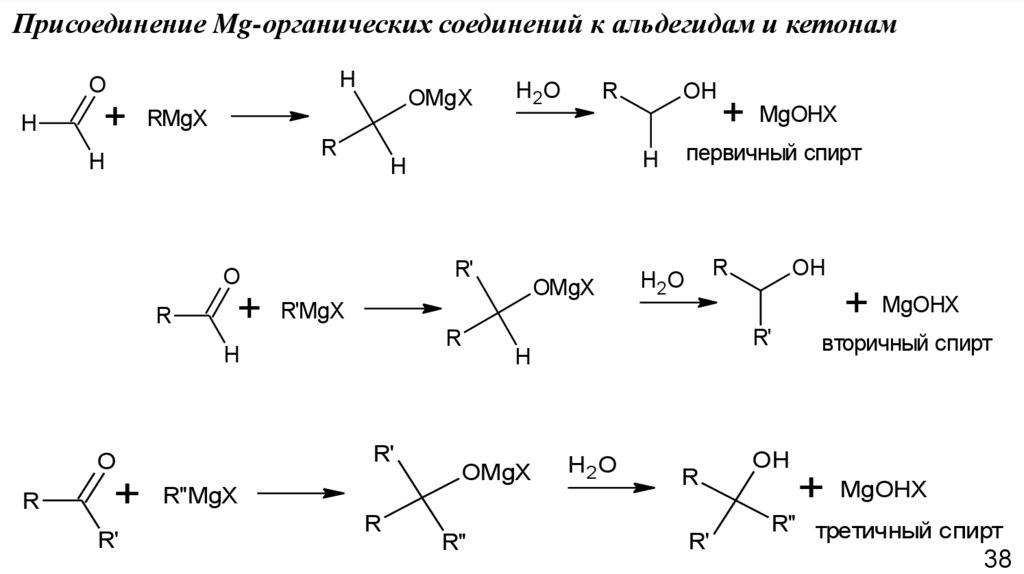
Присоединение Mg-органических соединений к альдегидам и кетонамH
O
H
+
OMgX
R
R
R'
+
R
R'
O
OMgX
+
MgOHX
первичный спирт
R
H2 O
OH
+
R'MgX
H
R'
OH
H
H
O
+
R
RMgX
H
R
H2O
R
H
OMgX
R''MgX
R''
R'
H2O
R
R'
OH
MgOHX
вторичный спирт
+
MgOHX
R'' третичный спирт
38
39.
3. ПолимеризацияO
3 H
+
H
O
H
n(CH2O)
kat.
O
O
триоксан (тв.)
(-CH2-O)n
полиформальдегид
параформ (тв.)
CH3
O
3 H3C
kat.
H
O
O
H
O
n H3C
+
H
O
CH3
n
H3C
O
CH3
о
параальдегид (ж-ть, t кип =120 С)
метаальдегид (тв.)
Кетоны не полимеризуются.
39
40.
4. КонденсацияКонденсация — реакция с увеличением молекулярной массы,
сопровождаемая выделением низкомолекулярных веществ (NH3, H2O, HCl).
4.1 Альдольная конденсация (Бородин)
а) Кето-енольная таутомерия: электроноацепторный эффект карбонильной группы
объясняет высокую С-Н-кислотность альдегидов и кетонов
субстрат
СН3 – СН3
СН3 – СО – СН3
СН3 – СО – СН2 – СО – СН3
рКа
50,0
20,0
9,0
O
кетон
СН-кислотность связана с высокой резонансной стабилизацией
карбаниона, образующегося при отщеплении протона,
находящегося из α-углеродного атома
OH
енол
40
41.
OO
H3C
С
CH3
H2C
С
O
CH3
H2C
С
CH3
+H
+
кетонная форма
Становится возможна электрофильная атака (протонирование) по атому
кислорода с образованием енольной формы
O
H2C
С
OH
CH3
+H
+
H2C
С
CH3
енольная форма
Кетонная форма и енольная являются изомерами. Они различаются положением
атома водорода, сигма- и пи-связей. Такой вид изомерии называется таутомерией. Для
альдегидов и кетонов это кето-енольная таутомерия. Процесс перехода кето-формы в
енольную называется енолизация.
41
42.
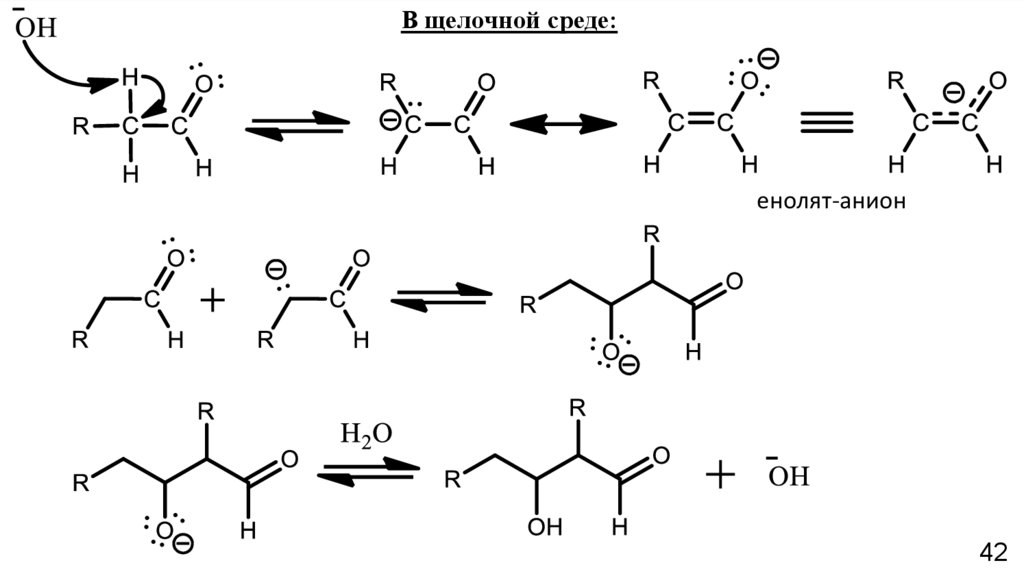
В щелочной среде:енолят-анион
42
43.
В кислотной среде:кето-форма
енол
альдоль
Кротоновая конденсация
43
44.
Альдегиды:O
O
H3C
+
+
Н или ОН
H3C
-
H
H
H3C
O
OH
H
3-гидроксибутаналь
альдоль
Кетоны:
H3C
H3C
O
CH3
+
O
CH3
KOH
HO
CH3 O
CH3
O
t
CH3 - H O
H3C
2
-оксикетон
диацетонов ый спирт
H3C
CH3
непредельный кетон
окись мезитила
44
45.
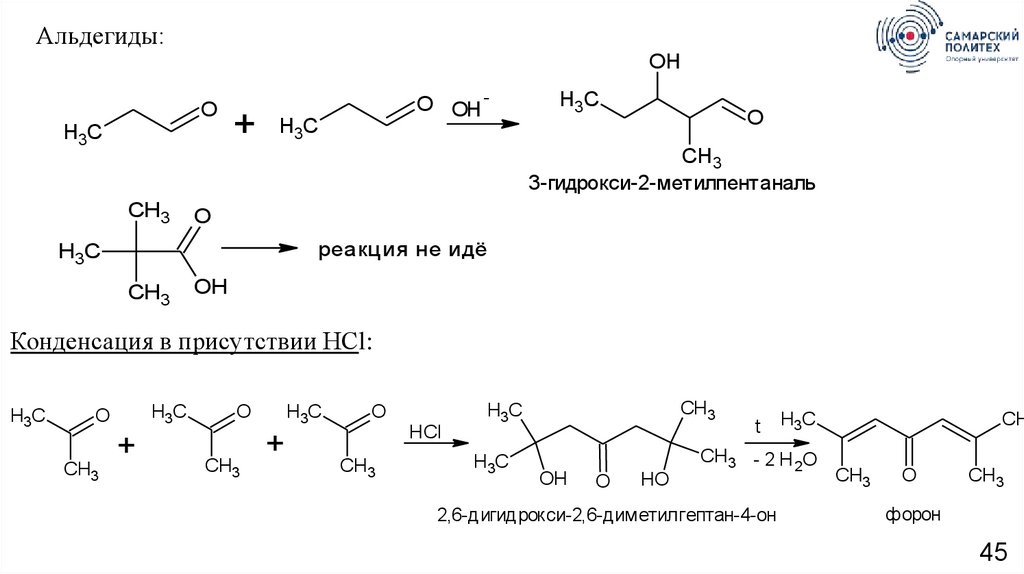
Альдегиды:OH
O
H3C
+
O OH -
H3C
H3C
O
CH3
3-гидрокси-2-метилпентаналь
CH3
O
реакция не идёт
H3C
CH3
OH
Конденсация в присутствии HСl:
H3C
H3C
O
CH3
+
O
CH3
H3C
+
CH3
H3C
O
HCl
CH3
H3C
OH
O
HO
t
H3C
CH3 - 2 H 2O
2,6-дигидрокси-2,6-диметилгептан-4-он
CH
CH3
O
CH3
форон
45
46.
Альдегиды:4.2 Кротоновая конденсация
O
O
H3C
+
+
Н или ОН
H3C
H3C
-
H
H
O
CH3
H3C
H3C
H3C
O
+
O
H
кротоновый альдегид
CH3
OH
t
H2SO4 конц.
O
CH3
H3C
CH3
CH3
HO
OH
CH3
H3C
Смешанная конденсация:
O
H3C
O
+
CH3
H
O
- H 2O
OH
H
3-гидроксибутаналь
альдоль
Кетоны:
в присутствии H2SO4
H3C
t
O
-
[OH ]
H3C
OH
- 3 H2O
H3C
мезитилен
CH3
O
CH3
CH3 - H2O H3C
пентен-3-он-2
46
47.
Получение глюкозы по Бутлерову:O
O
O
+ H
H
Ca(OH) 2
6H
Ca(OH) 2
-
O
+
HOH 2C
H
H
C6H12O6
O
H
H
H
OH
O
H
OH
+ 3 CH 2O
HO
H
HO
H
OH
OH
OH
O
N
Реакция Бутлерова:
6 CH 2O
+
4 NH 3
6 H 2O
+
H3C
R
R
O
O
+
H
H
H
2
HCl
N
R1
- H2O
N
N
N
уротропин
гексаметилентетрамин
C6H12N4
Образование фенолформальдегидных смол (см. фенолы)
Реакция Манниха:
+
Cl
R
O
-H
+ R2
N
R1
47
48.
Галогенальдегиды и галогенкетоныH3C
O
Cl 2
O
Cl
H3C
Br2
CH3
лакриматоры
O
Br
H3C
медленно
C C
C C
быстро
OH
H O
H3C
O
+
OH
3 Cl2
- 3 HCl
H2C
H
O
H
H
a
l
C
C
R
3
O
O
H
H
a
l
C
C
R
3
O
Hal
Hal2
C C
быстро
Hal
Cl 3C
H
O H - HHal
O + H2O
Hal O
OH
Cl 3C
OH
хлоральгидрат
H
H
O
R
C
H
a
l
3+ C
O
C C
O
R
C
H
H
a
l
3+ C
O
галоформная реакция
48
49.
Непредельные альдегиды и кетоныO
H2C
акролеин
о
tкип = 32,5 С
Альдегиды
Способы получения:
o
OH
HO
180 C
+
O
H2C
H
+
2 H 2O
OH
o
H2C
H3C
O
H
CH3
O2, 270 C
[kat.Cu]
-
+
CH 2O
[OH ]
O
H2C
O
H2C
+ H2 O
49
50.
Реакции:против правила Марковникова:
H2C
+
O
–
O
H2C
HBr
1,4-присоединение
Br
Br
OH
Н
O
Эльтеков - Эрленмейер
H
CH3
H3C
CH3
цитраль
H
O
O
CH2
H3C
метилвинилкетон
о
tкип = 81 С
50
51.
КетоныПолучение:
CH
H2C
+
-
H3C
CH3
H2C
O
O
O
O
H
+ H2 O
H2 O
H2SO4
[OH ]
O
H3C
OH
CH3
H
H3C
- H2O
CH2
Реакция Михаэля:
O
CH3
H2C
O
-
CH3
+
O
[OH ]
H3C
CH3
O
O
CH3
O
CH3
51
52.
Отдельные представителиФормальдегид – бесцветный газ с резки запахом. Ядовит, действует раздражающе на
слизистые оболочки. Растворим в воде, 40%-ный раствор, формалин используют в
качестве дезинфицирующего средства. Формальдегид применяется в производстве
синтетических смол (фенолформальдегидные, карбамидные), глицерина и т.д.
Гексаметилентетрамин (уротропин) применяют в производстве фенолформальдегидных
смол, взрывчатых веществ, в качестве горючего (сухой спирт).
Уксусный альдегид (ацетальдегид) – жидкость с резким запахом, вызывает
раздражение слизистых оболочек, удушье, головную боль. Из ацетальдегида в
промышленных масштабах получают уксусную кислоту, уксусный ангидрид, этиловый
спирт, бутиловый спирт, ацетали, этилацетат. Он конденсируется с фенолом, аминами и
другими веществами, образуя синтетические смолы, используемые в производстве
полимерных материалов.
Ацетон – бесцветная жидкость с характерным запахом. Хорошо растворим в воде и
органических растворителях. В качестве растворителя применяется в лакокрасочной
промышленности, в производстве ацетатного шелка, бездымного пороха (пироксилина),
для растворения ацетилена (в баллонах). Он служит исходным сырьем при производстве
органического стекла, кетена и т.д.
52













































 Химия
Химия








