Похожие презентации:
Современные принципы этиотропной терапии хронического вирусного гепатита С
1. Современные принципы этиотропной терапии хронического вирусного гепатита С
КАФЕДРА ГАСТРОЭНТЕРОЛОГИИ И ИНФЕКЦИОННЫХ БОЛЕЗНЕЙАО «МЕДИЦИНСКИЙ УНИВЕРСИТЕТ АСТАНА»
СОВРЕМЕННЫЕ ПРИНЦИПЫ ЭТИОТРОПНОЙ ТЕРАПИИ
ХРОНИЧЕСКОГО ВИРУСНОГО ГЕПАТИТА С
Подготовила:
доцент, к.м.н. Имамбаева Г.Г.
2. Течение ВГС-инфекции
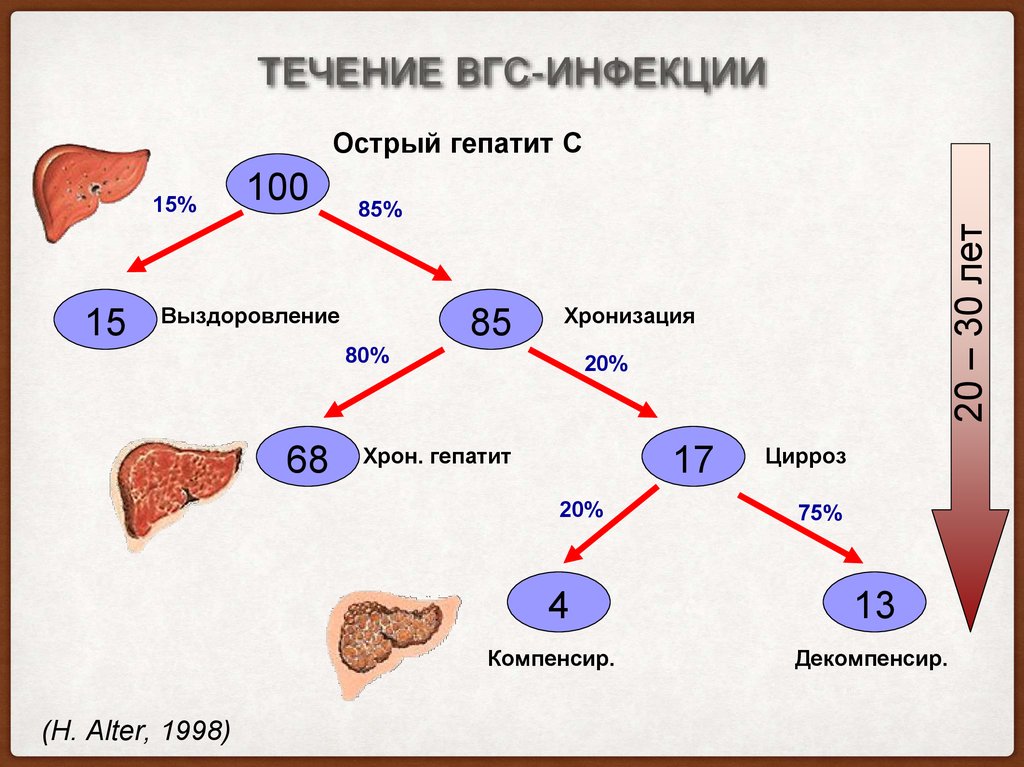
ТЕЧЕНИЕ ВГС-ИНФЕКЦИИОстрый гепатит С
15
100
85%
Выздоровление
85
Хронизация
80%
68
20%
Хрон. гепатит
17
20%
4
Компенсир.
(H. Alter, 1998)
20 – 30 лет
15%
Цирроз
75%
13
Декомпенсир.
3.
ПЕРИОД ПОЛУЖИЗНИHCV - 2,7-7,2 Ч.
РНК
Капсула-капсид - белок-соr
Оболочка из липидов и белков
Е1,Е2 - обеспечивают
связывание вируса с клеткой и
проникновение в нее
Вирус может существовать в
организме в виде набора
близкородственных,но не
идентичных вирусных частиц -
квазивиды
6 генотипов, более 90 субтипов
6 неструктурных белков (N) и 3
структурных белка
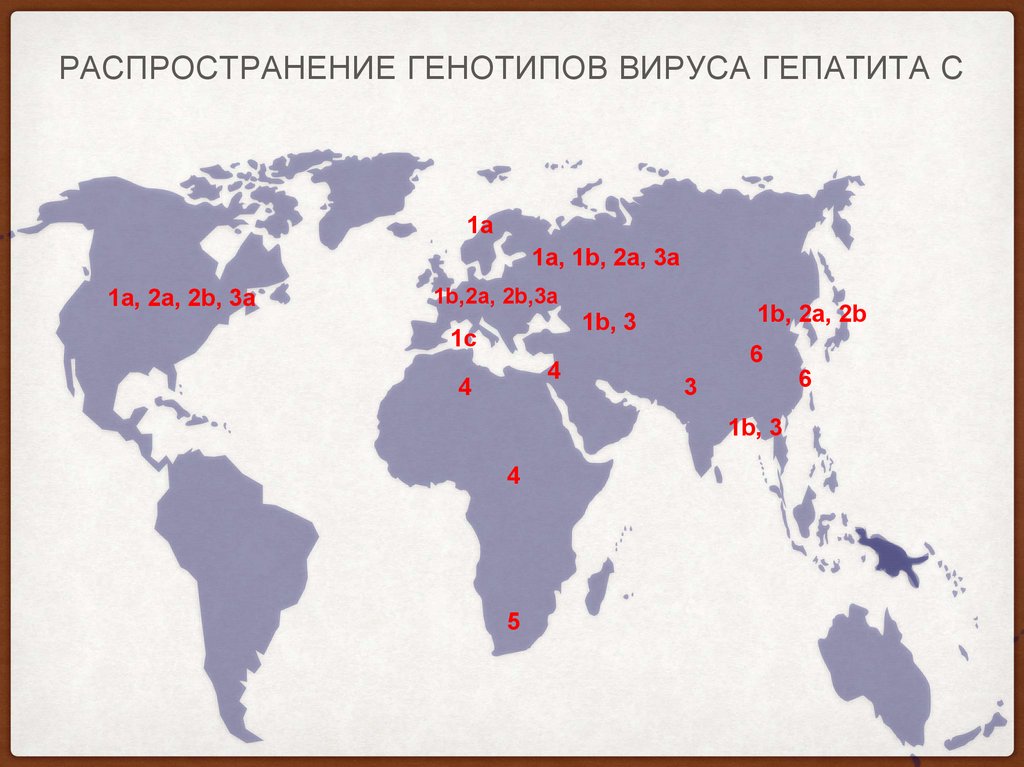
4. Распространение генотипов вируса гепатита С
РАСПРОСТРАНЕНИЕ ГЕНОТИПОВ ВИРУСА ГЕПАТИТА С1a
1a, 1b, 2а, 3а
1a, 2a, 2b, 3а
1b,2a, 2b,3а
1b, 2a, 2b
1b, 3
1c
4
4
6
6
3
1b, 3
4
5
5. жизненный цикл вируса гепатита с
ЖИЗНЕННЫЙ ЦИКЛ ВИРУСА ГЕПАТИТА СDONEC QUIS NUNC
6.
ГЕНОМ ВИРУСА ГЕПАТИТА Скапсид
Поверхно
стные
белки
Протеаза/хеликаза
c22
33c
РНК-зависимая РНК полимераза
c-100
3’
5’
core E1
E2
NS2
гипервариабельный
регион
NS3
NS4
NS5
Алгоритм лабораторной диагностики:
1. Сумма антител к различным белкам
2. Спектр антител (антитела к отдельным белкам Core, NS3, NS4, NS5)
3. РНК вируса ГС
7.
8. КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ХРОНИЧЕСКИЙ ВИРУСНЫЙ ГЕПАТИТ С У ВЗРОСЛЫХ
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯХРОНИЧЕСКИЙ ВИРУСНЫЙ ГЕПАТИТ С У ВЗРОСЛЫХ
УТВЕРЖДЕНО НА ЭКСПЕРТНОЙ КОМИССИИ ПО ВОПРОСАМ РАЗВИТИЯ ЗДРАВООХРАНЕНИЯ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ КАЗАХСТАН
ПРОТОКОЛ N6 ОТ «05» МАЯ 2014 ГОДА
ЦЕЛИ ПРОТИВОВИРУСНОЙ ТЕРАПИИ:
• Эрадикация ВГС с целью предотвращения развития цирроза
печени, ГЦК и смерти (рекомендация A1)
• У пациентов с циррозом печени – снижение частоты
декомпенсации и риска ГЦК (для данной группы пациентов
необходимо продолжать скрининг ГЦК) (рекомендация A1)
• Конечная точка терапии – устойчивый вирусологический ответ
(УВО) – неопределяемый уровень HCV RNA (<15 МЕ/мл) на 24
неделе после окончания терапии (рекомендация A1)
9.
Все пациенты с ХГС с компенсированным заболеванием печенидолжны быть рассмотрены в качестве кандидатов для
назначения терапии (рекомендация А1)
Лечение пациентов со стадией фиброза F3-F4 по METAVIR
должно проводиться в первоочередном порядке (рекомендация
А1)
Лечение пациентов со стадией фиброза F2 по METAVIR
показано в плановом порядке
У пациентов с менее тяжелым заболеванием (F0-F1) проведение
терапии может быть рассмотрено в индивидуальном порядке
(рекомендация B1)
10. Противопоказания для начала ПВТ
ПРОТИВОПОКАЗАНИЯ ДЛЯ НАЧАЛА ПВТАбсолютные
Неконтролируемая депрессии
Психоз
Эпилепсия
Неконтролируемые аутоиммунные
заболевания
ЦП (Чайлд-Пью B7 и выше)
Беременность и нежелание
соблюдения контрацепции
Тяжелые сопутствующие заболевания
− Сердечная недостаточность
− Плохо контролируемый СД
− Плохо контролируемая артериальная
гипертензия
− Хроническая обструктивная болезнь
легких (ХОБЛ)
Другие, указанные в инструкциях по
применению препаратов
Относительные
Гематологические изменения
• Hb<130 г/л (муж), 120 г/л (жен)
• Нейтрофилы <1500/мл
• Тромбоциты <90,000/мл
• Креатинин >1.5 мг/дл (132,6
мкмоль/л)
• Декомпенсированный ЦП
• Другие, указанные в инструкциях
по применению препаратов
11.
ХРОНИЧЕСКИЙ ГЕПАТИТ СГенотипирование
HCV
Генотипы 2, 3
Генотипы 1 (4, 5, 6)
24 недели
48 недель
NIH Consensus Development Conference Statement:
Management of Hepatitis C. Hepatology 2002;36:S3-S20.
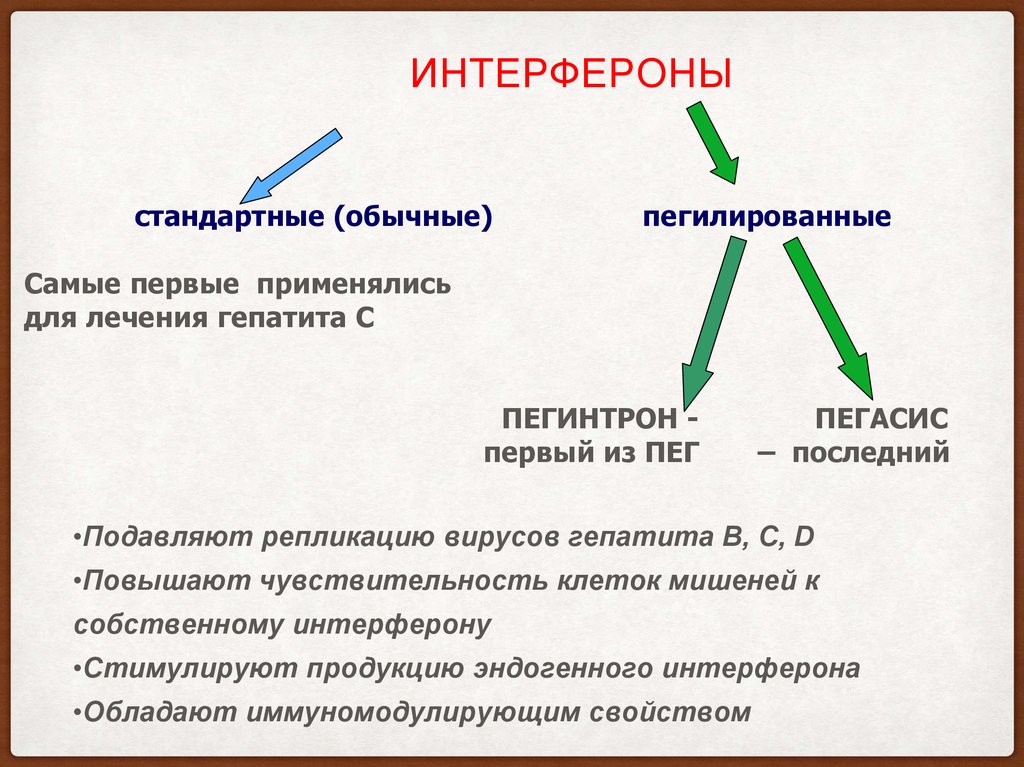
12. Интерфероны
ИНТЕРФЕРОНЫстандартные (обычные)
пегилированные
Самые первые применялись
для лечения гепатита С
ПЕГИНТРОН первый из ПЕГ
ПЕГАСИС
– последний
•Подавляют репликацию вирусов гепатита В, С, D
•Повышают чувствительность клеток мишеней к
собственному интерферону
•Стимулируют продукцию эндогенного интерферона
•Обладают иммуномодулирующим свойством
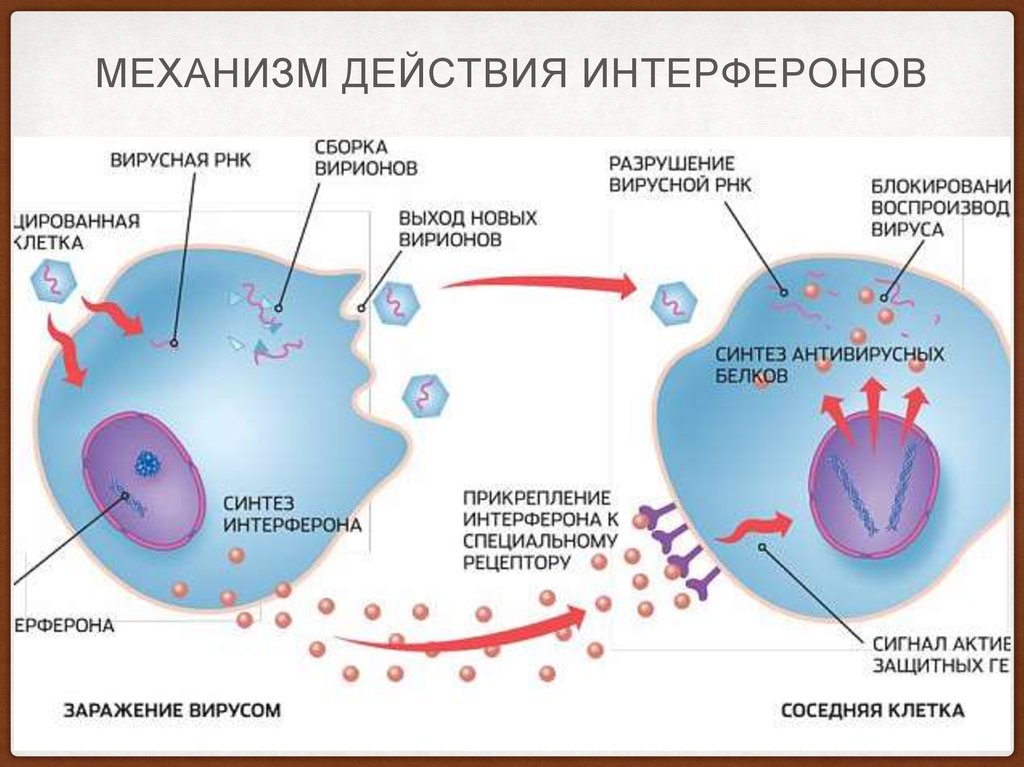
13. механизм действия интерферонов
МЕХАНИЗМ ДЕЙСТВИЯ ИНТЕРФЕРОНОВ14.
Противопоказания к препаратам ИФНАбсолютные
Относительные
1.Гиперчувствительность к ИФН
2.Тяжелые психические заболевания
1.Нетропения менее 1*109/л
(психозы, тяжелая депрессия), эписиндром
2.Тромбоцитопения менее
на момент обследования или в анамнезе
75*109/л
3.Наркотическая или алкогольная
3.Декомпенсированный
зависимость (лечение может быть начато
сахарный диабет
через 6 месяцев абстиненции)
4.Аутоиммунные заболевания:
4.Тяжелые сердечные заболевания
–Ревматоидный артрит
(хроническая сердечная недостаточность IIБ,
–Системная красная
III стадии, инфаркт миокарда)
волчанка
5.Декомпенсированный цирроз и опухоли
–Псориаз
печени
6.Беременность, кормление грудью
7.Отсутствие контролируемой контрацепции
–Аутоиммунный гепатит
–Аутоиммунный тиреоидит
15. Рибавирин (ребетол): Механизм действия
РИБАВИРИН (РЕБЕТОЛ):МЕХАНИЗМ ДЕЙСТВИЯ
Ребетол включается во внутриклеточный процесс
фосфорилирования нуклеотидов
Снижение синтеза нуклеиновых кислот
Блокирование внутриклеточного деления вируса
16.
Противопоказания к рибавиринуАбсолютные
1.Гиперчувствительность к
рибавирину
2.Беременность, кормление
грудью
3.Отсутствие контролируемой
контрацепции
4.Почечная недостаточность
(клиренс креатинина <50
мл/мин), гемодиализ
5.Анемия (Hb < 100 г/л)
6.Гемоглобинопатия
(талассемия, серповидноклеточная анемия)
7.тиротоксикоз
Относительные
Заболевания, при
которых анемия
может усугубить их
тяжесть, особенно
сердечно-сосудистые
и
цереброваскулярные
17. Вирусологический ответ
ВИРУСОЛОГИЧЕСКИЙ ОТВЕТИсходно
Период лечения
24 или 48 недель
6 месяцев
РНК HCV
Без ответа
Частичный
ответ
Рецидив
Предел определения
Устойчивый
ответ(излечение)
Неопределяемый
уровень РНК HCV
Время
Zeuzem et al. N Engl J Med. 2000.
18. Вирусологический ответ
ВИРУСОЛОГИЧЕСКИЙ ОТВЕТБыстрый Вирусологический ответ (RVR- rapid virological response)
Ранний вирусологический ответ (EVR – early virological response)
Снижение вирусной нагрузки более, чем на 2log от исходной или
неопределяемый уровень РНК HCV на 12 неделе лечения
Ответ по окончании лечения (End-of-treatment response)
Неопределяемый уровень РНК HCV после окончания лечения
(24 недели для генотипа HCV 2/3, 48 недель для HCV генотип 1)
Устойчивый вирусологический ответ (SVR- sustained virological
response
Неопределяемый уровень РНК HCV через 24 недели (6 месяцев) после
окончания лечения
Неответчики – Non-response
Выявляемый уровень РНК HCV после окончания лечения
Рецидив - Relapse
Неопределяемый уровень РНК HCV после окончания лечения, но становится
определяемым в течение 6 месяцев после окончания лечения
Zeuzem et al. N Engl J Med. 2000.
19. Лечение гепатита С: достижения Устойчивый вирусологический ответ
ЛЕЧЕНИЕ ГЕПАТИТА С: ДОСТИЖЕНИЯУСТОЙЧИВЫЙ ВИРУСОЛОГИЧЕСКИЙ ОТВЕТ
80%
72%
61%
60%
54%
41%
40%
20%
16%
6%
0%
ИФН -2b
3 млн.МЕ
6 мес.
ИФН - 2b
3 млн.МЕ
12 мес
Интрон А
+ Ребетол
ПегИнтрон
+ Ребетол
(800 мг/сут)
ПегИнтрон
+ Ребетол
( мг/кг/сут)
ПегИнтрон
+ Ребетол
(80/80/80)
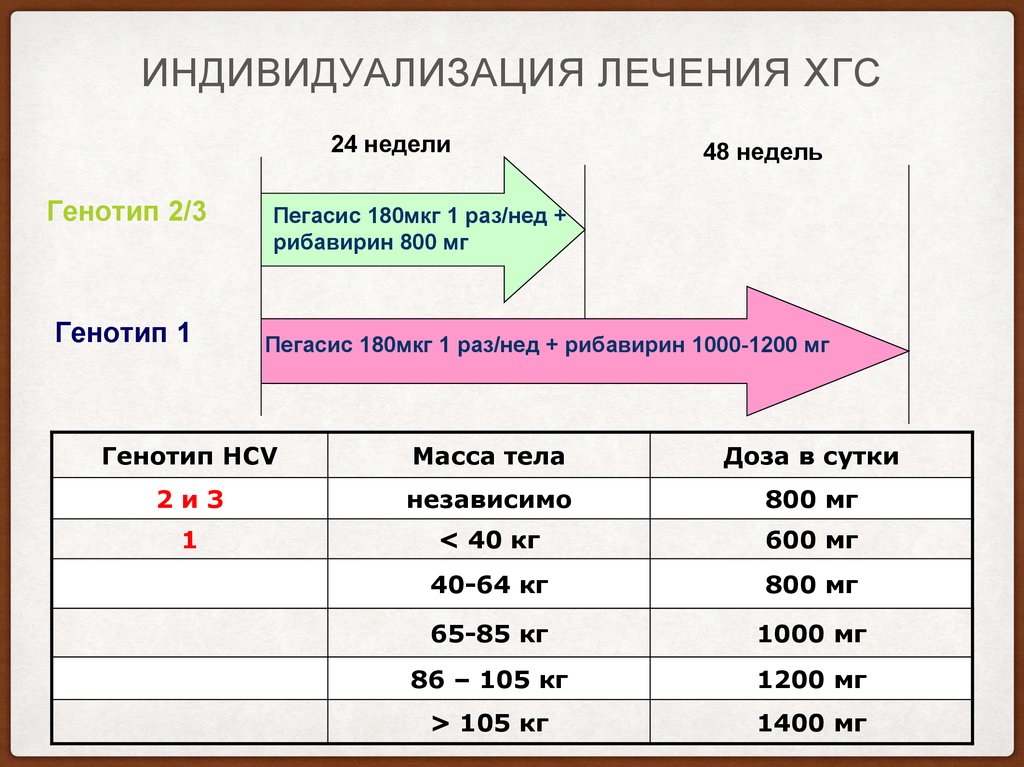
20. Индивидуализация лечения ХГС
ИНДИВИДУАЛИЗАЦИЯ ЛЕЧЕНИЯ ХГС24 недели
Генотип 2/3
Генотип 1
48 недель
Пегасис 180мкг 1 раз/нед +
рибавирин 800 мг
Пегасис 180мкг 1 раз/нед + рибавирин 1000-1200 мг
Генотип HCV
Масса тела
Доза в сутки
2и3
независимо
800 мг
1
< 40 кг
600 мг
40-64 кг
800 мг
65-85 кг
1000 мг
86 – 105 кг
1200 мг
> 105 кг
1400 мг
21. Вирусологический контроль
ВИРУСОЛОГИЧЕСКИЙ КОНТРОЛЬНачало
лечения
Конец
лечения
12 неделя
6 мес после
лечения
До лечения
диагноз
ИФА (+)
ПЦР (HCV)
качественный
ПЦР генотипирование
ПЦР количественный –
исходная вирусная
нагрузка
наблюдение
лечение
ПЦР (HCV)
качественный
ПЦР количественный –
вирусная нагрузка
Результат:
вирус не
определяется или
снижение вирусной Есть
нагрузки более, чем РВО
на 2log от исходного
Результат:
снижение
вирусной нагрузки
менее, чем на 2log
от исходного
Нет
РВО
Завершается полный курс
лечения
ПЦР (HCV)
качественный
УВО
Прекращение
лечения
22.
Факторы, влияющие на течениеи прогноз ХГС
Кофакторы
Алкоголь
Убедительно доказано
Коинфекция HBV
Влияние доказано
Коинфекция ВИЧ
Влияние доказано
Коинфекция другими гепато- и
лимфотропными вирусами
Влияние HGV, TTV не
доказано, других вирусов нуждается в изучении
Гемосидероз
Влияние вероятно
Ожирение, стеатоз печени
Влияние вероятно
Курение
Влияние не исключено
(недостаточно изучено)
Внешняя среда и характер
питания
Влияние не исключено
(недостаточно изучено)
Академическая группа Серова В.В., Рос.журнал гастроэнтерологии,
гепатологии и
колопроктологии, 2002
23. Наблюдение за больными во время лечения
НАБЛЮДЕНИЕ ЗА БОЛЬНЫМИ ВО ВРЕМЯ ЛЕЧЕНИЯОбщий анализ крови с подсчетом
тромбоцитов
1 раз в неделю
АЛТ
Билирубин
Тимоловая проба
Коагулограмма
1 раз в месяц
Щелочная фосфатаза ГГТП(при
наличии холестаза)
Протеинограмма
1 раз в 2 месяца
Т3, Т4, ТТГ, антитела к ТТГ
1 раз в 3 месяца
24. Поражение НС на фоне использования препаратов ИФН
ТяжестьПОРАЖЕНИЕ НС НА ФОНЕ
ИСПОЛЬЗОВАНИЯ ПРЕПАРАТОВ ИФН
Cлабость
Гриппоподобный
синдром
синдром
депрессии/тревоги
0
2
4
6
ИФН (недели)
8
10
12
25. Коррекция доз Пег/интерферонов и рибавирина при лечении ХГС
КОРРЕКЦИЯ ДОЗ ПЕГ/ИНТЕРФЕРОНОВ ИРИБАВИРИНА ПРИ ЛЕЧЕНИИ ХГС
Гематологические
показатели
Уменьшение дозы на
50%
Прекращение лечения
< 100 г/л
(только рибавирин)
< 85 г/л
Лейкоциты
< 1500 /мкл
(Пег/интерферон)
< 1000 /мкл
Нейтрофилы
< 750 /мкл
(Пег/интерферон)
< 500 /мкл
Тромбоциты
< 50.000 /мкл
(Пег/интерферон)
< 25.000 /мкл
Уровень
гемоглобина
26. НЕЭФФЕКТИВНОСТЬ ЛЕЧЕНИЯ комбинацией пегинтерферона и рибавирина
НЕЭФФЕКТИВНОСТЬ ЛЕЧЕНИЯ КОМБИНАЦИЕЙПЕГИНТЕРФЕРОНА И РИБАВИРИНА
Устойчивый вирусологический ответ (УВО) при лечении
пациентов в Европе и Северной Америке генотипом 1 ВГС
не превышает 40–50 %.
Плохо переносится пациентами
Необходимость проведения длительных курсов лечения
(24–48 недель)
Развитие резистентности у возбудителя
В связи с непереносимостью интерферона или наличием
противопоказаний к его применению эту комбинацию не
может получать значительная часть больных
Zeng Q.L., Zhang J.Y., Zhang Z., et al. Sofosbuvir and ABT-450: terminator of hepatitis C virus? World J Gastroenterol. 2013 Jun 7;19(21):3199–206.
27. Тройная терапия интерферонами и ингибиторами протеаз
ТРОЙНАЯ ТЕРАПИЯ ИНТЕРФЕРОНАМИ ИИНГИБИТОРАМИ ПРОТЕАЗ
2011 г. - препараты прямого действия (избирательно
ингибирующие репликацию вируса) группы ингибиторов
протеазы NS3/4A: боцепревир и телапревир
Применение боцепревира и телапревира в составе тройной
терапии (с рибавирином и пегинтерфероном) позволило
повысить эффективность лечения пациентов,
инфицированных генотипом 1 ВГС.
Тройная терапия была одобрена в качестве нового стандарта
лечения больных генотипом 1 ВГС в США, Европе и Японии.
Heim M.H. 25 years of interferon-based treatment of chronic hepatitis C: an epoch coming to an end. Nat Rev Immunol. 2013;13:535–42.
28.
ГЕНОМ ВИРУСА ГЕПАТИТА Скапсид
Поверхно
стные
белки
Протеаза/хеликаза
c22
33c
РНК-зависимая РНК полимераза
c-100
3’
5’
core E1
E2
NS2
гипервариабельный
регион
NS3
NS4
NS5
Алгоритм лабораторной диагностики:
1. Сумма антител к различным белкам
2. Спектр антител (антитела к отдельным белкам Core, NS3, NS4, NS5)
3. РНК вируса ГС
29. Тройная терапия ингибиторами протеаз
ТРОЙНАЯ ТЕРАПИЯ ИНГИБИТОРАМИ ПРОТЕАЗНедостатки
1. Наилучший терапевтический эффект наблюдается у ранее не леченных
пациентов, при инфекции, вызванной генотипом ВСГ 1b, у больных с
генотипом IL28B CC и в отсутствие выраженного фиброза или цирроза
печени
2. Телапревир и боцепревир провоцируют развитие резистентности вирусов,
что может приводить к неэффективности лечения
3. Оба препарата имеют короткий период полувыведения, вызывающий
необходимость трехкратного приема в сутки, снижающий приверженность к
лечению
4. Препараты оказывают ингибирующее действие на цитохром P4503A4 множественные клинически значимые лекарственные взаимодействия.
5. Препараты могут вызывать серьезные побочные эффекты - анемия,
утомляемость, сыпь, зуд, тошнота
Park C., Jiang S., Lawson K.A .Efficacy and safety of telaprevir and boceprevir in patients with hepatitis C genotype 1: a meta-analysis. J Clin Pharm Ther. 2013 Nov 16. [Epub ahead of print]
30. Тройная терапия ингибиторами протеаз
ТРОЙНАЯ ТЕРАПИЯ ИНГИБИТОРАМИ ПРОТЕАЗНедостатки
Частота серьезных нежелательных реакций со стороны больных
циррозом печени - 48,6 % при применении телапревира и 38 % –
боцепревира, связанная с ними летальность – 2 %
Тяжелые реакции гиперчувствительности - поражения кожи, с
летальными исходами при применении телапревира
Прямые затраты на достижение 1 случая УВО составляют
примерно 189 тыс. долл.
Компания Merck в 2015 году прекращает производство и
дистрибуцию в США препарата от гепатита С «Victrelis
(Боцепревир)"
Backus L.I., Belperio P.S., Shahoumaian T.A., Cheung R., Mole L.A. Comparative effectiveness of the hepatitis C virus protease inhibitors boceprevir and telaprevir in
a large US cohort. Aliment Pharmacol. Ther. 2014;39:93–103.
31. Симепревир
СИМЕПРЕВИРВ конце ноября 2013 г. в США был одобрен к медицинскому применению
Ингибитор протеазы NS3/4A
1 раз в сутки 12 недель в сочетании с 24- или 48-недельным курсами приема пегинтерферона и
рибавирина
Показания - генотип 1 ВГС, у пациентов с компенсированным заболеванием печени, ранее не
леченных или в отношении которых оказалась неэффективной предшествующая терапия
УВО при применении симепревира в составе тройной терапии - 93–96 % больных, ранее не
получавших лечение
УВО - в 68–79 % случаев среди больных, не ответивших на предыдущую противовирусную терапию
Эффективность симепревира существенно ниже у пациентов с полиморфизмом NS3 Q80K,
инфицированных генотипом 1а ВГC
Побочные эффекты - кожные сыпи, зуд, тошнота, реакции фотосенсибилизации
Объявленная производителем (Янссен) цена симепревира – 22 120 долл. за упаковку, содержащую 28
капсул по 150 мг и рассчитанную в среднем на месяц лечения
Стоимость 3-месячного курса составит 66 360 долл.
32. Международный конгресс по заболеваниям печени
МЕЖДУНАРОДНЫЙ КОНГРЕСС ПОЗАБОЛЕВАНИЯМ ПЕЧЕНИ
50 ежегодная встреча
Европейской ассоциации исследователей заболеваний
печени (EASL)
22-26 апреля 2015 г.
Вена (Австрия)
33. Рекомендации EASL
РЕКОМЕНДАЦИИ EASLПриоритетное лечение пациентов с высоким риском прогрессирования
печёночной недостаточности:
Выраженный фиброз
Цирроз печени (стадия F3-F4 по шкале Metavir)
Декомпенсированный цирроз
ВИЧ/ВГС
ВГВ/ВГС
Ожидающие или прошедшие трансплантацию печени
С клинически-значимыми внепеченочными проявлениями инфекции
С дебилитирующей усталостью
Высокий риск будет оставаться реальностью для пациентов во многих
европейских странах до тех пор, пока не будут снижены цены на
противовирусные препараты.
Рекомендуются - безинтерфероновые режимы терапии.
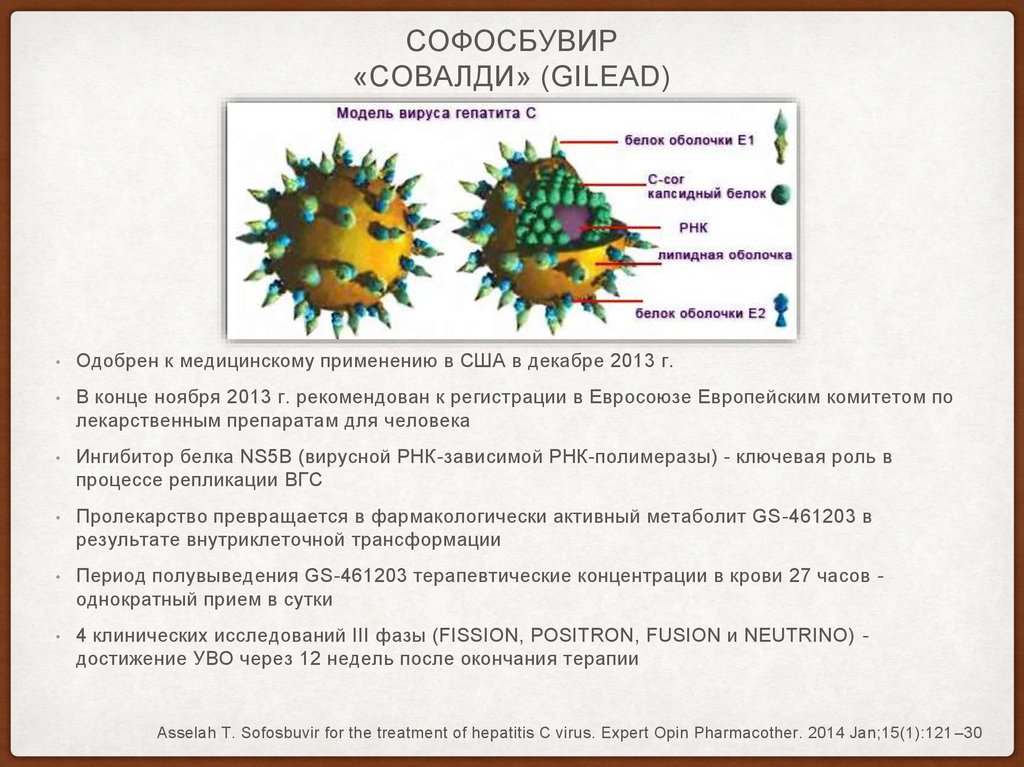
34. Софосбувир «Совалди» (Gilead)
СОФОСБУВИР«СОВАЛДИ» (GILEAD)
Одобрен к медицинскому применению в США в декабре 2013 г.
В конце ноября 2013 г. рекомендован к регистрации в Евросоюзе Европейским комитетом по
лекарственным препаратам для человека
Ингибитор белка NS5B (вирусной РНК-зависимой РНК-полимеразы) - ключевая роль в
процессе репликации ВГС
Пролекарство превращается в фармакологически активный метаболит GS-461203 в
результате внутриклеточной трансформации
Период полувыведения GS-461203 терапевтические концентрации в крови 27 часов однократный прием в сутки
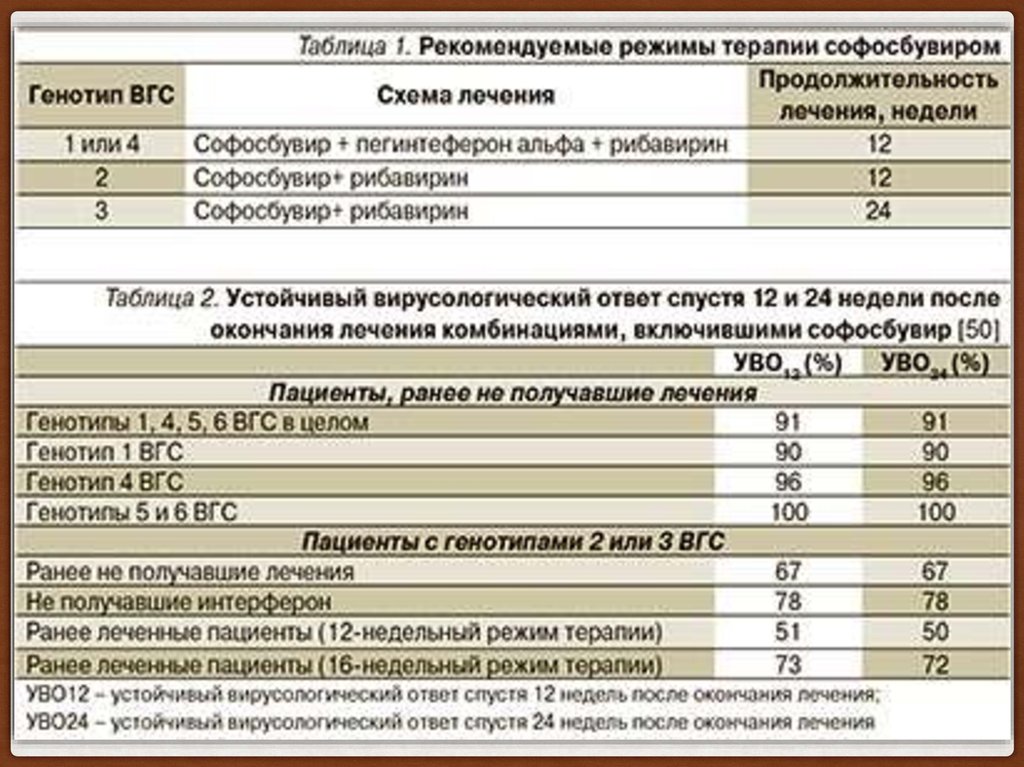
4 клинических исследований III фазы (FISSION, POSITRON, FUSION и NEUTRINO) достижение УВО через 12 недель после окончания терапии
Asselah T. Sofosbuvir for the treatment of hepatitis C virus. Expert Opin Pharmacother. 2014 Jan;15(1):121 –30
35.
36. Безинтерфероновые схемы терапии
БЕЗИНТЕРФЕРОНОВЫЕ СХЕМЫ ТЕРАПИИСофосбувир + рибавирин: генотипы 2 и 3
Софосбувир / ледипасвир (HARVONI «Gilead Sciences,
Inc») +/- рибавирин: генотипы 1, 4, 5 и 6
Паритапревир / ритонавир / омбитасвир + дасабувир +/рибавирин: генотип 1
Софосбувир + симепревир +/- рибавирин: генотип 1 и 4
Софосбувир + даклатасвир +/- рибавирин: любые
генотипы
Паритапревир / ритонавир / омбитасвир +/- рибавирин:
генотип 4
37. Продолжительность безинтерфероновых курсов
ПРОДОЛЖИТЕЛЬНОСТЬ БЕЗИНТЕРФЕРОНОВЫХ КУРСОВ12 недель
Пациенты с генотипом 1 и без признаков цирроза
печени - «софосбувир / ледипасвир» (HARVONI
«Gilead Sciences, Inc») 8 недель и без рибавирина
Пациенты с ВГС генотип 1 и с признаками цирроза добавить рибавирин к терапии 24 недели.
ВГС генотип 1b - рекомендации по лечению не
отличаются.
38. Интерферон-содержащие схемы терапии
ИНТЕРФЕРОН-СОДЕРЖАЩИЕ СХЕМЫ ТЕРАПИИПегилированный интерферон альфа-2а +
рибавирин + софосбувир: любые генотипы
Пегилированный интерферон альфа-2а +
рибавирин + симепревир: генотипы 1 и 4
39. Лечение декомпенсированного цирроза печени
ЛЕЧЕНИЕ ДЕКОМПЕНСИРОВАННОГОЦИРРОЗА ПЕЧЕНИ
софосбувир + рибавирин (генотип 2 и 3)
софосбувир + ледипасвир (генотипы 1, 4, 5, и 6)
софосбувир + даклатасвир (любые генотипы)
Тематические ссылки:
New EASL guidelines prioritise interferon-free hepatitis C treatment
Download the guidelines from the EASL website
40. Софосбувир
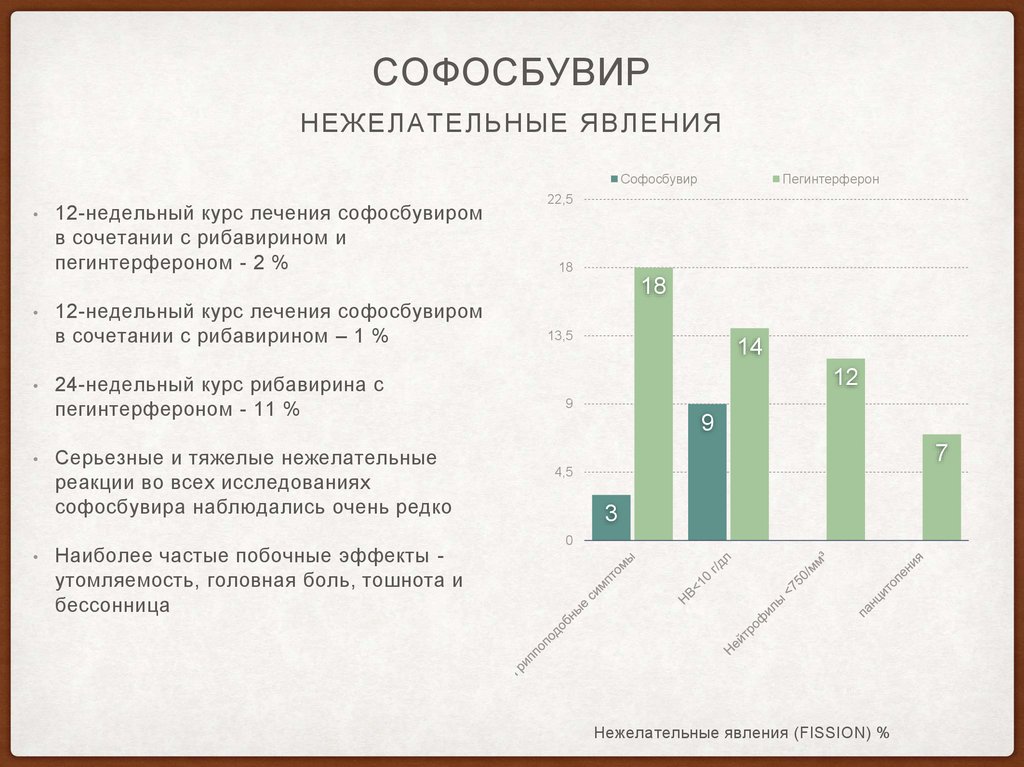
СОФОСБУВИРНЕЖЕЛАТЕЛЬНЫЕ ЯВЛЕНИЯ
Софосбувир
12-недельный курс лечения софосбувиром
в сочетании с рибавирином и
пегинтерфероном - 2 %
Пегинтерферон
22,5
18
18
12-недельный курс лечения софосбувиром
в сочетании с рибавирином – 1 %
24-недельный курс рибавирина с
пегинтерфероном - 11 %
Серьезные и тяжелые нежелательные
реакции во всех исследованиях
софосбувира наблюдались очень редко
Наиболее частые побочные эффекты утомляемость, головная боль, тошнота и
бессонница
13,5
14
12
9
9
7
4,5
3
0
Нежелательные явления (FISSION) %
41. Софосбувир
СОФОСБУВИРВ США оптовая цена упаковки (28 таблеток) - 28 тыс. долл.
Курс лечения одного пациента - более 80 тыс. дол.
Цена 1 таблетки препарата в рамках программы сострадательного
доступа во Франции – 666 евро
3-месячный курс лечения, содержащего интерферон - 59 195 евро
6-месячный курс безинтерфероновой двойной терапии – 113 890
евро
12-недельный курс софосбувира в суточной дозе 400 мг - 68–136
долл. (исследования VALENCE)
Asselah T. Sofosbuvir for the treatment of hepatitis C virus. Expert Opin Pharmacother. 2014 Jan;15(1):121 –30
42. Ранее нелеченные пациенты
РАНЕЕ НЕЛЕЧЕННЫЕ ПАЦИЕНТЫРезультаты клинического исследования «C-EDGE» показали,
что 12-недельный курс терапии с использованием комбинации
«гразопревир + элбасвир» позволял вылечить 95% ранее
нелеченных пациентов с ВГС генотип 1, 4 или 6.
Комбинированный таблетированный препарат
«гразопревир/элбасвир» вскоре пройдёт лицензирование в
Соединённых Штатах Америки, Европе и некоторых других
странах и возможно будет одобрен для применения к концу
2015 года.
Препарат станет третьим комбинированным препаратом,
используемым в безинтерфероновых схемах терапии и
выпускаемый одной и той же компанией.
Тематические ссылки:
Grazoprevir / elbasvir highly effective in previously untreated hepatitis C
43. Декомпенсированный цирроз, запущенный цирроз и пациенты после трансплантации печени
Результаты исследования «ALLY-1» - пациенты с любыми генотипами ВГС (1 6), с выраженным нарушением функции печени в результате цирроза печениили прошедшие трансплантацию печени:
12-недельный безинтерфероновый курс терапии по схеме «софосбувир +
даклатасвир + рибавирин»
Стойкий вирусологический ответ
83% пациентов с гепатитом С и тяжёлыми проявлениями цирроза печени
94% пациентов, прошедших трансплантацию печени
пациенты с трудно поддающимся лечению ВГС генотип 3
44. Безинтерфероновые схемы лечения «AbbVie»
БЕЗИНТЕРФЕРОНОВЫЕ СХЕМЫ ЛЕЧЕНИЯ «ABBVIE»6 клинических исследований III фазы с участием более
2300 пациентов с хроническим ВГ С 1-го генотипа в 25 странах.
Сочетание трех различных механизмов действия прерывает
процесс репликации вируса гепатита С - устойчивый
вирусологический ответ у пациентов разных групп
Исследуемая схема
ABT-450/ритонавира (150/100 мг) в сочетании с омбитасвиром
(АВТ-267) в дозе 25 мг, 1 раз в сутки
дасабувира (АВТ-333) 250 мг, в комбинации с рибавирином
(дозируется по массе тела) или без него, 2 раза в сутки.
45. Безинтерфероновые схемы лечения «AbbVie»
БЕЗИНТЕРФЕРОНОВЫЕ СХЕМЫ ЛЕЧЕНИЯ «ABBVIE»Положительное заключение Комитета по лекарственным препаратам для человека Европейского агентства по
лекарственным средствам: VIEKIRAX для перорального приема без применения интерферона
(омбитасвир/паритапревир/ритонавир) + EXVIERA (дасабувир) в сочетании с рибавирином или без него генотипы 1 и 4.
VIEKIRAX – 150 мг паритапревира, ингибитора протеазы NS3/4A и 100 мг ритонавира с 25 мг омбитасвира,
ингибитора NS5A (1 раз в день)
EXVIERA - 250 мг дасабувира, ненуклеозидного ингибитора полимеразы NS5B (2 раза в день) без рибавирина
или с рибавирином.
Новая схема AbbVie содержит три антивирусных препарата прямого действия, каждый из которых блокирует
конкретный белок, задействованный в процессе репликации вируса гепатита С.
Генотип 4 - паритапревир/ритонавир (150 мг/100 мг) и омбитасвир (25 мг) 1 раз в день с рибавирином (2 раза
в день)
Положительное заключение основано на результатах шести клинических исследований фазы 3 (SAPPHIRE -I,
SAPPHIRE-II, PEARL-II, PEARL-III, PEARL-IV и TURQUOISE-II), в которых приняли участие более 2300
пациентов в 25 странах, а также исследовании фазы 2 (PEARL-I), проведенного среди пациентов с генотипом
4 без цирроза, также как и предварительных данных исследования ТURQUOISE -I для пациентов с генотипом
1 и ко-инфицированных пациентов с ВИЧ-1 и исследования CORAL-I среди пациентов с трансплантацией
печени.
46. Спасибо за внимание!
СПАСИБО ЗАВНИМАНИЕ!





































 Медицина
Медицина








