Похожие презентации:
Электролитическая диссоциация
1.
Физическая и коллоиднаяхимия
занятие 5
Гатиатулин А. К.
1
2.
Электролитическая диссоциацияCH3COOH ↔ CH3COO- + H+
Kдисс = [CH3COO-][H+] / [CH3COOH]
C0 = [CH3COO-] + [CH3COOH]
α = [CH3COO-] / C0
2
3.
Сила электролитовСильные: α > 0.3
Средние: 0.03< α < 0.3
Слабые: α < 0.03
Ka>10-1
10-4<Ka<10-1
Ka<10-4
Активность — «эффективная» концентрация
a = γ∙c
в разбавленных растворах γ ≈ 1; a ≈ c
3
4.
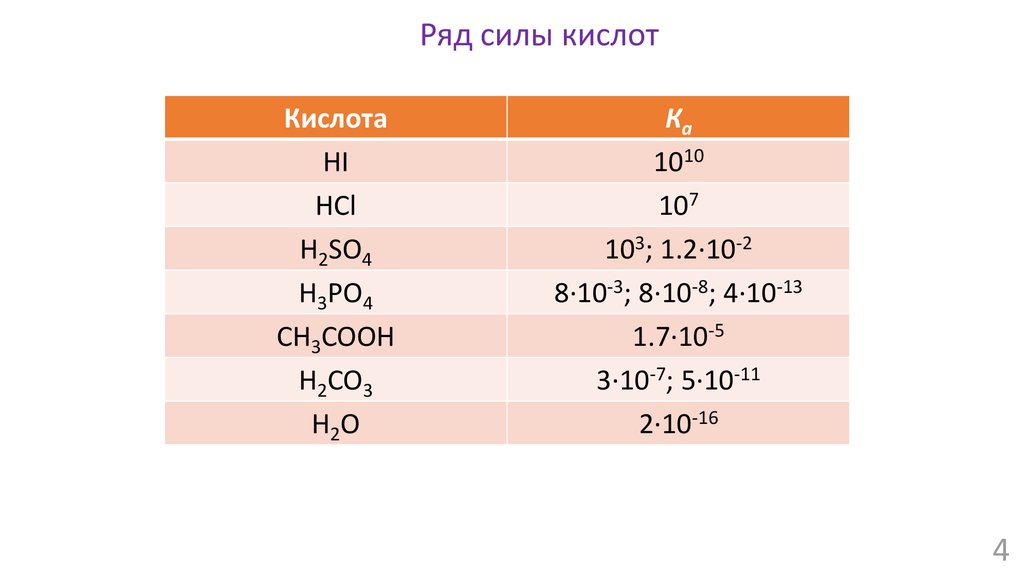
Ряд силы кислотКислота
HI
HCl
H2SO4
H3PO4
CH3COOH
H2CO3
H2O
Ка
1010
107
103; 1.2∙10-2
8∙10-3; 8∙10-8; 4∙10-13
1.7∙10-5
3∙10-7; 5∙10-11
2∙10-16
4
5.
Кислотность воды и растворовH2O ↔ OH- + H+
Kдисс = [OH-]∙[H+] / [H2O]
Ионное произведение воды:
Kw = [OH-]∙[H+] = 10-14 (при 25°С)
pH = -log a(H+) ≈ -log [H+]
Нейтральная вода:
[H+]=[OH-]=10-7
pH = 7
5
6.
ЗадачаРассчитать рН 0.1М раствора масляной (одноосновной)
кислоты, если её степень диссоциации равна 1.5%.
6
7.
ЗадачаРассчитать рН 0.1М раствора масляной (одноосновной)
кислоты, если её степень диссоциации равна 1.5%.
НА ↔ H+ + Aα = [A-] / C0
[A-] = α∙C0 = 0.015∙0.1 = 0.0015
[H+] = [A-] = 0.0015
pH ≈ -log [H+] = -log (0.0015) = 2.82
7
8.
89.
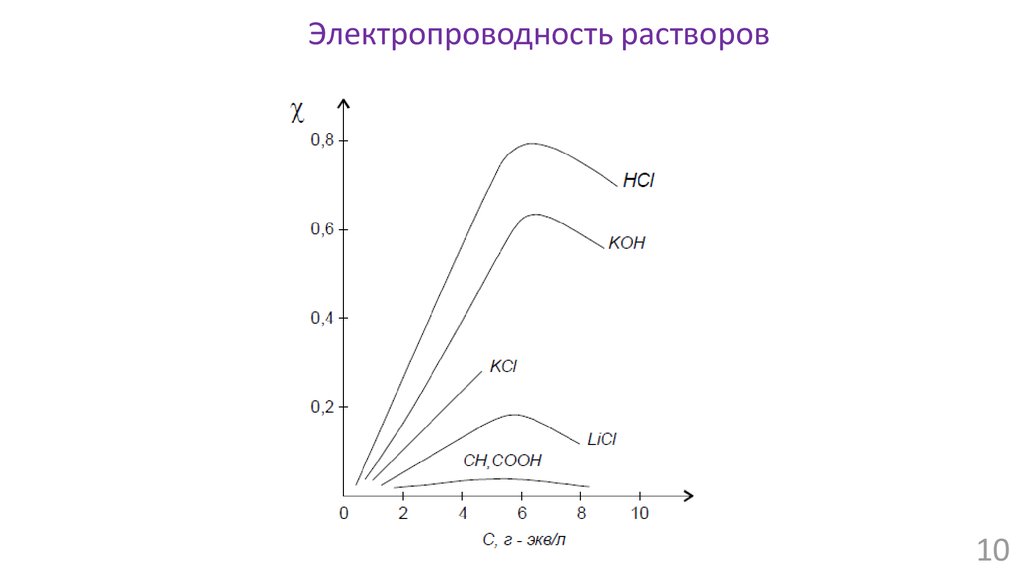
Электропроводность растворовЗакон Ома: I = U/R
Сопротивление проводника:
R = ρ∙L/S
Проводимость
1/R = 1/ρ ∙ S/L
Удельная электропроводность:
χ = 1/ρ
[Cм/м]
9
10.
Электропроводность растворов10
11.
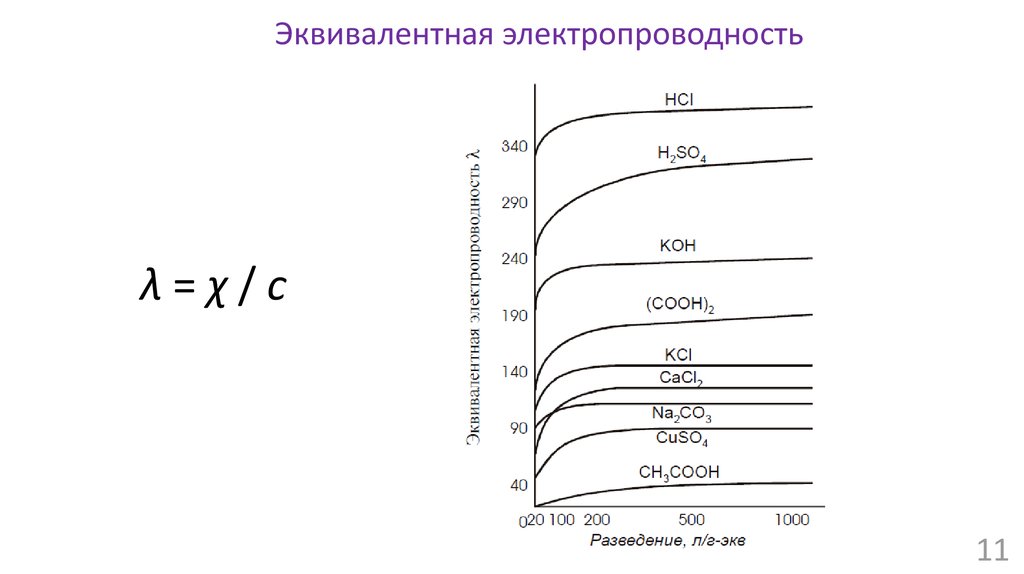
Эквивалентная электропроводностьλ=χ/с
11
12.
Эквивалентная электропроводностьи подвижность ионов
λ∞ = λ + + λα = λ/ λ∞
12
13.
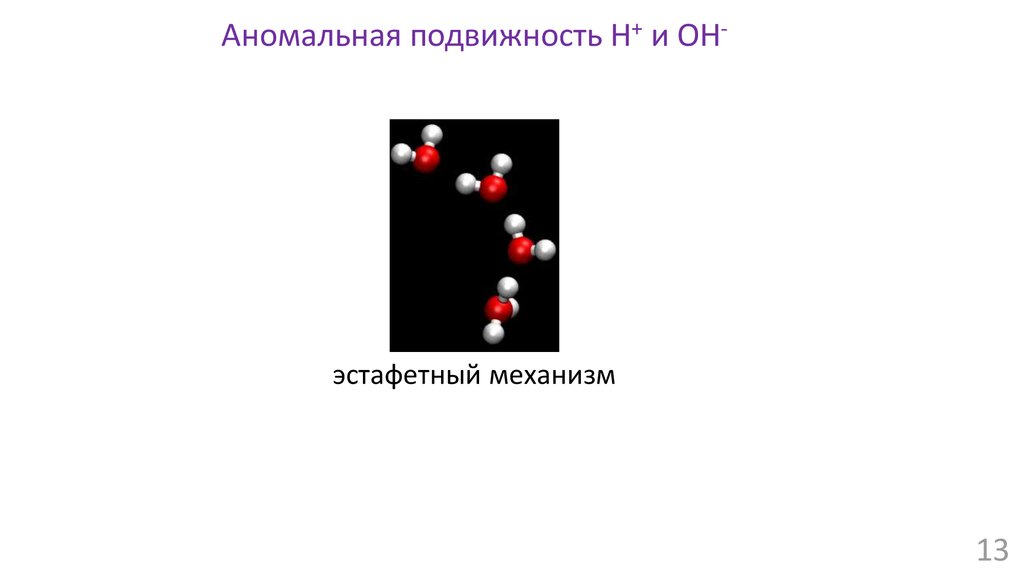
Аномальная подвижность H+ и OH-эстафетный механизм
13
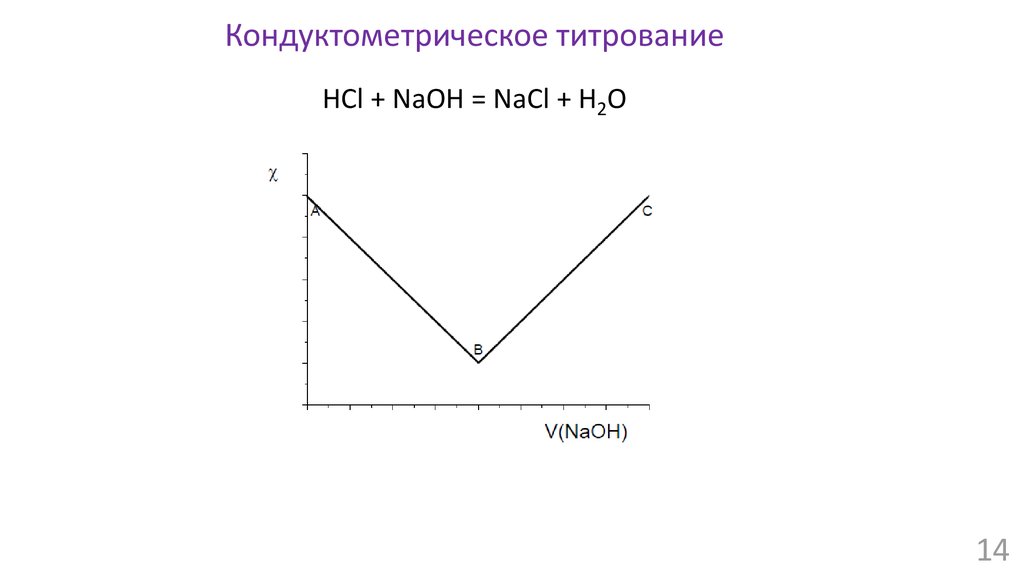
14.
Кондуктометрическое титрованиеHCl + NaOH = NaCl + H2O
14
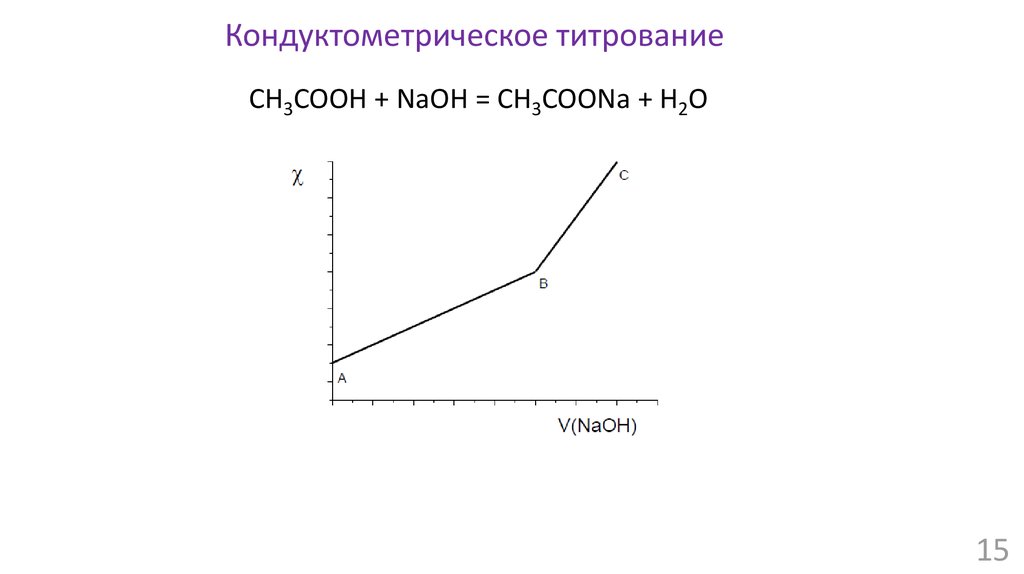
15.
Кондуктометрическое титрованиеCH3COOH + NaOH = CH3COONa + H2O
15
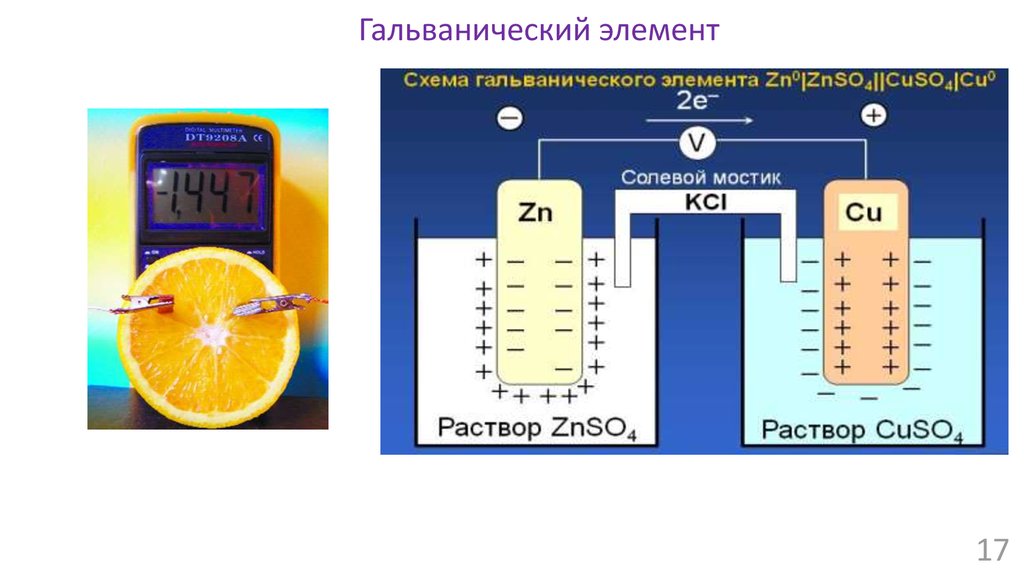
16.
Гальванический элемент16
17.
Гальванический элемент17
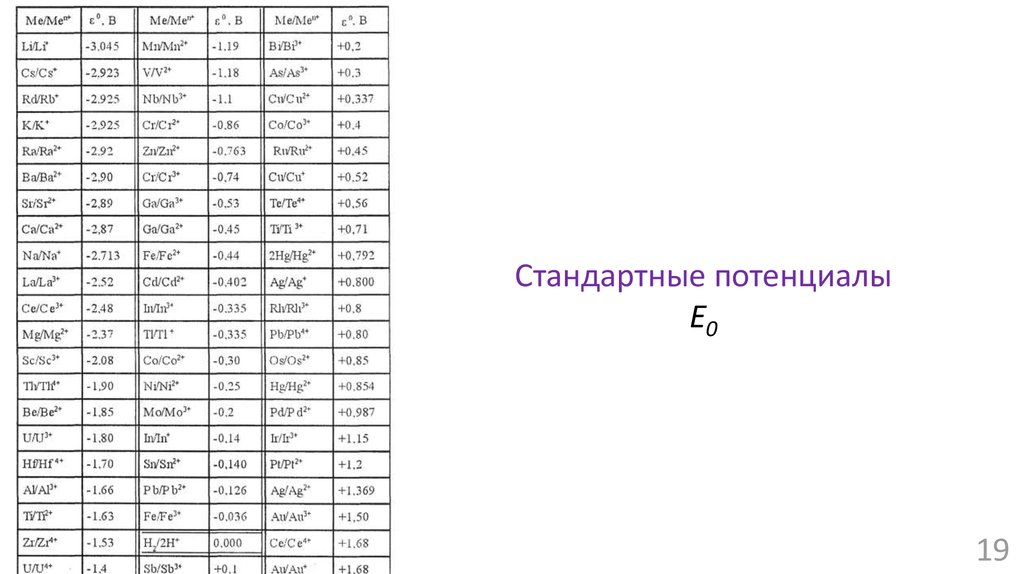
18.
Гальванический элементU = Eк – Eа
Уравнение Нернста:












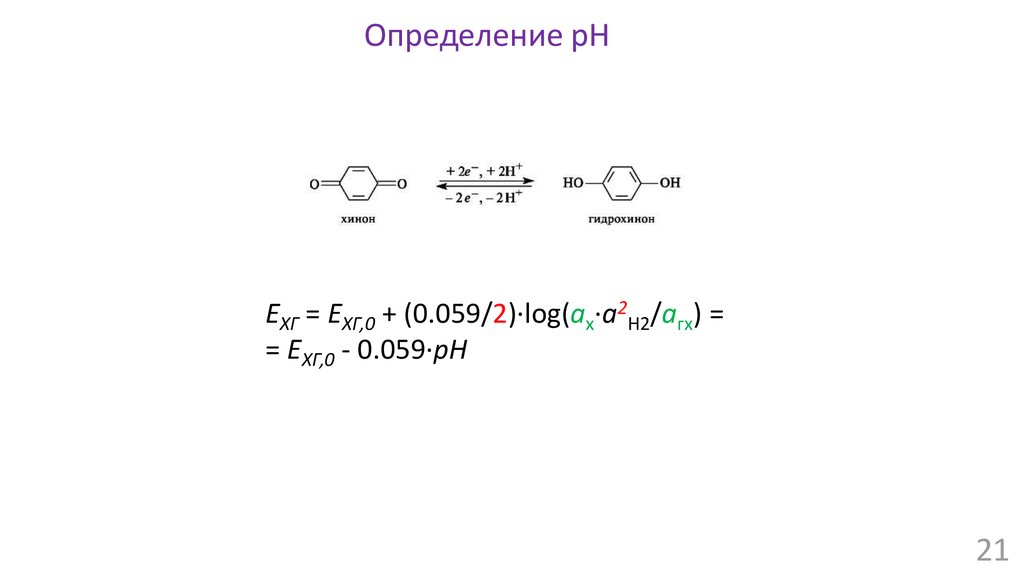


 Химия
Химия








