Похожие презентации:
Белки, или протеины
1.
2.
Белки или протеины ( отгреч. «протос» - «первый»), это природные органические
соединения, которые
обеспечивают все
жизнененные процессы
любого организма
3.
Впервые белокбыл выделен (в
виде клейковины)
в 1728 г.
итальянцем Якопо
Бартоломео
Беккари(16821766) из
пшечничной
муки. Это собитие
принято считать
рождением
химии белка
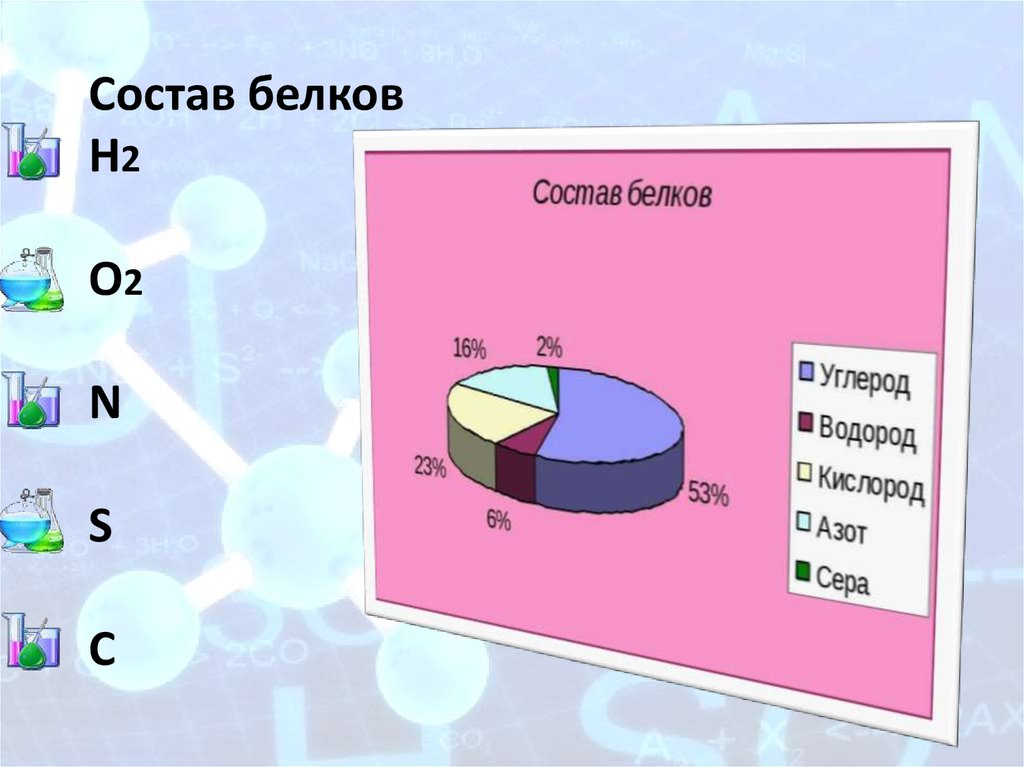
4. Состав белков H2 O2 N S C
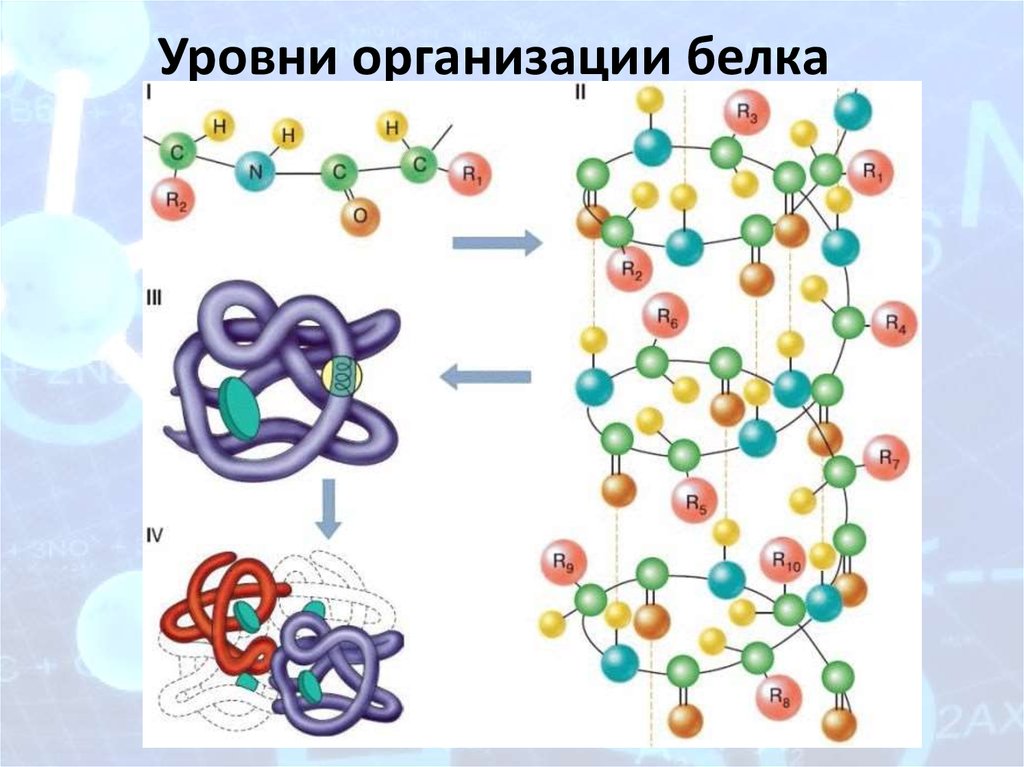
5. Уровни организации белка
6. Первичная структура
Первичная структура – число и последовательностьаминокислот , соединенных друг с другом пептидными
связями в полипептидной цепи
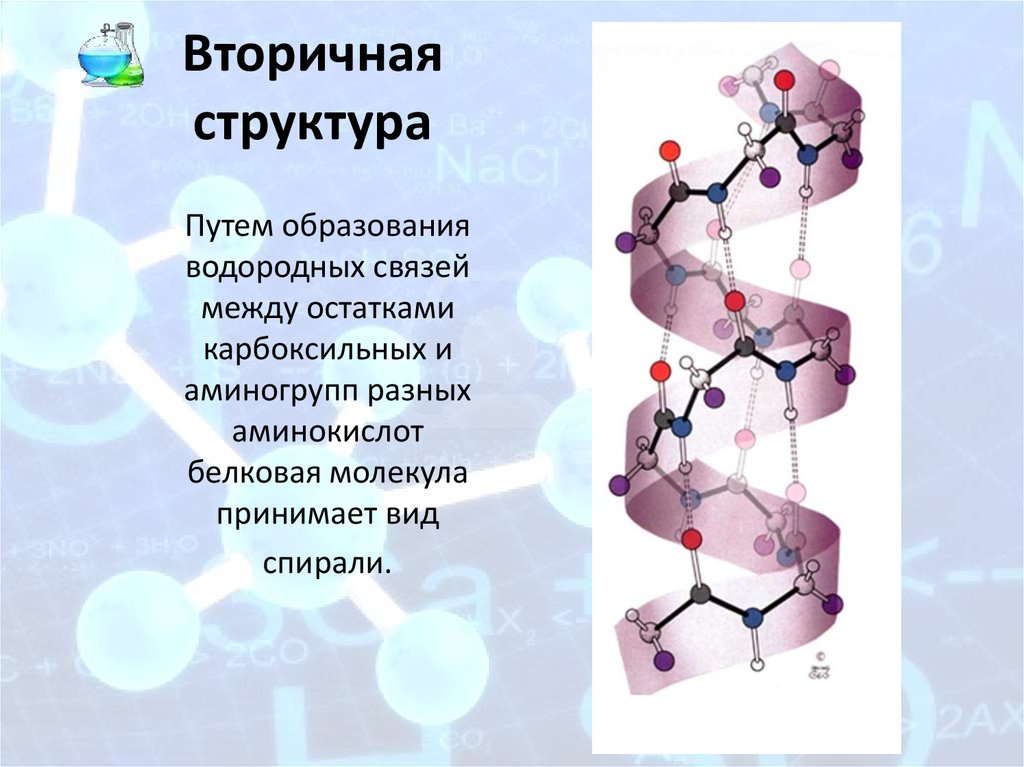
7. Вторичная структура
Путем образованияводородных связей
между остатками
карбоксильных и
аминогрупп разных
аминокислот
белковая молекула
принимает вид
спирали.
8. Третичная структура
Образуется благодаря взаимодействию радикалов, в частностирадикалов аминокислоты цистеина, которые содержат серу. Атомы
серы двух аминокислот, находящихся на некотором расстоянии друг
от друга в полипептидной цепи, соединяются, образуя так
называемые дисульфидные связи.
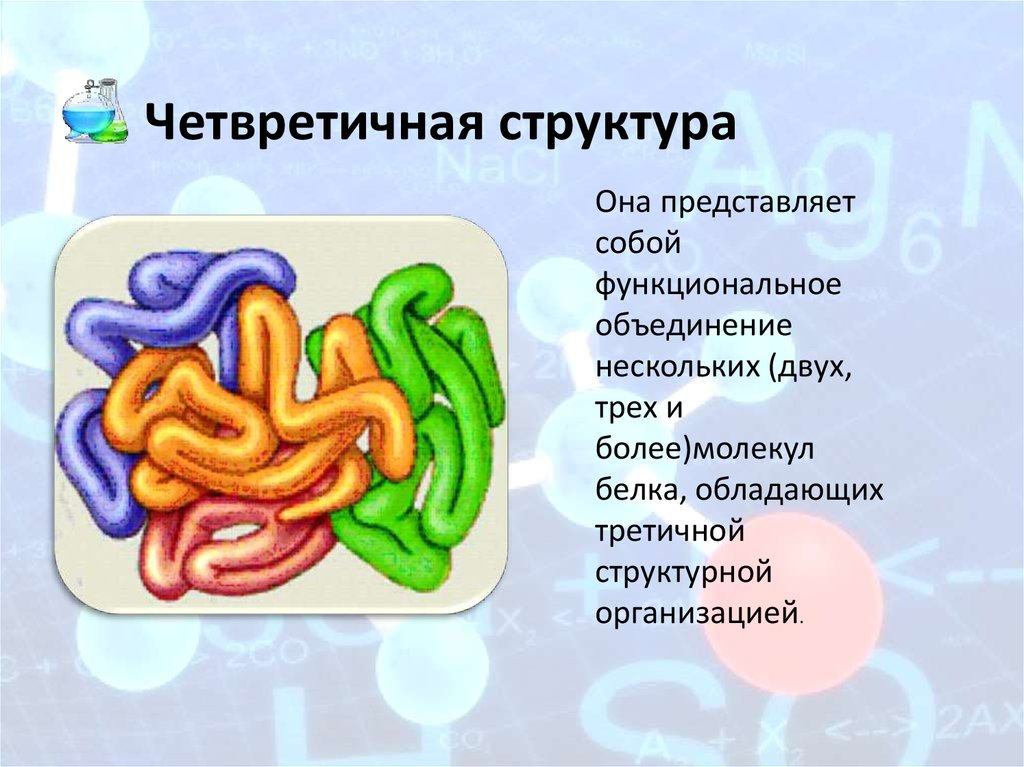
9. Четвретичная структура
Она представляетсобой
функциональное
объединение
нескольких (двух,
трех и
более)молекул
белка, обладающих
третичной
структурной
организацией.
10. Физические свойства
• Белки в твердом состояниибелого цвета, а в растворе
бесцветны, если только они не
несут какой-нибудь хромовой
(окрашенной)группы, как,
например, гемоглобин.
Растворимость в воде у разных
белков сильно варьирует.
Малекулярная масса белков
очень велика – от
несколькихтысяч до многих
миллионов дальтон. Благодаря
присутствию в молекулах
белков положительно и
отрицательно заряженных
групп они движутся с разной
скоростьюи в электрическом
поле.
Гемоглобин
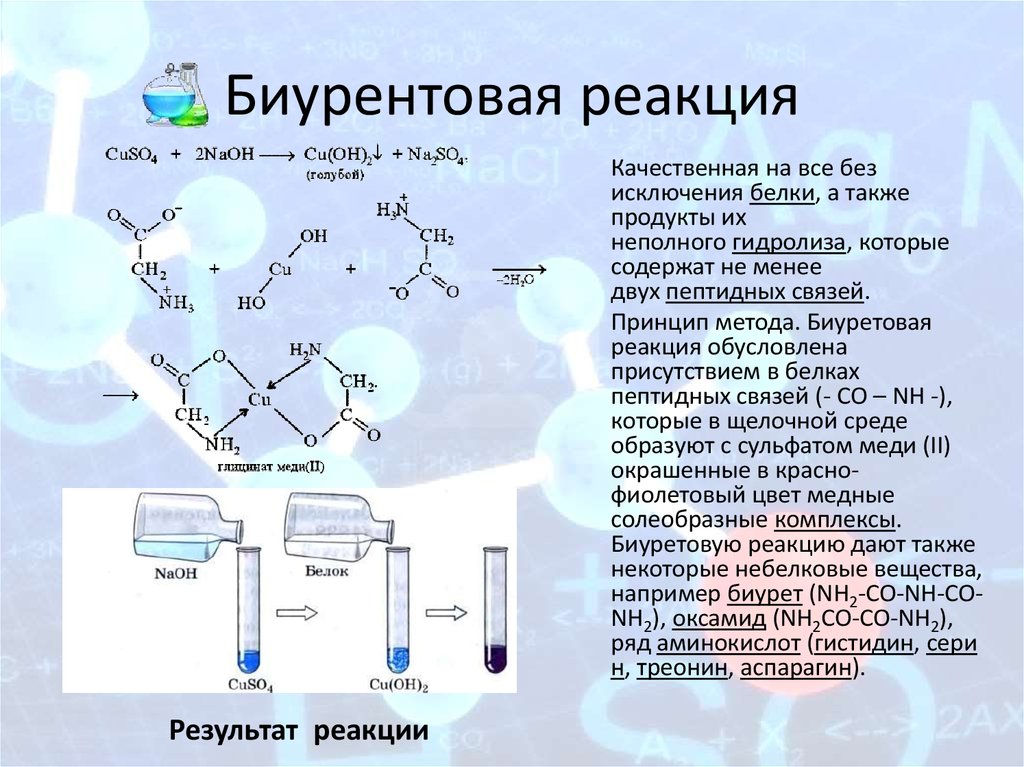
11. Биурентовая реакция
Качественная на все безисключения белки, а также
продукты их
неполного гидролиза, которые
содержат не менее
двух пептидных связей.
Принцип метода. Биуретовая
реакция обусловлена
присутствием в белках
пептидных связей (- СО – NH -),
которые в щелочной среде
образуют с сульфатом меди (ІІ)
окрашенные в краснофиолетовый цвет медные
солеобразные комплексы.
Биуретовую реакцию дают также
некоторые небелковые вещества,
например биурет (NH2-CO-NH-CONH2), оксамид (NH2CO-CO-NH2),
ряд аминокислот (гистидин, сери
н, треонин, аспарагин).
Результат реакции
12. Ксантопротеиновая реакция
Ксантопротеиновая реакция открывает наличие в белкахциклических аминокислот – триптофана, фенилаланина,
тирозина, содержащих в своем составе ароматическое ядро.
Реакция носит название от греч. слова Xanthos – желтый. Ряд
белков при добавлении к ним концентрированной азотной
кислоты при нагревании дают желтое окрашивание, которое
может переходить в оранжевое в щелочной среде.
Реакция вызвана нитрованием бензольного ядра указанных
циклических аминокислот и образованием нитросоединений
желтого цвета.
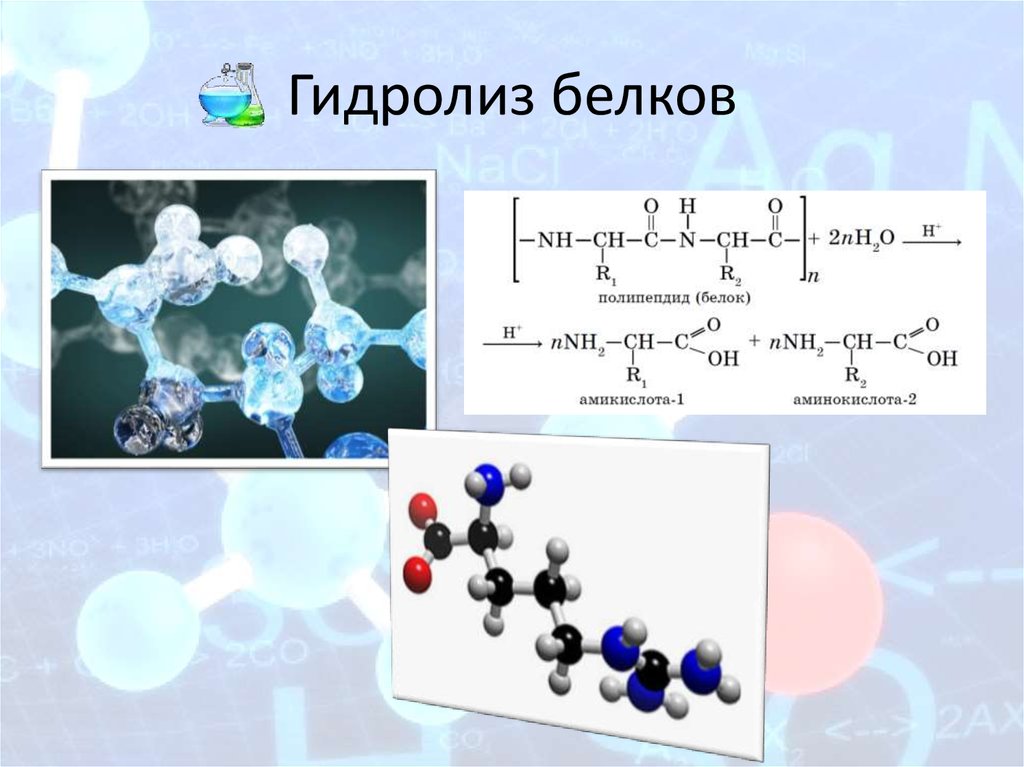
13. Гидролиз белков
14. Функции белков
––
–
–
–
–
–
–
Каталитическая
Транспортная
Регуляторная
Двигательная
Гормональная
Пластическая
Защитная
Структурная
15. Жиры, белки и углеводы – основа питания
16. Аминокислоты
Всего аминокислотболее 100 видов.
Белки строятся только
из 20 аминокислот.
17. Незаменимые аминокислоты
Аминокислоты, которыеорганизмы не
синтезирует, называются
незаменимыми. Всего их
восемь: лизин, метионин,
триптофаг, лейцин,
изолейцин, валин,
треонин и фенилаланин.
Незаменимые аминокислоты
долны поступать в
организм с пищей.
18. Необходимое количество белка
Суточная норма потребления белкасоставляет 0.75-0.80 грамм на килограмм
веса для взрослого( около 56 грамм в сутки
для среднего мужчины и 45 грамм для
женщины)
Детям требуется больше белка – до 1.9 грамм
на килограмм веса в сутки.
19. Заключение
Белки – обязательная составная часть всех живыхклеток, играют исключительно важную роль в
живой природе, являются главными, наиболее
ценными и незаменимыми компонентами питания.
Белки являются основной структурных элементов и
тканей, поддерживают обмен веществ и энергии,
учавствуют в процессах роста и размножения,
обеспечивают механизмы движений, развитие
иммунных реакция, необходимы для
функционирования
Всех органов и систем организма.












 Химия
Химия








