Похожие презентации:
Классификация неорганических веществ
1. Тема: «Классификация неорганических веществ»
2.
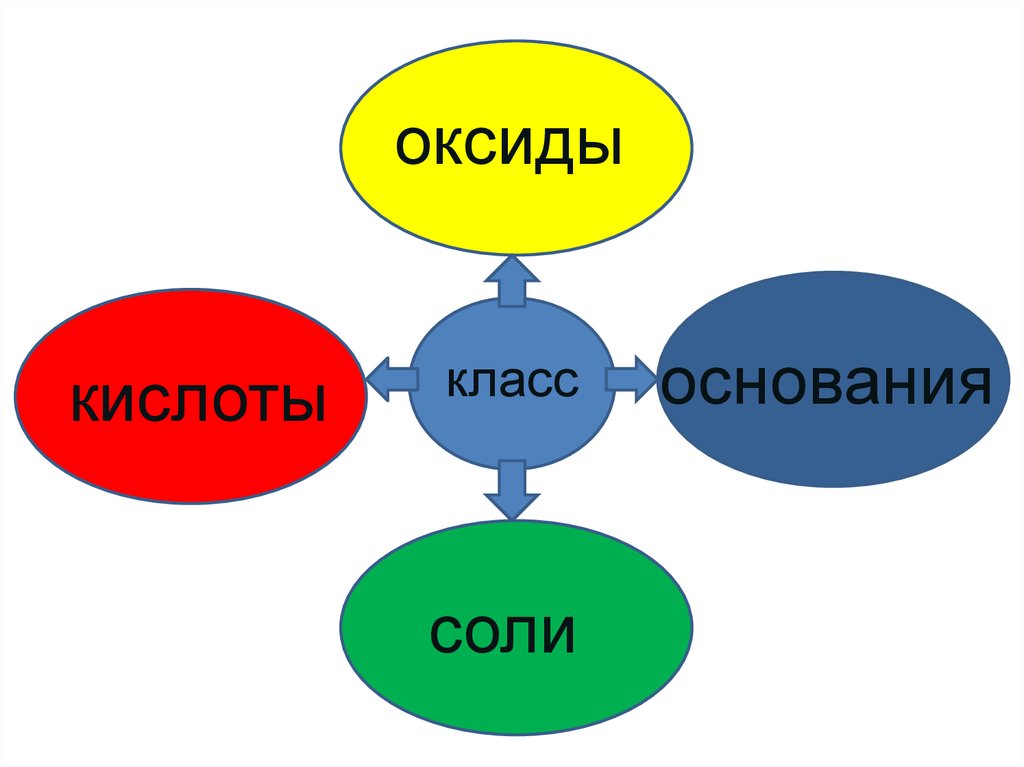
оксидыкислоты
класс
соли
основания
3.
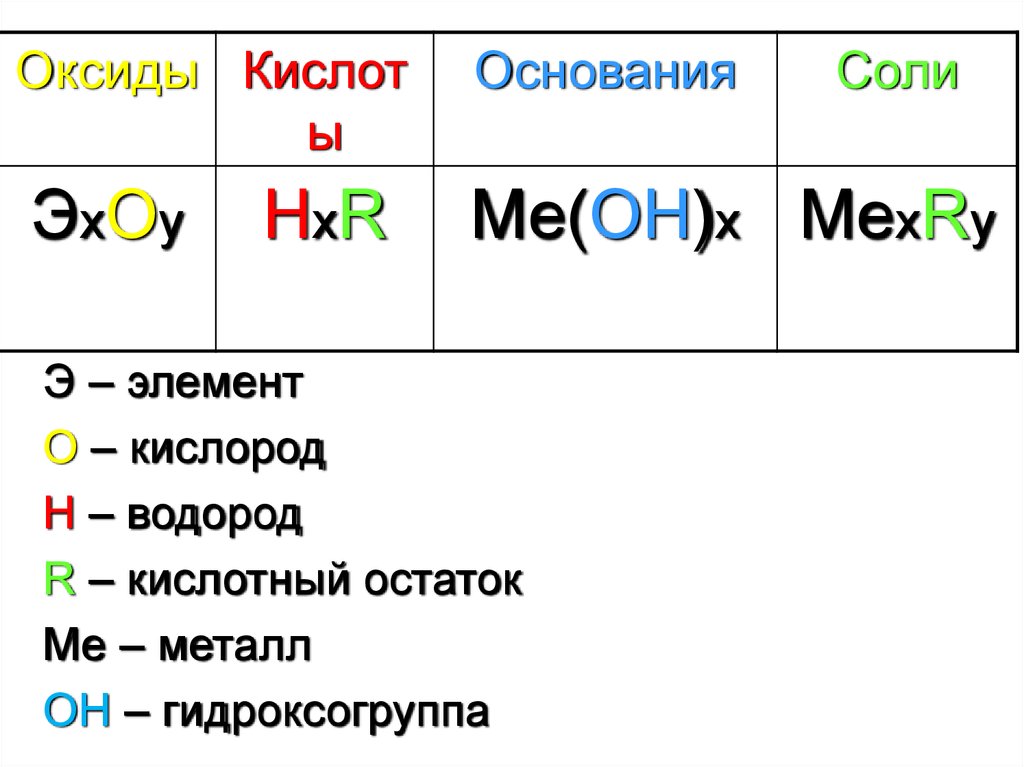
Оксиды Кислоты
Основания
ЭхОy
Ме(ОН)х МехRy
НхR
Э – элемент
О – кислород
Н – водород
R – кислотный остаток
Ме – металл
ОН – гидроксогруппа
Соли
4.
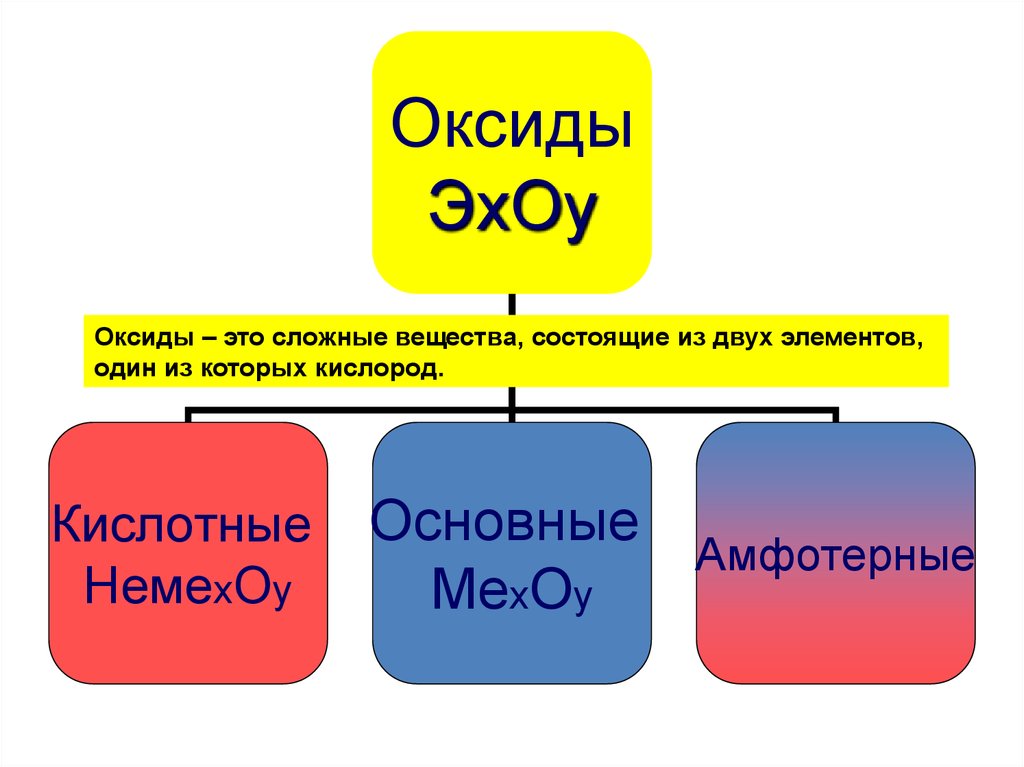
ОксидыЭхОy
Оксиды – это сложные вещества, состоящие из двух элементов,
один из которых кислород.
Кислотные
НемеxОy
Основные
Амфотерные
МеxОy
5. Основные оксиды – это оксиды металлов МехОy
6. Основные оксиды
СаО – оксид кальция, негашеная известь.Используется как побелка.
Nа2O – оксид натрия.
Входит в состав оконного стекла.
РbO – оксид свинца.
Входит в состав хрусталя.
7. Кислотные оксиды – это оксиды неметаллов НемеО
8. Оксид углерода (IV)
Одной из проблем, имеющихглобальный характер, стало
возрастание содержания
оксида углерода (IV) в
атмосфере в связи с
деятельностью человека
Деятельность человека
привела к заметному
истреблению растений,
которые усваивают оксид
углерода (IV) в процессе
фотосинтеза.
9. Оксид углерода (IV)
Большая часть СО2в атмосфере образуется
при использовании
топлива для получения
различных видов энергии
10. Оксид углерода (IV)
• Рост концентрации оксидауглерода (IV) в атмосфере
вызывает повышение
температуры воздуха,
создавая парниковый
эффект. Это может привести
к глобальным изменениям
климата.
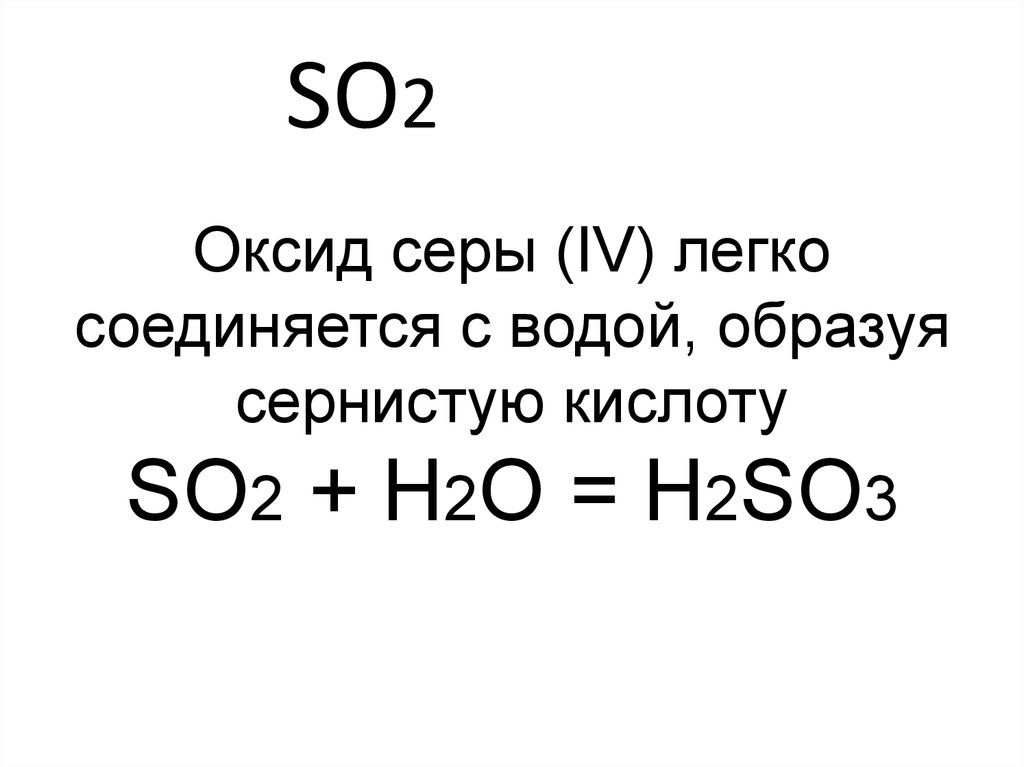
11. SO2
• Один из сильнейшихзагрязнителей атмосферы - оксид серы (IV)
• Попадает в атмосферу при обжиге
сульфидных руд для производства серной
кислоты и некоторых металлов:
12. SO2
Оксид серы (IV) легкосоединяется с водой, образуя
сернистую кислоту
SO2 + H2O = H2SO3
13. NO -> NO2
NO -> NO2• В выбросах некоторых
предприятий есть оксид
азота (II).
• Он летит над дымовыми
трубами, окисляясь
кислородом воздуха до
оксида азота (IV).
• Тривиальное название
оксида азота (IV) - «лисий
хвост».
2NO + O2 = 2NO2
14.
Оксид азота (IV) NO2 реагируетс водой с образованием азотной кислоты
3NO2 + H2O = 2HNO3 +
+ NO
Сернистая и азотная кислоты могут
входить в состав «кислотных дождей».
15. Кислотные дожди
• Кислотные дождипоражают
растительность, губят
живые организмы
водоемов и почв,
вызывают заболевания
у людей.
Лес после кислотного дождя
16. Кислоты НхR
Кислоты – это сложные вещества, состоящие изатомов водорода и кислотных остатков.
17. Соляная кислота НСl
• В начале 16 века Парацельс предположил,что в желудке при питье кислой воды
появляется кислота.
• В 1824 году английский врач и биохимик
Уильям Праут определил, что кислотой,
входящей в состав желудочного сока,
является соляная кислота
18. Кислотность желудка
• Соляная кислота запускаетпищеварение во всем
желудочно-кишечном
тракте, благодаря чему
микробы и паразиты,
попавшие в желудок,
расщепляются
пищеварительными
ферментами.
• Недостаток соляной кислоты
создает идеальные условия
для колонизации кишечного
тракта бактериями,
простейшими и червями.
19.
Кислоты вокруг насЯблочная
кислота
Аскорбиновая
кислота
Щавелевая кислота
Муравьиная
кислота
20. Основания Ме(ОН)х
Основания – это сложные вещества, состоящиеиз атомов металла и гидроксогрупп
21. Основания МеОН
• Растворимые основания - щёлочи содержатся в большом количестве вотбеливающих, моющих средствах,
жидкостях для чистки санитарной техники.
• Их бытовые названия - каустическая сода
(NaOH), каустический поташ (KOH), гашеная
известь (Ca(OH)2)
22. Fe(OH)2 + H2O + O2 = Fe(OH)3
• Ржавчина – этогидроксид железа (III).
• Вещество относится к
классу оснований,
точнее – нерастворимых
оснований
23. Соли МеxRy
Соли – это сложные вещества,состоящие из атомов металла и
кислотных остатков
24. Поваренная соль NaCl
Поваренная соль• Недостаток этой
соли приводит к
функциональным и
органическим
расстройствам
NaCl
Суточная
потребность в
поваренной соли
взрослого
человека
составляет 10-15 г
25.
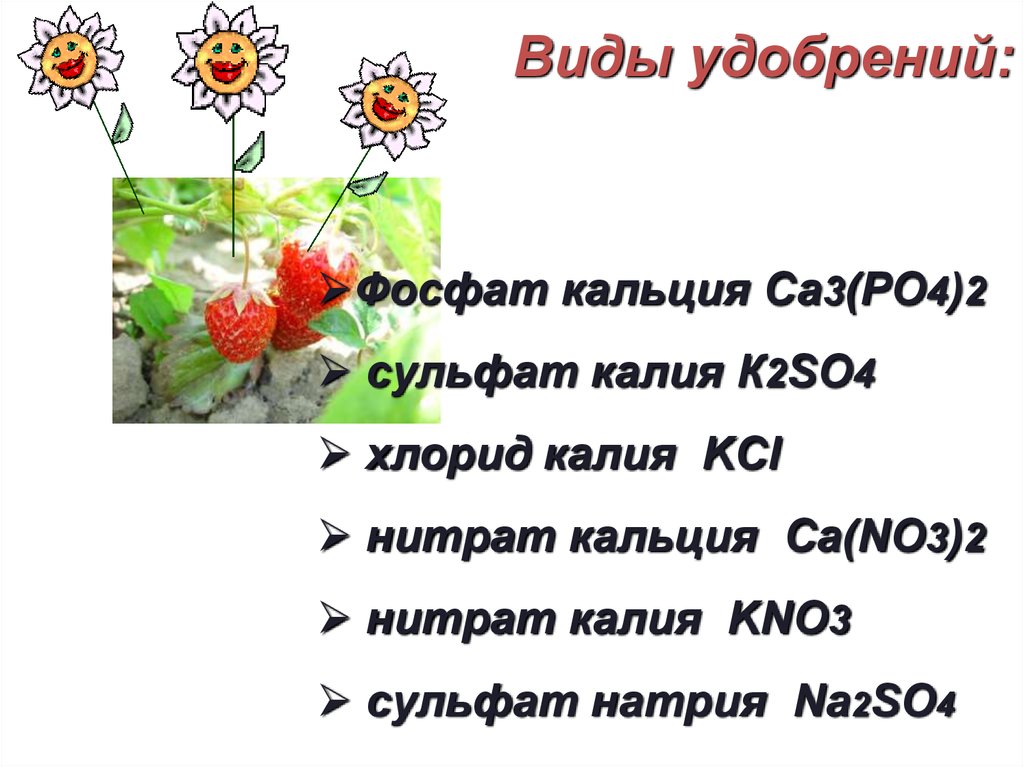
Химия в садуВсе удобрения относятся к классу солей.
Избыток и недостаток удобрений для
растений равносильны избытку или
недостатку питания человека. Голодное
растение постепенно перестает
плодоносить, а при перекорме
вырождается: в его плодах даже
появляются вредные вещества.
26.
Виды удобрений:Фосфат кальция Са3(РО4)2
сульфат калия К2SO4
хлорид калия KCl
нитрат кальция Ca(NO3)2
нитрат калия KNO3
сульфат натрия Na2SO4
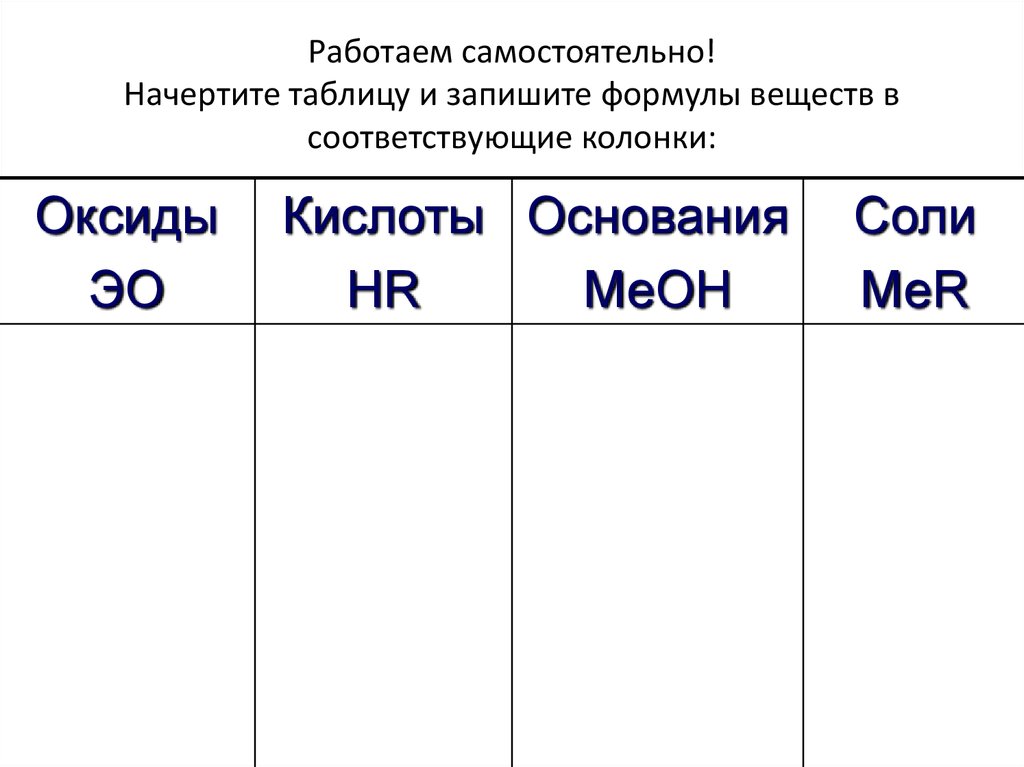
27. Работаем самостоятельно! Начертите таблицу и запишите формулы веществ в соответствующие колонки:
ОксидыЭО
Кислоты Основания
НR
МеОН
Соли
МеR
28.
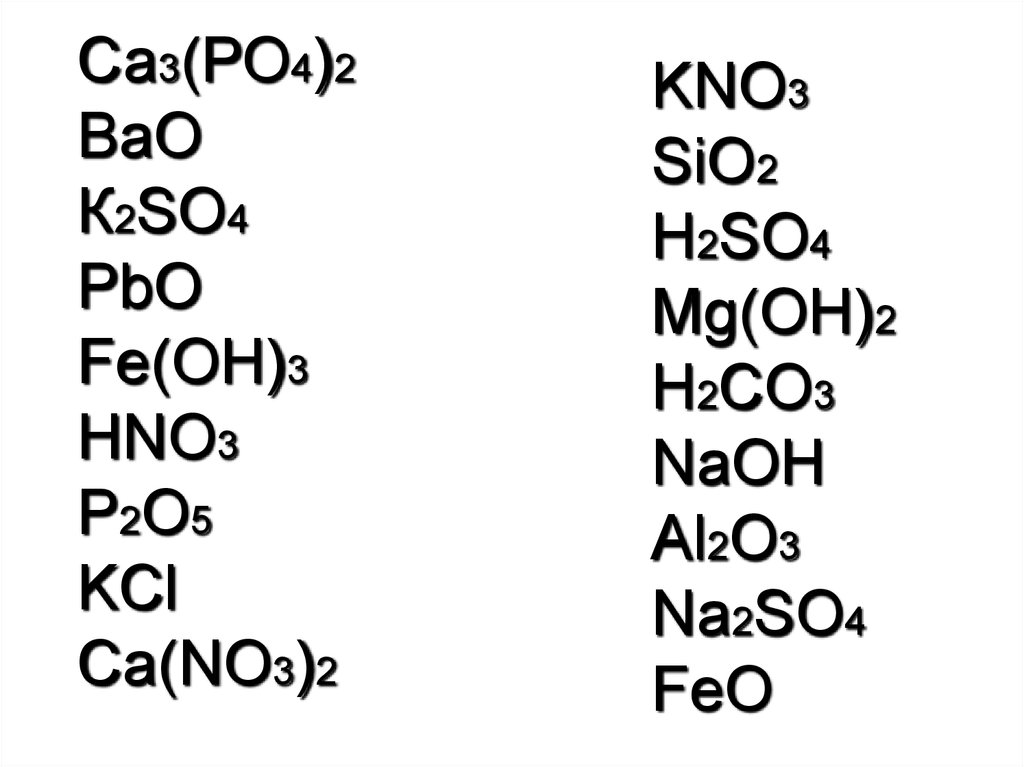
Са3(РО4)2ВаО
К2SO4
PbO
Fe(OH)3
HNO3
P2O5
KCl
Ca(NO3)2
KNO3
SiO2
H2SO4
Mg(OH)2
H2CO3
NaOH
Al2O3
Na2SO4
FeO
29.
А теперь проверим,что у нас получилось!
Итак…
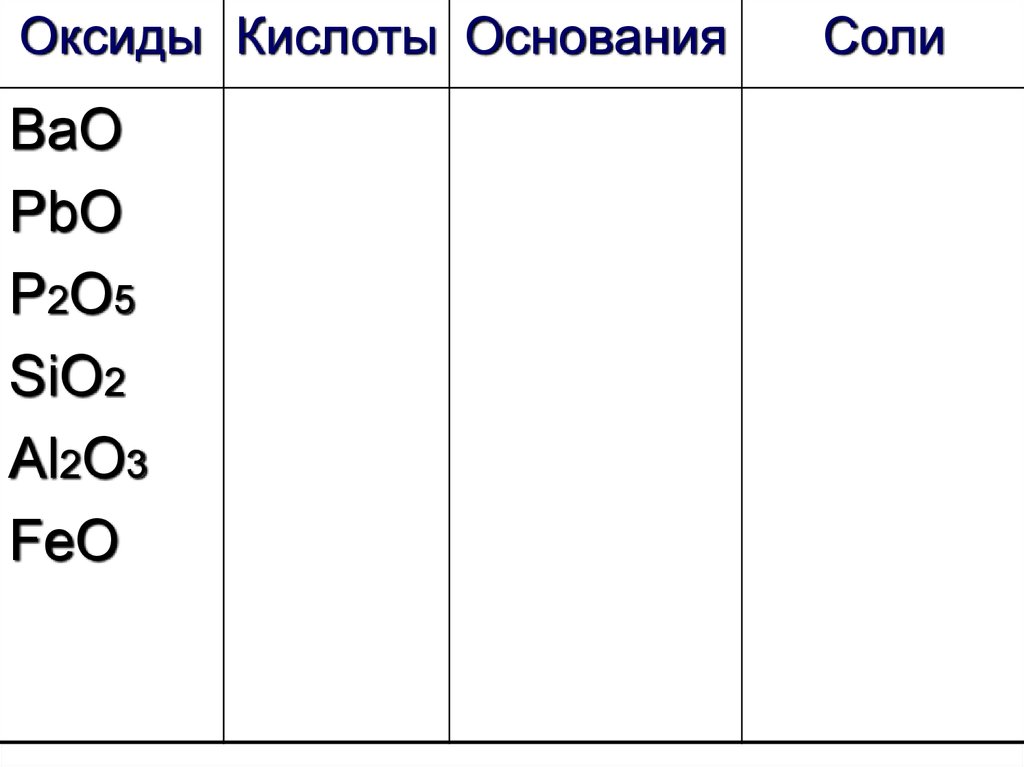
30.
Оксиды Кислоты ОснованияВаО
PbO
P2O5
SiO2
Al2O3
FeO
Соли
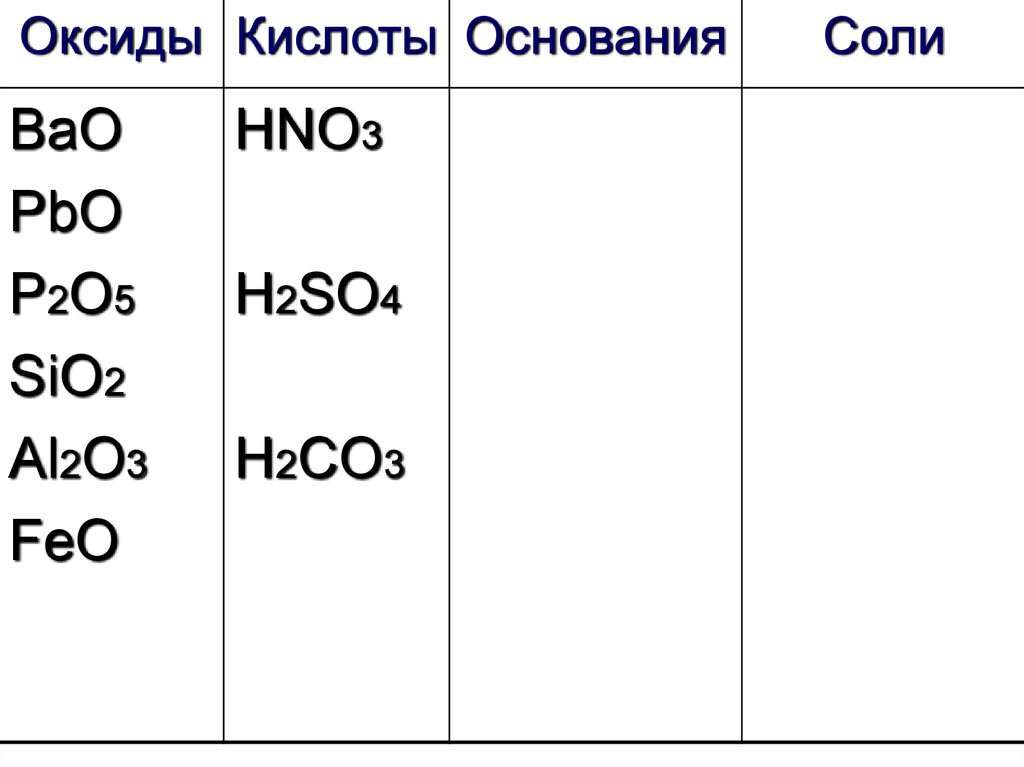
31.
Оксиды Кислоты ОснованияВаО
PbO
P2O5
SiO2
Al2O3
FeO
HNO3
H2SO4
H2CO3
Соли
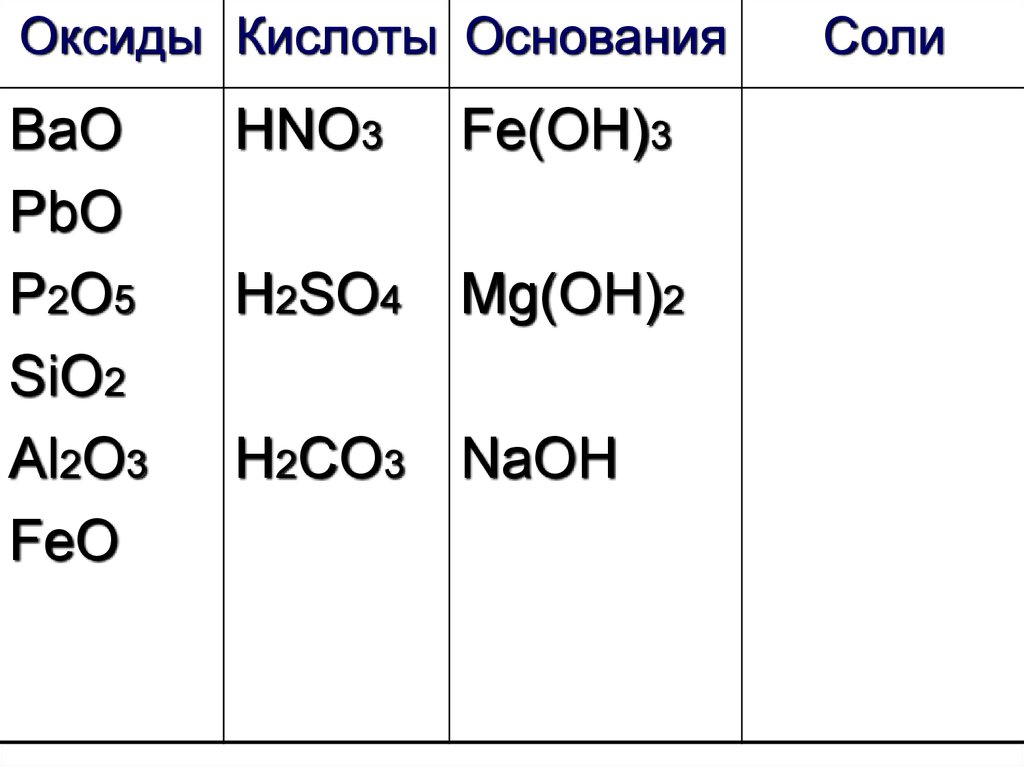
32.
Оксиды Кислоты ОснованияВаО
PbO
P2O5
SiO2
Al2O3
FeO
HNO3
Fe(OH)3
H2SO4
Mg(OH)2
H2CO3 NaOH
Соли
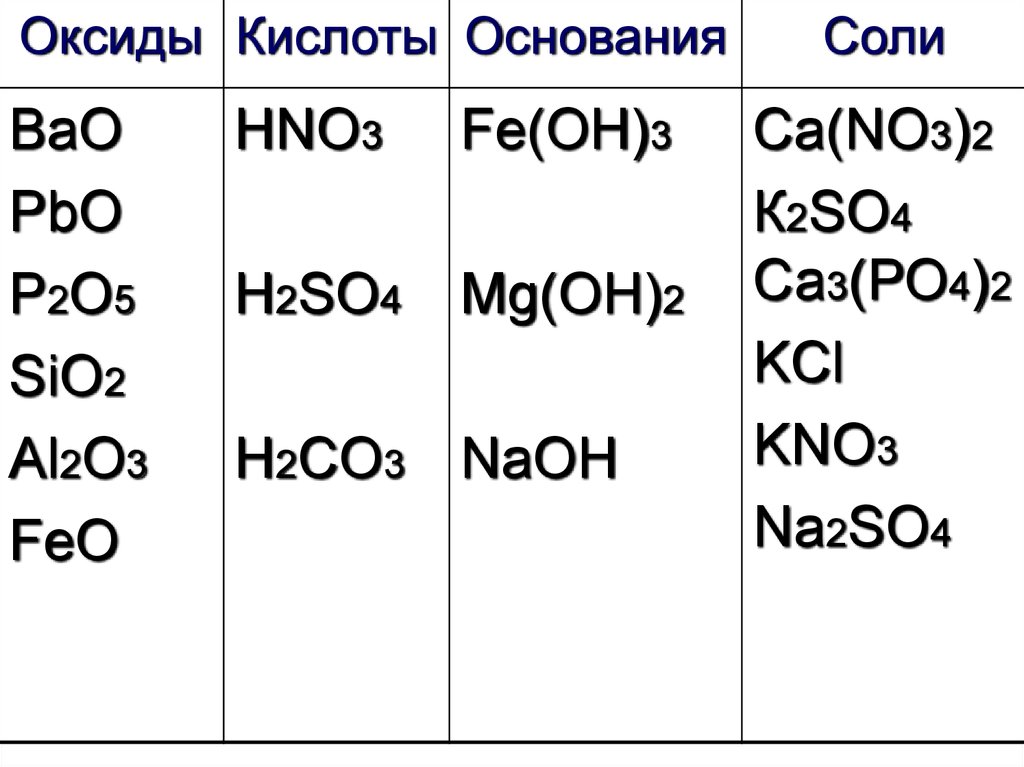
33.
Оксиды Кислоты ОснованияВаО
PbO
P2O5
SiO2
Al2O3
FeO
HNO3
Fe(OH)3
H2SO4
Mg(OH)2
H2CO3 NaOH
Соли
Ca(NO3)2
К2SO4
Са3(РО4)2
KCl
KNO3
Na2SO4





















 Химия
Химия








