Похожие презентации:
Биофизические основы патологии клетки. Свободные радикалы и болезни человека
1. Свободные радикалы и болезни человека
Биофизические основыпатологии клетки
Свободные радикалы и болезни человека
Ю.А. Владимиров, А.Н. Осипов
2018
2. Хемилюминесценция при перекисном окислении липидов
3. Триггерная функция Fe2+
LOOH L1 LOOH L
0
0
2
v ПОЛ
e t
v ПОЛ-0
k2
2+
k p O2 Fe
k9
3 При = 0
k2
Fe O2
Fe2+
крит
k9
2+
= kp([Fe2+]* – [Fe2+])
4
2+] > [Fe2+] *, < 0
При
[Fe
5
6 При [Fe2+] < [Fe2+] *, > 0
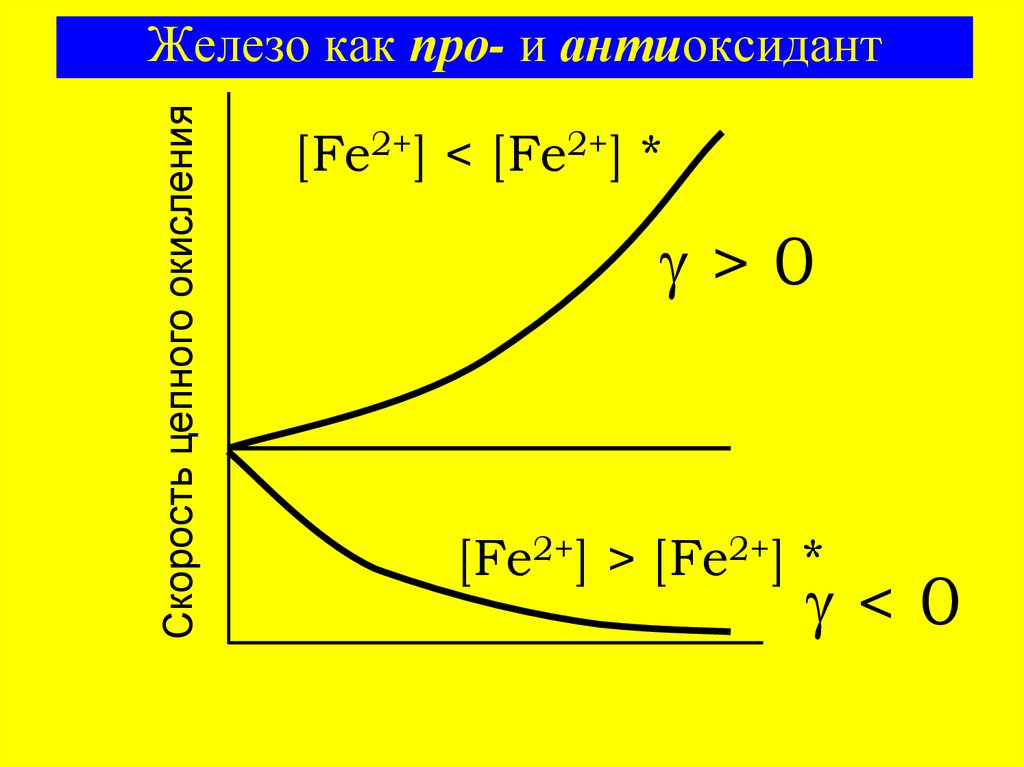
4. Железо как про- и антиоксидант
Скорость цепного окисленияЖелезо как про- и антиоксидант
[Fe2+] < [Fe2+] *
>0
[Fe2+] > [Fe2+] *
<0
5. Уравнения реакций цепного окисления липидов
Скорости реакцийv0 =
0) O2 + e- O2-… HO·
v1 = k1 [LH][HO·]
1) LH + HO· L· + HOH
v2 = k2 [O2][L·]
2) L• + O2 LOO·
v3 = k3 [LH][LOO·]
3) LOO· + LH LOOH + L
4) Fe2+ +LOOH Fe3+ + OH¯ + LO· vp = kp [Fe2+][LOOH]
v5 = k5 [LH][LO·]
5) LH + LO· LOH + L·
v6 = k6 [LOO·]2
6) LOO· + LOO· МП + hn
v7 = k7 [InH][L·]
7) L· + InH LH + In·
v8 = k8 [In·][L·]
8) L· + In· МП
v9 = k9 [Fe2+ ][L·]
9) L· + Fe2+ + H+ Fe3+ + LH
6. Кинетика перекисного окисления липидов
4030
20
10
МВ
СС
ЛП
20
50
Fe2+(мМ); CL (отн. Ед.)
ТБКАП (нмоль/мг белка )
БВ
16
ТБКАП
12
8
4
ХЛ
Fe2+
Fe2+
0
0
3
9
15
21
БВ – быстрая вспышка;
ЛП – латентный период;
МВ – медленная вспышка; СС – стационарное свечение
Владимиров, А., Т.Б. Суслова, В.И. Оленев, Хемилюминесценция, сопряженная с образованием липидных перекисей в биологических
мембранах. П. Роль Fe(2+) в разитии цепного окисления липидов и сверхслабого свечения. Биофизика, 1969. 14: p. 836.
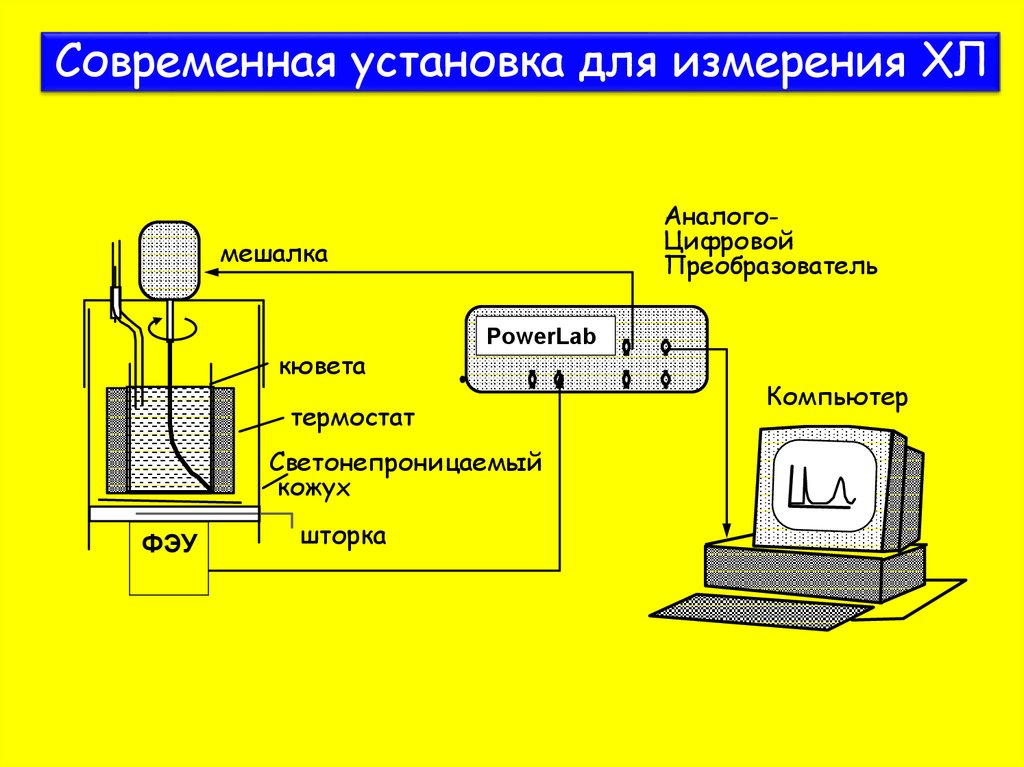
7. Современная установка для измерения ХЛ
АналогоЦифровойПреобразователь
мешалка
кювета
PowerLab
термостат
Светонепроницаемый
кожух
ФЭУ
шторка
Компьютер
8. Структура производных кумаринов
RR=
кумарин
C-525
R=
R=
C-314
C-334
9. Кумарин как физический активатор ХЛ
Радикалы липидовКумарин как физический активатор ХЛ
>C=O*
= 10-4
C-525 *
= 0.1 – 1.0
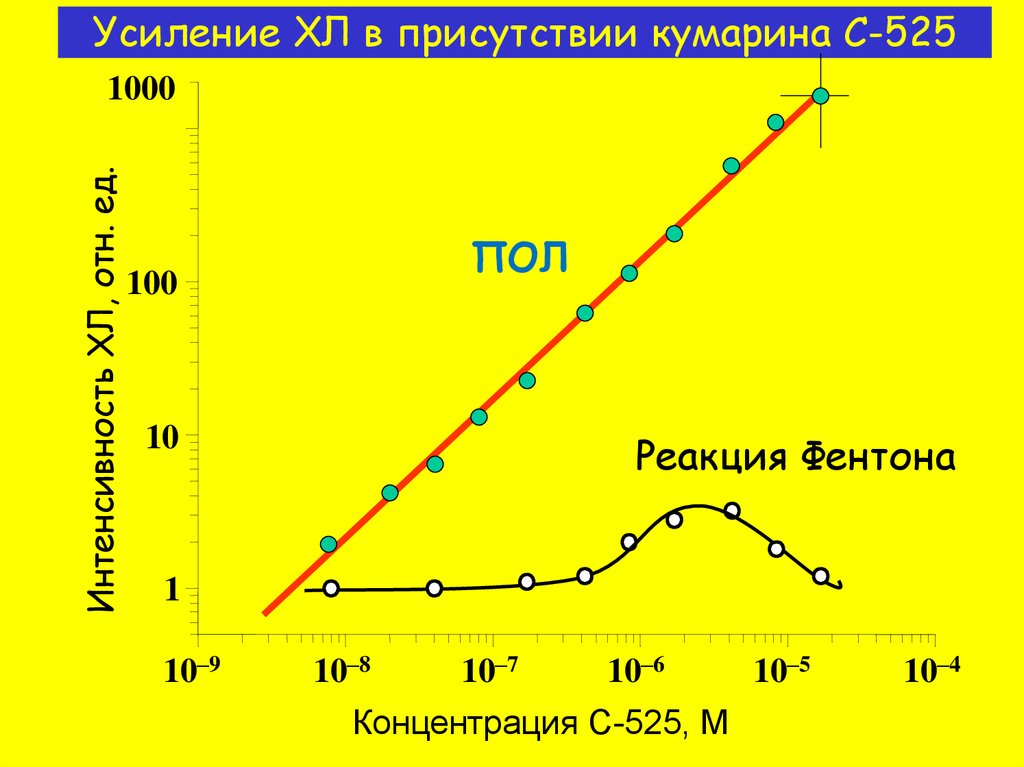
10. Усиление ХЛ в присутствии кумарина С-525
Интенсивность ХЛ, отн. ед.1000
ПОЛ
100
10
Реакция Фентона
1
10–9
10–8
10–7
10–6
Концентрация C-525, M
10–5
10–4
11. Усиление ХЛ при ПОЛ в присутствии C-525.
+С-525-С-525
30000
Интенсивность ХЛ, отн. ед.
120
16.8 mM
20 mM
80
8 mM
40
8.4 mM
20000
4.2 mM
10000
2+
Fe
0 mM
0 mM
0
0
0
4
8
Время, мин
12
0
4
8
Время, мин
12
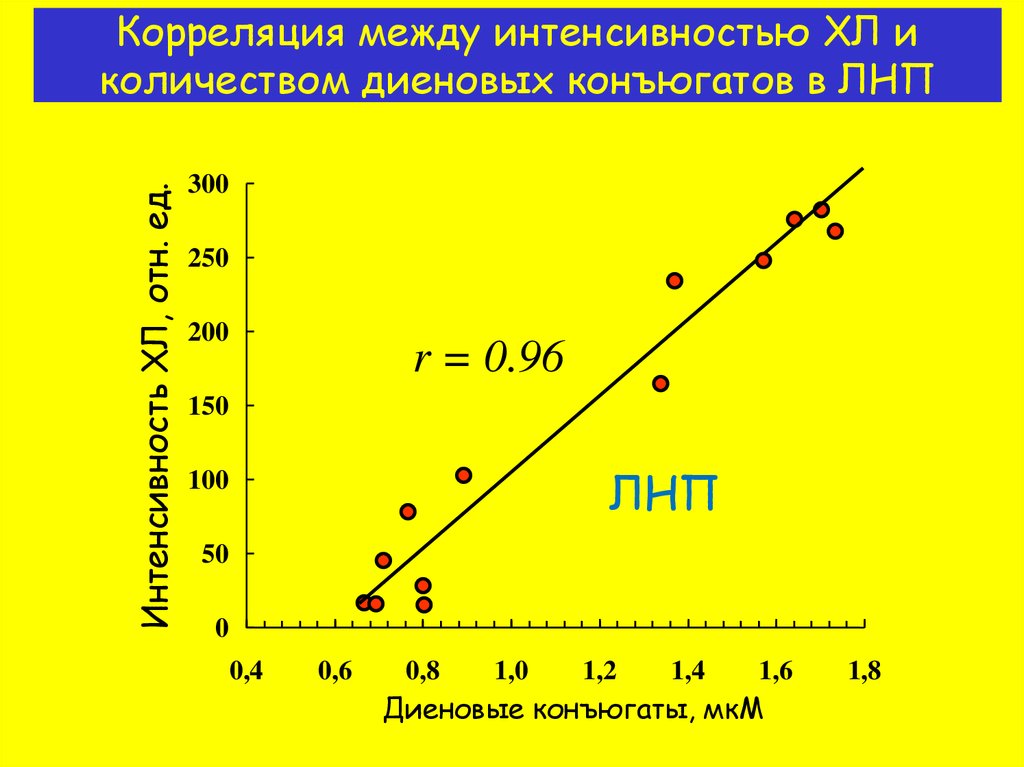
12. Корреляция между интенсивностью ХЛ и количеством диеновых конъюгатов в ЛНП
Интенсивность ХЛ, отн. ед.Корреляция между интенсивностью ХЛ и
количеством диеновых конъюгатов в ЛНП
300
250
200
r = 0.96
150
ЛНП
100
50
0
0,4
0,6
0,8
1,0
1,2
1,4
1,6
Диеновые конъюгаты, мкМ
1,8
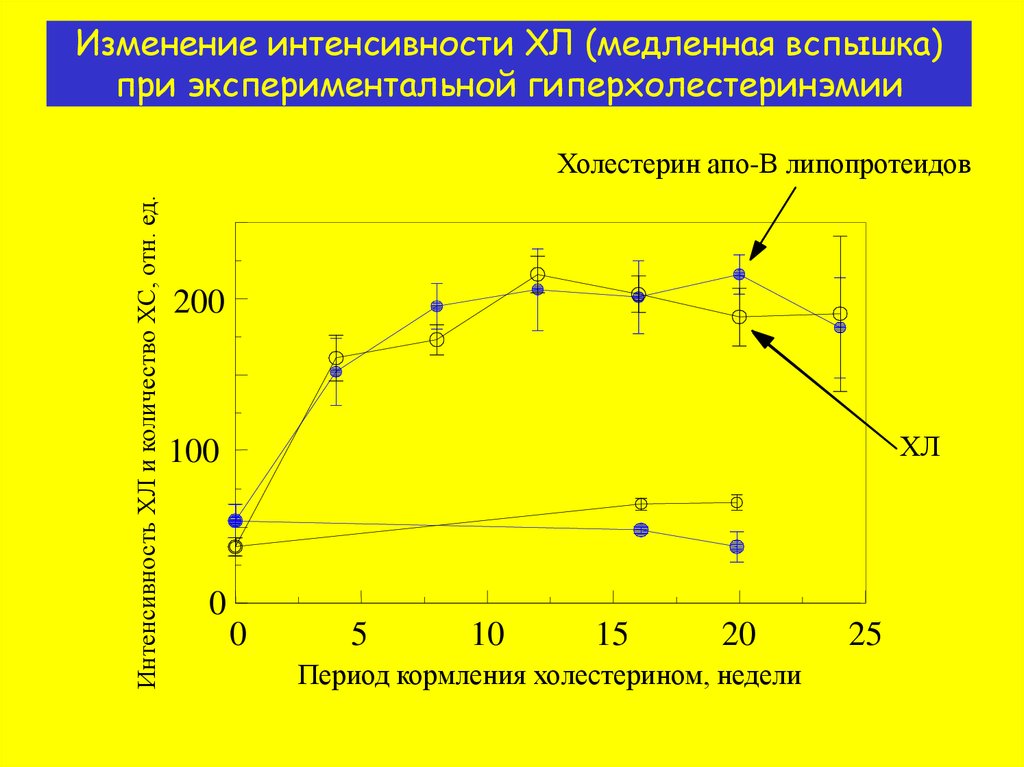
13. Изменение интенсивности ХЛ (медленная вспышка) при экспериментальной гиперхолестеринэмии
Интенсивность ХЛ и количество ХС, отн. ед.Холестерин апо-B липопротеидов
200
ХЛ
100
0
0
5
10
15
20
Период кормления холестерином, недели
25
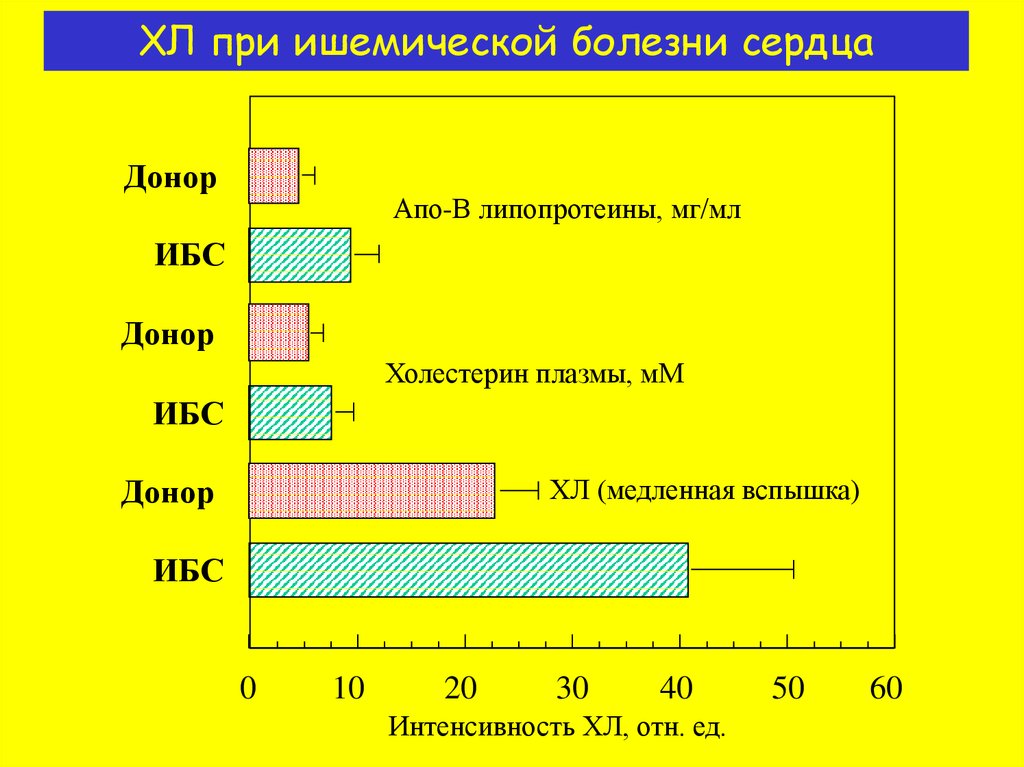
14. ХЛ при ишемической болезни сердца
ДонорАпо-B липопротеины, мг/мл
ИБС
Донор
Холестерин плазмы, мM
ИБС
Донор
ХЛ (медленная вспышка)
ИБС
0
10
20
30
40
Интенсивность ХЛ, отн. ед.
50
60
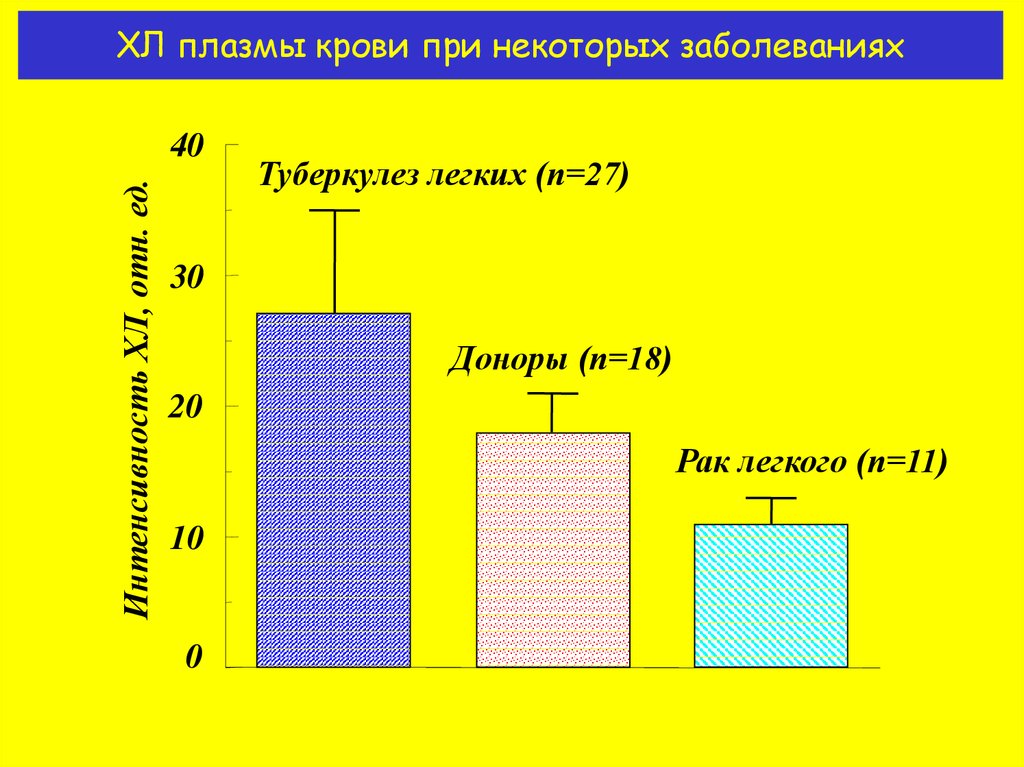
15. Интенсивность ХЛ плазмы крови, индуцированной Fe2+
ХЛ плазмы крови при некоторых заболеванияхИнтенсивность ХЛ, отн. ед.
40
Туберкулез легких (n=27)
30
Доноры (n=18)
20
Рак легкого (n=11)
10
0
16. ХЛ плазмы крови при некоторых заболеваниях
ХЛ плазмы крови при аппендицитеn = 29
n = 32
Светосумма ХЛ, отн. ед.
n = 12
Доноры
Катаральный Обструктивный
Аппендицит
17. ХЛ плазмы крови при аппендиците
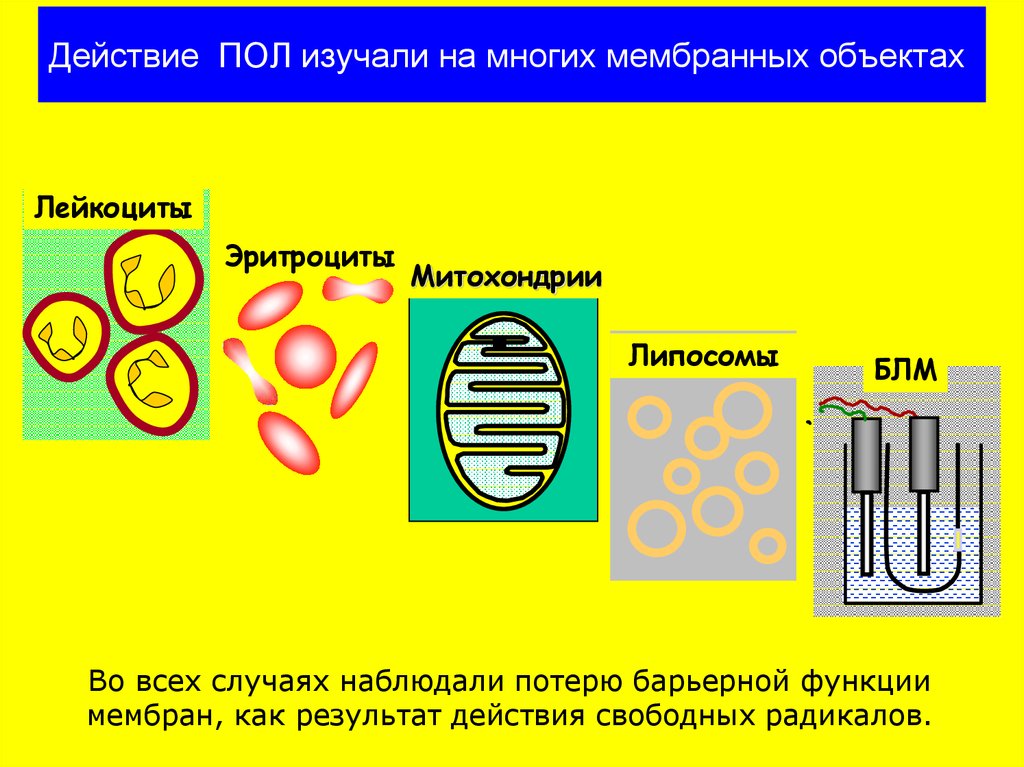
Действие радикалов наклеточные структуры
18. Действие радикалов на клеточные структуры
Действие ПОЛ изучали на многих мембранных объектахЛейкоциты
Эритроциты
Митохондрии
Липосомы
БЛМ
Во всех случаях наблюдали потерю барьерной функции
мембран, как результат действия свободных радикалов.
19. Действие ПОЛ изучали на многих мембранных объектах
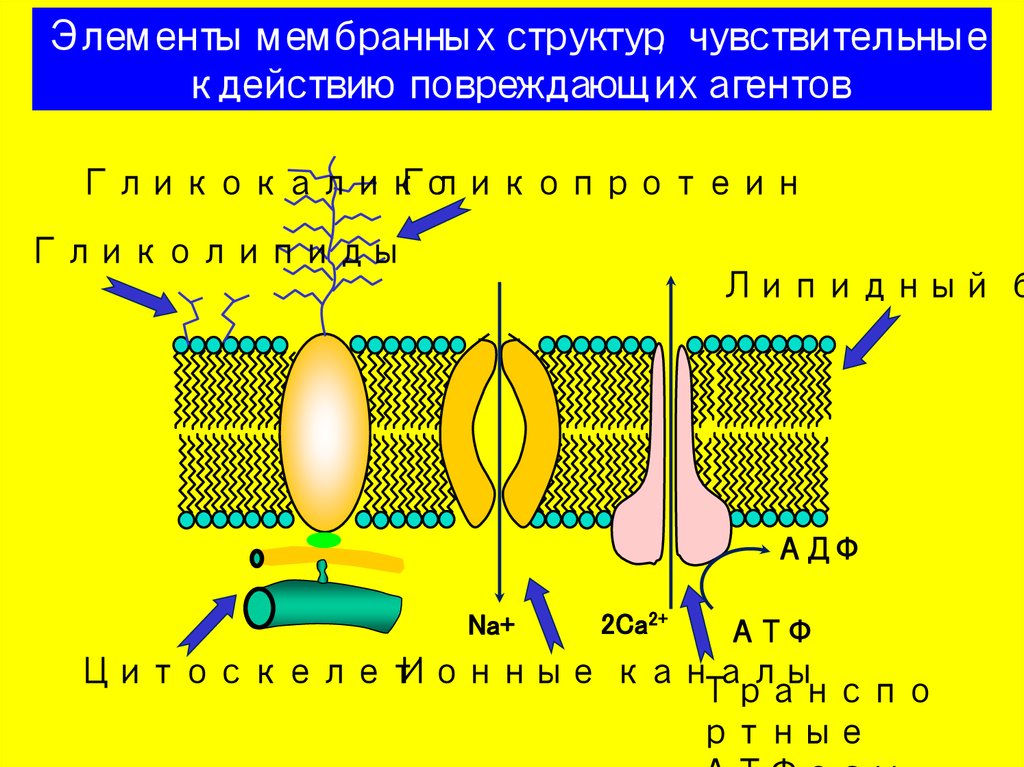
Элементымембранныхст
рук
т
ур, чувст
вит
ельные
кдейст
виюповреждающихаг
ент
ов
Гликокаликс
Гликопротеин
Гликолипиды
Липидный б
АДФ
Na+
2Ca2+
АТФ
Цитоскелет
Ионные каналы
Транспо
ртные
20. Элементы мембранных структур, чувствительные к действию повреждающих агентов
Действие перекисногоокисления липидов на –
белки
21. Действие перекисного окисления липидов на –белки
Действие перекисногоокисления липидов на
мембранные белки
Окисление тиоловых
групп
Обратимое: R1SH + HSR2 R1SSR2
Необратимое: RSH + LO2• + O2
RSO2
Инактивация
мембранных
ферментов
Инактивация Са2+-АТФазы
22. Действие перекисного окисления липидов на мембранные белки
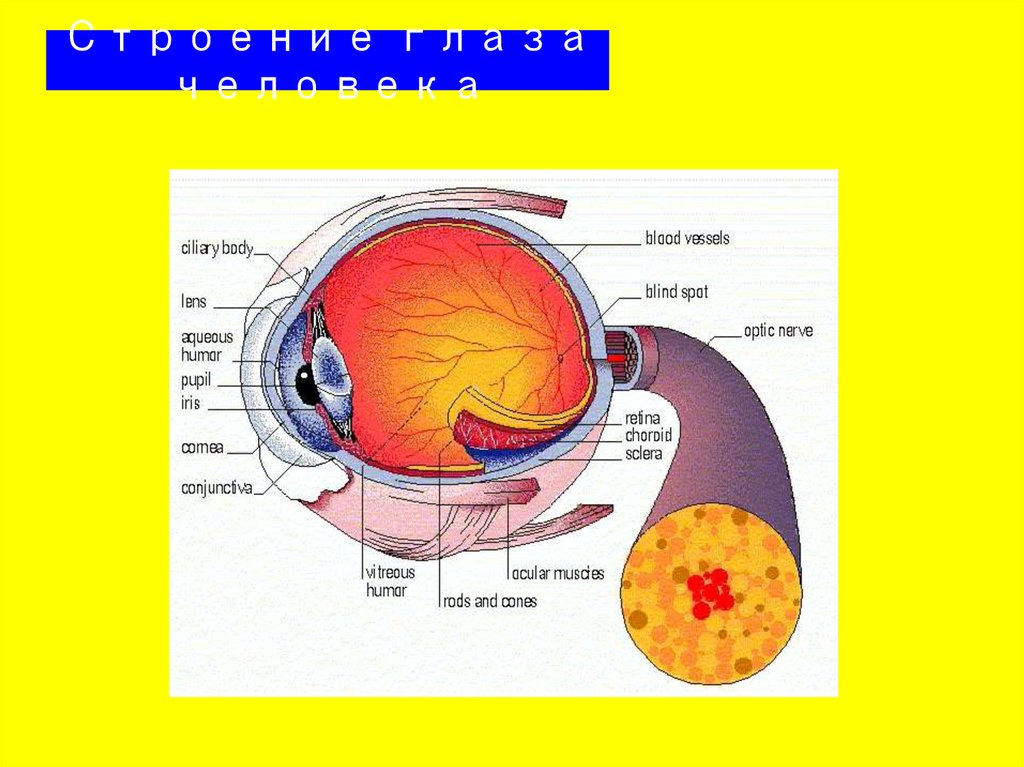
Строение глазачеловека
23. Строение глаза человека
Морфологические изменения вхрусталике при катаракте
В нормальном
хрусталике
глаза клеточные
мембраны не
разрушены
Эпителий
Волокна
Норма
При катаракте
мембраны
разрушены
вследствие
перекисного
Склероз ядра
окисления
липидов Рост эпи
Набух
ание
клето
Разруш
к
ение
мембра
н
Катаракт
24. Морфологические изменения в хрусталике при катаракте
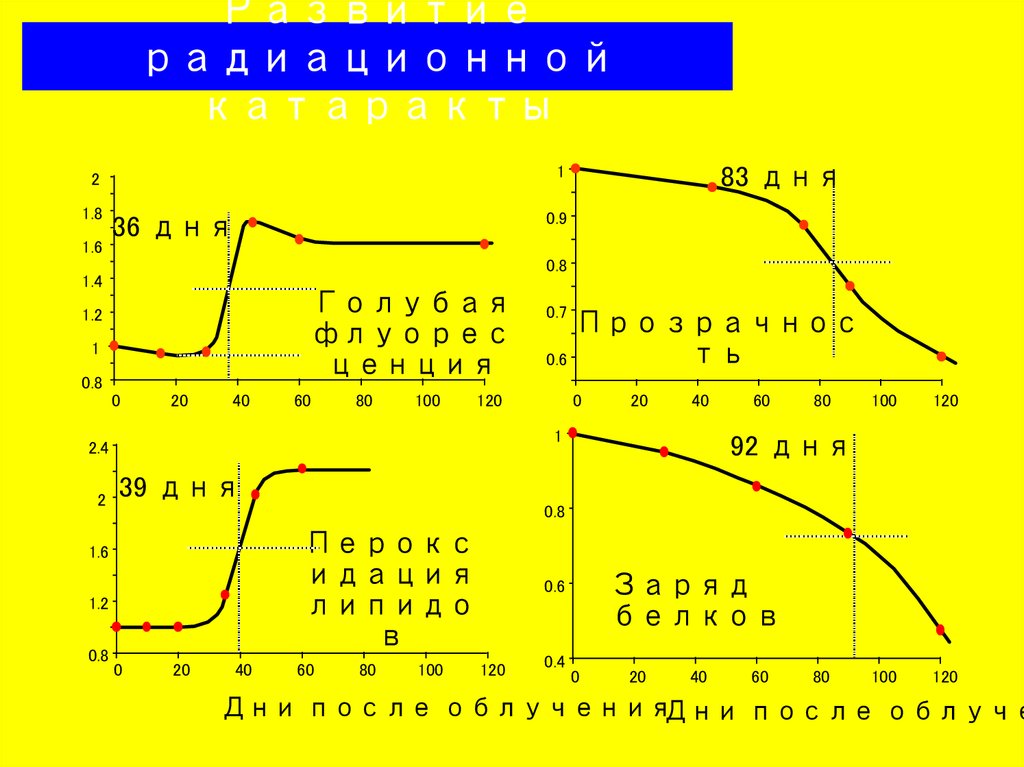
Развитиерадиационной
катаракты
1.8
1.6
0.9
36 дня
0.8
1.4
Голубая
флуорес
ценция
1.2
1
0.8
0
20
40
60
80
100
Прозрачнос
ть
0.6
0
20
40
1
60
80
100
120
100
120
92 дня
39 дня
0.8
Перокс
идация
липидо
в
1.6
1.2
0.8
0.7
120
2.4
2
83 дня
1
2
0
20
40
60
80
100
Заряд
белков
0.6
120
0.4
0
20
40
60
80
Дни после облученияДни после облуче
25. Развитие радиационной катаракты
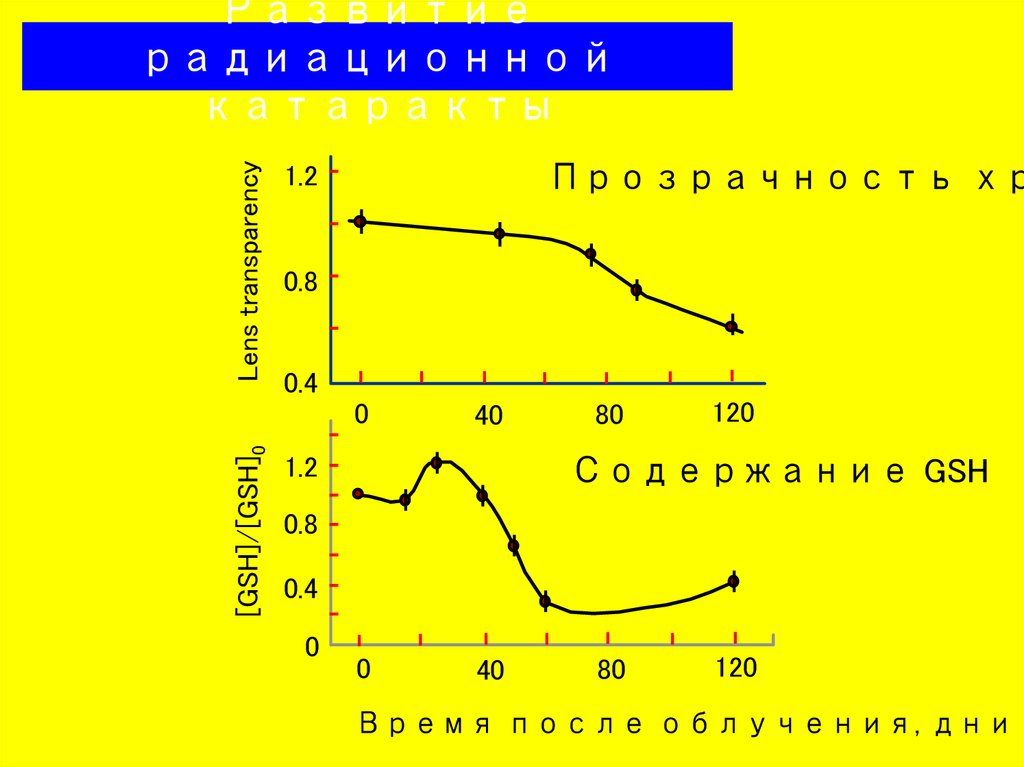
Lens transparencyРазвитие
радиационной
катаракты
Прозрачность хр
1.2
0.8
0.4
[GSH]/[GSH]0
0
40
1.2
80
120
Содержание GSH
0.8
0.4
0
0
40
80
120
Время после облучения, дни
26.
Действие липопероксидации на–Ca2+-транспортную АТФазу
27. Действие липопероксидации на –Ca2+-транспортную АТФазу
Регуляция уровняСа2+ в клетке
Низкий уровень ионов кальция (10-8
М) в живых клетках
обеспечивается работой Са2+ насосов клеточной мембраны и
Матрикс
митохондриями.
Клеточная мембрана
Митохондрии
Клетка
Ca2+
Ca2+ -АТФаза
Ca2+ - переносчи
28. Регуляция уровня Са2+ в клетке
Кальциевые насосы вживой клетке
Митохондри
Клетка
Ca2+
Ca2+
Ca2+ - ATPase in plasma
membrane and intracellular
depots
Electrophoretic Ca2+ transport
across mitochondrial inner
membrane
ATP 2Ca2+ 10-7 М
ADP
10-3 М
Cell membrane
Ca2+
29. Кальциевые насосы в живой клетке
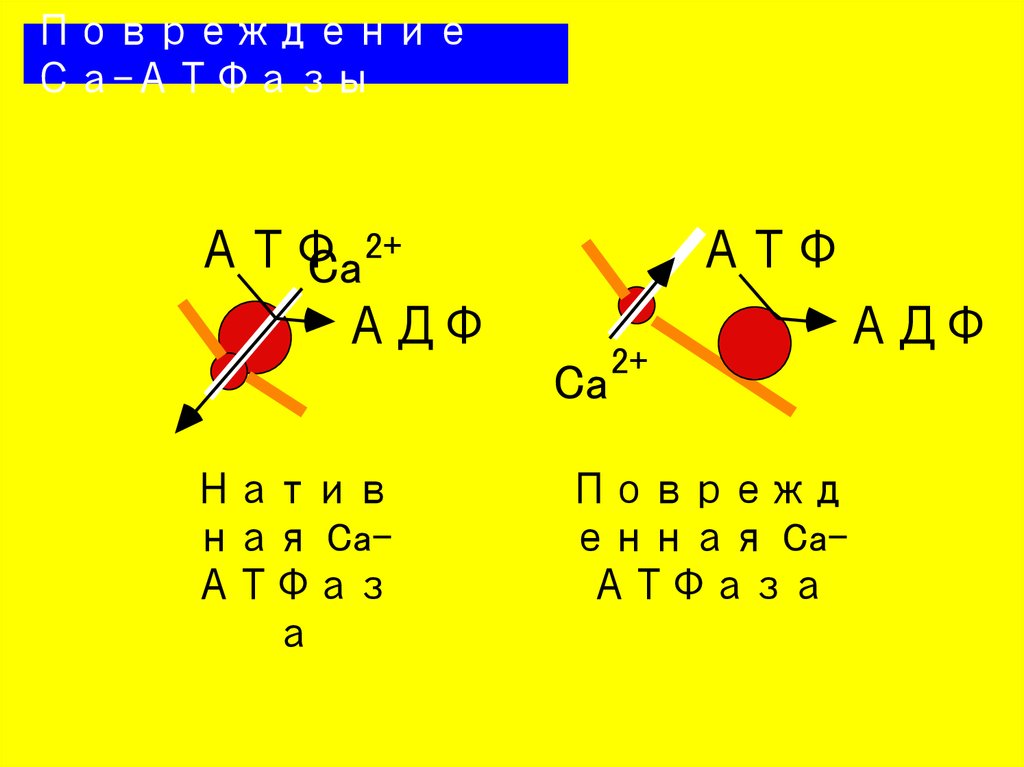
ПовреждениеСа-АТФазы
2+
АТФ
Ca
АДФ
АТФ
Ca
Натив
ная CaАТФаз
а
2+
АДФ
Поврежд
енная CaАТФаза
30. Повреждение Са-АТФазы
Влияние ПОЛ наCa2+-ATPазу
4
Kagan VE, Azizova OA, Arkhipenko YV, Klaan NA, Kozlov YP.
Vladimirov YuA (1977), Biofizika 22(4):625-630
VCa
3
VATP
2
Ca2+
ATP
1
0
0,33
4,71
8,02
1,66
TBARS (mM/mg protein)
31. Влияние ПОЛ на Ca2+-ATPазу
Электрический пробой мембран приперекисном окислении липидов
32. Effect of UV on Liposomes + Globin
Изучение электрическогопробоя на БЛМ
33. Effect of UV on Ca2+-ATPase
Электрические свойства Бислойной ЛипиднойМембраны (БЛМ)
R (сопротивление) БЛМ = 107 – 108 Ом*см2
Слой раствора электролита (KCl 0.01 М) имеет R = 10 – 4 Ом*см2
(диэлектрическая проницаемость) липидов мембраны = 2
(диэлектрическая проницаемость) воды = 80
5 нм (50 А)
Если концентрация ионов в
растворе равна 0.1 М, то в
липидной фазе она должна
упасть до 10-13 М.
34. Effect of UV on Ca2+ Transport
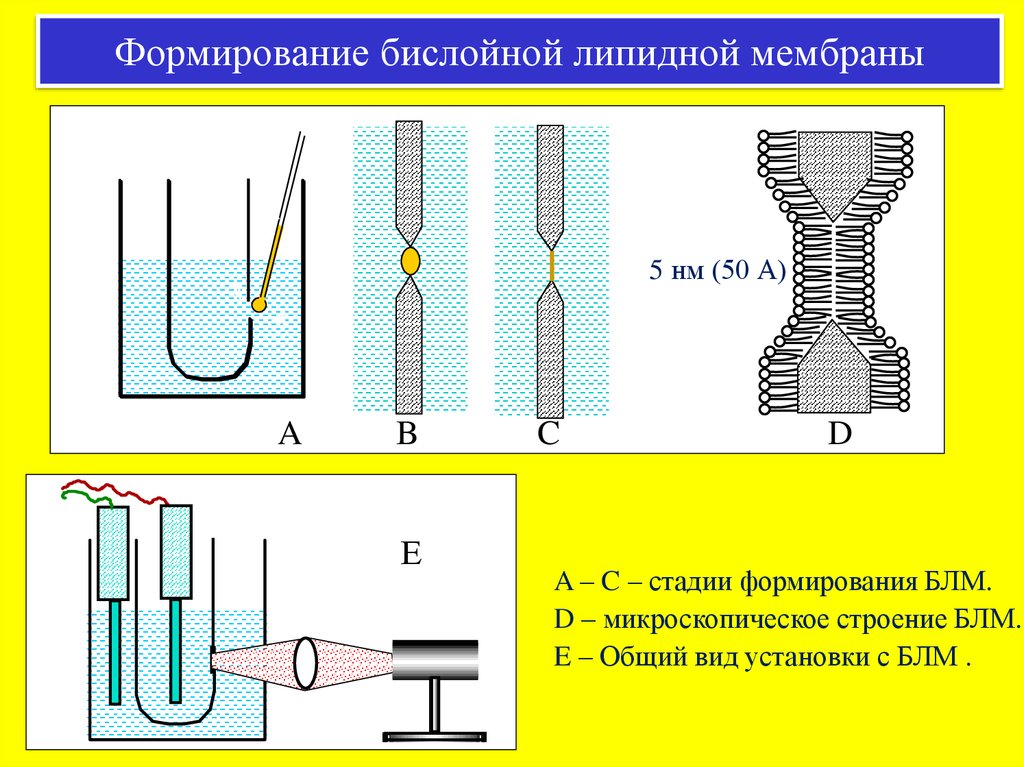
Формирование бислойной липидной мембраны2
4
5 нм (50 А)
3
5
1
A
B
Е
C
D
A – C – стадии формирования БЛМ.
D – микроскопическое строение БЛМ.
E – Общий вид установки с БЛМ .
35. Тиолы и ПОЛ в эритроцитах при УФ облучении
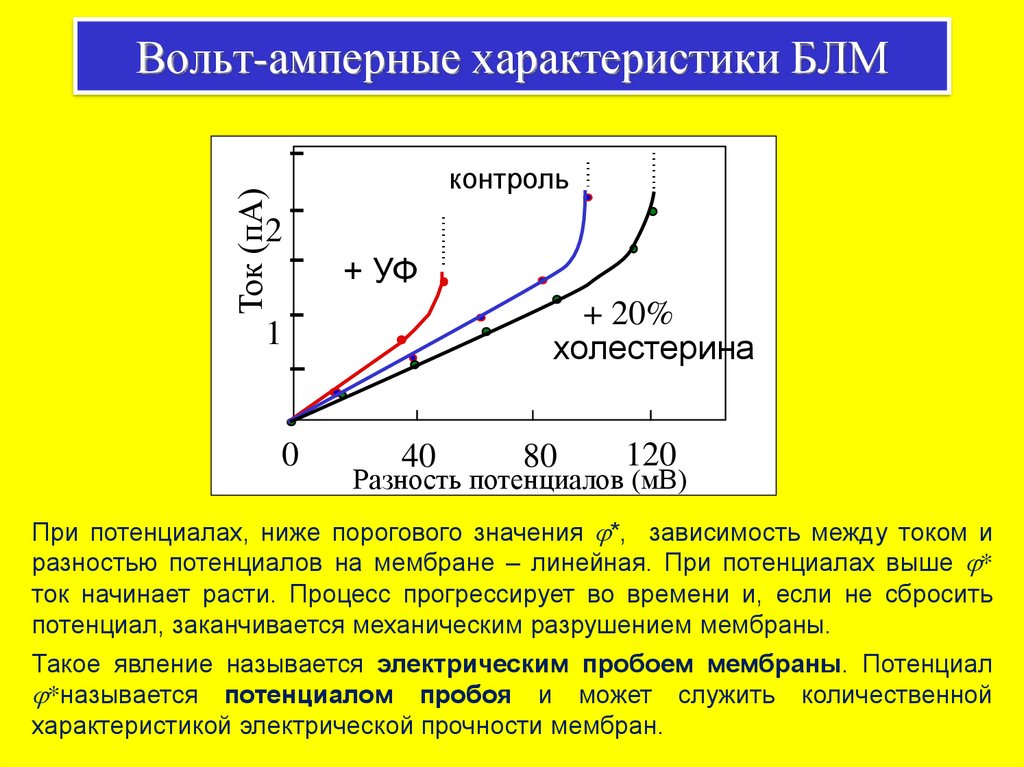
Вольт-амперные характеристики БЛМТок (пА)
контроль
2
+ УФ
+ 20%
холестерина
1
0
40
80
120
Разность потенциалов (мВ)
При потенциалах, ниже порогового значения j*, зависимость между током и
разностью потенциалов на мембране – линейная. При потенциалах выше j*
ток начинает расти. Процесс прогрессирует во времени и, если не сбросить
потенциал, заканчивается механическим разрушением мембраны.
Такое явление называется электрическим пробоем мембраны. Потенциал
j*называется потенциалом пробоя и может служить количественной
характеристикой электрической прочности мембран.
36.
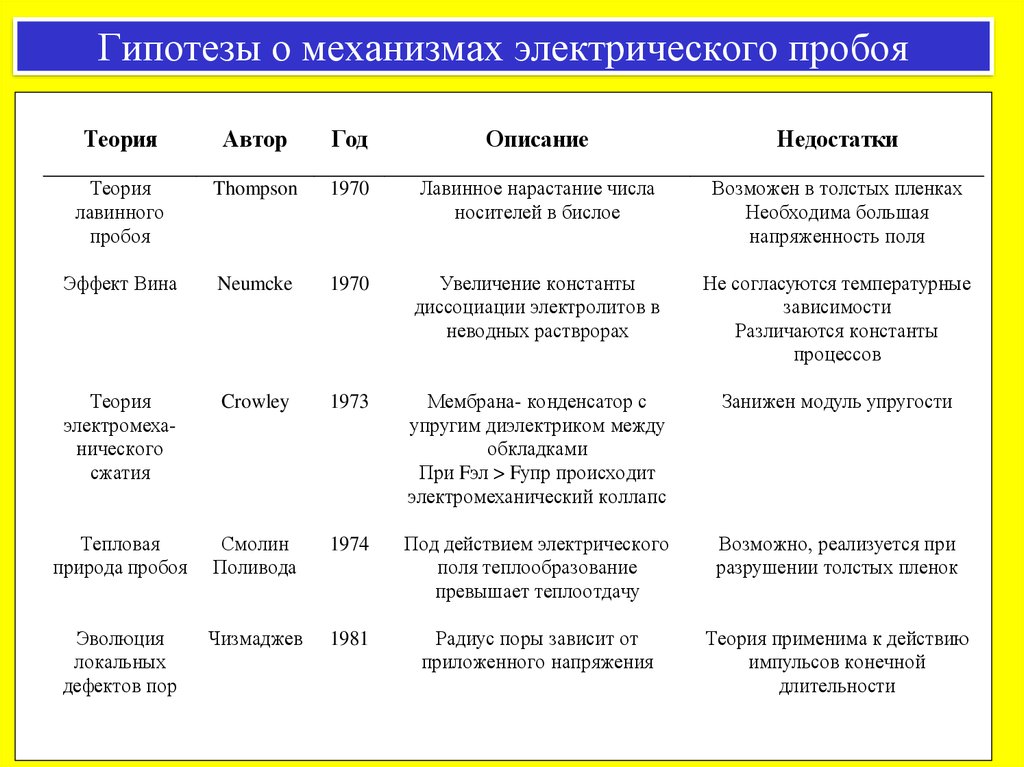
Гипотезы о механизмах электрического пробояТеория
Автор
Год
Описание
Недостатки
Теория
лавинного
пробоя
Thompson
1970
Лавинное нарастание числа
носителей в бислое
Возможен в толстых пленках
Необходима большая
напряженность поля
Эффект Вина
Neumcke
1970
Увеличение константы
диссоциации электролитов в
неводных растврорах
Не согласуются температурные
зависимости
Различаются константы
процессов
Теория
электромеханического
сжатия
Crowley
1973
Мембрана- конденсатор с
упругим диэлектриком между
обкладками
При Fэл > Fупр происходит
электромеханический коллапс
Занижен модуль упругости
Тепловая
природа пробоя
Смолин
Поливода
1974
Под действием электрического
поля теплообразование
превышает теплоотдачу
Возможно, реализуется при
разрушении толстых пленок
Эволюция
локальных
дефектов пор
Чизмаджев
1981
Радиус поры зависит от
приложенного напряжения
Теория применима к действию
импульсов конечной
длительности
37. Электрический пробой мембран при перекисном окислении липидов
Факты подтверждающие теориюпорообразования
1.
Неспецифическая проницаемость для разных
низкомолекулярных веществ;
2. Локальность изменения свойств мембраны;
3.
Резкое увеличение скорости флип-флопа липидов;
4.
Существование легко измеряемого эффективного диаметра
проницаемых структур, который зависит от параметров
электрообработки.
38. Изучение электрического пробоя на БЛМ
Зависимость времени жизни липидных пор от напряженияФЭ
ФХ
Lg t, мкс
6
4
2
ФХ + лизоФХ
0,2
0,4
j (V)
0,6
Точками обозначены данные
эксперимента, сплошные
кривые– теоретические.
Мембраны были
сформированы из разных
фосфолипидов:
ФЭ - фосфатидилэтаноламин;
ФХ - фосфатидилхолин
t - Время жизни пор
j - потенциал на мембране
39. Электрические свойства Бислойной Липидной Мембраны (БЛМ)
Пробой БЛМ при УФ облученииСопротивление БЛМ, ГОм
УФ
БЛМ из яичного
лецитина
БЛМ из липидов
митохондрий
Время инкубации, мин
40. Формирование бислойной липидной мембраны
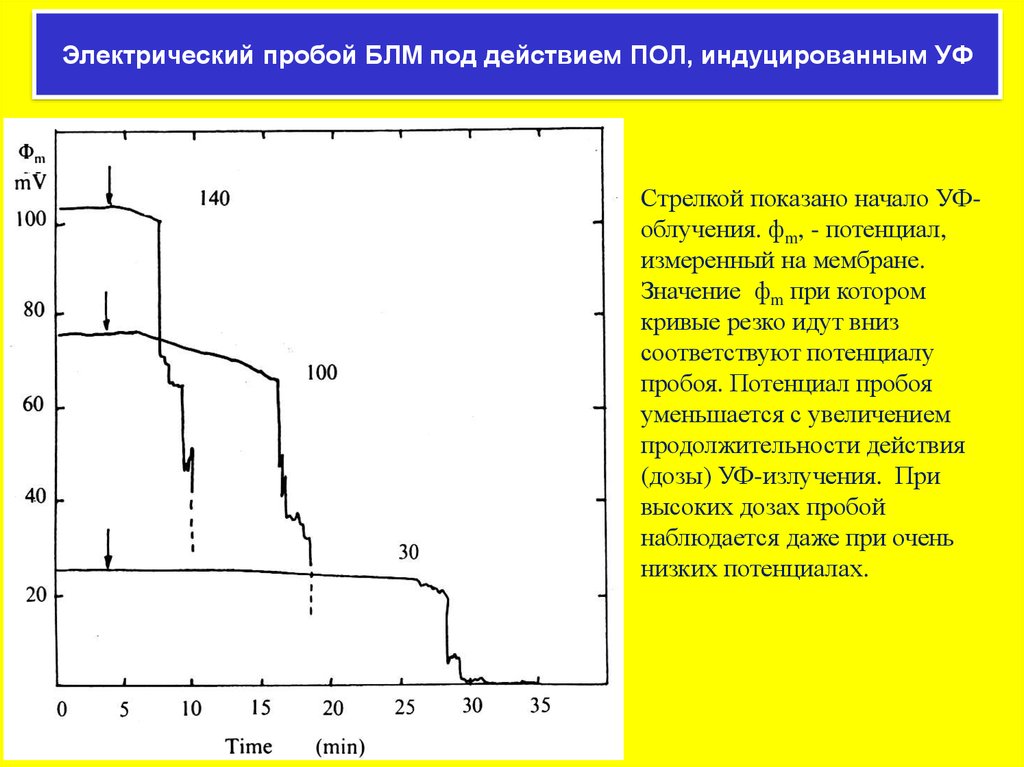
Электрический пробой БЛМ под действием ПОЛ, индуцированным УФСтрелкой показано начало УФоблучения. фm, - потенциал,
измеренный на мембране.
Значение фm при котором
кривые резко идут вниз
соответствуют потенциалу
пробоя. Потенциал пробоя
уменьшается с увеличением
продолжительности действия
(дозы) УФ-излучения. При
высоких дозах пробой
наблюдается даже при очень
низких потенциалах.
41. Вольт-амперные характеристики БЛМ
j (мВ)Самопробой БЛМ протонным диффузионным потенциалом
zF [ H ]2
U (mV )
ln
60 DpH
RT [ H ]1
Потенциал пробоя
DpH = 3.2
120
j (mV)
100
HCl
DpH = 1.2
80
60
40
20
0
1
2
3 4 5 6
Время (мин)
7
8 9
Измерение потенциала, генерируемого мембраной в результате диффузии ионов в присутствии
переносчика протонов ClCCP. Запись изменения потенциала. После добавления ClCCP с одной
стороны мембраны добавляли кислоту для создания разности рН (DpH).
42. Гипотезы о механизмах электрического пробоя
Valj*
2 мин
замыкание
ClCCP
Пробой
j*
30 мВ
замыкание
Пробой
Мембранный потенциал
25 мВ
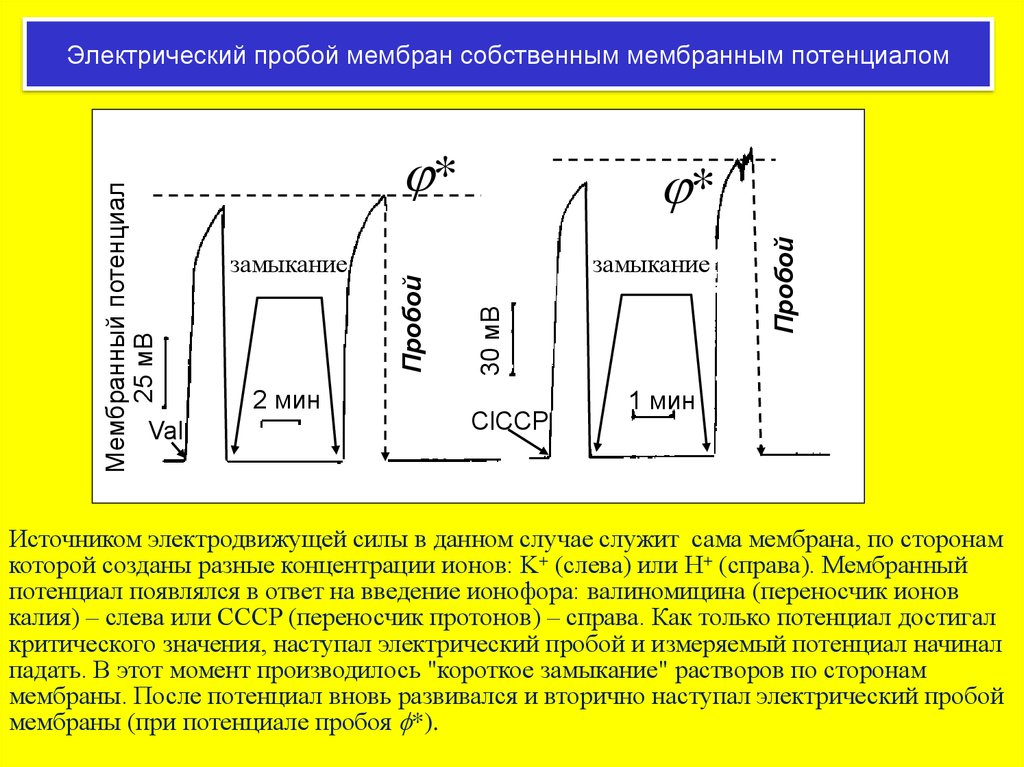
Электрический пробой мембран собственным мембранным потенциалом
1 мин
Источником электродвижущей силы в данном случае служит сама мембрана, по сторонам
которой созданы разные концентрации ионов: K+ (слева) или H+ (справа). Мембранный
потенциал появлялся в ответ на введение ионофора: валиномицина (переносчик ионов
калия) – слева или CCCP (переносчик протонов) – справа. Как только потенциал достигал
критического значения, наступал электрический пробой и измеряемый потенциал начинал
падать. В этот момент производилось "короткое замыкание" растворов по сторонам
мембраны. После потенциал вновь развивался и вторично наступал электрический пробой
мембраны (при потенциале пробоя f*).
43. Факты подтверждающие теорию порообразования
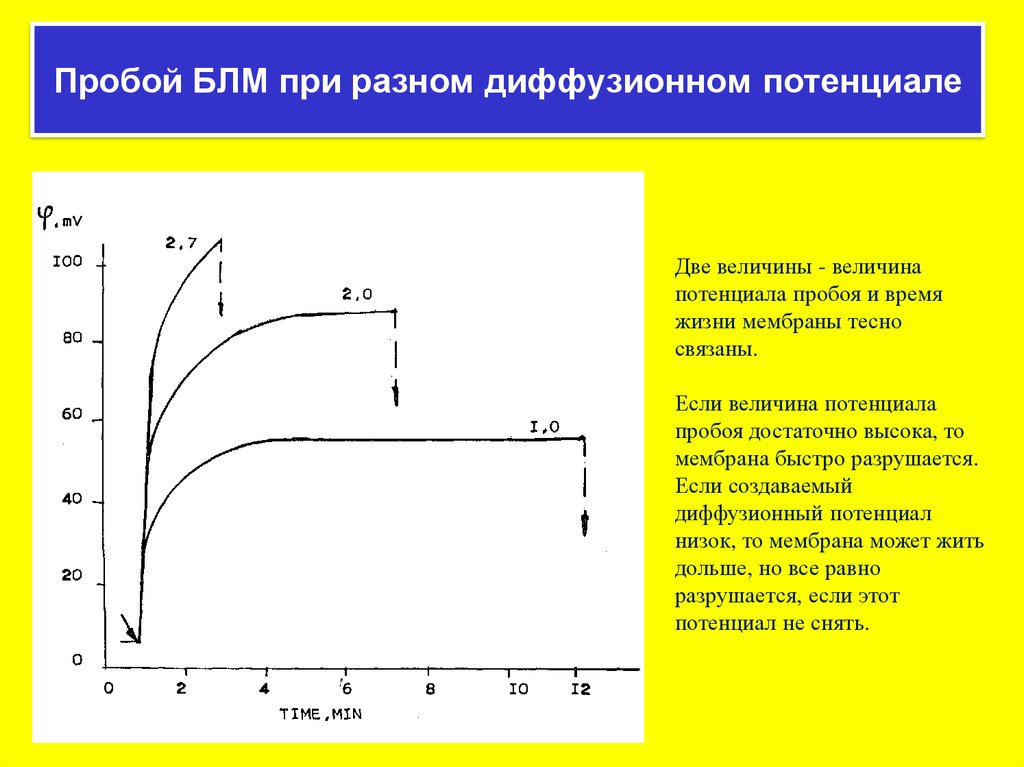
Пробой БЛМ при разном диффузионном потенциалеДве величины - величина
потенциала пробоя и время
жизни мембраны тесно
связаны.
Если величина потенциала
пробоя достаточно высока, то
мембрана быстро разрушается.
Если создаваемый
диффузионный потенциал
низок, то мембрана может жить
дольше, но все равно
разрушается, если этот
потенциал не снять.
44. Зависимость времени жизни липидных пор от напряжения
Изучение электрическогопробоя в липосомах
45. Пробой БЛМ при УФ облучении
Электрический пробой мембран липосомСветопропускание
+KAc
Ac –
DpH H +
+ClCCP
Dj
Время
Пробой
H+
KAc
KAc
Изменения светопропускания суспензии липосом при добавлении ацетата калия (KAc) и протонофора
(ClCCP).
Липосомы (0.2 мг/мл) были получены из яичного лецитина в растворе сахарозы (10 mmol/I).
Добавки ацетата: а - 5 мМ, б - 15 мМ, в - 40 мМ.
Ко всем пробам добавляли валиномицин до концентрации 100 нМ.
В результате вхождения уксусной кислоты и ионов калия внутрь липосомы, на мембране создается
равновесный калиевый потенциал. При определенном потенциале мембрану пробивает, концентрации
ацетата выравниваются и светопропукание суспензии резко подскакивает.
46. Электрический пробой БЛМ под действием ПОЛ, индуцированным УФ
Электрический пробой мембран липосом• Изменение
светопропускания
суспензии липосом при
добавлении протонофора
к липосомам,
нагруженным KAc
(справа) или
помещенным в раствор
сжатие KAc (слева). [KAC] и i
[KAC]o - концентрация
ацетата внутри и снаружи
липосом, соответственно.
Вверху— рассчитанный
мембранный потенциал.
Ордината — изменение
светопропускания
суспензии (DT/T) в ответ
на добавление ионофора.
DT/T (отн. ед.)
Мембранный потенциал
набухание
Lg([Kac]o / [Kac]i
47. Самопробой БЛМ протонным диффузионным потенциалом
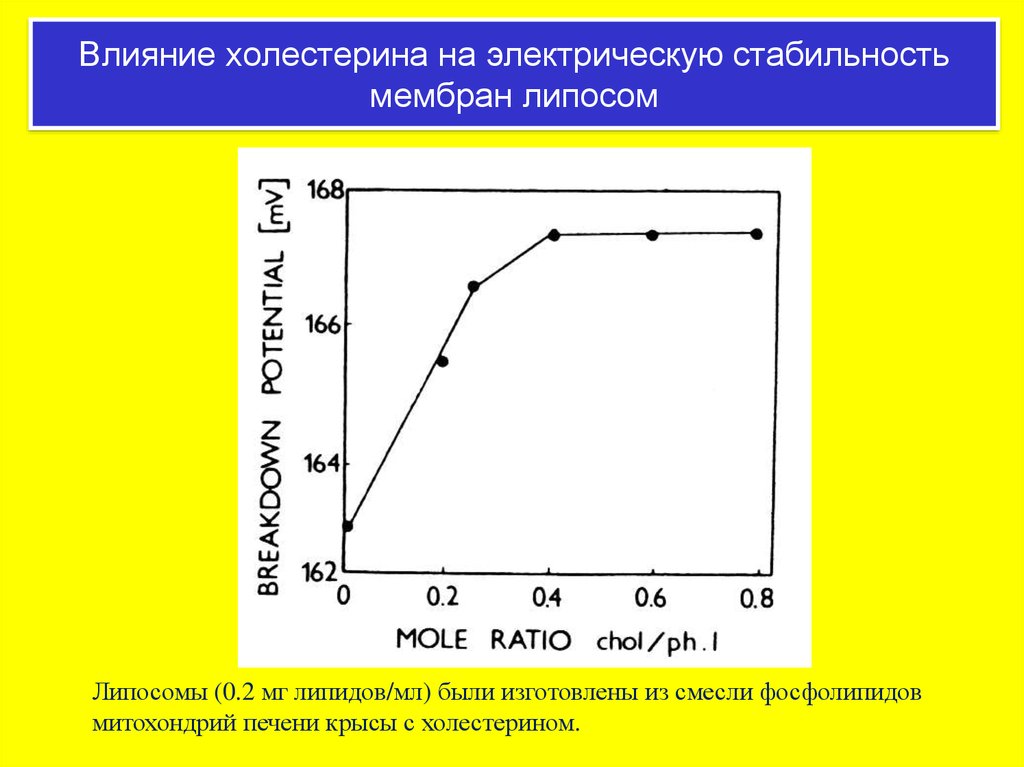
Влияние холестерина на электрическую стабильностьмембран липосом
Липосомы (0.2 мг липидов/мл) были изготовлены из смесли фосфолипидов
митохондрий печени крысы с холестерином.
48. Электрический пробой мембран собственным мембранным потенциалом
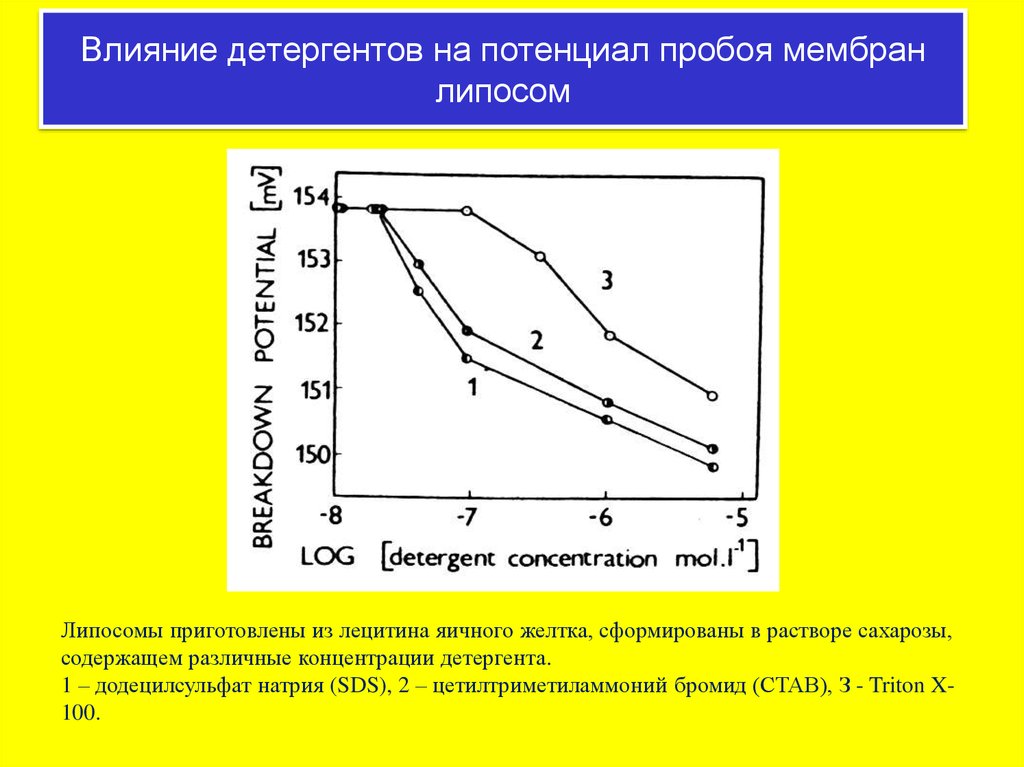
Влияние детергентов на потенциал пробоя мембранлипосом
Липосомы приготовлены из лецитина яичного желтка, сформированы в растворе сахарозы,
содержащем различные концентрации детергента.
1 – додецилсульфат натрия (SDS), 2 – цетилтриметиламмоний бромид (СТАВ), З - Triton X100.
49. Пробой БЛМ при разном диффузионном потенциале
Влияние УФ и продуктов перекисного окисления напотенциал пробоя
Уменьшение электрической
стабильности мембран липосом (из
яичного лецитина) при действии УФоблучения (а) и при добавлении
водорастворимых продуктов
перекисного окисления (WSP) (b). WSP
были выделены из супернатанта при
центрифугировании (100,000 x g)
липосом, предварительно облученных
УФ (250-350 нм).
50. Изучение электрического пробоя в липосомах
Изучение электрическогопробоя мембран митохондрий
51. Электрический пробой мембран липосом
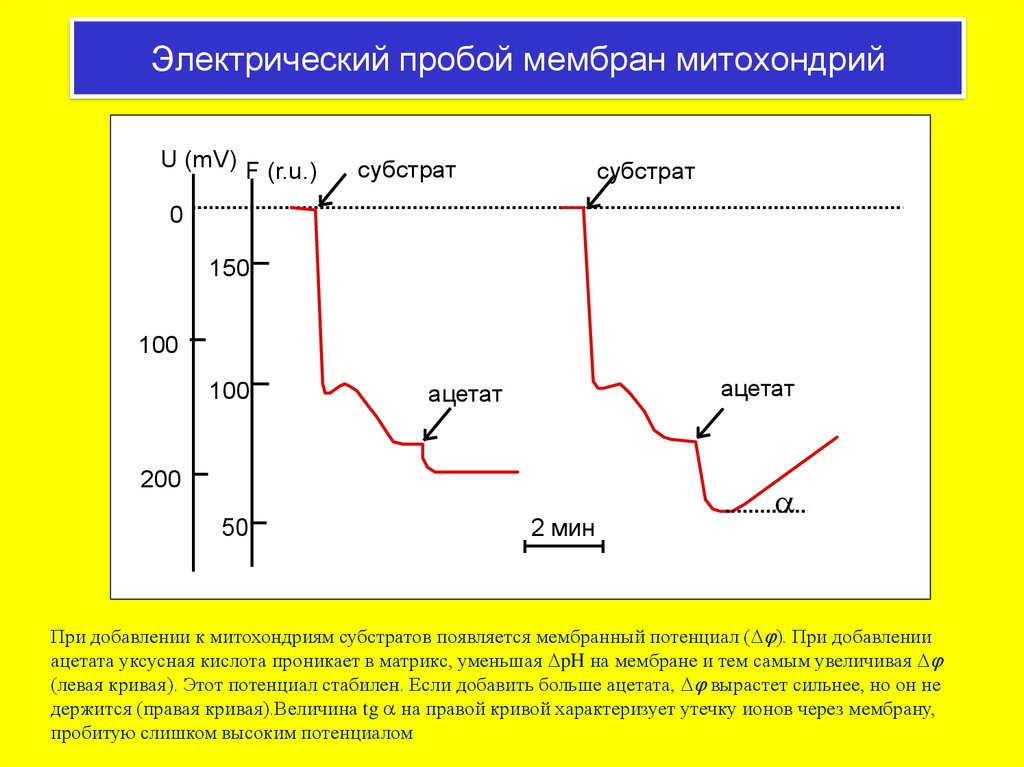
Электрический пробой мембран митохондрийU (mV) F (r.u.)
субстрат
субстрат
0
150
100
100
ацетат
ацетат
200
50
2 мин
a
При добавлении к митохондриям субстратов появляется мембранный потенциал (Dj). При добавлении
ацетата уксусная кислота проникает в матрикс, уменьшая DpH на мембране и тем самым увеличивая Dj
(левая кривая). Этот потенциал стабилен. Если добавить больше ацетата, Dj вырастет сильнее, но он не
держится (правая кривая).Величина tg a на правой кривой характеризует утечку ионов через мембрану,
пробитую слишком высоким потенциалом
52. Электрический пробой мембран липосом
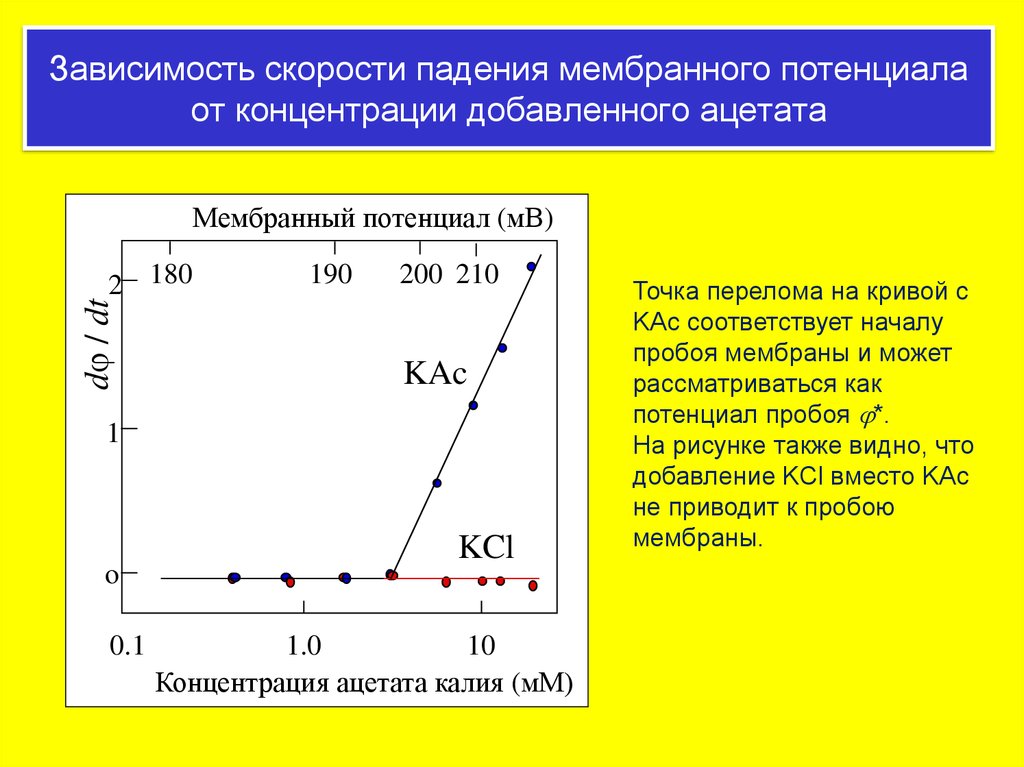
Зависимость скорости падения мембранного потенциалаот концентрации добавленного ацетата
Мембранный потенциал (мВ)
dj / dt
2 180
190
200 210
KAc
1
o
0.1
KCl
1.0
10
Концентрация ацетата калия (мМ)
Точка перелома на кривой с
KAc соответствует началу
пробоя мембраны и может
рассматриваться как
потенциал пробоя j*.
На рисунке также видно, что
добавление KCl вместо KAc
не приводит к пробою
мембраны.
53. Влияние холестерина на электрическую стабильность мембран липосом
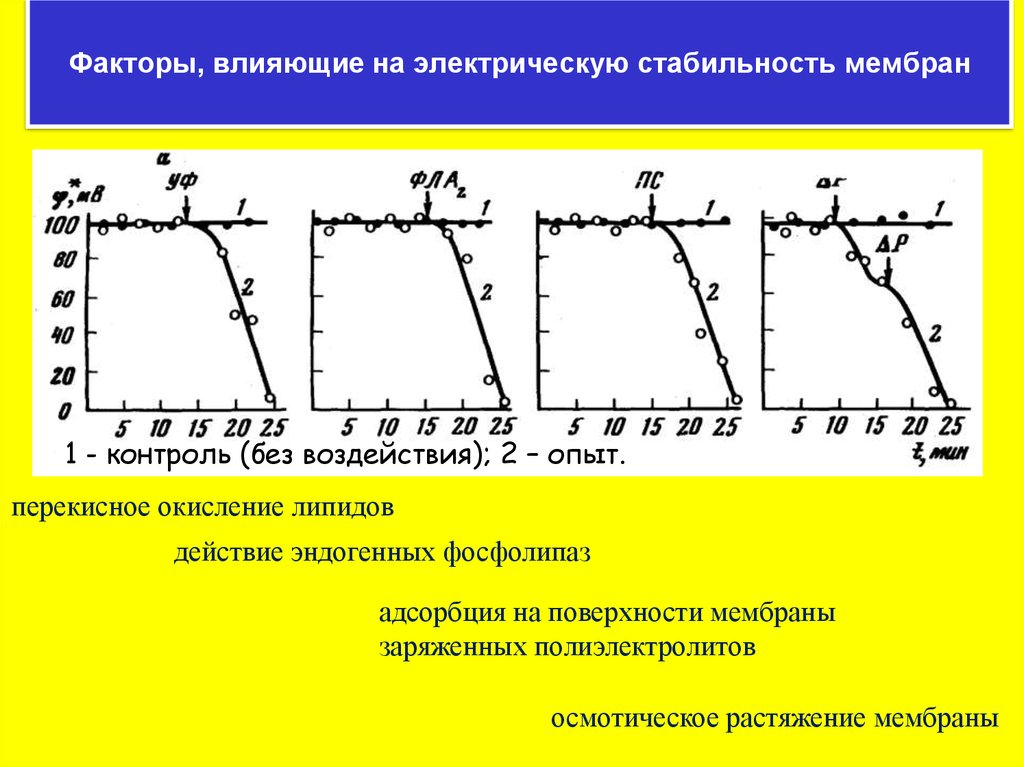
Факторы, влияющие на электрическую стабильность мембран1 - контроль (без воздействия); 2 – опыт.
перекисное окисление липидов
действие эндогенных фосфолипаз
адсорбция на поверхности мембраны
заряженных полиэлектролитов
осмотическое растяжение мембраны
54. Влияние детергентов на потенциал пробоя мембран липосом
Порочный круг в липидном бислое при пероксидацииПерекисное
окисление
липидов
Повреждение
Ca2+-АТФазы
1
Повышение
температуры в
точках пробоя
4
2
Снижение
потенциала
пробоя
Рост Ca2+
в клетке
3
Самопробой
мембраны
Потеря
свойства
барьера
55. Влияние УФ и продуктов перекисного окисления на потенциал пробоя
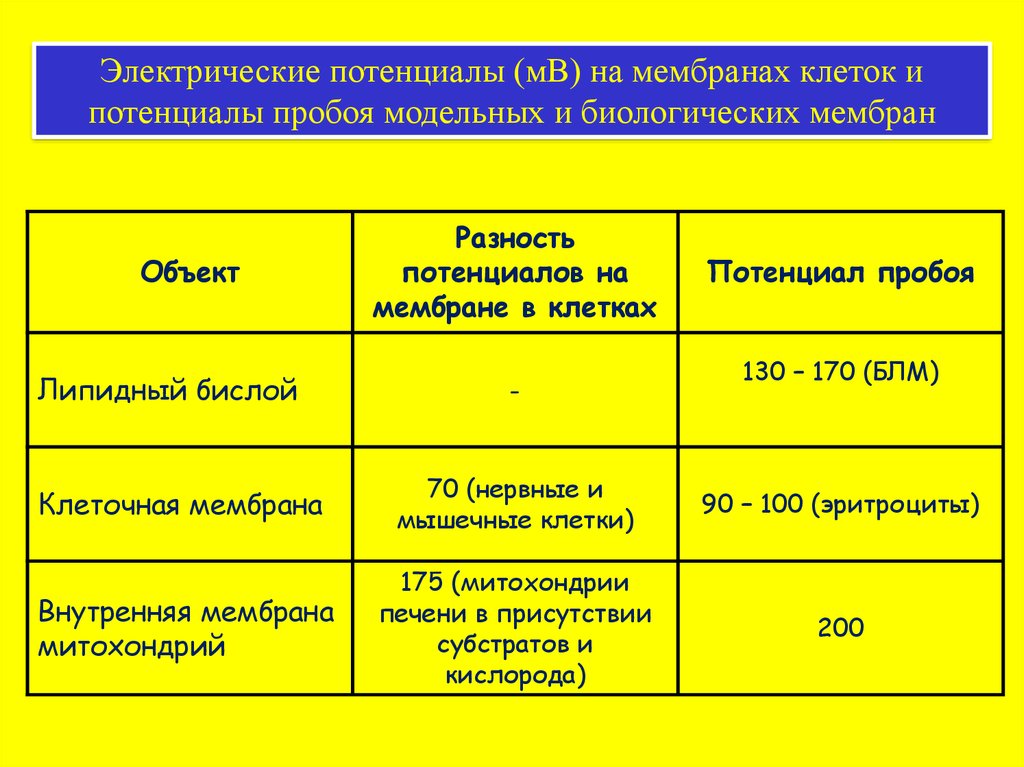
Электрические потенциалы (мВ) на мембранах клеток ипотенциалы пробоя модельных и биологических мембран
Объект
Липидный бислой
Разность
потенциалов на
мембране в клетках
-
Потенциал пробоя
130 – 170 (БЛМ)
Клеточная мембрана
70 (нервные и
мышечные клетки)
90 – 100 (эритроциты)
Внутренняя мембрана
митохондрий
175 (митохондрии
печени в присутствии
субстратов и
кислорода)
200
56. Изучение электрического пробоя мембран митохондрий
Применение явления электрического пробояЗагрузка клеток лекарственными препаратами
Электрослияние клеток
Генная трансформация клеток
Стерилизация
Электростимуляция
57. Электрический пробой мембран митохондрий
Модель слияния плазматических мембран вместе контакта спермия с яйцеклеткой
спермий
яйцо
мицеллы
спермий
яйцо
58. Зависимость скорости падения мембранного потенциала от концентрации добавленного ацетата
Влияние различных веществ и факторов на состояние мембраны1. Физические факторы
Величина приложенного потенциала
Температура
Высокочастотное электромагнитное поле
Гидростатическое давление
УФ облучение и перекисное окисление липидов
2. Качественный состав мембраны
Фосфатидная кислота
Лецитин
Ганглиозиды
Длина жирнокислотного остатка жирной кислоты
3. Химические соединения
Глицерин
Голотурин
Полимиксин

































 Химия
Химия








