Похожие презентации:
Йодиметрия и йодометрия. (Лекция 9)
1.
Йодиметрияи
йодометрия
2. План
1. Сущность йодиметрии и йодометрии.2. Возможности метода.
3. Условия проведения йодиметрических и
йодометрических определений.
4. Титранты.
5. Применение йодиметрии в анализе.
6. Применение метода йодометрии для
определения окислителей.
3. В основе методов йодиметрии и йодометрии лежат полуреакции:
I3- + 2ē ⇆ 3 I3 I- - 2ē ⇆ I3или:I2 + 2ē ⇆ 2 I2 I- - 2ē ⇆ I2
4.
RВозможности метода:
восстановители, стандартный потенциал которых
меньше 0,54 В (оксид мышьяка(III), натрия тиосульфат,
гидразина сульфат и т.д.) прямым титрованием. Такие
восстановители, как формальдегид, натрия сульфит,
натрия сульфид определяют обратным титрованием;
окислители, стандартный потенциал которых больше
0,54 В (пероксид водорода, калия дихромат, натрия
арсенат и т.д.), заместительным титрованием;
ароматические и гетероциклические соединения, с
которыми йод вступает в реакции замещения (антипирин),
а также ненасыщенные органические соединения по
реакциям присоединения.
5. Условия проведения йодиметрических и йодометрических определений
Определение следует проводить на холоду, т.к. йод и егорастворы летучи. Кроме того, при повышении температуры
понижается чувствительность крахмала как индикатора.
Определение нельзя проводить при рН более 9, так как при
рН>9 протекает реакция диспропорционирования йода:
I2 + 2 OH- ⇆ IO- + I- + H2O
В сильнокислой среде протекает реакция окисления йодидионов кислородом воздуха:
4 I- + 4 H+ + O2 ⇆2 I2 + 2 H2O
6.
Тиосульфат-ионы реагируют с оксидом углерода(IV):S2O32- + CO2 + H2O ⇆ S + HSO3- + HCO3при этом концентрация раствора увеличивается.
Тиосульфат-ионы окисляются кислородом воздуха:
2 S2O32- + O2 2 SO42- + 2 S
при этом концентрация раствора уменьшается.
7.
Стандартизация раствора натрия тиосульфата по калия дихромату1
Cr2O72- + 14 H+ + 6ē ⇆ 2 Cr3+ + 7 H2O
3
2 I- - 2ē ⇆ I2
Cr2O72- + 6 I- + 14 H+ ⇆ 2 Cr3+ + 3 I2 + 7 H2O
1 I2 + 2ē ⇆ 2 I1 2 S2O32- - 2ē ⇆ S4O62I2 + 2 S2O32- ⇆ 2 I- + S4O62-
8.
Определение оксида мышьяка(III)As2O3 + 6 OH- ⇆ 2 AsO33- + 3 H2O
AsO33- + 2 H+⇆ AsO2- + H2O
1 AsO2- + 2 H2O – 2ē ⇆ HAsO42- + 3 H+
1 I2 + 2ē ⇆ 2 IAsO2- + I2 + 2 H2O ⇆ HAsO42- + 2 I- + 3 H+
fэ(As2O3 ) = ¼
9.
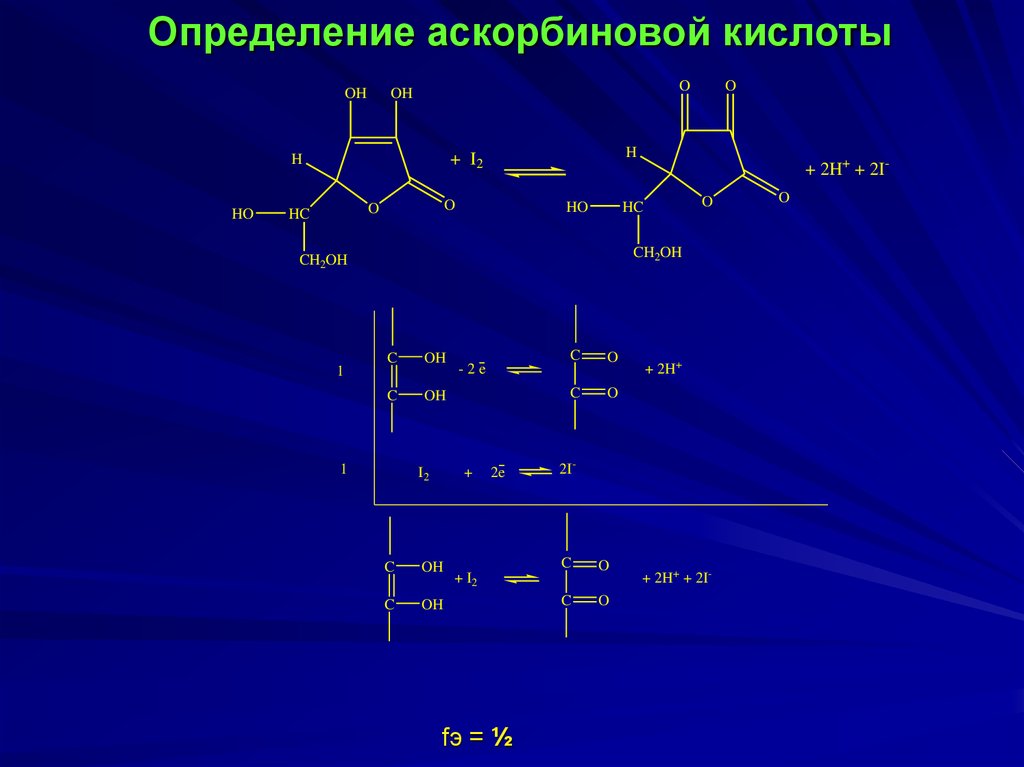
Определение аскорбиновой кислотыOH
O
OH
HO
H
+ I2
H
O
O
HC
HO
+ 2H+ + 2IO
HC
CH2OH
CH2OH
1
O
C
OH
C
OH
1
I2
+
C
OH
C
OH
C
O
C
O
-2e
2e
2I-
C
O
C
O
+ I2
fэ = ½
+ 2H+
+ 2H+ + 2I-
O
10.
Определение пероксида водорода1 H2O2 + 2 H+ + 2ē ⇆ 2 H2O
1 2 I- - 2ē ⇆ I2
H2O2 + 2 I- + 2 H+ ⇆ I2 + 2 H2O
I2 + 2 S2O32- ⇆ 2 I- + S4O62fэ = ½










 Химия
Химия








