Похожие презентации:
Иодометрия. Перманганатометрия. Трилонометрия
1.
Кафедра общей и медицинской химииЛекция
«Иодометрия.
Перманганатометрия.
Трилонометрия»
1
2.
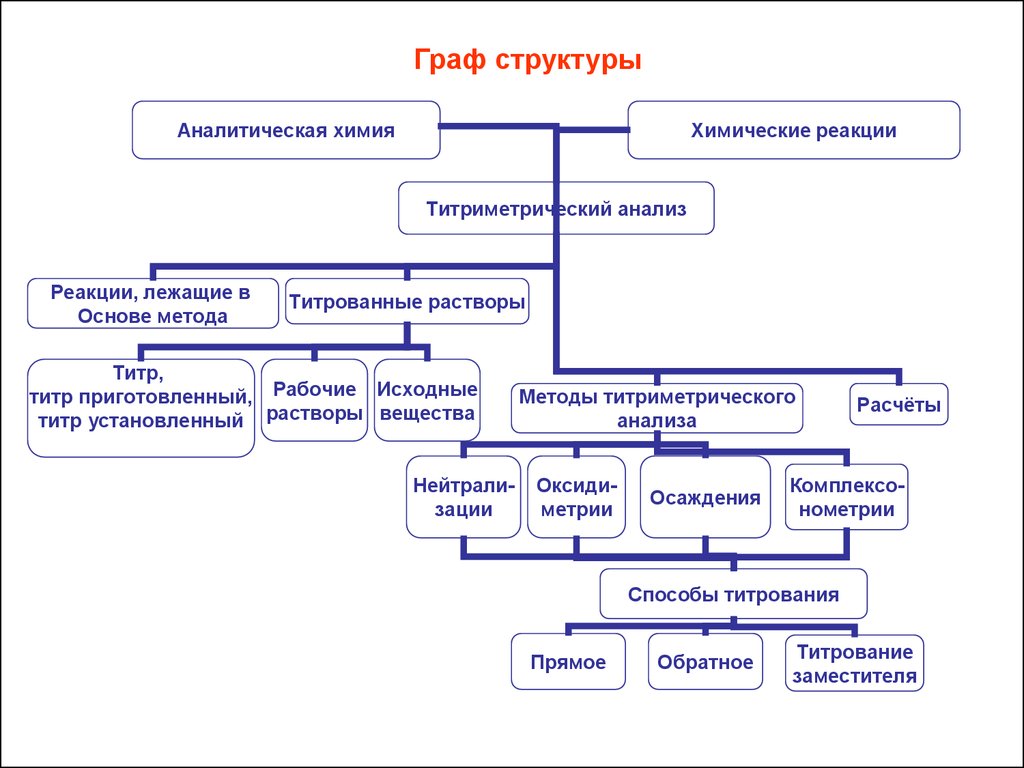
Граф структурыАналитическая химия
Химические реакции
Титриметрический анализ
Реакции, лежащие в
Основе метода
Титрованные растворы
Титр,
титр приготовленный, Рабочие Исходные
титр установленный растворы вещества
Нейтрализации
Методы титриметрического
анализа
Оксидиметрии
Осаждения
Расчёты
Комплексонометрии
Способы титрования
Прямое
Обратное
Титрование
заместителя
3.
Окислительно-восстановительное титрованиеОкислитель – молекула, атом
или ион, принимающий электроны,
при этом степень окисления
его уменьшается.
Восстановитель – молекула,
атом или ион, отдающий
электроны, при этом степень
окисления его растет.
4.
Уравнение Нернста.RT [Ox]
е е
ln
nF [Red]
о
Вальтер Нернст
(25.06.1864 –
18.11.1941)
0,059 [Ox]
е е
lg
n
[Red]
о
В 1888-1889 гг. Нернст изучал поведение
электролитов при пропускании электрического
тока и открыл фундаментальный закон,
известный как уравнение Нернста.
Закон устанавливает зависимость между
электродвижущей силой (разностью потенциалов)
и концентрацией ионов и позволяет предсказать
максимальный потенциал, который может быть
получен в результате электрохимического
взаимодействия.
Нобелевская премия по химии (1920)
«в признание его работ по термодинамике».
5.
Окислительно-восстановительные потенциалыЭлектродные потенциалы в водных растворах при 25оС и при
парциальном давлении газов, равном нормальному
атмосферному давлению.
Электродный процесс
Li+ + ē = Li
Na+ + ē = Na
Уравнение электродного потенциала
φ = – 3,045 + 0,059 lg [Li+]
φ = – 2,714 + 0,059 lg [Na+]
Mg2+ + 2ē = Mg
φ = – 2,363 + 0,030 lg [Mg2+]
Zn2+ + 2ē = Zn
2H+ + 2ē = H2
I2 (к) + 2ē = 2I–
φ = – 0,763 + 0,030 lg [Zn2+]
φ = – 0,059 pH
φ = 0,536 – 0,059 lg [I–]
Fe
3+
+ ē = Fe
2+
Ag+ + ē = Ag
MnO4– + 8H+ + 5ē = Mn2+ +
4H2O
F2 + 2ē = 2F–
[Fe3 ]
φ = 0,771 + 0,059 lg
[Fe2 ]
φ = 0,799 + 0,059 lg [Ag+]
0,059 [MnO 4 ]·[H ]8
φ = 1,51 +
·lg
5
[Mn 2 ]
φ = 2,87 – 0,059 lg [F–]
6.
Направление окислительно – восстановительных реакцийПользуясь значениями ео, можно прогнозировать
возможность протекания и направление окислительновосстановительной реакции.
Из пары с большим е0 берем окислитель.
Из пары с меньшим е0– берем восстановитель.
Оставшиеся вещества есть продукты реакции.
F2 + 2e → 2F-
е0 = 2.87 В
I2 +2e →
е0 = 0.54 В
2I-
F2 + 2I- = I2 + 2FF2 + 2KI = I2 + 2KF
7.
ИодометрияВ качестве рабочих растворов используют растворы I2
и тиосульфата натрия - Na2S2O3 . Вспомогательный - раствор KI.
I2 +2e →
S4O62- +2e →
2I2S2O32-
φ0 = 0.54 В
φ0 = 0.17 В
I2 + S4O62- → 2S2O32- + 2II2 +2Na2S2O3 → Na2 S4O6 + 2NaI
I2 +2Na2S2O3 → Na2 S4O6 + 2NaI
Значение стандартного окислительного потенциала системы
I2/2I- находится между сильными восстановителями и сильными
окислителями, что позволяет использовать метод иодометрии
для определения как восстановителей, так и окислителей.
Меняется только способ титрования.
8.
Окислительно-восстановительные потенциалыЭлектродные потенциалы в водных растворах при 25оС и при
парциальном давлении газов, равном нормальному
атмосферному давлению.
Электродный процесс
Li+ + ē = Li
Na+ + ē = Na
Уравнение электродного потенциала
φ = – 3,045 + 0,059 lg [Li+]
φ = – 2,714 + 0,059 lg [Na+]
Mg2+ + 2ē = Mg
φ = – 2,363 + 0,030 lg [Mg2+]
Zn2+ + 2ē = Zn
2H+ + 2ē = H2
I2 (к) + 2ē = 2I–
φ = – 0,763 + 0,030 lg [Zn2+]
φ = – 0,059 pH
φ = 0,536 – 0,059 lg [I–]
Fe
3+
+ ē = Fe
2+
Ag+ + ē = Ag
MnO4– + 8H+ + 5ē = Mn2+ +
4H2O
F2 + 2ē = 2F–
[Fe3 ]
φ = 0,771 + 0,059 lg
[Fe2 ]
φ = 0,799 + 0,059 lg [Ag+]
0,059 [MnO 4 ]·[H ]8
φ = 1,51 +
·lg
5
[Mn 2 ]
φ = 2,87 – 0,059 lg [F–]
9.
Растворы тиосульфата обычно готовят изкристаллического Na2S2О3∙5Н2О, который
при хранении постепенно теряет часть
кристаллизационной воды.
Важнейшими факторами, определяющими
устойчивость раствора тиосульфата,
являются:
-значение рН
-присутствие микроорганизмов и примесей
-концентрация раствора
-присутствие атмосферного кислорода
-воздействие прямого солнечного света.
10.
Приготовление и стандартизация раствора иода.Кристаллический иод мало растворим в воде (0,00133 моль/л),
но его растворимость существенно повышается в водном
растворе иодида калия вследствие образования трииодит-иона
(I3-):
I2 + I- = I3-
Трииодид-ион и молекулярный иод в окислительновосстановительных реакциях выступают как реагенты
практически равной окислительной способности . Растворы I2 в
KI обычно называют для простоты растворами иода.
11.
Вкачестве
индикатора
в
иодометрии используется раствор
крахмала в воде, который с I2 дает
интенсивно синюю окраску.
В зависимости от титранта
окраска в точке эквивалентности
может появляться или исчезать.
I2 +2Na2S2O3 → Na2 S4O6 + 2NaI
При титровании раствора тиосульфата натрия раствором I2 в
точке эквивалентности появляется интенсивно синяя окраска.
12.
При титровании раствора йода раствором тиосульфатасиняя окраска исчезает.
Для исключения потерь I2 за счет адсорбции крахмал
добавляют перед концом
титрования, когда раствор
приобретает соломенно-желтую окраску. Раствор окрашивается
в темно-синий цвет.
Продолжают титрование, добавляя по одной капле тиосульфата.
В точке эквивалентности раствор обесцвечивается.
I2 +2Na2S2O3 → Na2 S4O6 + 2NaI
13.
Приборы для определенияйода в иодидах металлов.
14.
Прямое титрованиеиспользуется для определения активных восстановителей.
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
К определенному объему тиосульфата натрия добавляем
раствор йода (в присутствии крахмала), в точке
эквивалентности появится синяя окраска.
VJ 2 · N J 2 VNa 2S2O3 · N Na 2S2O3
VJ 2
(средний)
· 0,01 10 · N Na 2S2O3
N Na 2S2O3
VJ 2
(средний)
10
· 0,01
15.
Растворами иода можно непосредственно титровать соединенияAs(III), Sb(III), Sn(II), сульфиты, сульфиды, тиосульфаты,
сероводород и некоторые другие восстановители.
Иодометрическое титрование арсенита протекает по уравнению:
AsO2- + I2 + 2Н2О → НAsO42- + 2I- + 3H+.
Ацетон в щелочном растворе под действием I2 образует иодоформ
СН3СОСН3 + 3I2 + 4ОН- → СНI3 + СН3СОО- + 3I- + 3Н2О.
Тиомочевину можно титровать в кислом растворе, однако более
хорошие результаты дает окисление в щелочной среде
СS(NН2)2 + 4I2 + 10ОН- → СО(NН2)2 + SО42- + 8I- + 5Н2О.
Определение заканчивается обратным титрованием иода в
кислом растворе
16.
Метод заместителяИодометрическое определение окислителей основано на окислении
иодид-иона и тировании выделившегося иода тиосульфата натрия.
(например, определение активного хлора в белильной извести).
CaOCl2 + 2HCl = CaCl2 + Н2О + Cl2
Cl2 + KI = 2KCl + I2
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
К определенному объему окислителя, добавляем произвольный
избыток KI. Выделяется I2 в количестве эквивалентном окислителю.
Выделившийся I2 титруем раствором Na2S2O3 до исчезновения синей
окраски.
CaOCl2 Cl2 J 2
Na 2S2O3
17.
Одной из наиболее важных реакций этого типа являетсяреакция иодида с дихроматом
Сr2О72- + 6I- + 14Н+ → 2Сr3+ + 3I2 + 7Н2О.
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Эти реакции используется для определения хрома в сталях и
других материалах с предварительным окислением Сr3+ до Сr(VI).
Одним из практически важных применений реакции является
использование ее для иодометрического определения катионов,
образующих малорастворимые хроматы (барий, свинец и др.). В
этом методе анализируемый катион осаждают в виде хромата,
который затем растворяют в кислоте:
2ВаСrО4 + 2Н+ → 2Ва2+ + Сr2О72- + Н2О
Дихромат в растворе определяют иодометрически по приведенной
выше реакции.I
18.
Определение железаИоны Fе3+ окисляют I- в кислом растворе:
2Fе3+ + 2I- = 2Fe2+ + I2
Выделившийся I2 оттитровывают
тиосульфатом натрия:
I2 +2Na2S2O3 → Na2S4O6 + 2NaI
19.
Определение витамина С в чёрной смородинеОтмеряем 20 мл отжатого сока чёрной смородины и разбавляем
его водой до объёма 100 мл;
Добавляем 1 мл крахмального клейстера;
Добавляем по каплям 5 % р-ра йода до появления устойчивого
синего окрашивания, не исчезающего в течении 10-15 сек.
20.
Обратное титрование( используется для определения
малоактивных и летучих восстановителей).
I2 + Na2S = 2NaI + S0↓
К определенному объему Na2S добавляем фиксированный
избыток йода. Часть йода вступает в реакцию, оставшийся
йод определяем титрованием Na2S2O3.
Na 2S J 2 2NaJ S
J 2 (ост.) Na 2S2O3 Na 2S4 O6 2NaJ
21.
ПерманганатометрияМетод химического титриметрического анализа, основанный на
применении растворов перманганата калия (KMnO4) для количественных
объемных определений.
Преимущество перманганатометрии заключается в том, что для нее
отпадает необходимость в применении специального индикатора при
установлении точки эквивалентности, так как раствор KMnO4 имеет
характерный фиолетово-красный цвет.
22.
Исходные вещества:H2C2O4, Na2C2O4
2KMnO4 + 5Na2С2O4 + 8H2SO4→2MnSO4 + K2SO4 + 5Na2SO4 +10CO2↑ + 8H2O
В большинстве случаев титрование восстановителей (например, Fe(II) и
Mn(II), Mo(III) и Ti(III), -C2O42-, AsO2-, NO2- , H2O2 ) стандартным раствором
KMnO4 проводится в кислой среде;
Окислительно-восстановительная реакция протекает тогда по схеме:
MnO4- + 8H+ + 5е ↔ Mn2+ + 4H2O
23.
Некоторые вещества (например, сульфиты, сульфиды,тиосульфаты, гидразин) окисляются легче в нейтральной или
щелочной среде; в этом случае реакция идет по схеме:
MnO4- + 4H+ + 3e = MnO2↓ + 2H2O
24.
Рабочим раствором в этом методе являетсяраствор KMnO4.
Например, нужно приготовить 1 л 0,1н. раствора KMnO4.
В 1 л такого раствора должно содержаться 0,1 моль эквивалентов KMnO4, что соответствует 3,1610 г KMnO4.
Учитывая, что в сухом KMnO4 всегда есть примеси, на
технических весах берут навеску чуть больше
рассчитанной, например 3,3 г.
Кристаллы KMnO4 растворяются в воде довольно
медленно, поэтому часть воды нагревают, горячей водой
обрабатывают навеску перманганата калия при
тщательном перемешивании в стакане или колбе.
Поскольку перманганат калия окисляет
резиновые и корковые пробки, бумагу,
нельзя допускать соприкосновения
раствора с ними.
25.
Хранить раствор KMnO4 следует в склянкеиз темного стекла либо в темном месте.
Охлажденный приготовленный раствор сливают в темную
посуду емкостью 1 л и туда же добавляют оставшуюся воду
из мерного цилиндра, все тщательно перемешивают,
закрывают плотно стеклянной пробкой и оставляют
в темном месте на 7-10 дней.
26.
Затем раствор фильтруют и устанавливают точнуюконцентрацию, используя исходные вещества:
H2C2O4, Na2C2O4
27.
ПрименениеДля определения концентраций:
а) перекиси водорода Н2О2 (пергидроль) –
методом прямого титрования
2KMnO4 + 5H2O2 + 3H2SO4 →2MnSO4 + 5O2↑ + K2SO4 + 8H2O
28.
б) Ионов Fe(II), Cr(III), TI(I), W(V), V(IV), Sb(III),гидразина, других органических восстановителей
методом прямого титрования
в) Окислителей - дихроматов, персульфатов, ванадатов, MnO2, PbO2,
Pb3O4 и др. Их предварительно восстанавливают с помощью Fe(II),
избыток которого оттитровывают раствором KMnO4
методом обратного титрования
29.
г) Восстановителей, медленно реагирующих с KMnO4 (иодиды,цианиды, тиоцианаты), а также летучих, например НСООН, Н2S
методом обратного титрования
Суть метода обратного титрования:
К определенному объему восстановителя добавляют
фиксированный избыток КMnO4. Часть перманганата вступает в
реакцию.
НСООК + 2КMnO4 + 3КOH → К2CO3 + 2К2MnO4 + 2Н2O
оставшийся КMnO4 оттитровывают раствором щавелевой кислоты.
2КMnO4 + 5Н2C2O4 + 3H2SO4 → 2MnSO4 + К2SO4+ 10CO2↑ + 8H2O
30.
В медицине:а) для контроля качества пероксидов водорода,
лактата и глюконата кальция, нитрита натрия,
левомицетина, фумарата железа.
31.
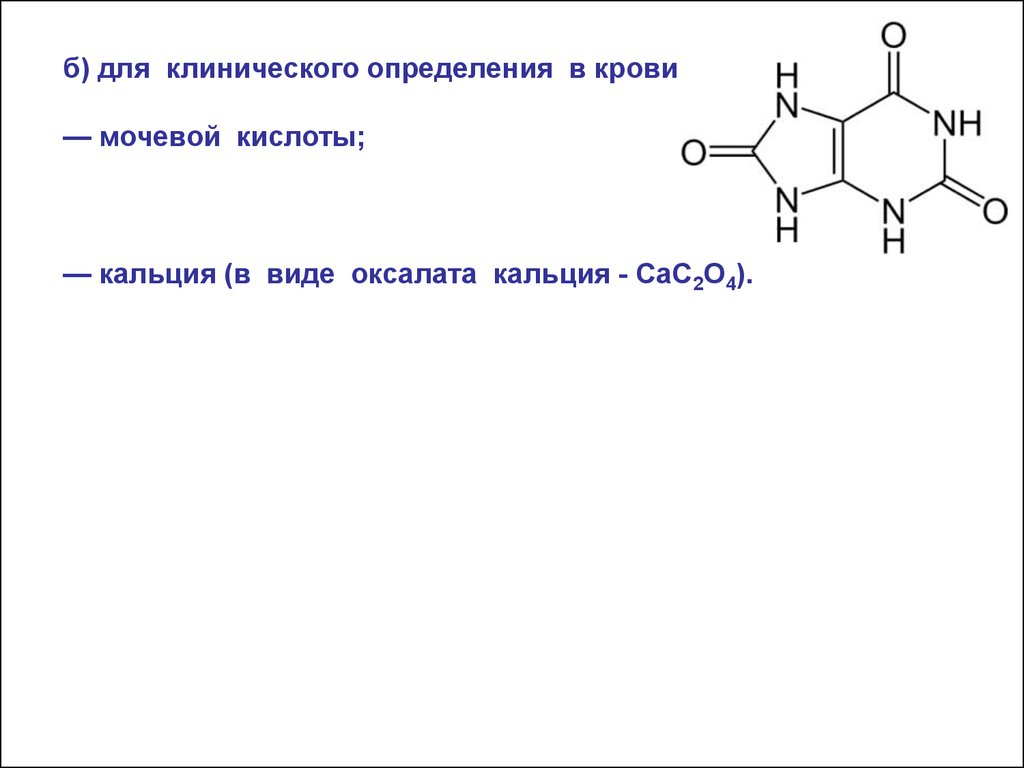
б) для клинического определения в крови:— мочевой кислоты;
— кальция (в виде оксалата кальция - CaC2O4).
32.
КомплексонометрияТрилонометрия
Комплексоны (хелаты) - полидентатные лиганды – органические
соединения, образующие комплексные соединения с ионами
металлов.
Происхождение термина хелат от греческого «клешня краба».
33. Комплексонометрическое титрование:
Метод основан на образовании хорошо растворимых в воде ислабо диссоциированных комплексных соединений при
реакции большинства катионов с аминополикарбоновыми
кислотами
Исходными веществами являются растворы MgCI2, MgO,
ZnO, CaCO3
Рабочими растворами являются растворы аминополикарбоновых
кислот, титр которых устанавливается по исходному веществу.
34.
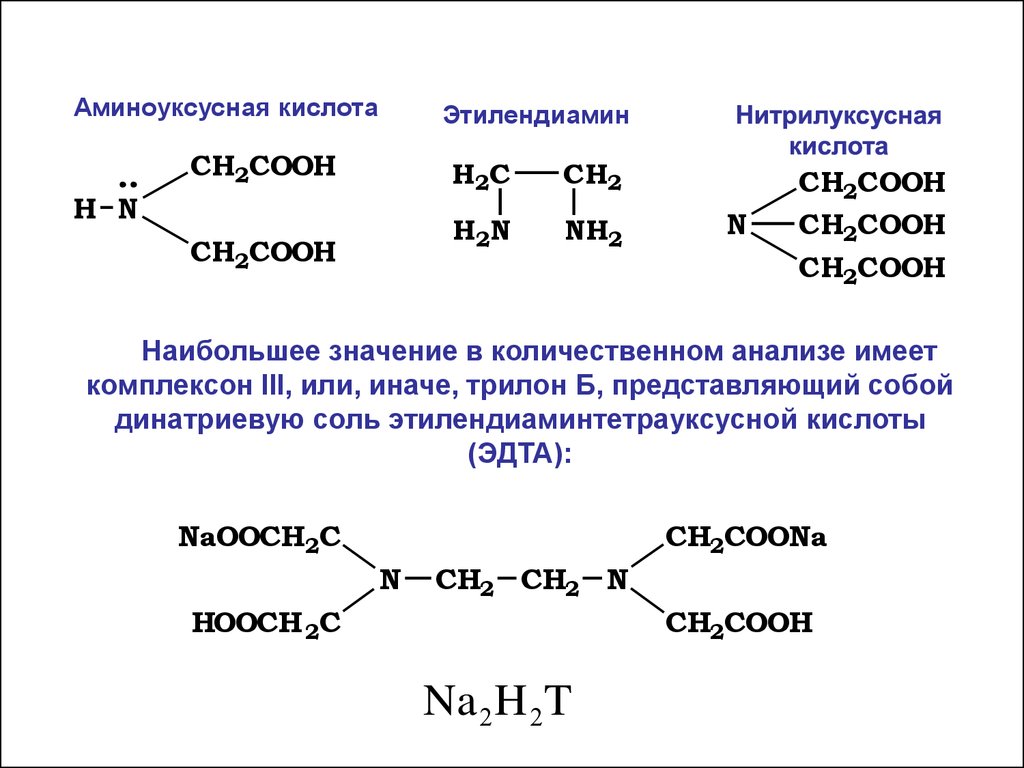
Аминоуксусная кислотаЭтилендиамин
CH2COOH
H N
CH2COOH
H2C
CH2
H2N
NH2
CH2COOH
N
CH2COOH
CH2COOH
Наибольшее значение в количественном анализе имеет
комплексон III, или, иначе, трилон Б, представляющий собой
динатриевую соль этилендиаминтетрауксусной кислоты
(ЭДТА):
NaOOCH2C
CH2COONa
N
CH2 CH2 N
HOOCH 2C
CH2COOH
Na 2 H 2T
35.
NaOOCH2CCH2COONa
N
CH2 CH2 N
HOOCH 2C
CH2COOH
O
CH2
C
2-
O
O
N
O
C
CH2
Ca
CH2
C
O
O
CH2
N
O
CH2
C
CH2
O
Состав комплекса Ме-Трилон «Б» всегда 1:1!!! И все они бесцветны!
36.
Чем выше заряд иона Мех+, тем образующийся комплекс прочнее!Na 2 H 2T 2Na H 2T 2
H 2T 2 Ca 2 CaT2 2H
H 2T 2 Al3 AlT 2H
H 2T 2 Ce4 CeT 2H
По возрастающей степени устойчивости комплекса металл-ЭДТА
двухвалентные металлы располагаются в таком порядке:
Sr, Mg, Ca, Fe, Mn, Co, Zn, Cd, Pb, Cu, Hg, Ni.
37.
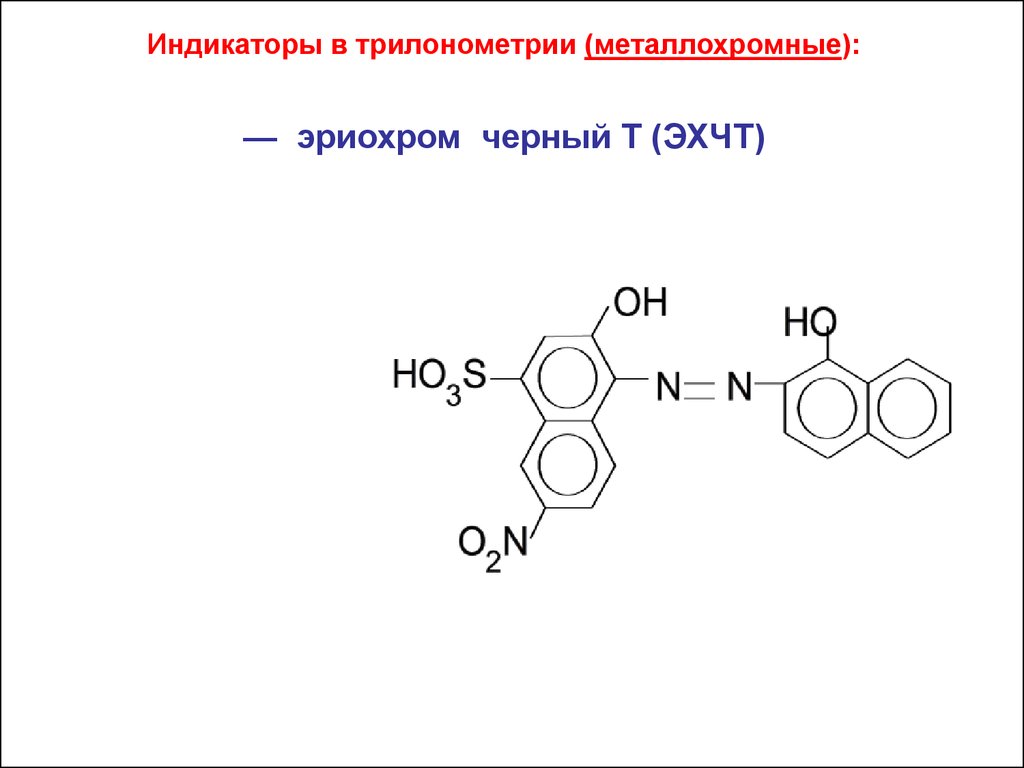
Индикаторы в трилонометрии (металлохромные):— эриохром черный Т (ЭХЧТ)
38.
— эриохромтемно-синий
39.
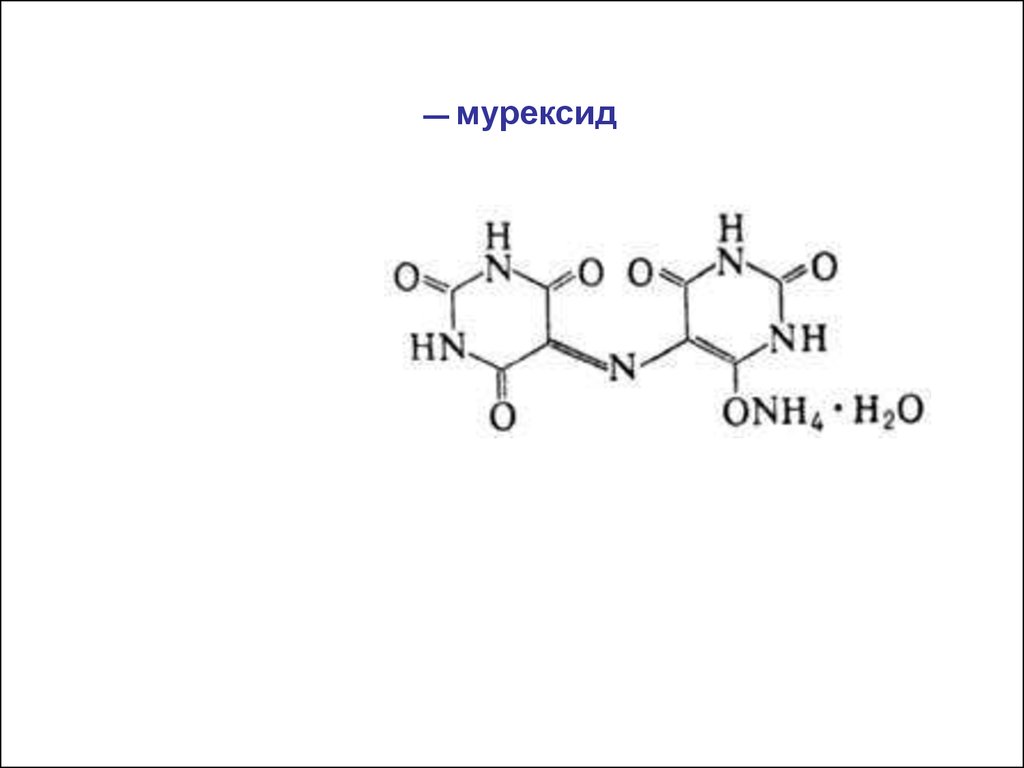
— мурексид40.
— пирокатехиновыйфиолетовый
41.
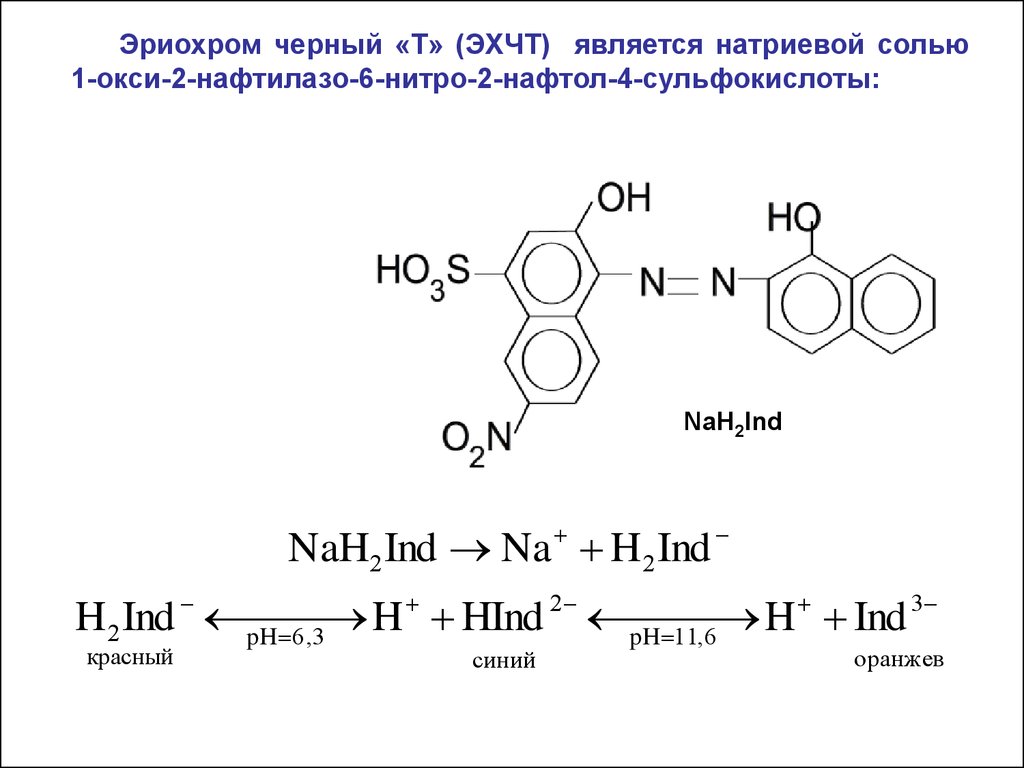
Эриохром черный «Т» (ЭХЧТ) является натриевой солью1-окси-2-нафтилазо-6-нитро-2-нафтол-4-сульфокислоты:
NaH2Ind
NaH2 Ind Na H 2 Ind
2
3
H 2 Ind
H
HInd
H
Ind
pH 6 , 3
pH 11, 6
красный
синий
оранжев
42.
Титрование проводится в «идеальном» аммиачном буферес рН=9,25, в котором индикатор имеет синюю окраску.
Индикатор также образует с ионами металлов комплексы 1:1,
но менее прочные, чем с трилоном «Б».
Комплексы металл-индикатор – винно-красного цвета!
HInd 2 Ca 2 CaInd H
винно красный
цвет
43.
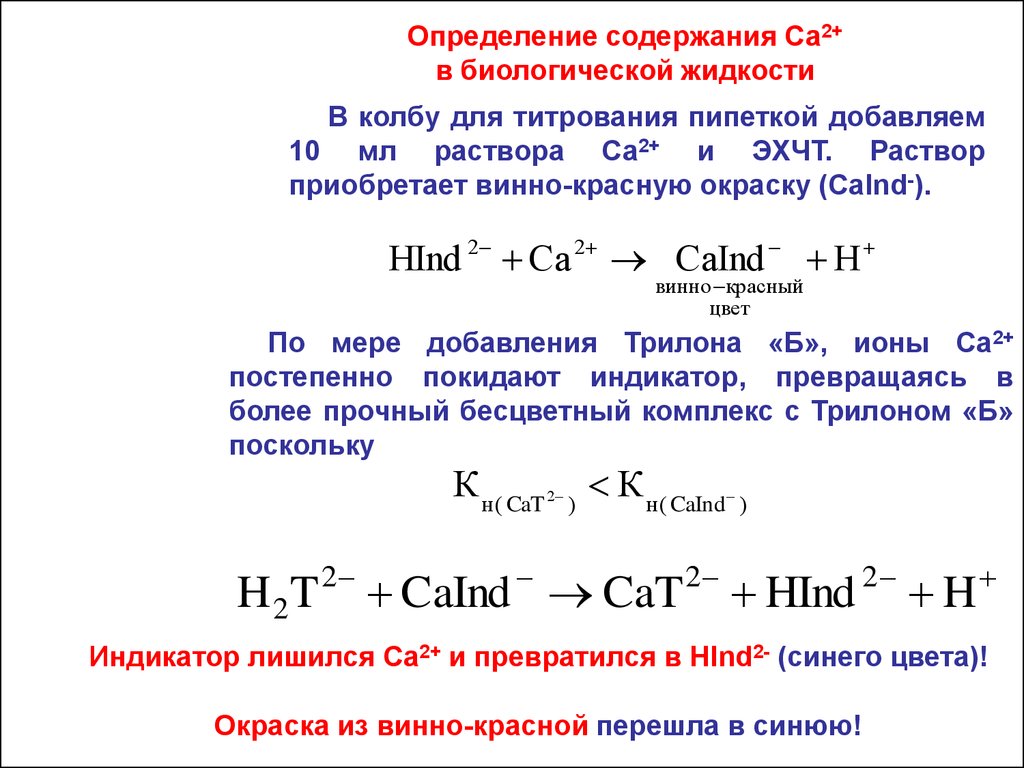
Определение содержания Ca2+в биологической жидкости
В колбу для титрования пипеткой добавляем
10 мл раствора Ca2+ и ЭХЧТ. Раствор
приобретает винно-красную окраску (CaInd-).
HInd 2 Ca 2 CaInd H
винно красный
цвет
По мере добавления Трилона «Б», ионы Са2+
постепенно покидают индикатор, превращаясь в
более прочный бесцветный комплекс с Трилоном «Б»
поскольку
К н ( CaT 2 ) К н ( CaInd )
H 2T 2 CaInd CaT 2 HInd 2 H
Индикатор лишился Ca2+ и превратился в HInd2- (синего цвета)!
Окраска из винно-красной перешла в синюю!
44.
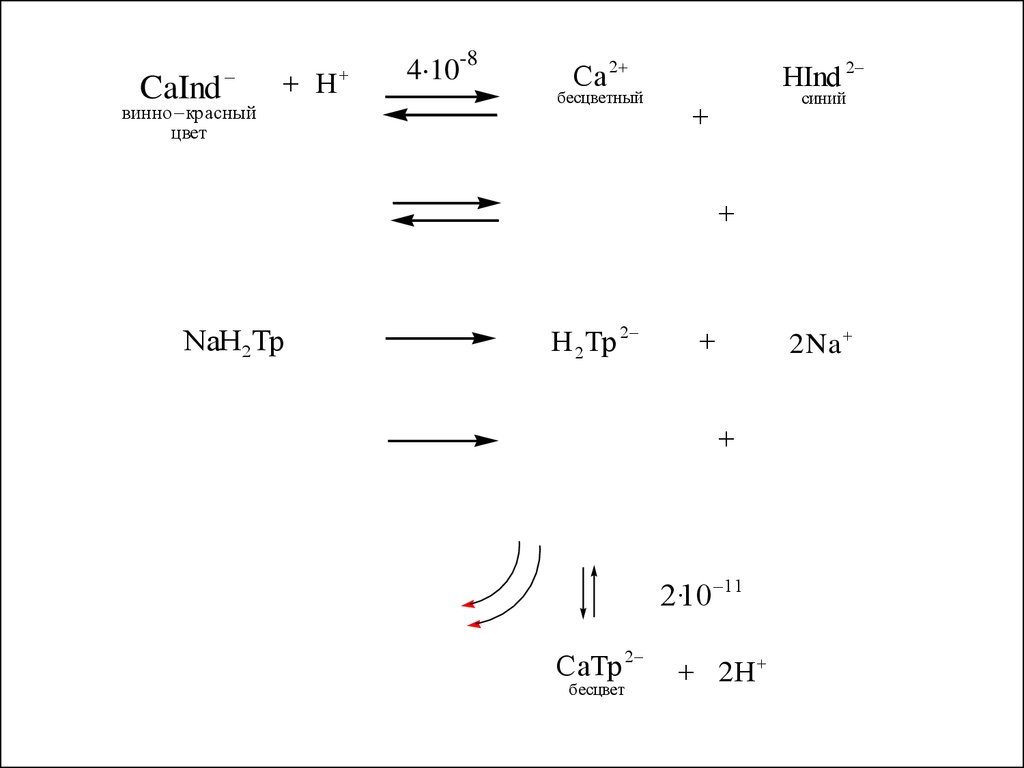
CaIndвинно красный
цвет
Н
4·10-8
Ca 2
бесцветный
HInd 2
синий
NaH2Tp
H 2Tp 2
2 Na
2·10 11
CaTp 2
бесцвет
2Н
45.
Расчёты ведём по формулам:C М Тр ·VТр ( ср ) С М Ca 2 ·VCa 2
C М Ca 2
TCa 2
С М Тр ·VТр ( ср )
VCa 2
C M Ca 2 ·M Ca 2
1000
2
m(Ca ) ( суточная) 1500·TCa 2
46. Применение:
1. Для определения жесткости воды.Раствор с индикатором до
начала титрования
В точке эквивалентности цвет
раствора приобрел синюю
окраску, на этом титрование
прекращают
47.
2. В медицине для определения в различных жидкостях итканях человеческого организма микроэлементов и
содержания различных катионов металлов в
фармацевтических препаратах
48.
3. Комплексоны успешно применяются для растворениякамней, образующихся в почках, печени и желчном пузыре.
Такое применение комплексонов требует очень большой
осторожности, чтобы вместе с растворением камней не
происходило разрушение минеральной основы костной и
других тканей человеческого организма.
49.
4. Для лечения лучевой болезни.5. При свинцовых и ртутных
отравлениях.
50.
6. Для устранения жесткости воды(уменьшения концентрации ионов Са 2+ и Mg 2+
51.
Методы осажденияAg+ + Cl- = AgCl↓
Ba2+ + SO42- = BaSO4 ↓
3Ca2+ + 2PO43- = Ca3(PO4)2 ↓
Cu2+ + 2OH- = Cu(OH)2 ↓
Для осаждения большинства ионов тяжелых металлов из сточных
растворов часто применяется гидроксид кальция (гашеная известь).
Если годовой объем очищаемой воды равен 1000 м3, а содержание в
нем ионов никеля составляет 295 мг/дм3, то с учетом 10 %-го избытка
реагента, необходимого для полного осаждения, расход гидроксида
кальция составит ______ кг в год. Ar(Ni) = 59.)
Ni2+ + Ca(OH)2 = Ni(OH)2 ↓ + Ca2+
m Ni 2 0.295 103 103 0.295 106 г
0.295 106
nNi 2 nСа(ОH) 2
5 103 моль
59
m Са(ОН) 2 M n 74 5 103 370 10 3г 370 кг (ттеор.
mСa ( OН ) 2 ( практ.) 370 1.1 407 кг












































 Медицина
Медицина Химия
Химия








