Похожие презентации:
Броматометрия. (Лекция 10)
1.
Броматометрия2. План
Сущность броматометрииИндикаторы метода броматометрии
Применение броматометрии
Бромометрия
Нитритометрия
Условия реакции диазотирования
Определение КТТ в нитритометрии
Применение нитритометрии
3.
BrO3- + 6 H+ + 6ē ⇆ Br - + 3 H2OE
0
BrO 3- ,6H /Br - = 1,44 B
4.
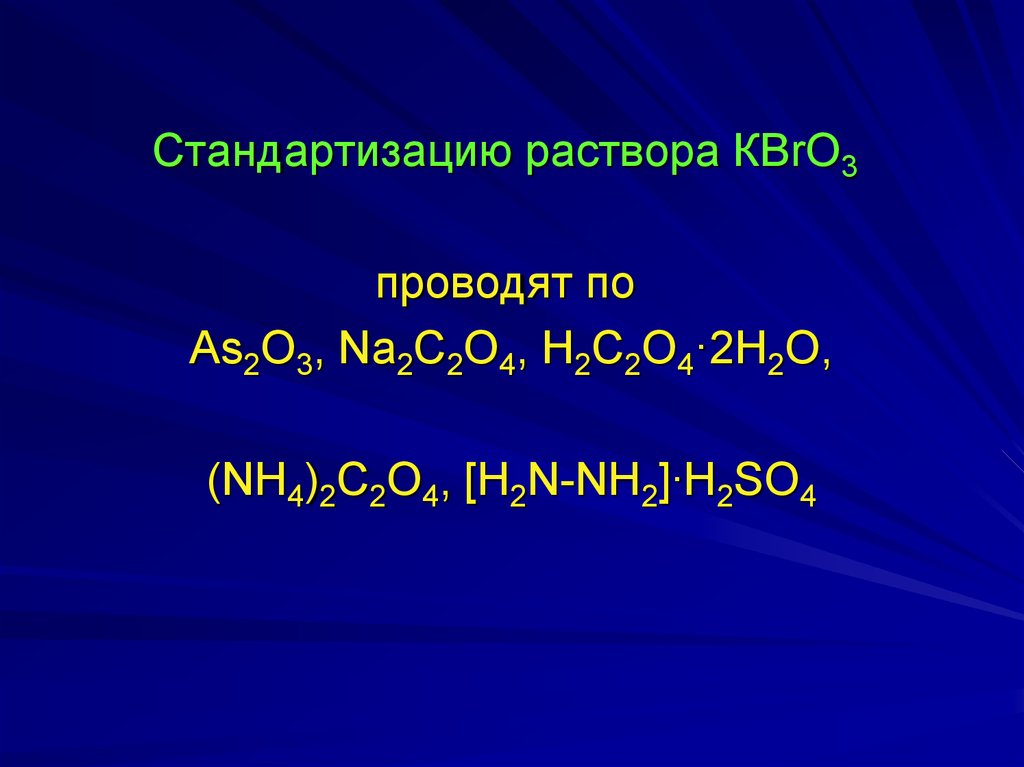
Стандартизацию раствора КBrO3проводят по
As2O3, Na2C2O4, H2C2О4·2H2О,
(NH4)2C2O4, [H2N-NH2]∙H2SO4
5. После ТЭ
BrO3- + 5 Br - + 6 H+ ⇆ 3 Br2 + 3 H2O6. Применение броматометрии
восстановители способом прямоготитрования: As(III), Sb(III), Fe(II), H2O2,
N2H4, а также некоторые
фармацевтические препараты;
окислители (перманганат,
гипохлориты и др.) способом обратного
титрования.
7.
Определение оксида мышьяка(III)As2O3 + 6 OH- ⇆ 2 AsO33- + 3 H2O
AsO33- + 3 H+ ⇆ Н3AsO3
3 Н3AsO3 + H2O – 2ē ⇆ H3AsO4 + 2 H+
1 BrO3- + 6 H+ + 6ē ⇆ Br - + 3 H2O
3 Н3AsO3 + BrO3- ⇆ 3 H3AsO4 + Br fэ(As2O3 ) = ¼
8. Определение сурьмы(III)
3H2[SbCl5] + Cl- – 2ē ⇆ H[SbCl6] + H+
1
BrO3- + 6 H+ + 6ē ⇆ Br - + 3 H2O
3 H2[SbCl5] + 3 Cl- + BrO3- + 3 H+ ⇆ 3 H[SbCl6] + Br - + 3 H2O
fэ(Sb) = 1/2
9.
БромометрияBr2 + 2ē ⇆ 2 Br BrO3- + 5 Br - + 6 H+ ⇆ 3 Br2 + 3 H2O
10.
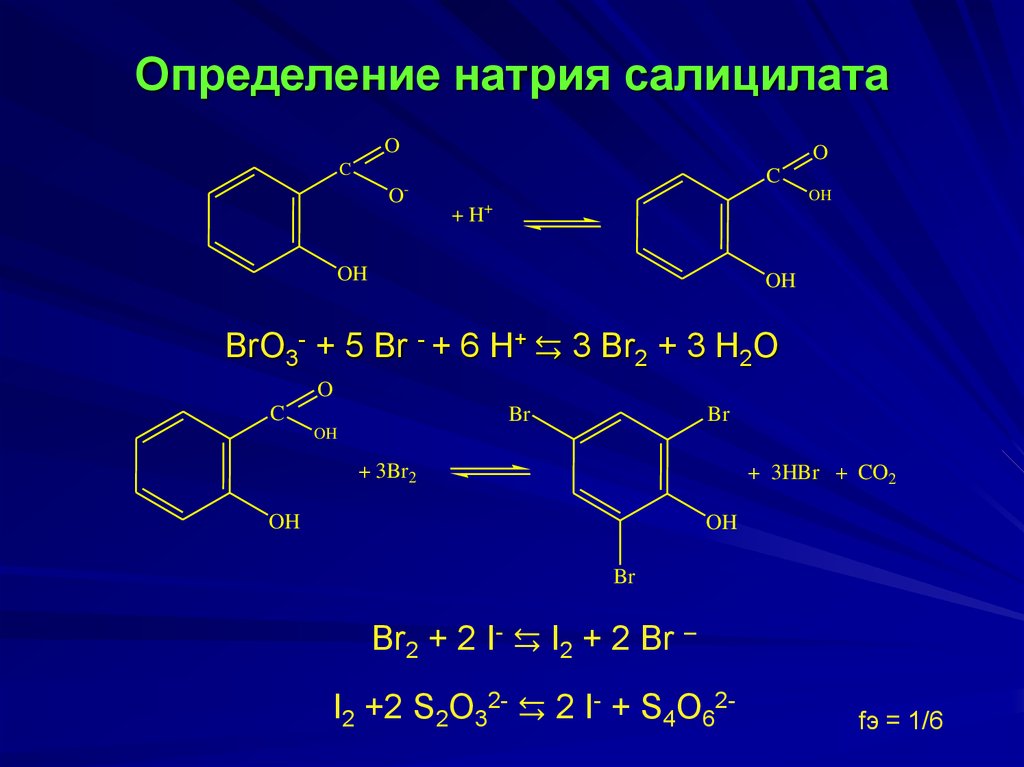
Br2 + 2 I- ⇆ I2 + 2 Br -11. Определение натрия салицилата
OO
C
O-
C
OH
+
+H
OH
OH
BrO3- + 5 Br - + 6 H+ ⇆ 3 Br2 + 3 H2O
O
C
Br
Br
OH
+ 3Br2
+ 3HBr + CO2
OH
OH
Br
Br2 + 2 I- ⇆ I2 + 2 Br –
I2 +2 S2O32- ⇆ 2 I- + S4O62-
fэ = 1/6
12.
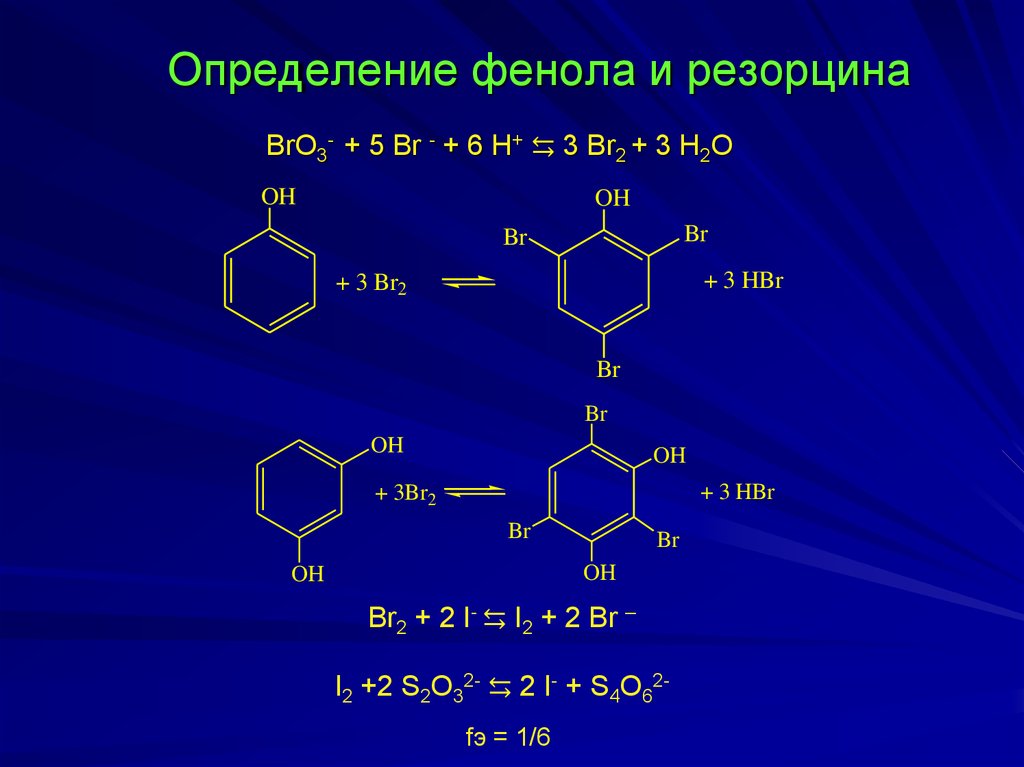
Определение фенола и резорцинаBrO3- + 5 Br - + 6 H+ ⇆ 3 Br2 + 3 H2O
OH
OH
Br
Br
+ 3 HBr
+ 3 Br2
Br
Br
OH
OH
+ 3 HBr
+ 3Br2
Br
Br
OH
OH
Br2 + 2 I- ⇆ I2 + 2 Br –
I2 +2 S2O32- ⇆ 2 I- + S4O62fэ = 1/6
13.
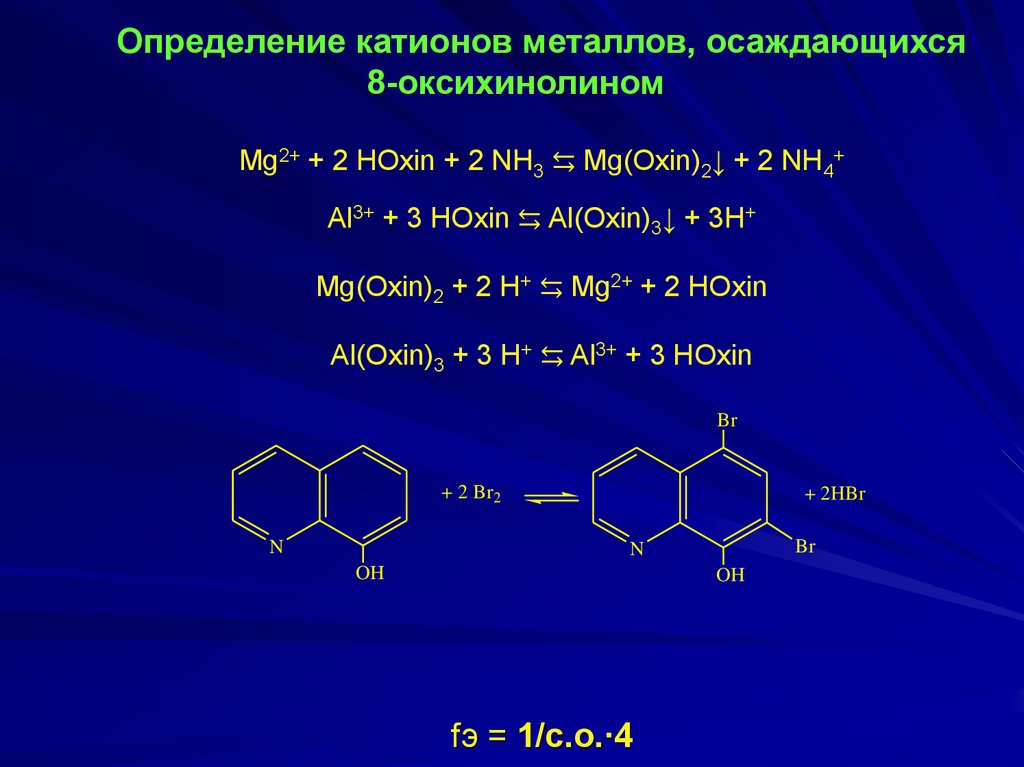
Определение катионов металлов, осаждающихся8-оксихинолином
Mg2+ + 2 HOxin + 2 NH3 ⇆ Mg(Oxin)2↓ + 2 NH4+
Al3+ + 3 HOxin ⇆ Al(Oxin)3↓ + 3H+
Mg(Oxin)2 + 2 H+ ⇆ Mg2+ + 2 HOxin
Al(Oxin)3 + 3 H+ ⇆ Al3+ + 3 HОxin
Br
+ 2 Br2
N
+ 2HBr
Br
N
OH
OH
fэ = 1/с.о.∙4
14.
Нитритометрия15.
Как окислитель нитрит натрия используют дляопределения восстановителей Sn2+, Fe2+, As2O3, N2H4
HNO2 + H+ + ē ⇆ NO + H2O
E 0 HNO 2 / NO = +0,98 B
f э (NaNO2) = 1
Как восстановитель нитрит натрия используют для
определения перманганата, хлора, йодата и др.
HNO2 + H2O – 2ē ⇆ NO3- + 3 H+
E0
NO3 / HNO2
= +0,94 B
f э (NaNO2) = 1/2
16. Реакция диазотирования протекает с первичными ароматическими аминами в кислой среде Ar – NH2 + NaNO2 + 2HCl ⇆ [Ar – N≡N]+Cl- + NaCl + 2H2O
17. Стандартизация по сульфаниловой кислоте
NH2N
N
Cl- + NaCl + 2H2O
+ NaNO2 + 2HCl
SO3H
SO3H
18.
После ТЭ2 I- + 2 NO2- + 4 H+ ⇆ I2 + 2 NO↑ + 2 H2O











![Реакция диазотирования протекает с первичными ароматическими аминами в кислой среде Ar – NH2 + NaNO2 + 2HCl ⇆ [Ar – N≡N]+Cl- + NaCl + 2H2O Реакция диазотирования протекает с первичными ароматическими аминами в кислой среде Ar – NH2 + NaNO2 + 2HCl ⇆ [Ar – N≡N]+Cl- + NaCl + 2H2O](https://cf.ppt-online.org/files/slide/v/VYaF9w5ZSJTlqckhyitPKMX4IC18dUfsoDQpuG/slide-15.jpg)


 Медицина
Медицина Химия
Химия








