Похожие презентации:
Аминокислоты. Пептиды. Белки
1. АМИНОКИСЛОТЫ. ПЕПТИДЫ. БЕЛКИ.
2.
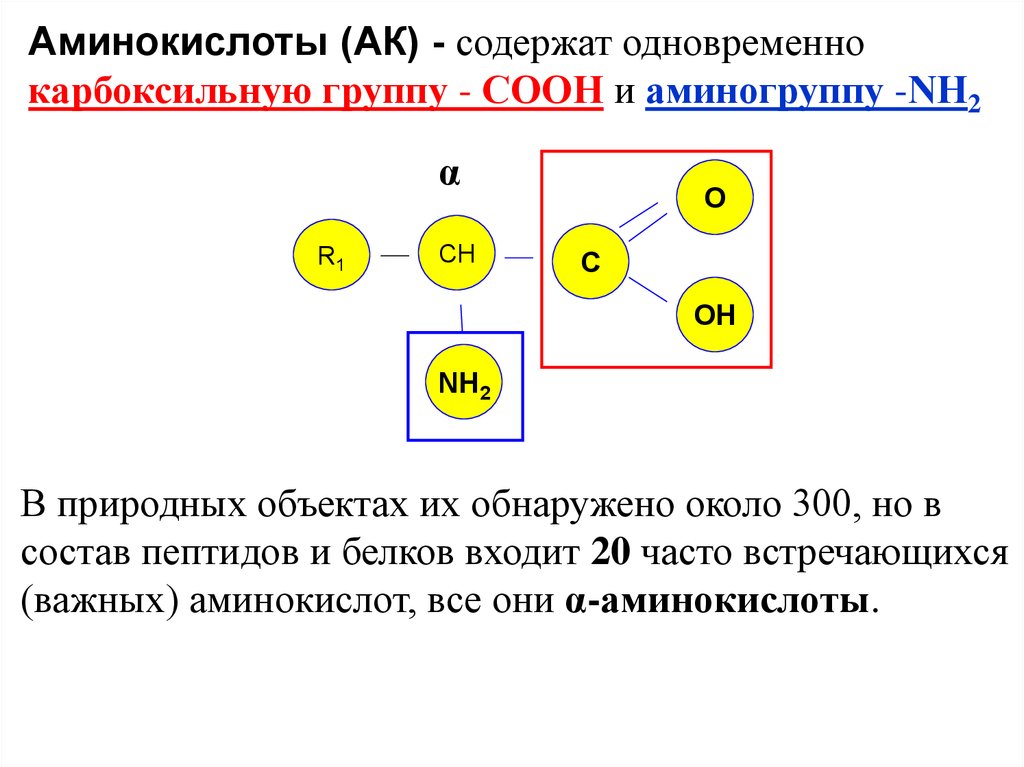
Аминокислоты (АК) - содержат одновременнокарбоксильную группу - СООН и аминогруппу -NН2
α
R1
СH
O
C
OH
NH2
В природных объектах их обнаружено около 300, но в
состав пептидов и белков входит 20 часто встречающихся
(важных) аминокислот, все они α-аминокислоты.
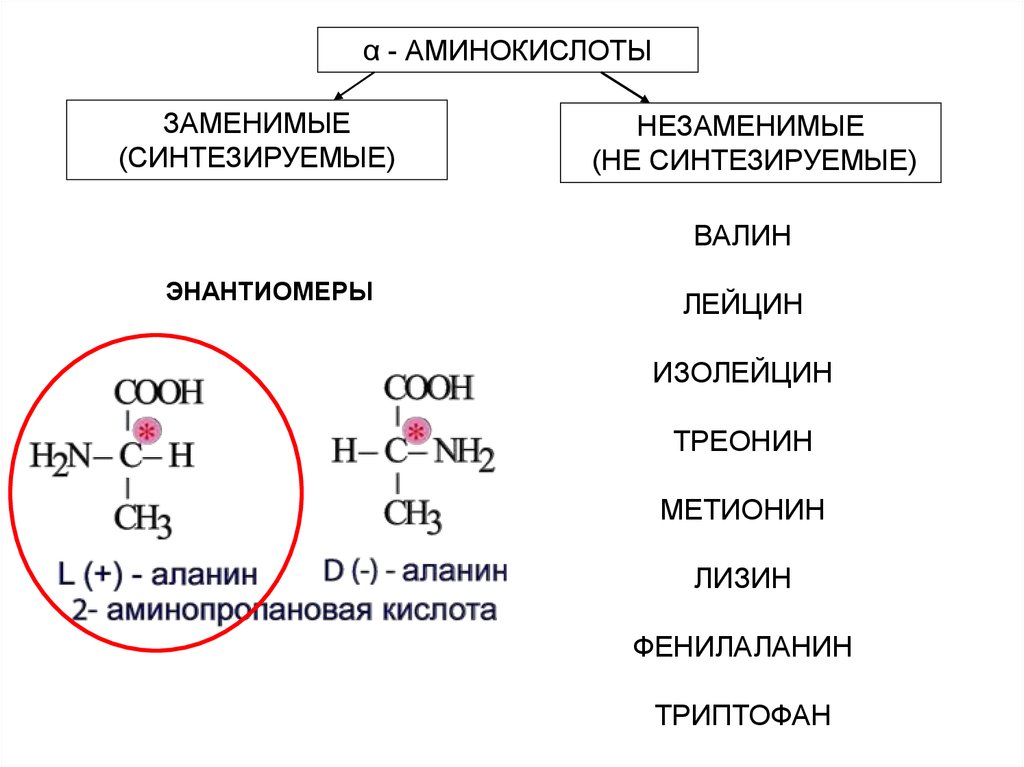
3. КЛАССИФИКАЦИЯ α-АМИНОКИСЛОТ
САМОСТОЯТЕЛЬНОЛитература:
1. Биоорганическая химия: учебник для вузов / Н.А.
Тюкавкина, Ю.И. Бауков – М.: Дрофа, 2005. –
С.316 – 317.
2. Слесарев В.И. Химия: Основы химии живого:
Учебник для вузов – СПб:Химиздат, 2001. С. 529
– 533.
4.
α - АМИНОКИСЛОТЫЗАМЕНИМЫЕ
(СИНТЕЗИРУЕМЫЕ)
НЕЗАМЕНИМЫЕ
(НЕ СИНТЕЗИРУЕМЫЕ)
ВАЛИН
ЭНАНТИОМЕРЫ
ЛЕЙЦИН
ИЗОЛЕЙЦИН
ТРЕОНИН
МЕТИОНИН
ЛИЗИН
ФЕНИЛАЛАНИН
ТРИПТОФАН
5.
По кислотно-основным свойствам аминокислотыделят на три группы:
Кислые - с карбоксильными группами в боковом
радикале:
аспарагиновая и глутаминовая кислоты.
Основные - в боковом радикале имеющие
гуанидиновую, имидазольную или аминогруппы:
лизин, аргинин и гистидин.
Все остальные - нейтральные.
6.
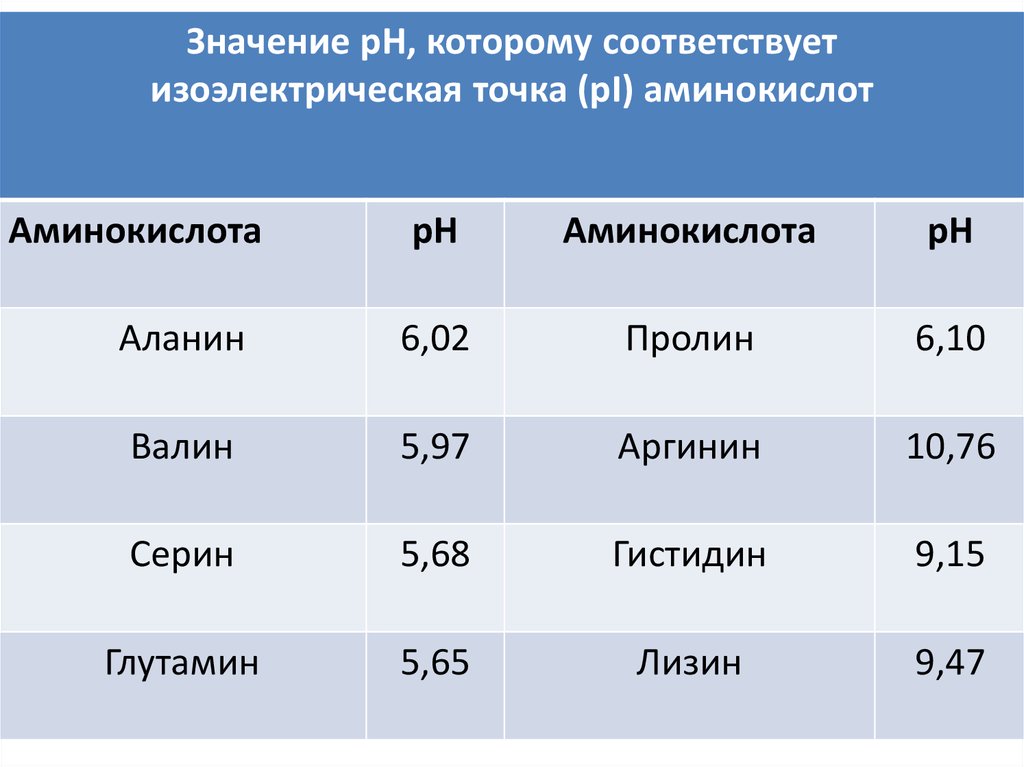
Значение рН, точкакоторому
соответствует
Изоэлектрическая
(ИЭТ)
– это значение
изоэлектрическая
точка
(рI) аминокислот
pH раствора,
при котором
молекулы
существуют
в виде диполярных ионов.
Аминокислота
рН
Аминокислота
рН
Аланин
6,02
Пролин
6,10
Валин
5,97
Аргинин
10,76
Серин
5,68
Гистидин
9,15
pKкотором
2,3
9,7 в виде
Состояние при
находится
1 pK 2белок
pI
6,0
диополярного
2 (цвиттер-иона),
2 называется9,47
Глутамин иона
5,65
Лизин
изоэлектрическим состоянием (ИЭС).
7.
Биологически важные реакцииα-аминокислот
8.
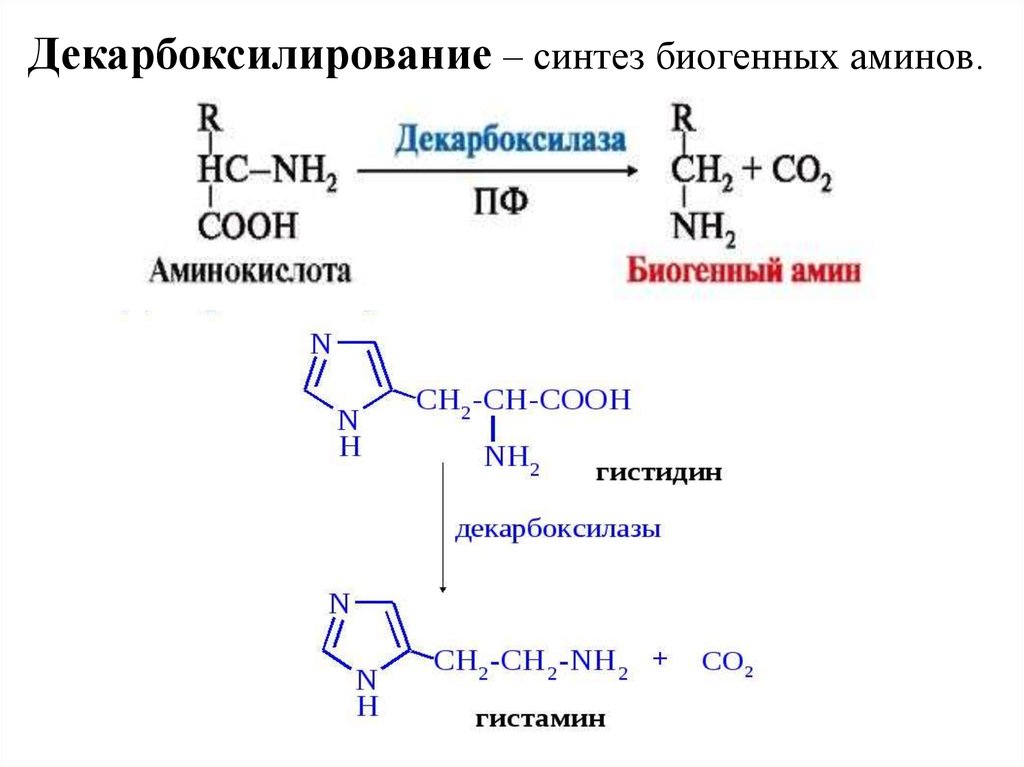
Декарбоксилирование – синтез биогенных аминов.9.
Дезаминирование –удаления α-АК, которая выделяется в виде
NH3 и образования α-кетокислоты. Общее
количество АК уменьшается.
Дезаминированию не подвергаются
лизин и пролин.
10.
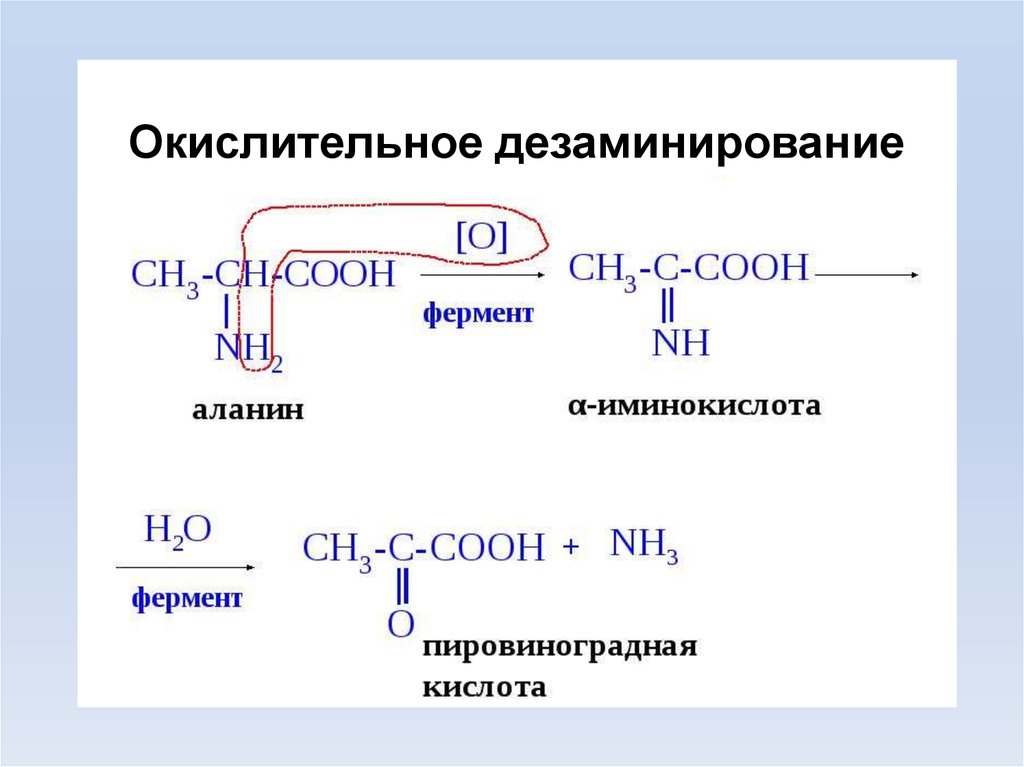
Окислительное дезаминирование11.
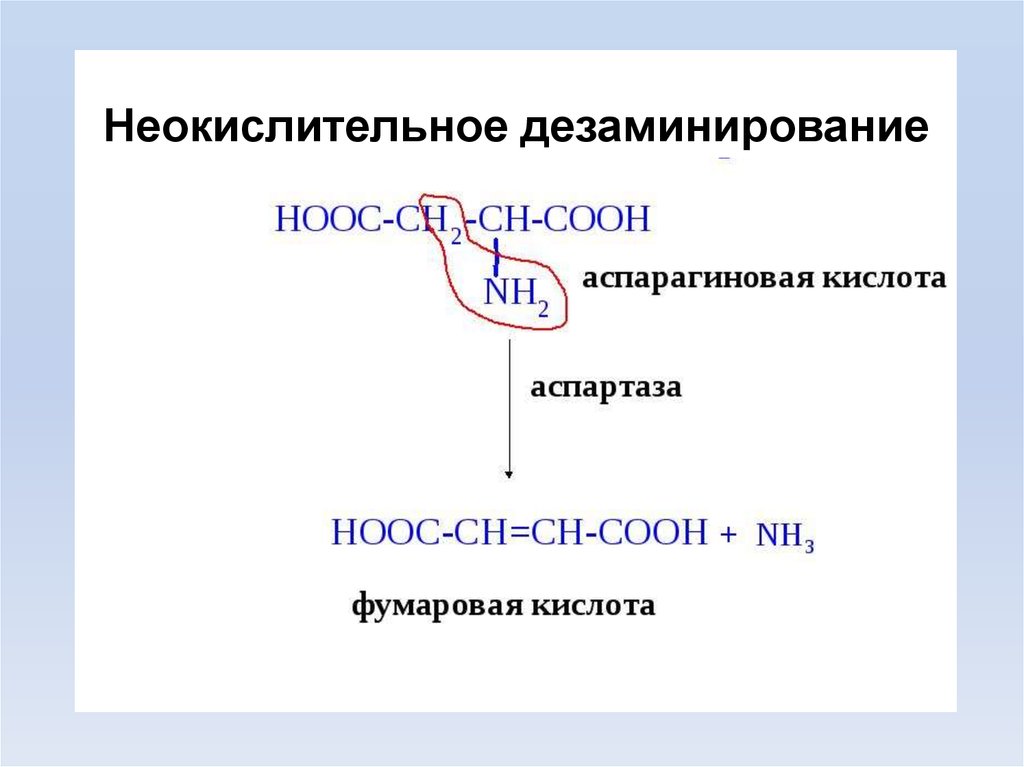
Неокислительное дезаминирование12.
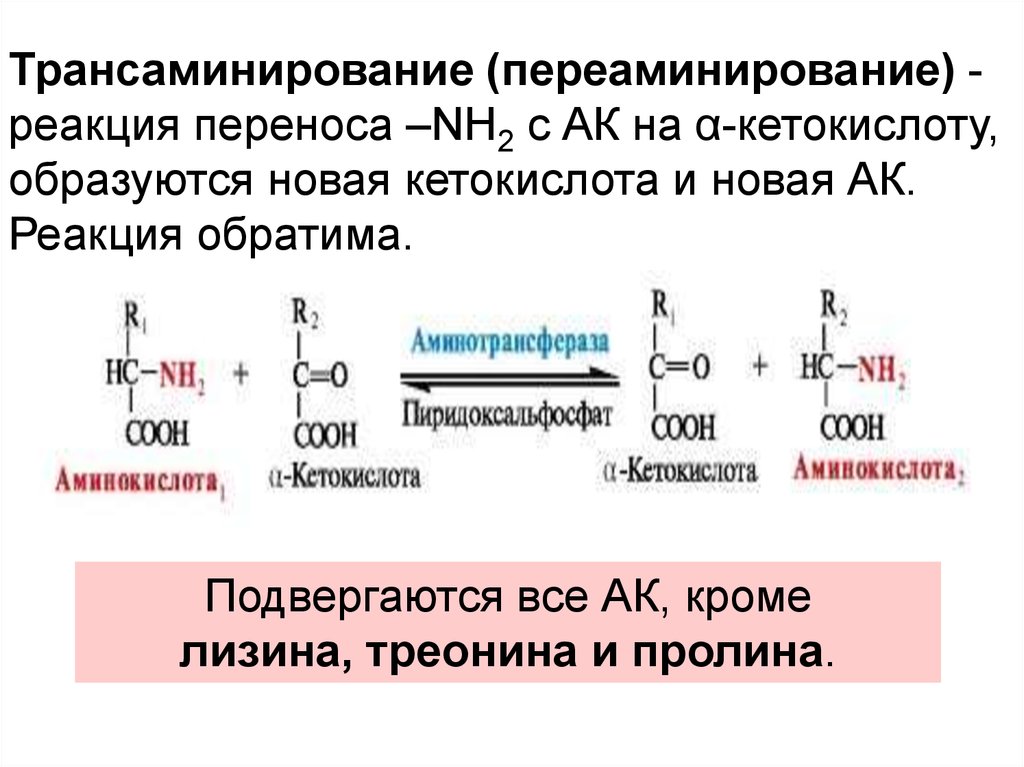
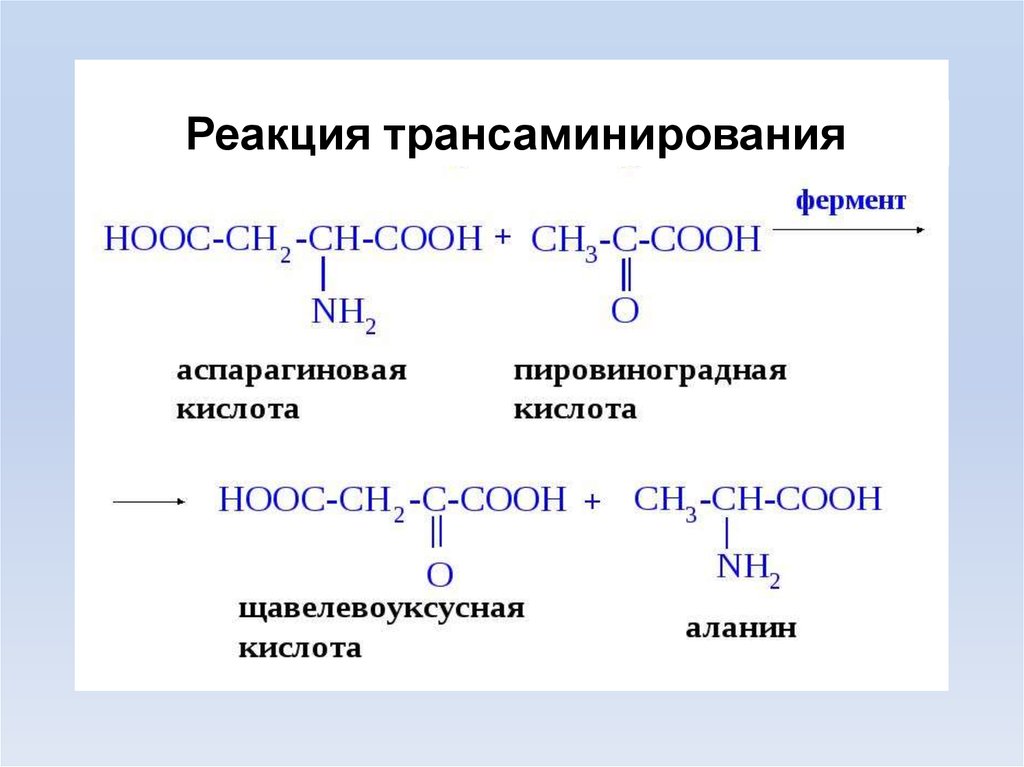
Трансаминирование (переаминирование) реакция переноса –NH2 с АК на α-кетокислоту,образуются новая кетокислота и новая АК.
Реакция обратима.
Подвергаются все АК, кроме
лизина, треонина и пролина.
13.
Реакция трансаминирования14.
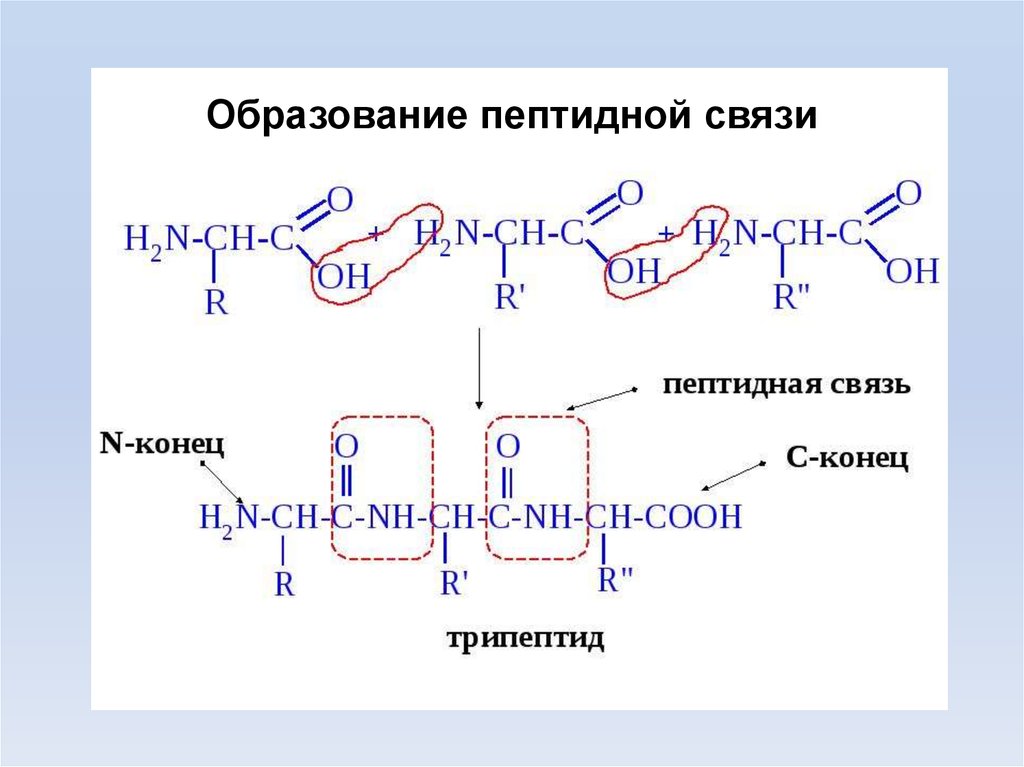
Образование пептидной связи15.
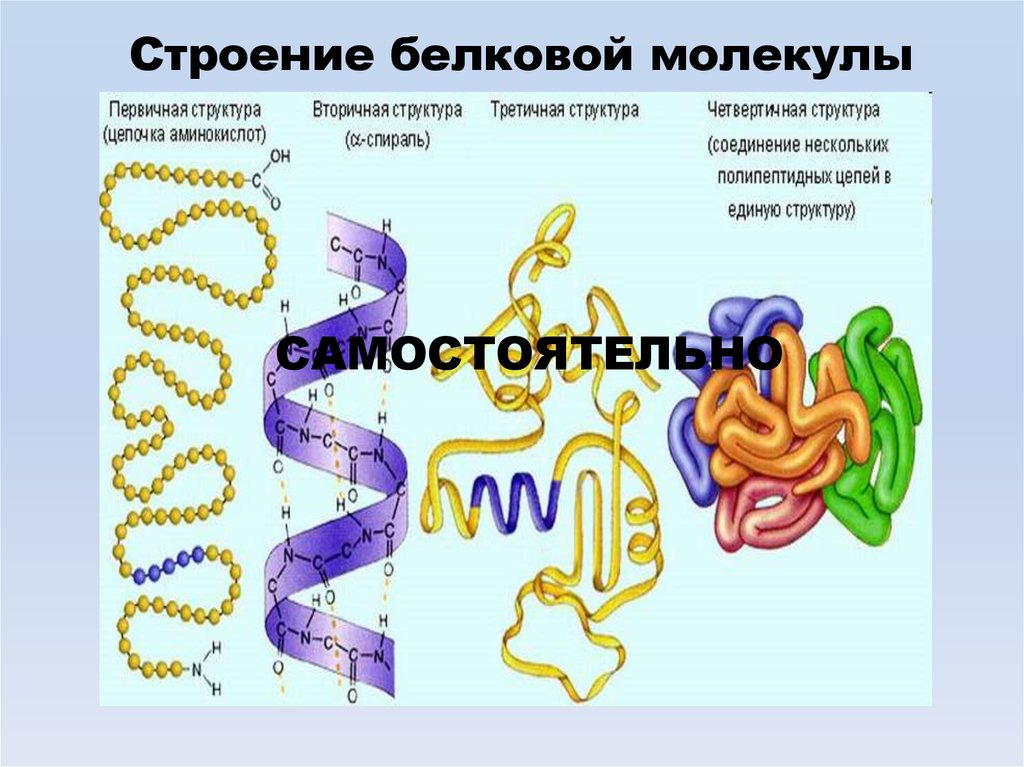
Строение белковой молекулыСАМОСТОЯТЕЛЬНО
16.
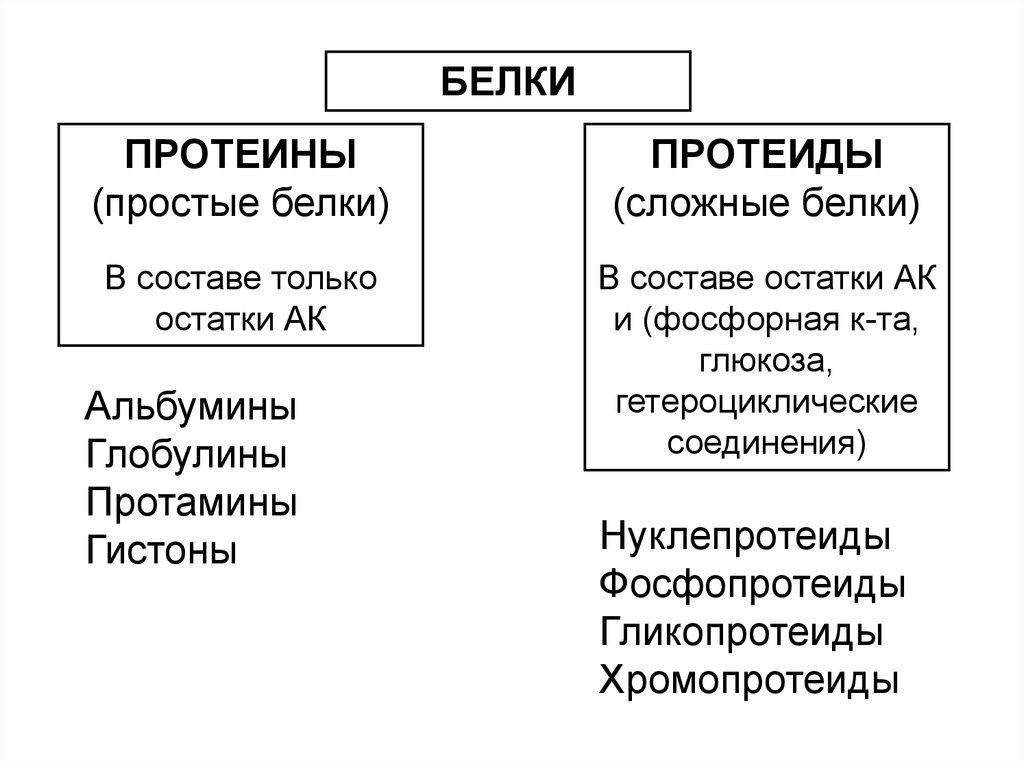
БЕЛКИПРОТЕИНЫ
(простые белки)
ПРОТЕИДЫ
(сложные белки)
В составе только
остатки АК
В составе остатки АК
и (фосфорная к-та,
глюкоза,
гетероциклические
соединения)
Альбумины
Глобулины
Протамины
Гистоны
Нуклепротеиды
Фосфопротеиды
Гликопротеиды
Хромопротеиды




 Биология
Биология








