Похожие презентации:
Лекарственные катастрофы, которые потрясли мир
1. л
ЛЕКАРСТВЕННЫЕКАТАСТРОФЫ,
Л
КОТОРЫЕ
ПОТРЯСЛИ
МИР
11 ноября 2016 года 14:00
Первое заседание научного кружка по клинической фармакологии
В программе: История клинических исследований. Понятие и принципы
“Надлежащей клинической практики” (GCP). Система фармаконадзора.
НУЗ ОКБ на ст.Волгоград-1 ОАО “РЖД”, Автотранспортная ул.75
Руководитель СНК: Кузьмина Татьяна Николаевна tata_razdrogina@mail.ru
2. Историческая справка
Первое задокументированноеклиническое
исследование
было выполнено в 1747 году на
борту
корабля
«Солсбери»
шотландским морским врачом
Джеймсом
Линдом
Результаты
эксперимента
Джеймс Линд опубликовал в
1753 году в работе «Лечение
цинги»,
где
предложил
использовать цитрусовые для
профилактики
болезни
3. Историческая справка
Первое слепое рандомизированноеисследование
(1931)
провел
Джеймс Амберсон, в котором он
сравнивал эффективность лечения
туберкулеза препаратами золота
(санокризин)
с
плацебо
Исследование показало полное
отсутствие полезных эффектов
санокризина
4. Лекарство эффективно и безопасно?
Клинические исследования проводятся, чтобы доказать безопасность иэффективность лекарственных средств
В настоящее время лекарства не могут быть лицензированы/зарегистрированы
без предоставления данных, полученных в результате проведения тщательных
исследований, включая исследования с участием человека.
Исследователь – единственный участник клинического исследования, который
непосредственно контактирует с пациентом.
Пациент зависит от врача…
Всегда ли пациент знает свои права?
5. Лекарственные катастрофы
Неправильное сырье и эликсирсульфаниламида - 1930 годы
Впервые
сульфаниламидные
препараты
появились в 1935 году, и многие производители
начали выпускать новые противоинфекционные
средства. Одна компания решила использовать
диэтиленгликоль – ядовитый растворитель и
химический аналог антифриза в оральном
«Эликсире сульфаниламида». До того момента,
пока выяснили в чем дело, погибло 107 человек,
многие из них дети.
6. Лекарственные катастрофы
В ответ на эту трагедию Конгресс США в 1938 годупринял Закон о пищевых продуктах, медикаментах и
косметике.
Впервые от компаний-производителей стали требовать
подтверждения безопасности их продукции до ее
появления в продаже. Данный закон существенно
расширил
полномочия
FDA по
надзору
за
косметическими препаратами и терапевтическим
оборудованием, а также по проведению детальных
инспекций предприятий. Закон ужесточил стандарты на
пищевую продукцию и разрешил в случае нарушения
правил осуществлять принудительную остановку
производства в качестве дополнительной карательной
меры в добавление к уже действующим конфискации
продукции и уголовному преследованию.
7. Лекарственные катастрофы
1940-ые и 50-ые годыВ 1941 году случилась трагедия, которая не имела никакого отношения к
событиям Второй мировой войны. Около 300 человек погибло и пострадало от
принятия сульфатиазоловых таблеток, в которые было добавлено успокоительное
средство фенобарбитал. Этот инцидент заставил FDA в корне пересмотреть
требования к производству и контролю над качеством лекарственной продукции и
в значительной степени послужил становлению системы GMP.
Закон «О здравоохранении», принятый в 1944 году, решал большое количество
проблем, в том числе в сфере регулирования биологических продуктов и контроля
над инфекционными заболеваниями.
8. Лекарственные катастрофы
Кроме того, в годы Второй мировой войны стала обязательной пакетная (групповая)сертификация отдельных видов препаратов. Данная сертификация обязывала
компании предоставлять в FDA пробы из каждой выпускаемой партии продукции.
После проведения анализа проб FDA выдавала разрешение на реализацию данной
партии. Подобная практика началась в 1941 году для инсулина и в 1945 году для
пенициллина, а затем распространилась на все антибиотики. Обязательная
сертификация каждой партии выпускаемых препаратов была отменена лишь в 1983
году.
9. Лекарственные катастрофы
1960-ые годыТалидомид был представлен на рынке Европы, как снотворное лекарство и лекарство для
борьбы с утренней тошнотой во время беременности. Когда регулирующие учреждения
выдавали разрешение на продажу данного препарата, они еще не знали, какие ужасные
побочные эффекты он имеет. Оказалось, что данный препарат обладает тератогенным
эффектом – вызывает уродство у внутриутробного плода. Дети, чьи матери принимали
препарат Талидомид в начале беременности, рождались с деформированными
конечностями. Общее количество случаев врожденных уродств, связанных с данным
препаратом, насчитывает 10 тысяч.
Однако на американский рынок данный препарат не был допущен. Ответственным за
принятие решение о запрете препарата была женщина-ученый Фрэнсис Келси. В 1962
году президент США Джон Кеннеди вручил ей награду «За выдающиеся заслуги перед
Отечеством» — высшую награду, которую могут получить государственные служащие.
10. Талидомидовая трагедия
11. Лекарственные катастрофы
Случай с Талидомидом всколыхнул общественное мнение.Два законодателя – Кефавер и Харрис — настояли на принятии Конгрессом строгих поправок,
обязывающих компании обеспечивать не только безвредность своей продукции, но и подтверждать
лечебные свойства препаратов, другими словами — их эффективность. Данная поправка обязывала
компании проводить клинические испытания на животных, прежде чем апробировать новые
препараты на людях. Ответственность за эффективность препаратов, проходящих испытания,
ложилась на исследователей. Производителям было предписано в обязательном порядке уведомлять
людей, принимающих участие в исследовании, о факте его проведения и получать их официальное
согласие перед употреблением тестируемого препарата. Теперь лекарства должны были
подтверждать свою эффективность, прежде чем попасть на рынок. Также производители были
обязаны сообщать о случаях выявления негативного побочного эффекта.
Кроме того, с этого момента FDA получило полномочия регулировать рекламу рецептурных
препаратов.
12. Лекарственные катастрофы
1970-ые годы70-ые годы стали переломным моментом в законодательном регулировании продукции. В 1978 году
был утвержден окончательный вариант правил GMP для медицинских препаратов и медицинских
аппаратов. Целью введения данных правил было обеспечение безопасности и эффективности всех
видов продукции.
«Правила… содержат минимум требований GMP к помещениям, методам производства и способам
контроля над производством, обработкой и упаковкой препаратов с целью соответствия их
требованиям безопасности, а также наличию у них заявленных характеристик эффективности и
чистоты».
Требования GMP для медицинских техника в соответствии с последней редакцией предназначены
«определять методы и способы контроля при разработке, производстве, упаковке, хранении,
маркировке, установке и обслуживании всех медицинских аппаратов, предназначенных для
использования человеком».
13. Лекарственные катастрофы
В 1979 году появляются GLP – Правила организации и контроля качества лабораторных исследований.Данные правила «предназначены для проведения неклинических лабораторных исследований с целью
получения в Управлении по санитарному надзору за качеством пищевых продуктов и медикаментов
разрешений на продажу лекарств для людей и животных, пищевых добавок и красителей, медицинского
оборудования и биопрепаратов, а также электронных устройств». Правила обеспечивают качество
и достоверность полученных в ходе исследований данных.
Несколькими годами ранее поправки о медицинских аппаратах, оформленные в 1976 году в виде закона,
расширили полномочия FDA по контролю за медицинской техникой. Данные поправки были форсированы
инцидентами с внутриматочными средствами по предотвращению беременности, которыми пользовались
свыше 2 млн. женщин. Многие женщины серьезно пострадали. В 1975 году это средство убрали с рынка.
Поправки о медицинском оборудовании обязывали ее производителей представлять в FDA сведения об их
безопасности и эффективности до выпуска на рынок. Более того, закон закреплял систему надзора за
продукцией до и после ее появления на рынке. Надзор включал в себя инспекции FDA в целях
обеспечения следования компаниями правилам GMP, ведения надлежащего учета разработок и
произведенной продукции, а также работе с жалобами. Сегодня такие положения кажутся нам абсолютно
естественными.
14. Лекарственные катастрофы
Исследование Таскиги (сифилис)1932-1972 – этические проблемы и сокрытие
информации о появившемся лечении
1979 USA: Белмонтский отчет:
интересы индивидуума выше
интересов общества
15. Лекарственные катастрофы
1980-ые и 1990-ые годыОтравленные капсулы ацетаминофена. В 1982 году 12-летняя Мэри Келлерман пожаловалась родителям на простуду.
Родители дали девочке капсулу ацетаминофена «Tylenol Extra-strength», а через несколько часов она умерла. Позже после
принятия данного лекарства погибли еще шесть человек, включая троих членов одной семьи (два брата и жена одного из
них), а также роженицу – мать четырех детей.
Johnson & Johnson, производитель Тайленола, был вынужден отозвать 31 миллион банок с лекарством по всей стране.
Проведенное собственное расследование компании обвинило во всем неизвестного злоумышленника (его, впрочем,
никто не нашел), который якобы вскрыл несколько банок и отравил их цианистым калием. Тем не менее компания была
вынуждено уничтожить 31 млн. баночек самого распространенного безрецептурного средства.
После этого случая FDA ввела специальные предписания по упаковке всех безрецептурных лекарственных средств в
целях обеспечения их защиты от отравителей и включила данные предписания в правила GMP. В 1983 году Конгресс
США принял Закон против отравителей-злоумышленников, превратив вскрытие готовой продукции в уголовно
наказуемое деяние. Ацетаминофеновая трагедия оказала огромное влияние на всю индустрию. Теперь во всем мире
проводятся семинары и тренинги, чтобы убедиться, что сотрудники компаний-производителей осознают свою
ответственность за выполнение своей работы. Сегодняшние реалии заставляют компании задумываться о том, как
защитить свою продукцию от действий злоумышленников.
В 1990 году были опубликованы предложения по внесению изменений в правила GMP лекарственных средств. В
соответствии с окончательными правилами электронного учета необходимы механизмы контроля для обеспечения
безопасности и точности всех используемых компьютерных систем.
16. GCP: этапы создания
1938 Federal Food, Drug and Cosmetic Act - Управление по контролю запищевыми продуктами и лекарственными веществами
1947 Nuremberg Code -Нюрнбергский код
1964 Declaration of Helsinki (1975, 1983, 1989, 1996, 2000, 2002, 2004, 2008)
- Хельсинская декларация
1979 GLP – Правила организации и контроля качественных лабораторных
исследований
1981 FDA rules for Informed Consent Form - Правила по
информированному согласию
1982 FDA rules for Ethics Committees - Правила по этическим комитетам
17. Что такое ICH?
Международная конференция по гармонизации технических требований к регистрациифармацевтических продуктов, предназначенных для применения человеком
Апрель 1990
Участники: Регуляторные органы Европы, Японии и США + эксперты
фармацевтической промышленности этих стран
Наблюдатели: ВОЗ, Канадский Комитет здоровья и Европейская Ассоциация производителей
Цель: экономичное использование людских, животных и материальных ресурсов и устранение задержек
глобального развития и доступности новых ЛС при сохранении высоких стандартов качества,
безопасности и эффективности и соблюдения регуляторных требований по охране
18. «Международная конференция гармонизации (ICH Guidelines)»
Q uality – of chemical and pharmaceutical processes(Качество)
S afety – in vitro and in vivo experiments
(Безопасность)
E fficacy – clinical trials on humans E6 (Эффективность)
M ultidisciplinary topics (Другое)
19. ICH E (fficacy)
E1 – the extent of populations exposure to assess clinical data safetyE2 – Clinical safety data management Adverse Event Reporting
E3 – Structure and content of clinical study reports
E4 - Dose-response information to support drug registration
E5 – Ethnic factors in the acceptability of foreign clinical data
E6 – Good Clinical Practice Consolidate Guideline
E7 – Studies in support of special populations
E8 – General considerations for clinical trials
E9 – Statistical principles for clinical trials
E10 – Choice of control group for clinical trials
E11 – Clinical investigation of medical products in the pediatric population
E12 – Principles of clinical evaluation of new antihypertensive agents
20. ICH GCP
Пункт «Е6» – Руководство по Надлежащей клинической практике (май 1996)Япония – апрель 1997 – как новый закон
США – май 1997 – Руководство для отрасли в Федеральном Регистре
ЕС – апрель 2001 – часть Европейской Директивы по
клиническим исследованиям 2001/20/ЕС
Россия – утвержден 27 сентября 2005 – внедрен 01 апреля 2006 –
Национальный стандарт Российской Федерации «Надлежащая клиническая
практика GOOD CLINICAL PRACTICE (GCP)» ГОСТ Р 52379-2005
21. Договоримся о терминах
Качественная клиническая практика=
Доброкачественная клиническая практика
=
Добросовестная клиническая практика
=
Надлежащая клиническая практика
=
Национальный стандарт
22. Надлежащая клиническая практика
«…международный этический и научный стандарт планирования и проведения исследований с участиемчеловека в качестве субъекта, а также документального оформления и представления результатов таких
исследований.»
«Соблюдение указанного стандарта служит для общества гарантией того, что права, безопасность и
благополучие субъектов исследования защищены, согласуются с принципами, заложенными Хельсинкской
декларацией Всемирной медицинской ассоциации, и что данные клинического исследования достоверны.»
Надлежащая клиническая практика (Good Clinical Practice; GCP): Стандарт
планирования,организации, проведения, мониторинга, аудита, документирования клинических
исследований, а также анализа и представления их результатов, служащий гарантией достоверности и
точности полученных данных и представленных результатов, а также обеспечивающий защиту
прав, здоровья и конфиденциальности субъектов исследования
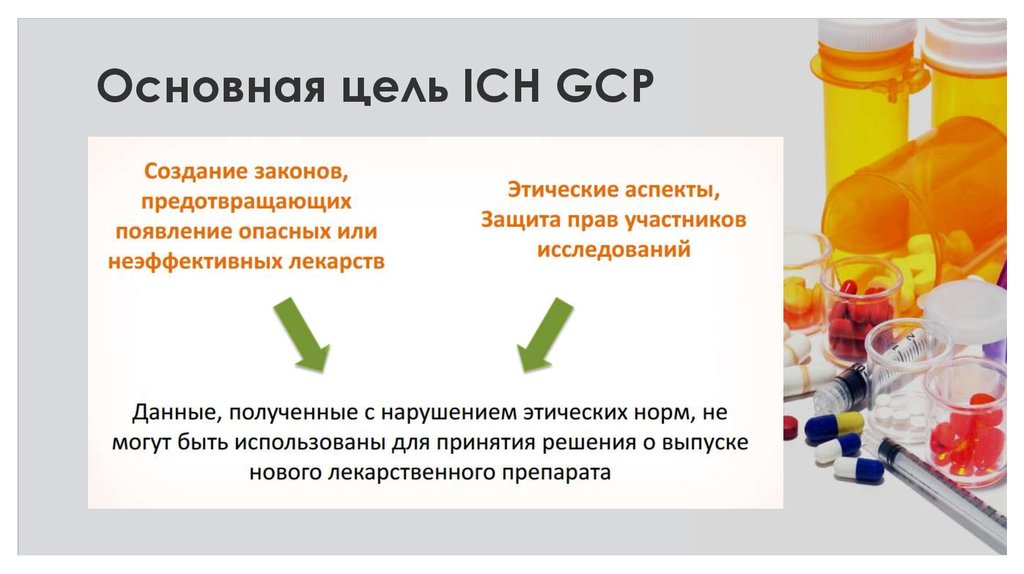
23. Основная цель ICH GCP
24. Основные принципы ICH GCP
2.1 Клинические исследования должны проводиться в соответствии сэтическими принципами, заложенными Хельсинкской декларацией ВМА
и отраженными в GCP и нормативных требованиях
2.2 До начала исследования должна быть проведена оценка соотношения
прогнозируемого риска и неудобств с ожидаемой пользой для субъекта
исследования и общества. Исследование может быть начато и продолжено
только в том случае, если ожидаемая польза оправдывает риск
2.3 Права, безопасность и благополучие субъекта исследования имеют
первостепенное значение и должны превалировать над интересами науки и
общества
2.4 Информация (доклиническая и клиническая) об исследуемом
продукте должна быть достаточной для обоснования предполагаемого
клинического исследования
25. Основные принципы ICH GCP
2.5 Клинические исследования должны отвечать научнымтребованиям и быть чётко и подробно описаны в протоколе
2.6 Клиническое исследование должно проводиться в соответствии
с протоколом, утверждённым/одобренным Экспертным советом
организации (ЭСО)/Независимым этическим комитетом (НЭК)
2.7 Ответственность за оказываемую субъекту медицинскую
помощь и принятие решений медицинского характера несёт врач
26. Основные принципы ICH GCP
2.8 Все привлекаемые к проведению исследования лица должны иметьсоответствующие образование, подготовку и опыт для выполнения
возложенных на них задач
2.9 Добровольное информированное согласие должно быть получено у
каждого субъекта до его включения в исследование
2.10 Всю полученную в клиническом исследовании информацию необходимо
регистрировать, передавать и хранить таким образом, чтобы были обеспечены
точность и правильность её представления, интерпретации и
верификации
27. Основные принципы ICH GCP
2.11 Конфиденциальность записей, позволяющих идентифицироватьсубъектов исследования, должна быть обеспечена с соблюдением права
на частную жизнь и защиту конфиденциальности в соответствии с
нормативными требованиями
2.12 Производство и хранение исследуемых продуктов, а также
обращение с ними необходимо осуществлять в соответствии с
правилами надлежащей
производственной практики (good manufacturing practice; GMP).
Исследуемые продукты должны применяться в соответствии с
утвержденным протоколом
2.13 Для обеспечения качества каждого аспекта исследования должны
быть внедрены
28.
НАЦИОНАЛЬНЫЙ СТАНДАРТРОССИЙСКОЙ
ФЕДЕРАЦИИ
НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ
ПРАКТИКА
GOOD CLINICAL PRACTICE (GCP)
ГОСТ Р 52379-2005





























 Медицина
Медицина








