Похожие презентации:
Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов
1.
РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙМЕДИЦИНСКИЙ УНИВЕРСИТЕТ им. Н.И.ПИРОГОВА
Неорганическая химия
Курс лекций
для студентов медико-биологического
факультета, специальность 30.05.01
«Медицинская биохимия»
2018/19 уч. год
Кафедра химии лечебного факультета
2.
Лекция № 1Химическое равновесие.
Прот олит ические равновесия и
процессы в раст ворах элект ролит ов
3.
Содержание лекции1. Введение. Значение химии в системе медицинского образования
2. Химическое равновесие . Константа химического равновесия
3. Факторы, влияющие на смещение равновесия. Принцип
Ле Шателье-Брауна. Влияние температуры, давления и катализатора.
4. Протолитическая теория кислот и оснований
5. Протолитические равновесия в водных растворах
6. Степень и константа диссоциации
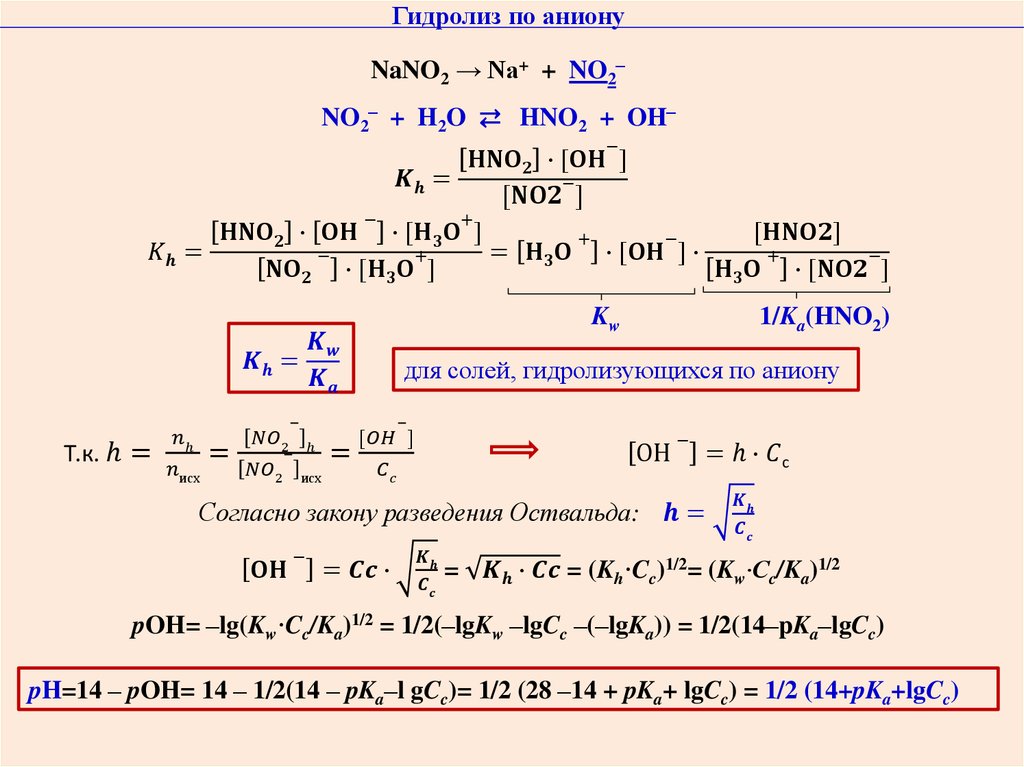
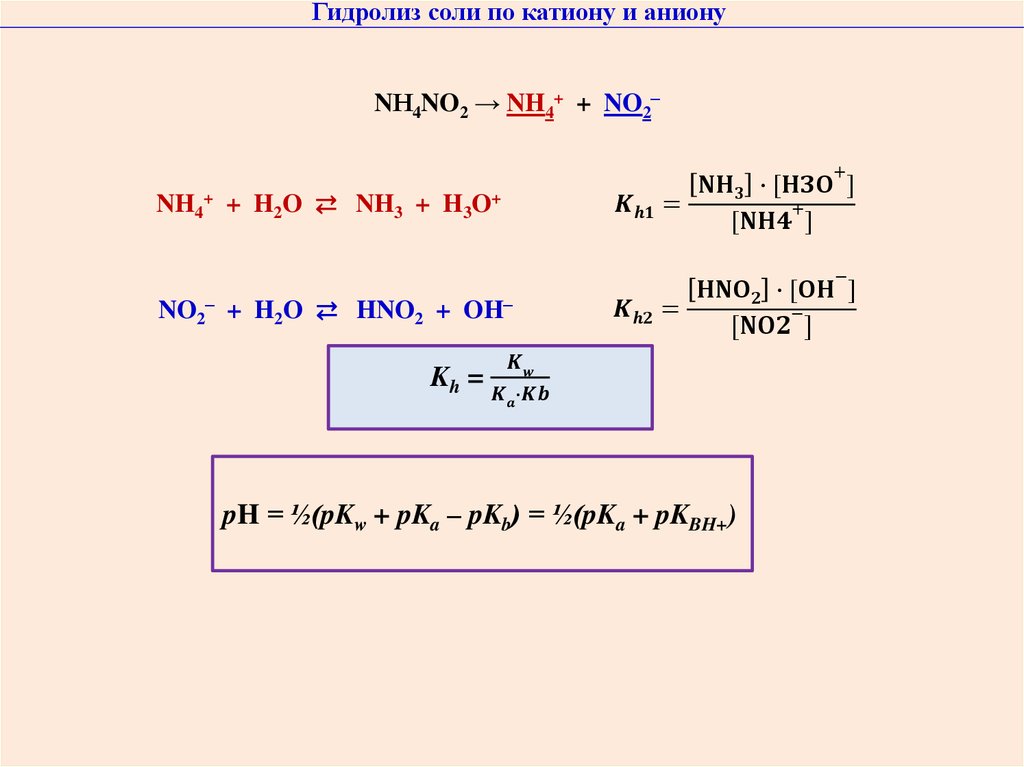
7. Гидролитические процессы в растворах солей
8. Расчет рН в растворах сильных и слабых электролитов
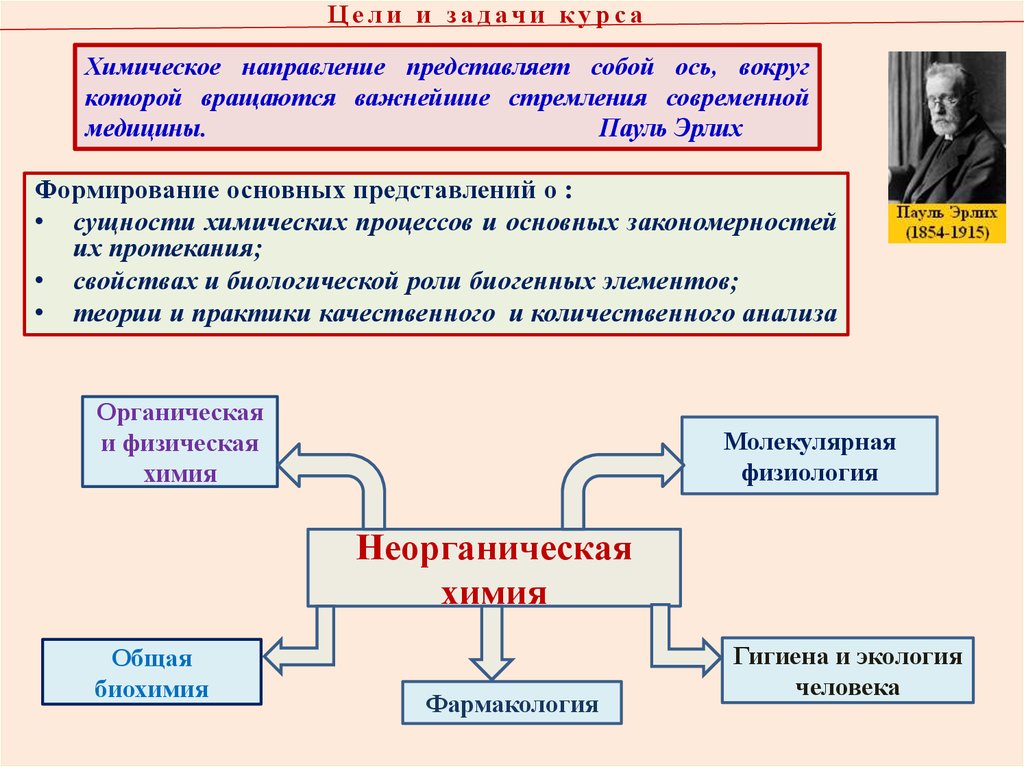
4. Цели и задачи курса
Ц е л и и з а д ач и ку рс аХимическое направление представляет собой ось, вокруг
которой вращаются важнейшие стремления современной
медицины.
Пауль Эрлих
Формирование основных представлений о :
• сущности химических процессов и основных закономерностей
их протекания;
• свойствах и биологической роли биогенных элементов;
• теории и практики качественного и количественного анализа
Органическая
и физическая
химия
Молекулярная
физиология
Неорганическая
химия
Общая
биохимия
Фармакология
Гигиена и экология
человека
5.
Х и м и ч е с ко е р а в н ов е с и еРЕАКЦИИ
О Б РАТ И М Ы Е
П р о те ка ют в пря м ом
и о б р а т н ом
направлениях:
N2 + 3 H2 2 NH3
« Н Е О Б РАТ И М Ы Е »
П р о те ка ют в одн ом
направлении:
AgNO3 + NaCl AgCl + NaNO3
продукты и реагенты
присутствуют в
реакционной смеси
В С Е Р Е А К Ц И И О Б РАТ И М Ы !
6.
Х и м и ч е с ко е р а в н ов е с и еХимическое равновесие ― такое состояние системы реагирующих
веществ, при котором за определенный интервал времени в
химическую реакцию вступают точно такие же количества веществ,
сколько их образуется из продуктов реакции.
Особенности равновесного состояния
1. Динамический характер: прямая и обратная реакции не
прекращаются, а идут с равными скоростями относительно
одного и того же вещества;
2. Постоянство состояния во времени при неизменных внешних
условиях;
3. Подвижность равновесия – смещение равновесия при изменении
внешних условий;
4. Возможен двусторонний подход к состоянию равновесия
7.
Химиче ское равнове сиеПримеры равновесных процессов
H2О(ж) H2O(г)
Фазовые равновесия:
– выпаривание – конденсация
2NO2(г) N2О4(г)
Ассоциация - диссоциация
– димеризация–диссоциация
HF + H2O H3
F–
O+
+
Протолитические равновесия:
– кислотно-основное равновесие
Гетерогенные равновесия:
AgCl(тв) Ag+ + Cl–
– равновесие в системе осадок – раствор
СO2(г) + Н2О(ж) СО2 ·Н2О (р-р)
– растворение газов
Окислительно-восстановительные равновесия:
2Fe3+ + 2I– 2Fe2+ + I2
– окисление-восстановление
Cu2+ +
Лигандообменные равновесия:
4NH3 [Cu(NH3)4]2+
– образование-диссоциация комплекса
Изомеризация:
– циклооксотаутомерия
8.
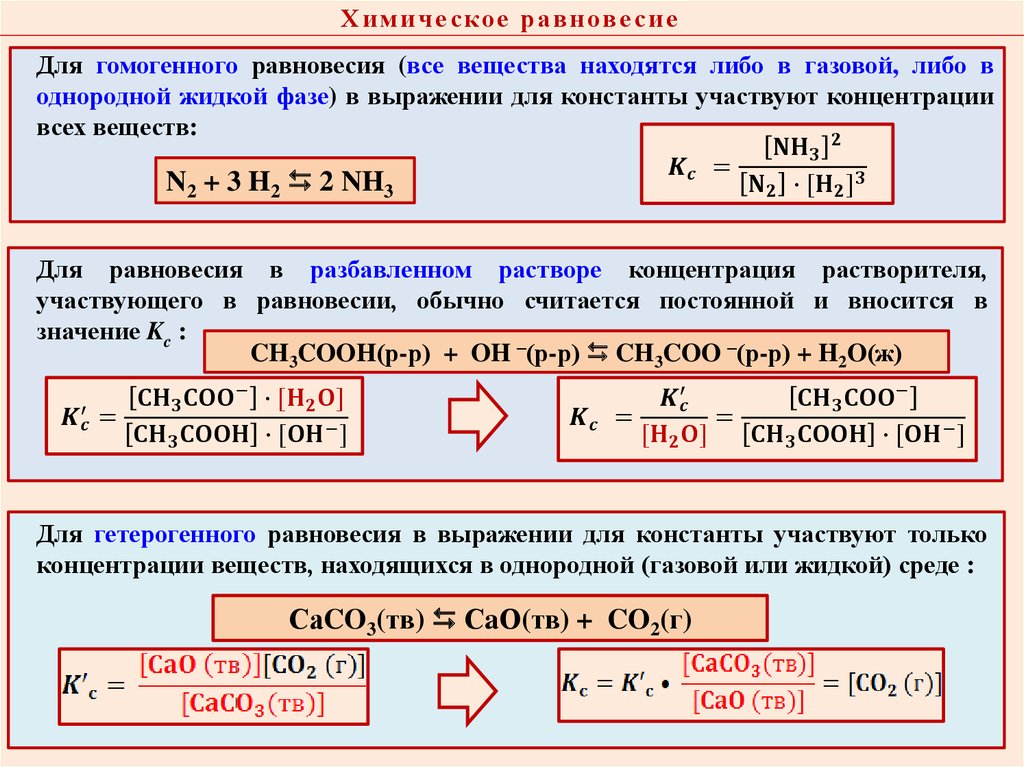
Х и м и ч е с ко е р а в н ов е с и еКонцентрации реагирующих веществ в условиях химического равновесия
называют равновесными концентрациями и часто обозначают химической
формулой вещества, заключенной в квадратные скобки. Например, для
обратимой реакции: N2 + 3 H2 2 NH3
равновесные концентрации реагентов обозначаются [N2], [H2] и [NH3].
Константа равновесия – количественная характеристика химического
равновесия, которая зависит только от температуры и природы
реагентов, и не зависит от их начальных концентраций
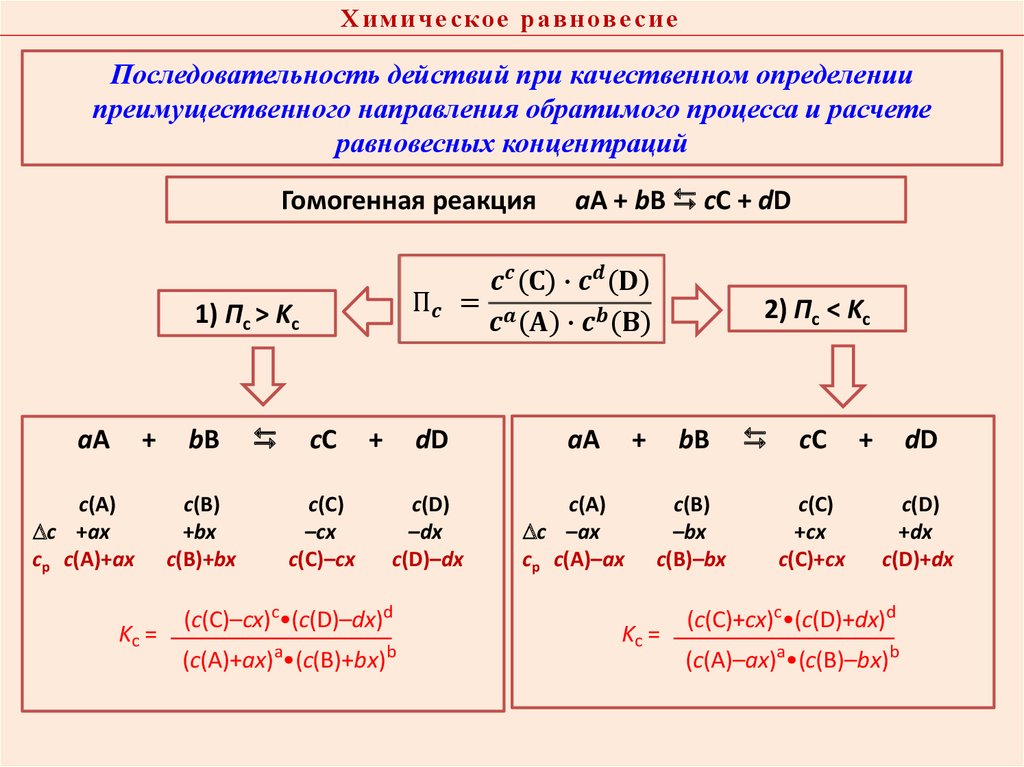
Гомогенная реакция
аА + bВ сС + dD
Математическое выражение для Kc из закона действующих масс:
9.
Х и м и ч е с ко е р а в н ов е с и еДля гомогенного равновесия (все вещества находятся либо в газовой, либо в
однородной жидкой фазе) в выражении для константы участвуют концентрации
всех веществ:


































 Химия
Химия








