Похожие презентации:
Химическое равновесие
1. Химические реакции – это необратимые самопроизвольные процессы, протекающие до установления равновесия.
Химическоеравновесие
Задачи химической
термодинамики:
1) Оценить возможность протекания
химической реакции
2) Определить её направление
3) Найти состояние равновесия
4) Определить влияние внешних
факторов на равновесие
5) Рассчитать max выход продуктов
реакции.
2.
G f ( p, T , , ,...)1
2
G
G
G
G
dG ( ) dp ( ) dT ( )
d (
)
d ...
T
,
p
,
T
,
p
,
1
T
,
p
,
2
p
T
1
2
1
2
(
G
) V ; ( G ) S
p T
T p
G
(
)
(1)
i
T , p, i
i
dG Vdp SdT d
i i
При p,T=const
dG d (2)
i i
При равновесии dG=0
i d i 0
(3)
- химический потенциал – часть изобарно-
изотермического потенциала, приходящаяся на 1 моль
данного участника химической реакции. (мольный
изобарный потенциал)
При P,T=const изменение энергии Гиббса в
системе равно суммарному изменению
химических потенциалов.
В состоянии равновесия суммарное изменение
химических потенциалов равно 0
3. Для 1 моля G=
Зависимость= f(p)
и
=f(c)
G G RT ln p
0
RT ln p(4)
0
- стандартный химический потенциал, это химический потенциал
0
системы когда р=1атм.
G G RT ln C
0
RT ln C (5)
0
- стандартный химический потенциал когда С=1
0
4. Константы химического равновесия
3HPH 2
H
2
3
2
N
2 NH
2
PN 2
N
3
i i 0,
PNH 3
NH
2
3
1
2
2 (3 1) 2
2 NH 3 3 H 2 N 2 0
0
0
0
( 2 NH
3 H
N
)
3
2
2
RT ( 2 ln p NH 3 3 ln p H 2 ln p N 2 ) 0
0
0
0
( 2 NH
3
H2
N 2 ) RT ln
3
Kp
0
2 NH
3
2
p NH
3
(6)
- константа равновесия
2
p NH
3
3
pH
pN2
2
p pN2
0
0
3 H
N 2 RT ln Kp(7)
2
3
H2
5.
Константа равновесия – это дробь, в числитель которой входятпарциальные давления конечных продуктов, а в знаменатель
исходных веществ, в степенях, соответствующих их
стехиометрическим коэффициентам. (Закон действующих масс)
В состоянии равновесия парциальные давления всех веществ связанные
определенным образом. Изменение Р одного из них автоматически
меняет Р других таким образом что Крав остается постоянной.
Связь между Крав, выраженные различными
способами КP, КC, КN
P cRT
Pi Pобщ N i
Kp Kc (RT ) (8)
i
Ni
i
Kp K N p
- мольная доля
участников реакции
(9)
6. При повышении давления состав равновесной смеси меняется, но константа равновесия (К0) остаётся той же величиной.
K0
p
P
3
2
p
NH 3 равн.
H 2 равн.
N 2 равн.
7. Влияние внешних условий на состояние равновесия. Принцип Гиббса-Ле Шателье
Влияние температурыДля экзотермической реакции
3H N 2 NH H
2
2
3
Джозайя-Уиллард
Гиббс
(11.02.183928.04.1903)
равновесие
T
T
Для эндотермической реакции
H ( U ) 0
CO(г) H O(г) CO (г ) H 2 (г )
2
2
Анри-Луи Ле-Шателье
(8.10.185017.09.1936)
H ( U ) 0
T
T
равновесие
8.
Влияние давление0 p K P
равновесие
0 p K P
равновесие
Особенности равновесия в
гетерогенных системах
Влияние концентрации
участников реакции
1)CaCO3 (т) CaO(т) CO2 (г)
Kp
pCaO pCO2
pCaCO3
pCaO, pCaCO3 const Kp / PCO2
0
p не влияет 1) FeO(ж) CO Fe(ж) CO2 (г)
Kp
pFe pCO2
pFeO pCO
pFe, pFeO const Kp
/
pCO2
pCO
9. Уравнение изотермы химической реакции Вант-Гоффа
Значение Можно оценить направление протекания реакции и состояниеуравнения: равновесия, если известна Крав и концентрации вещества в
исходном состоянии
Исходное
3H
(неравновесное
состояние)
PH/ 2
H
2
N
2
/
PN2
N2
2
NH
1
3
При p,T=const
2 NH
3
/
PNH 3
i i G
3
2
0
0
0
/
/
/
(2 NH
3
)
RT
(
2
ln
p
3
ln
p
ln
p
H2
N2
NH 3
H2
N 2 ) G
3
С учетом уравнения (7):
G RT ln Kp RT ln
Обозначим:
/2
p NH
3
p p
/3
H2
/
(10)
N2
G RT ln Kp RT ln p (11)
/
Ap RT ( ln p / ln Kp)(12)
ln
/2
p NH
3
p
/3
H2
p
/
N2
ln p /
G Ap
Уравнения изотермы хим. реакции
показывает максимальную полезную работу,
которую может совершить обратимо
протекающая химическая реакция при
переходе исходного (неравновесного) в
конечное (равновесное) состояние.
10. Анализ уравнения Вант-Гоффа(11)
2) Δlnṕ=lnKp;1) Δlnṕ>lnKp; ΔG>0
ΔG=0
т.е. реакция не идёт
Состояние
слева направо (так
равновесия
как записана), но её
протекание
возможно справа
налево, когда ΔG<0
3) Δlnṕ<lnKp; ΔG<0
Реакция протекает
слева направо, т.е.
так как она
записана
Исходное состояние приводят к стандартному:
ṕH = ṕN = ṕNH =1 атм, тогда
GTo RT ln Kp(13)
GTo
ln Kp
(13/ )
RT
2
2
3
- Уравнение изотермы химической реакции
Вант-Гоффа в стандартных условиях
11. Подставив в уравнение (14)
r GT0 r HT0 T r ST0 (14)r H T0
- Энергия Гиббса для реакции
-рассчитывается по уравнению
Кирхгоффа и закону Гесса (с помощью
стандартных энтальпий образования)
r ST0
-рассчитывается по абсолютным
энтропиям участников реакции
При T=298
0
o
o
r G298
( i f G298
)прод ( i f G298
)исх (15)
В справочниках приводятся
0
f G298
0
o
o
r H 298
( i f H 298
) прод ( i f H 298
)исх (16)
При T<>298
T
0
r H T0 r H 298
( a bT cT 2 ...)dT (17)
S S
0
T
0
298
298
a
( b cT ...)dT (18)
T
298
T
T
rG r H
o
T
0
298
( a bT cT ...)dT T S
2
298
Метод Темкина-Шварцмана:
o
r 298
a
T ( b cT ...)dT (19)
T
298
T
0
0
r GTo r H 298
T r S 298
T ( aM 0 bM 1 cM 2 c / M 2 )( 20)
M 0 , M1 , M 2 , M 2 f (T ) в справочниках
12.
Расчет f G298 ведется так же, как и теплового эффекта. По энергиям Гиббсаобразования из простых веществ.
0
В таблицах справочников приводится f G298 (Т=298 и Р=1атм)
0
Для простых веществ f G298
=0
0
По величине f G298 можно судить об устойчивости и
реакционной способности данного соединения:
0
0,это означает, что Крав реакции
1) Если f G298
образования данного соединения велика(lnKр>>0), т.е. в
реакционной смеси находится мало продуктов
разложения, т.е. соединение устойчиво и мало
реакционоспособно. Оно вступает в реакцию с
соединениями более устойчивыми
0
2) Если f G298 0, то это означает, что Крав мала
(lnKp<<0),т.е. соединение неустойчиво и
реакционоспособно.
0
13. Зависимость константы равновесия от Т Уравнение изобары и изохоры Вант-Гоффа
GT0 RT ln Kp(1)Уравнение изотермы Вант-Гоффа
GT0
G H T (
) p (2) Уравнение Гиббса-Гельмгольца
T
GT0
ln Kp
R ln K p RT
(3)
T
T
0
T
0
T
RT ln K p H T0 RT ln K p RT 2
ln K p
H T0
( 4)
2
T
RT
ln K c U T0
(5)
T
RT 2
ln K p
T
Уравнение изобары
Вант-Гоффа
Уравнение изохоры
Вант-Гоффа
KT 2 H T0 1
1
1) H const ; ln
( )
KT 1
R T1 T 2
2) ln K T
H 1
const
R T
H f (T )
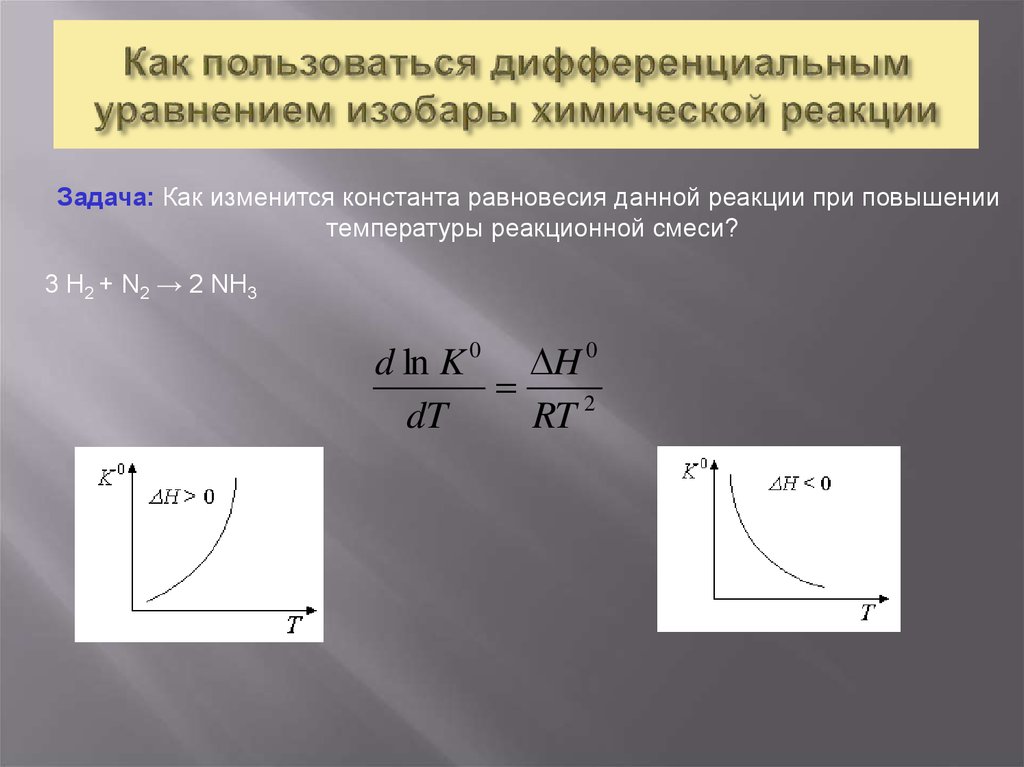
14. Как пользоваться дифференциальным уравнением изобары химической реакции
Задача: Как изменится константа равновесия данной реакции при повышениитемпературы реакционной смеси?
3 H2 + N2 → 2 NH3
d ln K 0 H 0
dT
RT 2
15. Как пользоваться интегральным уравнением изобары химической реакции
ЗадачаИзвестны константы равновесия при 2-х температурах:
К01 при Т1 = 500К
К02 при Т2 = 570К
Посчитать константу равновесия при некоторой третьей температуре:
К03 при Т3 = 590К
16. задача
Известны1) исходный состав реакционной смеси,
2) Т и общее давление в реакторе
Определить направление химического процесса.
Т =500К, Р = 5атм.
NH3,
10 моль
Н2,
N2
190 моль 300 моль
Т =500К, Р = 5атм
3 H2 + N2 → 2 NH3
Термодинамический процесс
NH3,
12 моль
Н2,
187 моль 299 моль
G2
G1
N2
17.
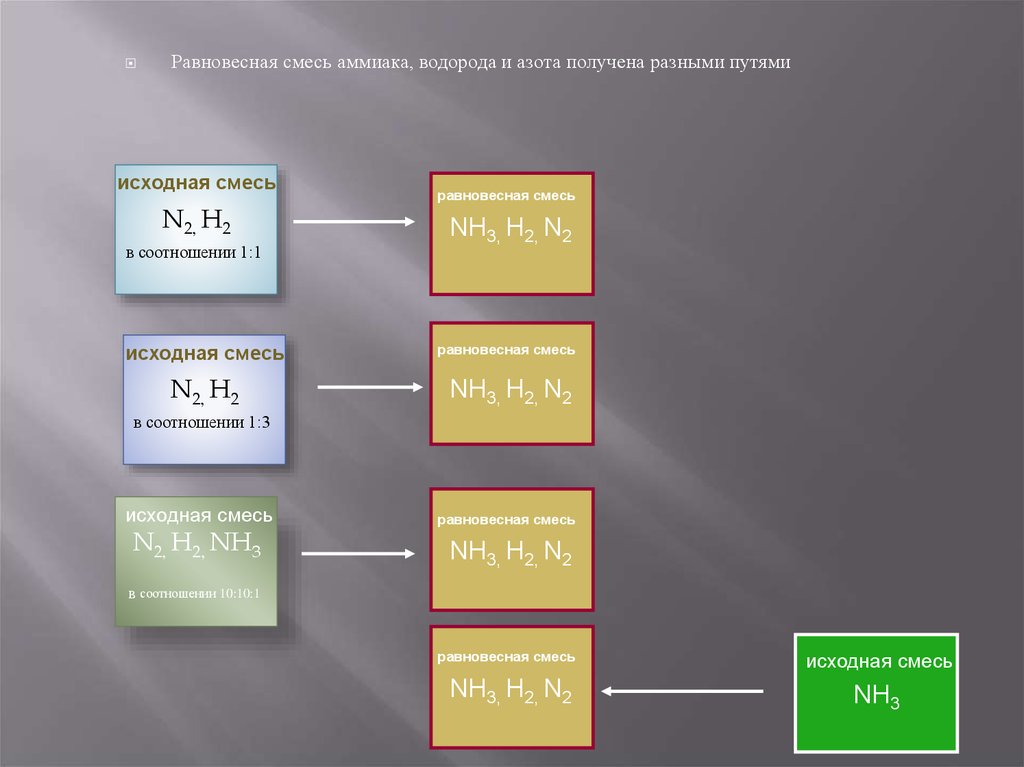
Равновесная смесь аммиака, водорода и азота получена разными путямиисходная смесь
N2, H2
в соотношении 1:1
равновесная смесь
NH3, Н2, N2
исходная смесь
равновесная смесь
N2, H2
NH3, Н2, N2
в соотношении 1:3
исходная смесь
N2, H2, NH3
равновесная смесь
NH3, Н2, N2
в соотношении 10:10:1
равновесная смесь
исходная смесь
NH3, Н2, N2
NH3
18.
Изменение константы равновесия реакции N2 + 3H2 = 2NH3 взависимости
от температуры
Температура,0С
Константа равновесия, K0
300
4.34∙10-3
400
1.64∙10-4
450
4.51∙10-5
500
1.45∙10-5
550
5.38∙10-6
600
2.25∙10-6
Влияние температуры и полного давления газовой смеси на равновесный выход
аммиака для исходной смеси с соотношением реагентов H2 /N2 равном 3/1.
Температура,0С
Полное давление реакционной смеси, атм
200
300
400
500
400
38,7%
47,8%
54,9%
60,6%
450
27,4%
35,9%
42,9%
48,8%
500
18,9%
26,0%
32,2%
37,8%
600
8,8%
12,9%
16,9%
20,8%
















 Химия
Химия








