Похожие презентации:
Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов
1.
Тема урока:Электронные конфигурации
атомов химических элементов.
Графическое изображение
электронных конфигураций
атомов
2.
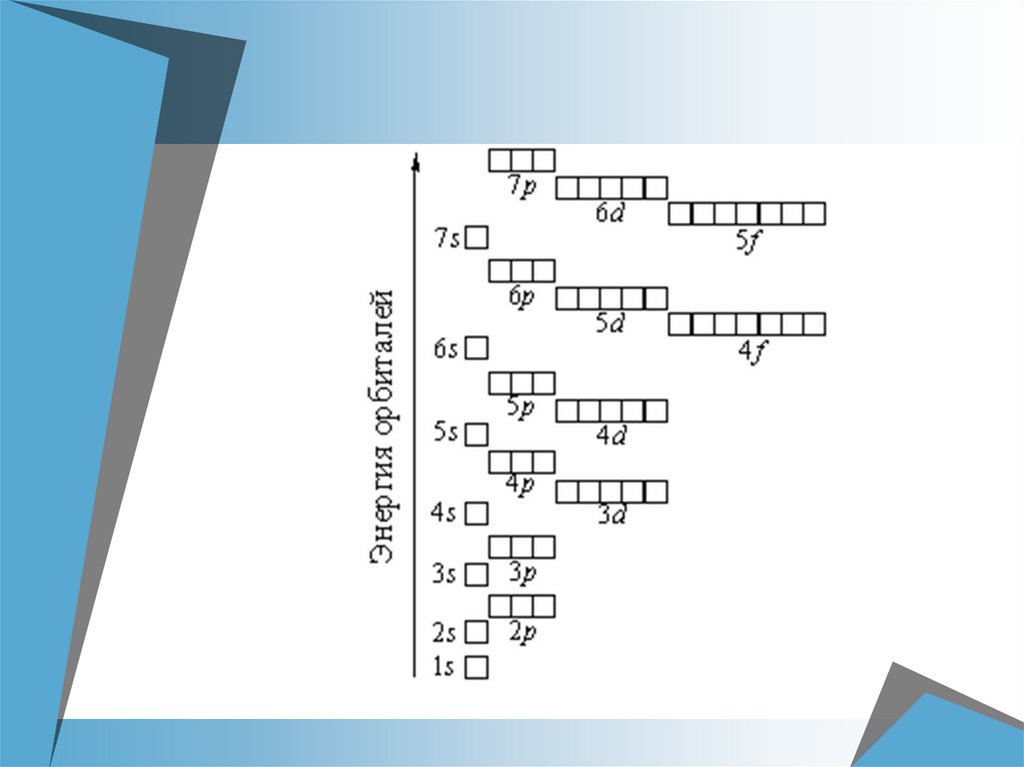
Принцип минимальной энергииЭлектроны заполняют орбитали в
порядке увеличения их энергии
Следовательно, заполняется тот
энергетический уровень, тот
подуровень, та АО, которая ближе
к ядру: 1s, 2s, 2р, ...
3.
ЗаданиеНапишите электронные конфигурации
химических элементов: фосфора и марганца
15
P
25
Mn
1s2
1s2
2s2
2p6
2s2 2p6 3s2
3s2
3p6
3p3
4s2 3d5
4.
5.
Правило Клечковского (1861 г.)вначале записывается та АО, тот
подуровень, тот энергетический уровень,
где сумма квантовых чисел n + l будет
меньше. Чем меньше эта сумма, тем
меньше энергия подуровня.
3d: сумма n + l = 3 + 2 = 5.
4s: сумма n + l = 4 + 0 = 4.
4 < 5 ⇒ вначале заполняется 4s
6.
ЗаданиеНапишите электронные конфигурации
химических элементов: ванадия и цинка
23
V
30
Zn
1s2 2s2 2p6 3s2 3p6 4s2 3d3
1s2 2s2 2p6 3s2 3p6 4s2 3d10
7.
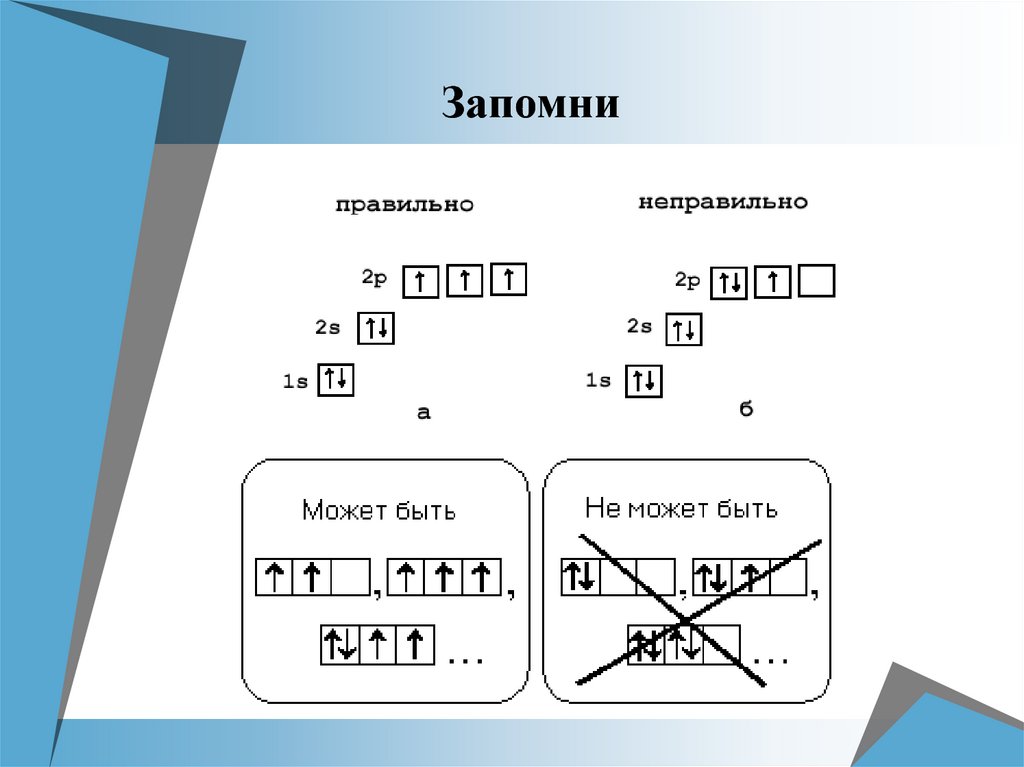
Принцип ПаулиВ атоме не может быть двух электронов, у
которых все четыре квантовых числа
охарактеризованы одинаковыми
значениями.
Из этого принципа следует следствие: в
одной АО могут находиться не более
двух электронов, охарактеризованных
различными значениями спинового
квантового числа.
8.
Пример: Дана электронная формула атомахимического элемента 1. S2
Нe + 2
2
2
S 1 S
n=1
l = 0 один подуровень
ml = 0 одна орбиталь
S - элемент
2 спаренных электрона на завершенной оболочке
Орбиталь рисуем ячейкой, электрон — вектором.
9.
Правило Хунда (Гунда)При распределении электронов в подуровнях
р-, d-, f- следует помнить, что суммарный спин
был максимальным.
Следствие из правила Хунда
Электроны сначала по одному занимают все
АО, а потом идут на спаривание.
— неспаренные электроны (по
одному на АО).
— спаренные электроны (по два
на АО)
— одна пара спаренных е- и два
неспаренных е-.
10.
Запомни11.
Проскок электрона — отступления от общей длябольшинства элементов последовательности
заполнения электронных оболочек.
Полузаполненные и заполненные d-подуровни
более устойчивые, чем частично заполненные
Исключения 10 элементов:
Сu, Ag, Au, Cr, Md, Nb, Ru, Rh,Pd, Pt.
В атомах данных элементов происходит
самопроизвольный переход одного электрона
(у Pt — двух) с s-подуровня внешнего
энергетического уровня в d-подуровень
предвнешнего энергетического уровня.
12.
Атомная валентная зонаЭлемент
теоретическая
практическая
Cu
Ag
Au
Cr
Mo
3d9 4s2
4d9 5s2
5d9 6s2
3d4 4s2
4d45s2
3d10 4s1
4d10 5s1
5d10 6s1
3d5 4s1
4d5 5s1
13. Выводы
Причина сходства элементовзаключается в одинаковом строении
внешних энергетических уровней их
атомов
Одинаковое строение внешних
энергетических уровней периодически
(т.е. через определенные промежутки периоды) повторяется, поэтому
периодически повторяются и свойства
химических элементов
14. Домашнее задание
Проработать §3-4Письменно ответить на вопросы 1-5,
стр.24
15. Рефлексия
Я все понял, могуобъяснить другому
По данной теме у меня
остались вопросы
Недостаточно понял
тему, сам ошибаюсь
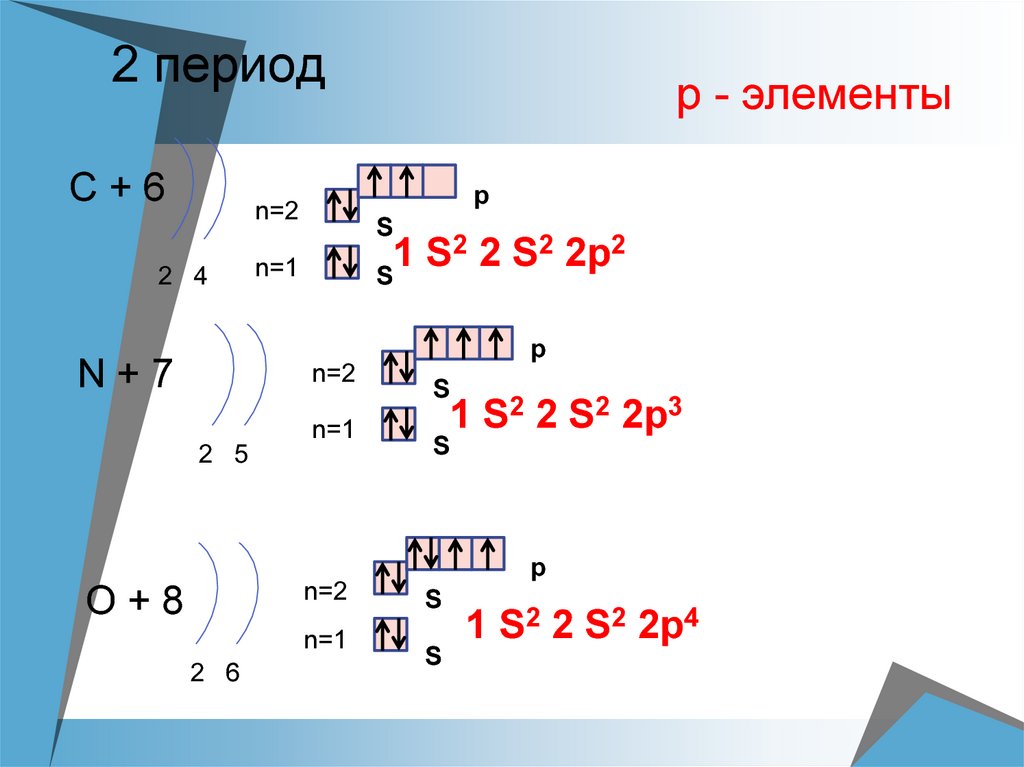
16. 2 период
С+6p
n=2
2 4
р - элементы
S
2 2 S2 2p2
1
S
S
n=1
p
N+7
n=2
n=1
2 5
S
1 S2 2 S2 2p3
S
p
n=2
O+8
n=1
2 6
S
S
1 S2 2 S2 2p4
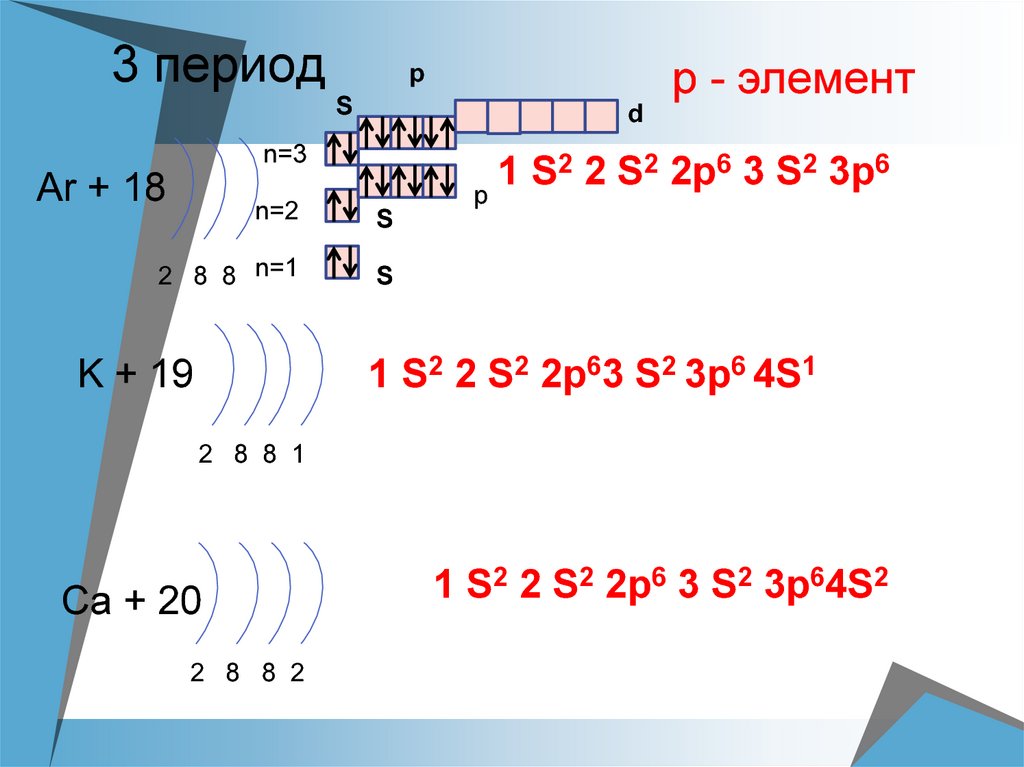
17. 3 период
Sd
n=3
Ar + 18
р - элемент
p
2 2 S2 2p6 3 S2 3p6
1
S
p
n=2
S
2 8 8 n=1
S
1 S2 2 S2 2p63 S2 3p6 4S1
K + 19
2 8 8 1
Ca + 20
2 8 8 2
1 S2 2 S2 2p6 3 S2 3p64S2












 Химия
Химия








