Похожие презентации:
Отбор, транспортировка и хранение материала для исследования методом ПЦР
1. Отбор, транспортировка и хранение материала для исследования методом ПЦР
ОТБОР, ТРАНСПОРТИРОВКА И ХРАНЕНИЕМАТЕРИАЛА ДЛЯ ИССЛЕДОВАНИЯ МЕТОДОМ ПЦР
Кузнецова М.М., к.б.н.
2.
Полимеразная цепная реакция (ПЦР)ПЦР – это метод лабораторной
диагностики, направленный на
выявление специфического участка
ДНК возбудителя, путём
многократного удвоения этого
участка
2
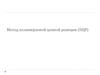
3. Этапы ПЦР
Денатурация ДНК(95оС)
Отжиг
праймеров
(55-65оС)
Полимеризация цепей
ДНК
(72оС)
3
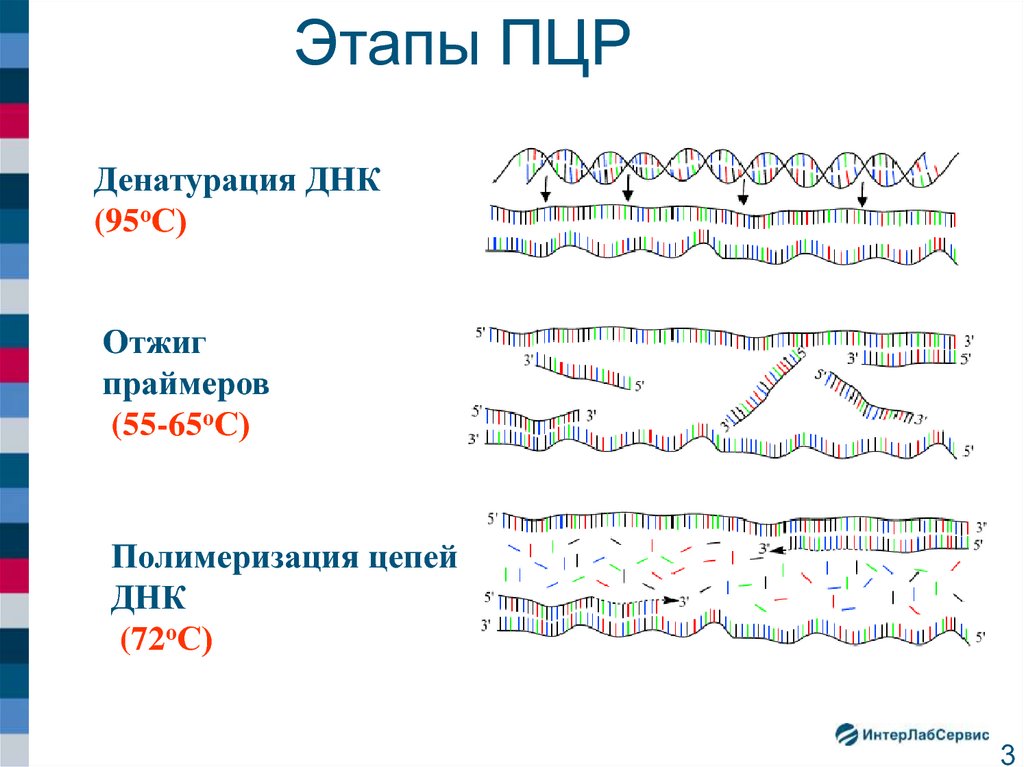
4. Цикличность реакции амплификации
ДенатурацияДенатурация
Денатурация
Денатурация
Денатурация
Денатурация
Денатурация
Денатурация
Полимеризация
Отжиг
Денатурация
Полимеризация
Отжиг
праймеров
Полимеризация
Отжиг
праймеров
Полимеризация
Отжиг
N=40
праймеров
Полимеризация
Отжиг
праймеров
Полимеризация
Отжиг
праймеров
Полимеризация
Отжиг
праймеров
Полимеризация
Отжиг
праймеров
Полимеризация
Отжиг
праймеров
N – количество
праймеров
циклов ПЦР
N=1
4
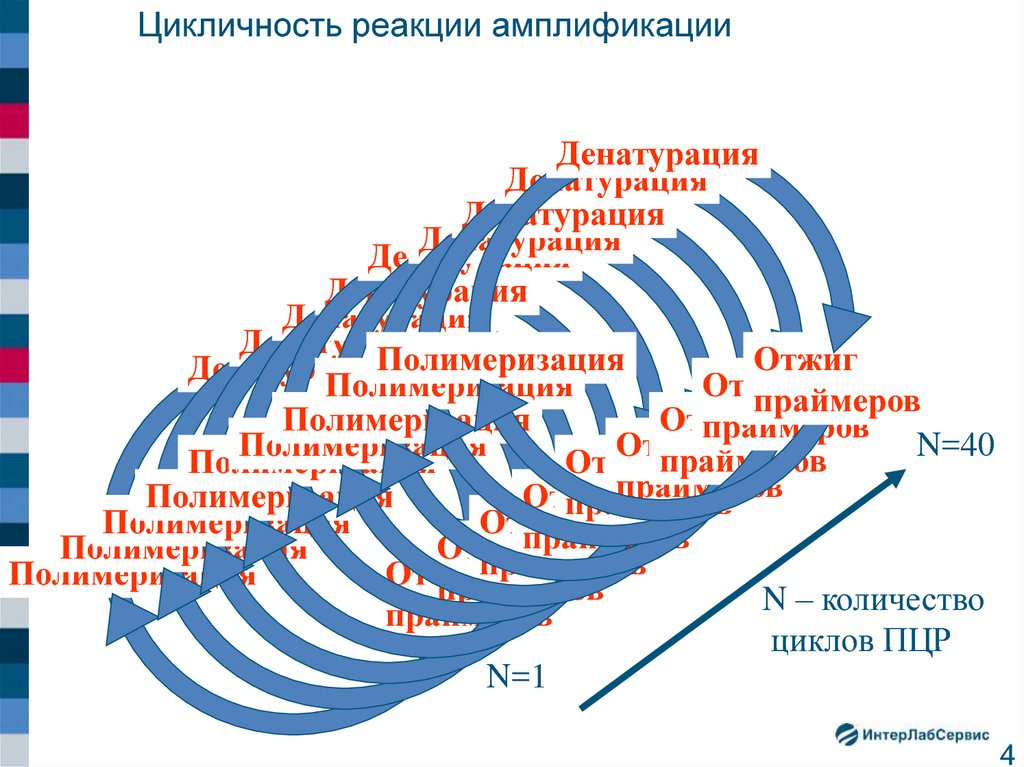
5. Экспоненциальный характер течения ПЦР
6.
7.
Основные характеристики ПЦРВысокая чувствительность, основанная на
экспоненциальном принципе накопления продукта.
Высокая специфичность, основанная на выявлении
уникальных для микро-(макро)-организма участков
генетического материала.
Метод прямого выявления возбудителя, основанный на
универсальности способа хранения и передачи
генетической информации живой материи.
Универсальность протокола исследования: единый
принцип экстракции и амплификации ДНК/РНК
Выявление некультивируемых возбудителей
(например, вирусы)
Возможность стандартизации: все этапы
лабораторного исследования можно автоматизировать
8.
Характеристика тест-систем на основе ПЦРВысокая специфичность, основанная на
выявлении уникальных для
микроорганизма участках генетического
материала
Высокая чувствительность, основанная
на экспоненциальном накоплении мишени
НК (500 – 1000 клеток на мл)
9.
Преимущества метода ПЦРПрямой метод обнаружения возбудителя
Широкий спектр биологического
материала
Кровь, сыворотка
Моча
Фекалии
Соскобы, мазки со слизистых
Слюна
Сперма
Внутренние органы и др.
10.
Особенности применения метода ПЦРАдекватный материал
Где искать?
Когда искать?
Хранение, транспортировка материала
Как хранить?
Как транспортировать?
11.
Экстракция нуклеиновых кислот (НК)- получение очищенного препарата НК
Биологический материал
Лизис клеточных
оболочек
Разрушение
нуклеопротеидных
комплексов
Инактивация эндогенных
и экзогенных нуклеаз
Удаление ингибиторов ПЦР
Концентрирование
в малом объеме
Очищенный препарат ДНК/РНК
12.
Ингибиторы ПЦРГемоглобин
Гепарин
Иммуноглобулины
Билирубины и желчные кислоты
Слизь (мукополисахариды)
Гормоны
Ферменты
Ионы металлов (Ca2+, Fe3+)
Соли
Продукты жизнедеятельности микрофлоры
Высокомолекулярная геномная ДНК
13.
Методы экстракции нуклеиновых кислотПростые (экспресс) – кипячение, разбавление
Быстрые в исполнении,
НО!
Низкая эффективность
очистки от ингибиторов
Нет концентрирования
Непригодны для
выделения РНК!!!
14.
Сложные – сорбция ДНК/РНК на носителе/преципитация НК и удаление ингибиторов
промыванием
Длительные и трудоемкие (по сравнению экспресс)
Высокая эффективность экстракции
Высокая эффективность удаления ингибиторов
Возможность автоматизации
15.
Сложные методы экстракциинуклеиновых кислот
Лизис хаотропными агентами (н-р.
гуанидинтиоцианат) сорбция ДНК/РНК на силикагеле
или магнитных частицах (ДНК-сорб В, РИБО-Сорб,
МАГНО-сорб)
Лизис хаотропными агентами сорбция ДНК/РНК на
стекловолоконных фильтрах
(Qiagen Inc., АВТО-сорб)
Лизис гуанидинтиоцианатом кислофенольная
экстракция РНК высаживание РНК изопропанолом
(РИБО-золь).
Для экстракции ДНК используют фенол pH=8.0
Лизис гуанидинтиоцианатом высаживание
РНК/ДНК изопропанолом в присутствии носителя
16.
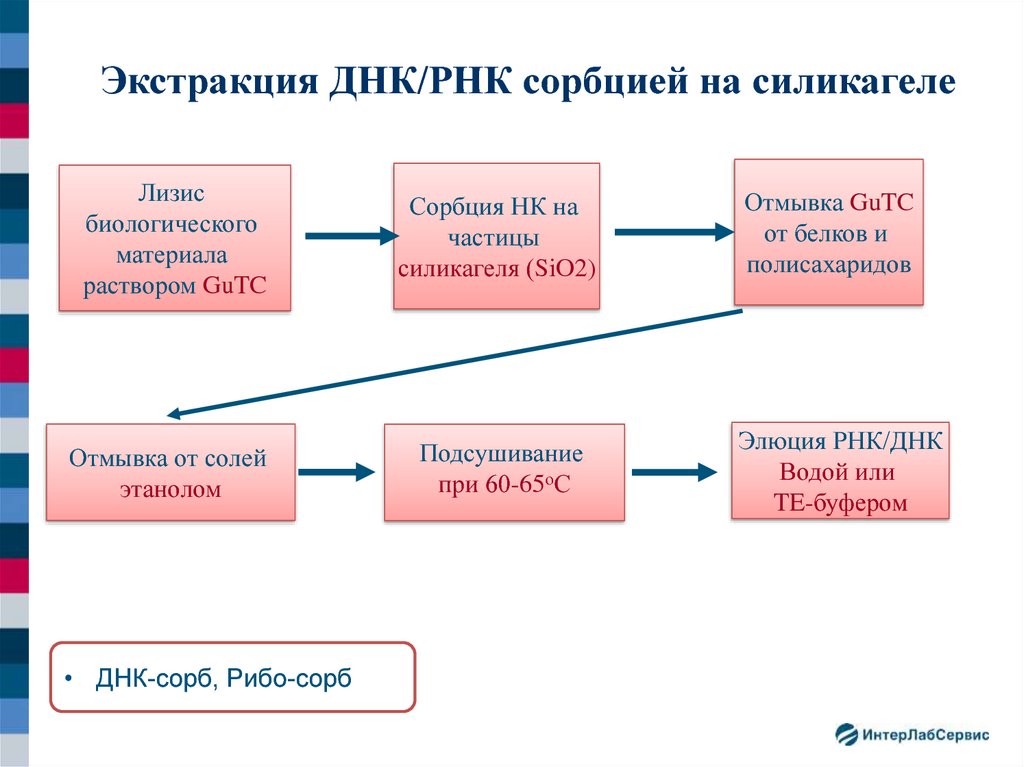
Экстракция ДНК/РНК сорбцией на силикагелеЛизис
биологического
материала
раствором GuTC
Сорбция НК на
частицы
силикагеля (SiO2)
Отмывка от солей
этанолом
Подсушивание
при 60-65оС
• ДНК-сорб, Рибо-сорб
Отмывка GuTC
от белков и
полисахаридов
Элюция РНК/ДНК
Водой или
TE-буфером
17.
Схема экстракции НК сорбцией на колонкахПроба
Лизирующи
й раствор
Лизис
Сорбци
я НК
Удаление
примесей
Элюция
НК
• Возможность автоматизации процесса («QIAcube», Qiagen Inc.)
• Использовать ВКО из ПЦР-комплекта!
Перенос
НК в
чистую
пробирку
18.
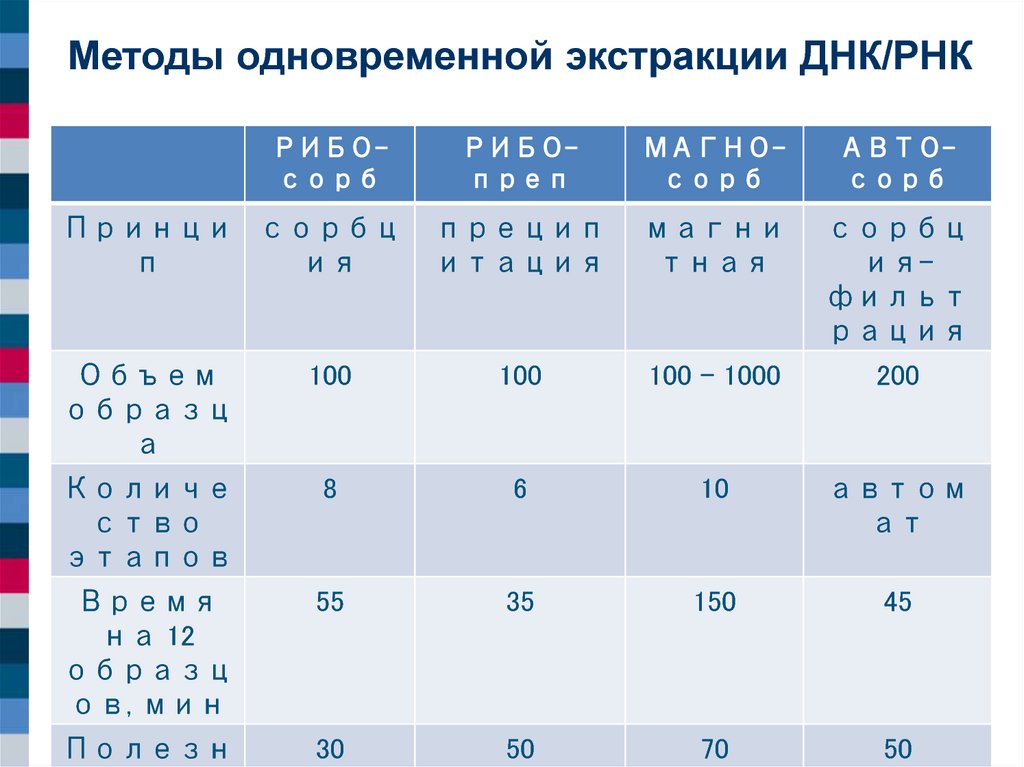
Методы одновременной экстракции ДНК/РНКРИБОсорб
Принци сорбц
п
ия
РИБОпреп
МАГНОсорб
АВТОсорб
прецип
итация
магни
тная
сорбц
ияфильт
рация
Объем
образц
а
100
100
100 - 1000
200
Количе
ство
этапов
8
6
10
автом
ат
Время
на 12
образц
ов, мин
55
35
150
45
Полезн
30
50
70
50
19.
Внутренний контроль (ВК) –неотъемлемая часть ПЦР-исследования
Контроль взятия и сохранности материала (эндогенный)
Потери ДНК/РНК (эффективность экстракции)
Полнота удаления ингибиторов
Контроль за работой персонала
20.
Общая классификация (ВК)РНК/ДНК
Эндогенный – экзогенный
Флуоресцентные - электрофоретические
21.
РНК и ДНК контролиМишень
Контроль
ДНК,
ДНК
вирусов,
бактерий
упакованная в фаг λ
или
Эндогенный
фрагмент
ДНК генома
животного
РНК,
РНК вирусов,
мРНК
бактерий
упакованная в
фаг MS2
или
Эндогенная мРНК
генома
животного
22.
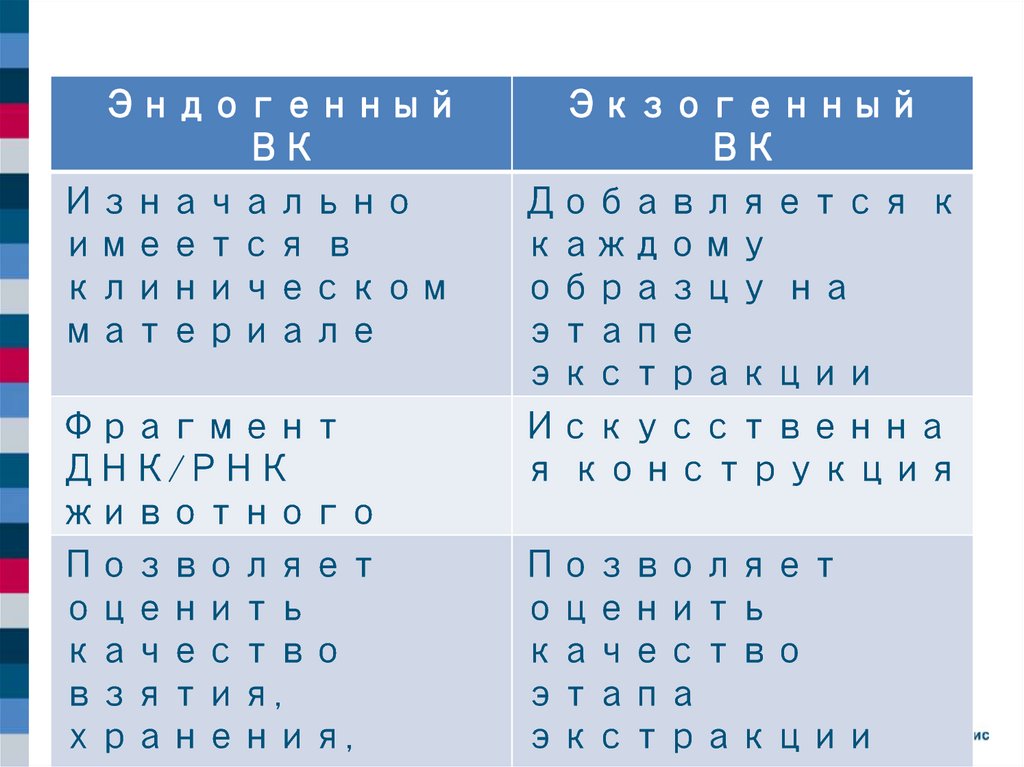
ЭндогенныйВК
Изначально
имеется в
клиническом
материале
Фрагмент
ДНК/РНК
животного
Позволяет
оценить
качество
взятия,
хранения,
Экзогенный
ВК
Добавляется к
каждому
образцу на
этапе
экстракции
Искусственна
я конструкция
Позволяет
оценить
качество
этапа
экстракции
23. Использование экзогенного ВК при проведении ПЦР-исследования
вкообразцы
Экстракция НК
В- К- К+
В-
В- К- К+
Маркер
длин
ДНК
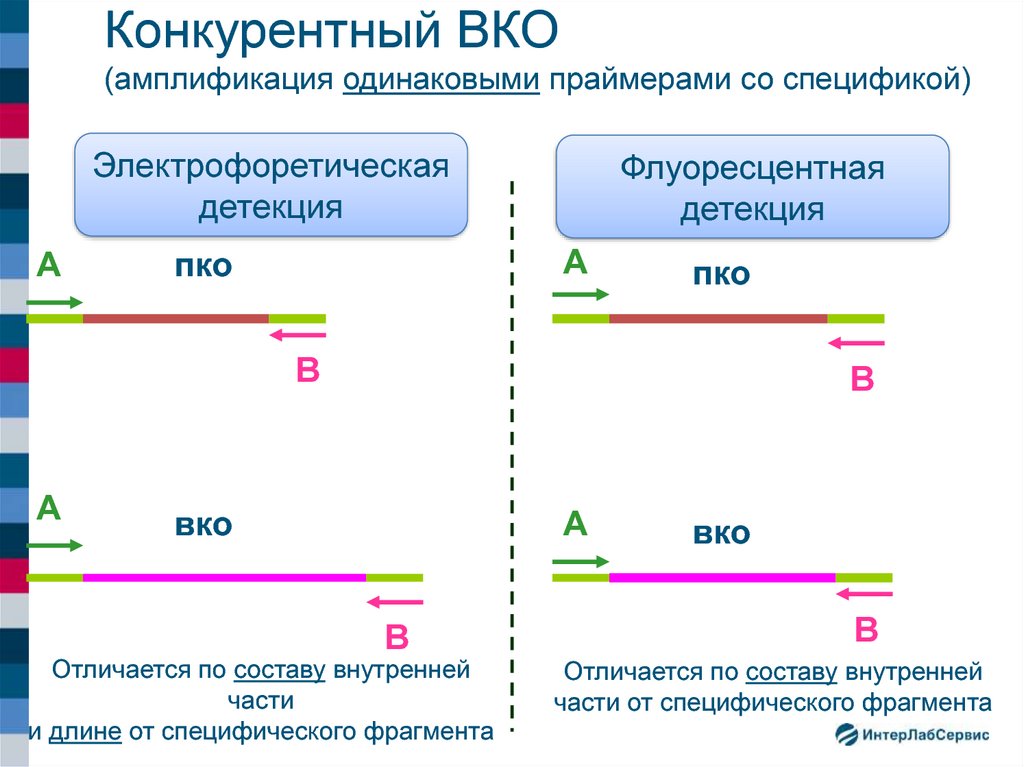
24. Конкурентный ВКО (амплификация одинаковыми праймерами со спецификой)
Электрофоретическаядетекция
А
Флуоресцентная
детекция
А
пко
пко
В
А
В
вко
А
В
Отличается по составу внутренней
части
и длине от специфического фрагмента
вко
В
Отличается по составу внутренней
части от специфического фрагмента
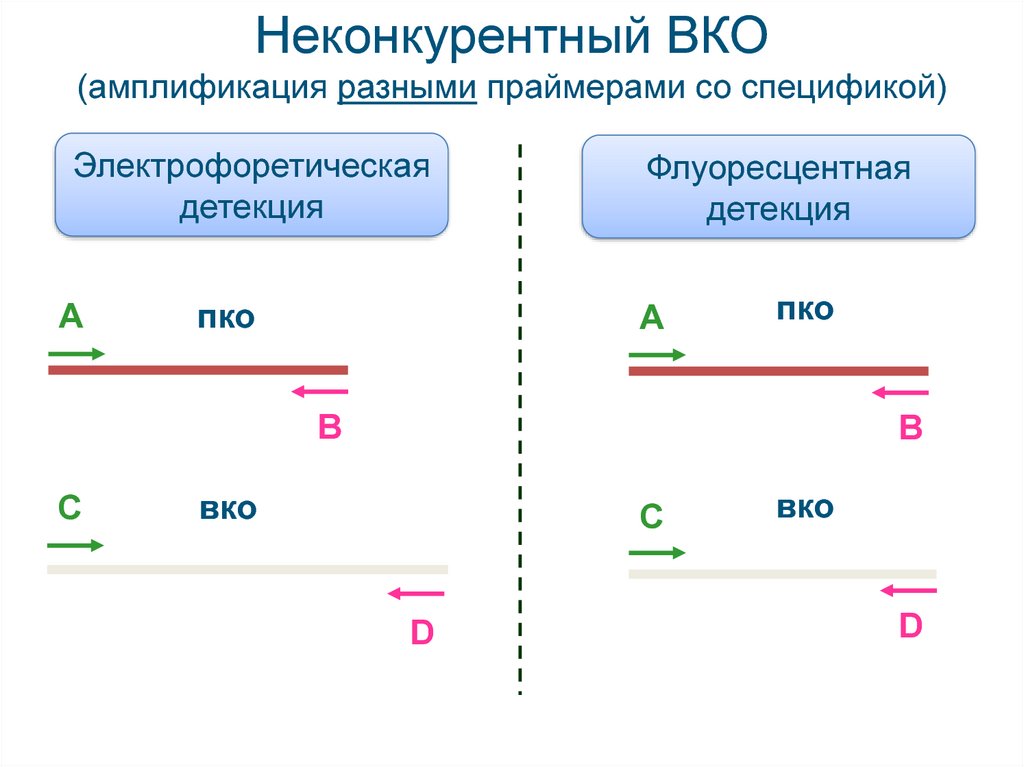
25. Неконкурентный ВКО (амплификация разными праймерами со спецификой)
Электрофоретическаядетекция
А
пко
Флуоресцентная
детекция
А
пко
В
С
В
вко
С
D
вко
D
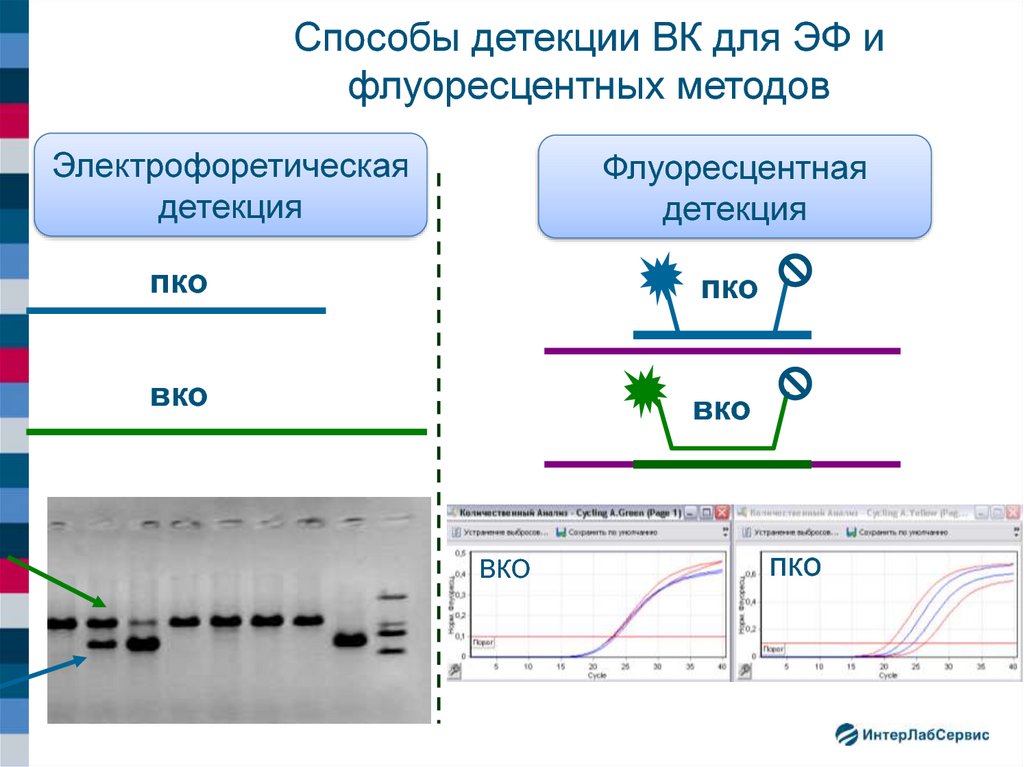
26. Способы детекции ВК для ЭФ и флуоресцентных методов
Электрофоретическаядетекция
Флуоресцентная
детекция
пко
пко
вко
вко
ВКО
пко
27.
Ключевые моменты предамплификационныхэтапов для получения правильного результата
ПЦР-исследования
Адекватный вид материала
Зачем искать?
Где искать?
Когда искать?
Правильное взятие материала
Хранение и транспортировка
по инструкции
Метод экстракции
28.
Ключевые моменты выбора материала дляПЦР-исследования
Цель
Мониторинг
Скрининг
Выявление этиологического агента
другие
Патогенез
Где искать?
Когда искать?
Возраст и пол
Вид животного
29.
Принципы взятия материалаАсептика и антисептика
Одноразовые пробирки
Индивидуальные инструменты
Количество, достаточное для повторного исследования
Понятная маркировка
Правильная упаковка
30.
Материал для ПЦР-исследованияКровь, сыворотка/плазма
Материал из респираторного тракта
Урогенитальные мазки
Сперма
Фекалии, помет, ректальные мазки
Молоко
Корма
Вода
31.
Цельная кровьОтбор в одноразовые пробирки
ЭДТА или цитратом натрия
Гемолитик
РИБО-сорб (РНК), РИБО-преп (РНК+ДНК), ДНК-сорб-В(ДНК)
50-100 мкл
Сыворотка/плазма крови
Без предобработки
РИБО-сорб, РИБО-преп, ДНК-сорб-В, МАГНО-сорб
100 мкл или более
32.
КровьБиохимия, серология, ИФА
Пробирка покрыта тонкодисперсными частицами
диоксида кремния, которые ускоряют процесс
образования кровяного сгустка
Небьющийся корпус пробирки исключает потерю
биопробы и контаминацию окружающих
предметов
ПЦР и гематология
Внутренняя стенка пробирки покрыта EDTA в
концентрации 1,8 мг на 1 мл крови, которая
предотвращает свертывание крови, блокируя
ионы кальция и не влияет на гематологические
параметры
Эритроциты, лейкоциты остаются стабильными
до 24 часов, тромбоциты в течении 6-8 часов.
33.
34.
35.
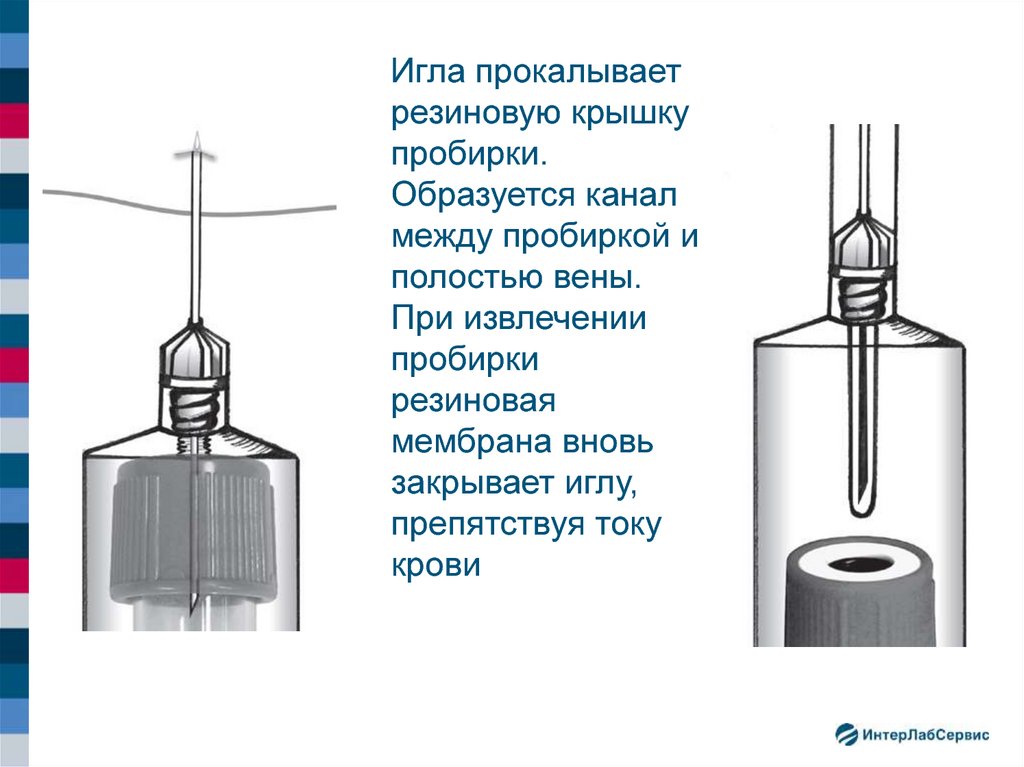
Игла прокалываетрезиновую крышку
пробирки.
Образуется канал
между пробиркой и
полостью вены.
При извлечении
пробирки
резиновая
мембрана вновь
закрывает иглу,
препятствуя току
крови
36.
КРСЛошади
Из яремной вены (v. jugularis)
Кровь берут в нижней трети шеи
Из хвостовой вены (v .сoccygea)
Кровь берут в средней трети тела 2-5
хвостовых позвонков, находящейся на
линии, идущей вдоль хвоста и делящей
его на 2 симметричные части.
37.
СвиньиИз ушной вены (v. auricularis)
Из яремной вены (v.jugularis)
Из хвостовой вены (v .сoccygea)
Из передней полой вены (v. cava inferior)
38.
Мелкиедомашние животные
из лучевой (v. radialis) вены
из бедренной (v. femoralis) вены
Можно комплектовать пробирку
иглой-бабочкой с люер-адаптером,
что позволит поставить капельницу
без дополнительной венепункции
39.
Материал из респираторного трактаМазки из рото- и носоглотки
Стерильный одноразовый зонд из акрона или вискозы
Транспортная среда для респираторных мазков
Без предварительной обработки
РИБО-сорб, РИБО-преп, ДНК-сорб-В
100 мкл
Не использовать зонды
на деревянной основе
Не использовать зонды с
хлопковыми тампонами
40.
41.
Материал из респираторного трактаТрахеобронхиальный лаваж – 20 мл
Бронхоальвеолярный лаваж – 20 мл
Стерильные полипропиленовые пробирки
Для бактериальных возбудителей – 1,5мл ТБЛ/БАЛ
центрифугировать при 12000g 15 минут, надосадочную жидкость
удалить и ресуспендировать осадок в 100 мкл PBS или физ.раствора
Для вирусных возбудителей – 100 мкл ТБЛ/БАЛ без
предварительного центрифугирования
РИБО-сорб, РИБО-преп, ДНК-сорб-В – 100 мкл
42.
Материал из урогенитального трактаМазки, соскобы
РИБО-сорб, РИБО-преп, ДНК-сорб-В – 100 мкл
Смывы с препунция
РИБО-сорб, РИБО-преп, ДНК-сорб-В – 100 мкл
Сперма
Нативная/консервированная
К образцу добавить 4 объема PBS, центрифугировать 5 минут при 6500g
РИБО-сорб, РИБО-преп, ДНК-сорб-В – 100 мкл надосадочной жидкости
43.
Фекалии, пометНе менее 5 гр в стерильном контейнере
10-20% суспензия
РИБО-сорб, РИБО-преп, ДНК-сорб-В – 100 мкл
Хранение:
С добавлением 20% глицерина при -20 С до1 недели
Архивный материал – нативные фекалии
Из фекалий готовят 10-20% суспензию на стерильном физиологическом растворе
или фосфатном буфере. Центрифугируют при 10-12 тыс об/мин в течение 2 мин.
Экстракцию НК производят из надосадочной жидкости по возможности сразу.
При необходимости хранения надосадочную жидкость в объеме 400-800 мкл
переносят в новую пробирку и добавляют глицерин до концентрации 20% (или
другой криопротектор). Допускается хранение надосадочной жидкости при
температуре не выше минус 16 С
44. Особенности предобработки материала методом экспресс-фильтрации
Особенности предобработкиматериала методом экспрессфильтрации
Суспензия фекалий
Фильтрат суспензии фекалий рекомендовано применять для
экстракции ДНК и РНК с применением комплектов
реагентов «РИБО-преп» и «РИБО-сорб»
Фильтрат
суспензии
фекалий
45.
ПатматериалФрагменты тканей и органов 1х1х1 см
Отбор из очага поражения
Формирование усредненной пробы
Гомогенизация
РИБО-сорб, РИБО-преп, ДНК-сорб-В – 50-100 мкл
Готовят 10% суспензию на стерильном физиологическом растворе или фосфатном буфере.
Отстаивают полученную суспензию в течение 3 минут. Надосадочную жидкость используют для
экстракции НК.
46.
Транспортировка и хранениеТранспортировка
В течение суток при температуре +2 - +8 без заморозки
Более суток при температуре -16 С
В лаборатории
- 16 С в течение недели
- 68 С длительно
ОБРАЗЦЫ ПОВТОРНОЙ ЗАМРОЗКЕ НЕ ПОДЛЕЖАТ!!
47. Работа над ошибками
РАБОТА НАД ОШИБКАМИ48.
Ошибки преаналитического этапаОшибки аналитического этапа
Ошибки постаналитического этапа
49.
Ошибки преаналитического этапа1.
2.
3.
4.
Место взятия биологического материала
Правильность взятия биологического материала
Обработка биологического материала
Хранение биологического материала
50.
Взятие биологического материалаНеверное определение места предполагаемой
локализации инфекционного процесса,
особенно для микроорганизмов, имеющих
тропность ко многим видам тканей
Поиск в крови возбудителей, для которых
гематогенный путь передачи и распространения
не доказан или не является основным
51.
Взятие биологического материалаМатериал должен содержать максимальную концентрацию микроорганизмов
Минимальное количество примесей, способных ингибировать ПЦР (слизь, гной и
т.д.)
52.
Обработка биологического материалаНеобходимо использовать антикоагулянты
Присутствие гепарина в крови (антикоагулянтная терапия) может привести к ложноотрицательному результату
53.
Хранение биологического материалаРазрушение РНК и ДНК возбудителей при
нарушении сроков хранения и условий
транспортировки
Замораживание цельной крови
54.
Нормативная документацияСП 1.2.036-96
СП 1.3.1285-03
СП 1.3.2322-08
55.
Ошибки аналитического этапаВыбор системы пробоподготовки
Технологические ошибки
56.
Выбор системы пробоподготовкиНеправильный выбор системы пробоподготовки
Использование экспресс-методов на «сложных»
образцах, может привести к ложноотрицательным результатам ПЦР
Кросс-контаминация
Потери ДНК с сорбентом
Выбор метода выделения должен определяться
характером биоматериала, степенью его
загрязнения потенциальными ингибиторами
57.
Технологические ошибкиЭлектрофоретическая детекция
Риск принять неспецифические фрагменты за
специфические при отсутствии К+ и маркером длин
фрагментов
Детекция по конечной точке
Неправильное приготовление фоновых пробирок
Неправильное хранение фоновых пробирок
Неправильное хранение амплификационных пробирок
Детекция в «реальном времени»
Колебание флуоресценции в приборе, появление
артефактных кривых
58.
Ошибки постаналитического этапаОшибки интерпретации результатов ПЦР
Сравнение результатов ПЦР и ИФА
Сравнение ПЦР и микроскопии
Сравнение ПЦР и культурального метода
Контаминация
59.
Ошибки интерпретаци результатов ПЦРНеверная интерпретация результатов ПЦР-анализа,
вследствие ошибочных представлений об
инфекционном агенте или о возможностях метода
Непринятие во внимание особенностей персистенции
и элиминации возбудителя
Клиническая оценка положительного результата ПЦР,
определение его прогностической значимости
Неверная интерпретация результатов количественного
ПЦР-анализа
60.
Сравнение результатов ПЦР и ИФАНаличие серологического окна
Развитие иммунологической толерантности
Генетически обусловленная серонегативность
Выявление «иммунологического следа»
Использование родоспецифических тестсистем для ИФА
Зависимость результатов анализа методом
ПЦР от используемого материала
ПЦР не позволяет определить стадию
инфекционного процесса
61.
Сравнение результатов ПЦР и микроскопииНизкая чувствительность микроскопии
Субъективность оценки результатов
Ограниченный спектр выявляемых патогенов
62.
ПЦР и культуральный методНаличие труднокультивируемых и
некультивируемых форм
Гибель микроорганизмов в процессе
транспортировки
Несинхронный рост микроорганизмов –
трудности с количественной оценкой




















































 Биология
Биология