Похожие презентации:
Метод полимеразной цепной реакции (ПЦР)
1. Метод полимеразной цепной реакции (ПЦР)
2. ПЦР
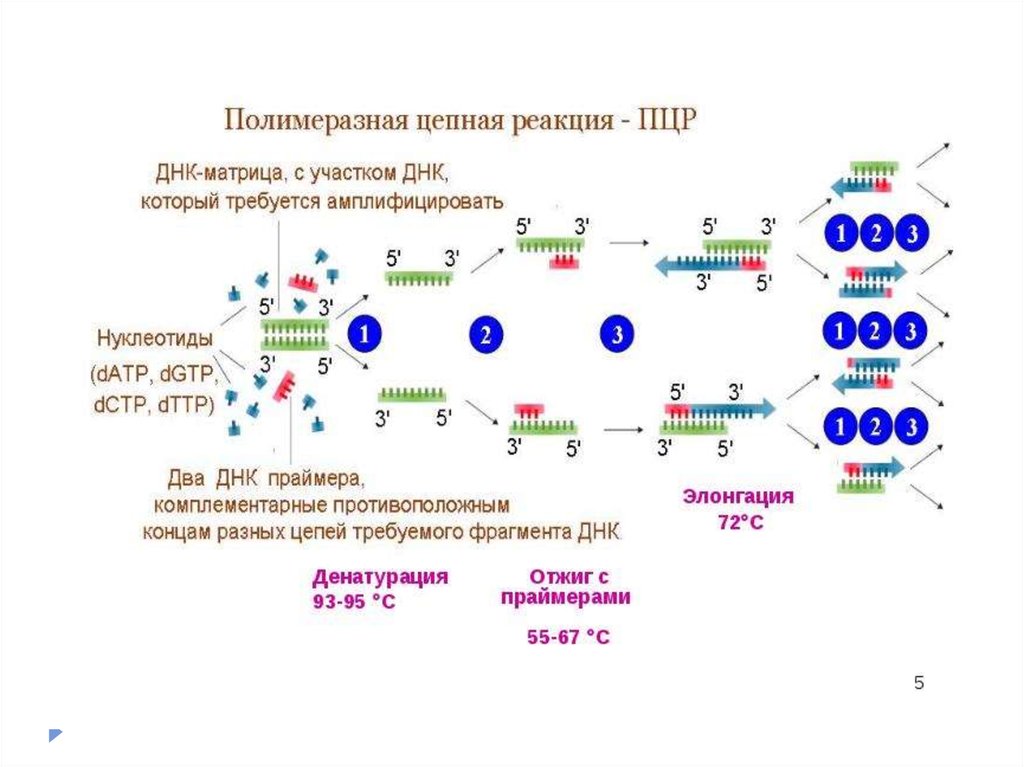
Полимеразная цепная реакция (ПЦР) —экспериментальный метод молекулярной биологии,
позволяющий добиться значительного увеличения малых
концентраций определённых фрагментов нуклеиновой
кислоты (ДНК) в биологическом материале.
3.
4. Проведение ПЦР
Метод основан на многократном избирательномкопировании определённого участка нуклеиновой
кислоты ДНК при помощи ферментов в искусственных
условиях (in vitro).
При этом происходит копирование
только того участка, который удовлетворяет заданным
условиям, и только в том случае, если он присутствует
в исследуемом образце.
В отличие от амплификации
ДНК в живых организмах (репликации), с помощью
ПЦР амплифицируются относительно короткие
участки ДНК.
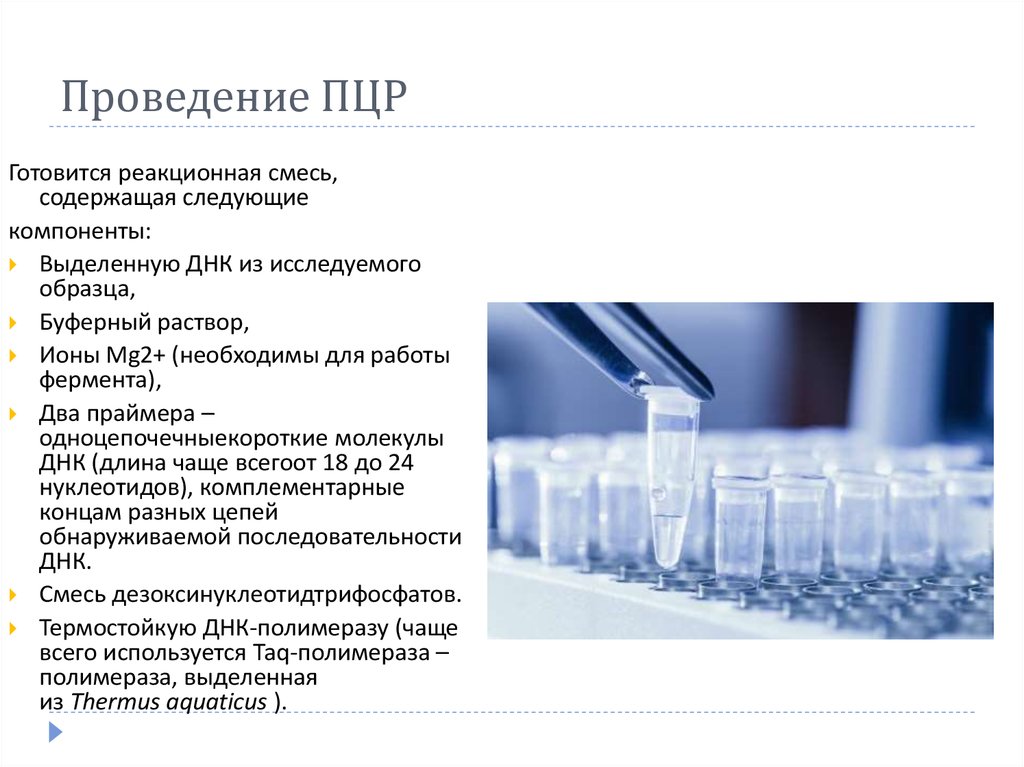
5. Проведение ПЦР
Готовится реакционная смесь,содержащая следующие
компоненты:
Выделенную ДНК из исследуемого
образца,
Буферный раствор,
Ионы Mg2+ (необходимы для работы
фермента),
Два праймера –
одноцепочечныекороткие молекулы
ДНК (длина чаще всегоот 18 до 24
нуклеотидов), комплементарные
концам разных цепей
обнаруживаемой последовательности
ДНК.
Смесь дезоксинуклеотидтрифосфатов.
Термостойкую ДНК-полимеразу (чаще
всего используется Taq-полимераза –
полимераза, выделенная
из Thermus aquaticus ).
6. Проведение ПЦР
Затем данная реакционная смесь помещается вамплификатор, который фактически представляет
собой программируемый термостат. В
амплификаторе проводится 30-40 циклов смены
температур.
7. Проведение ПЦР
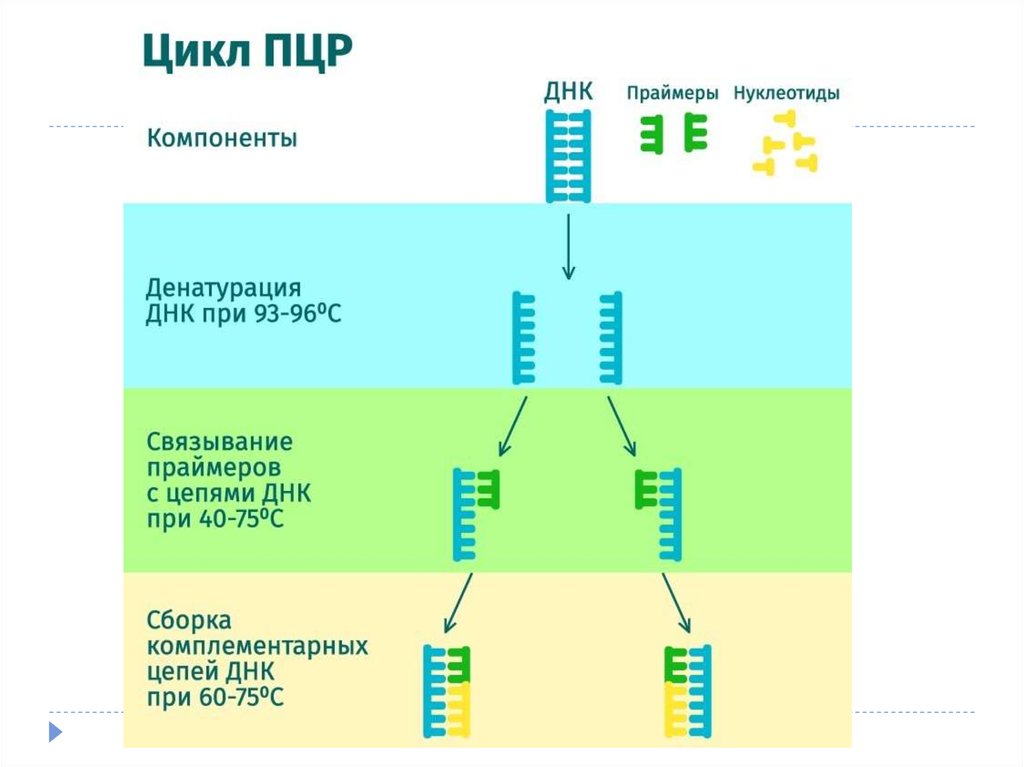
Каждый из этих циклов состоит из трех этапов:1.
Денатурация (температура 94оС) – разрываются водородные цепи, и
цепочки ДНК расходятся.
2.
Отжиг праймеров (температура обычно в районе 50-60оС) – к
концам цепей ДНК присоединяются праймеры. Вообще, при
снижении температуры энергетически выгоднее воссоединение
исходных цепей ДНК из исследуемого образца (ренатурация),
однако концентрация праймеров в реакционной смеси на много
порядков больше концентрации ДНК из образца (по крайней мере,
на начальных циклах ПЦР), поэтому реакция отжига праймеров
протекает быстрее ренатурации ДНК. Температура отжига
выбирается в зависимости от температур плавления (денатурации)
праймеров.
3.
Элонгация (температура обычно 72оС) – ДНК-полимераза
достраивает праймеры по матрице длинных цепей ДНК.
Температура соответствует оптимальной температуре работы
используемой ДНК-полимеразы.
8.
9. Сферы применения
Чаще всего ПЦР-метод применяют длядиагностики:
ВИЧ;
герпеса;
различных половых инфекций, в частности хламидиоза, уреаплазмоза,
гарднереллеза, микоплазмоза и трихомониаза;
кандидоза;
гепатитов;
мононуклеоза;
листериоза;
цитомегаловируса;
туберкулеза;
вируса папилломы человека;
клещевого энцефалита.
10. Сферы применения
Метод ПЦР применяется не только вмедицинских целях.
В наши дни он используется и в иных сферах,
например в криминалистике, в тех случаях,
когда требуется определить, кому
принадлежит найденный на месте преступления
биоматериал.
ПЦР иногда используется также при установлении
отцовства.
11. Преимущества
Высокая чувствительность. Метод позволяет выявитьвозбудителя болезни даже при наличии нескольких
молекул его ДНК, то есть на очень ранних стадиях, при
хронической форме заболевания, а так же в случаях,
когда болезнь никак себя не проявляет, протекая
латентно.
Универсальность. Для проведения ПЦР анализа
подходит почти любой биоматериал — от крови и
слюны до клеток кожи.
Широкий охват. Исследование одного образца может
выявить сразу нескольких возбудителей болезни.
12. Преимущества
Оперативность. Результат, как правило, готов через 5–7 часов, то есть получить заключение можно уже на
следующий день после забора биоматериала.
Точность. Метод ПЦР практически никогда не дает
ложноположительных или ложноотрицательных
результатов, если была соблюдена технология
проведения этого анализа.
Невысокая стоимость. По цене ПЦР-анализ сравним с
любыми другими лабораторными анализами крови.
13. Недостатки
Высокие требования к соблюдению технологии и кпрофессионализму лаборантов.
Если образец был загрязнен, анализ может
дать ложный результат. Поэтому проводить
ПЦР-диагностику лучше только в самых
лучших лабораториях, где внедрены системы
контроля качества работы.
14. Исследуемый биоматериал
Выбор зависит от типа инфекции.Моча. Может использоваться при инфекционном поражении мочеполового
тракта у мужчин и мочевыделительных органов у женщин (у мужчин
использование в качестве материала мочи заменяет эпителиальный соскоб).
Мокрота. Применяется для диагностики туберкулеза и реже для диагностики
респираторных форм хламидиоза и микоплазмоза. Мокроту в количестве 1520 мл собирают в стерильный (одноразовый) флакон.
Биологические жидкости. Сок простаты, плевральная, спинномозговая,
околоплодная, суставная жидкость, бронхоальвеолярный лаваж, слюна
забираются по показаниям.
Эпителиальные соскобы со слизистых оболочек. Обычно используются для
диагностики заболеваний, передающихся половым путем (ЗППП), таких как
гонорея, хламидиоз, микоплазмоз, уреаплазмоз, трихомониаз, гарднереллез,
герпетическая и другие инфекции, поражающие слизистые оболочки.
Биоптаты. Чаще всего используют биоптаты желудка и двенадцатиперстной
кишки для выявления хеликобактерной инфекции.
Кровь, плазма, сыворотка. Используются для ПЦР анализа вирусов гепатитов B,
C, D, G, герпеса, ЦМВ, ВИЧ, исследования генов человека.
15. Подготовка к исследованию
Подготовка к ПЦР-диагностике напрямуюзависит от типа биоматериала.
Кровь сдается натощак утром.
Моча также сдается утром, в лабораторных условиях,
в стерильный контейнер.
Перед сдачей мазка или соскоба из урогенитальной
области нельзя вступать в половые контакты за
несколько дней до исследования, не следует
проводить спринцевания.
Мазок или соскоб нельзя сдавать во время
менструации и в течение 2-х дней после ее окончания.
16. Методы ПЦР-диагностики заболеваний
Существует немало различных методик ПЦРдиагностики:
ПЦР в реальном времени;
Секвенирование;
Пиросеквенирование;
Микрофлюидные технологии.
Сейчас наиболее распространенным способом
проведения анализа является ПЦР в реальном времени —
этот
метод практически не допускает ложноположительных
результатов, к тому же срок обработки образцов при
исследовании таким способом сокращается — результат
можно
получить уже через час.
17. Расшифровка результатов
Для пациента результат ПЦР-анализа может быть либоположительным, либо отрицательным.
Отрицательный означает, что следов враждебной ДНК не
обнаружено и человек здоров.
Положительный подразумевает наличие фрагментов ДНК
возбудителя болезни — это значит, что человек заражен и
ему требуется лечение.
Нередко ПЦР-диагностика дает положительный результат, но
пациент не чувствует никакого недомогания, а признаки
болезни
отсутствуют. Однако это означает не ошибку, а очень раннюю
стадию заболевания. В этом случае необходимы
дополнительные
исследования и лечение.
18.
ПЦР-диагностика инфекций невероятно точна— она позволяет обнаружить возбудителя
болезни, даже если в пробе находится всего
одна-единственная молекула его ДНК.
Именно это качество сделало ПЦР-анализ одним
эффективнейших диагностических инструментов
как для определения наличия инфекции, так и
для контроля за ходом лечения.
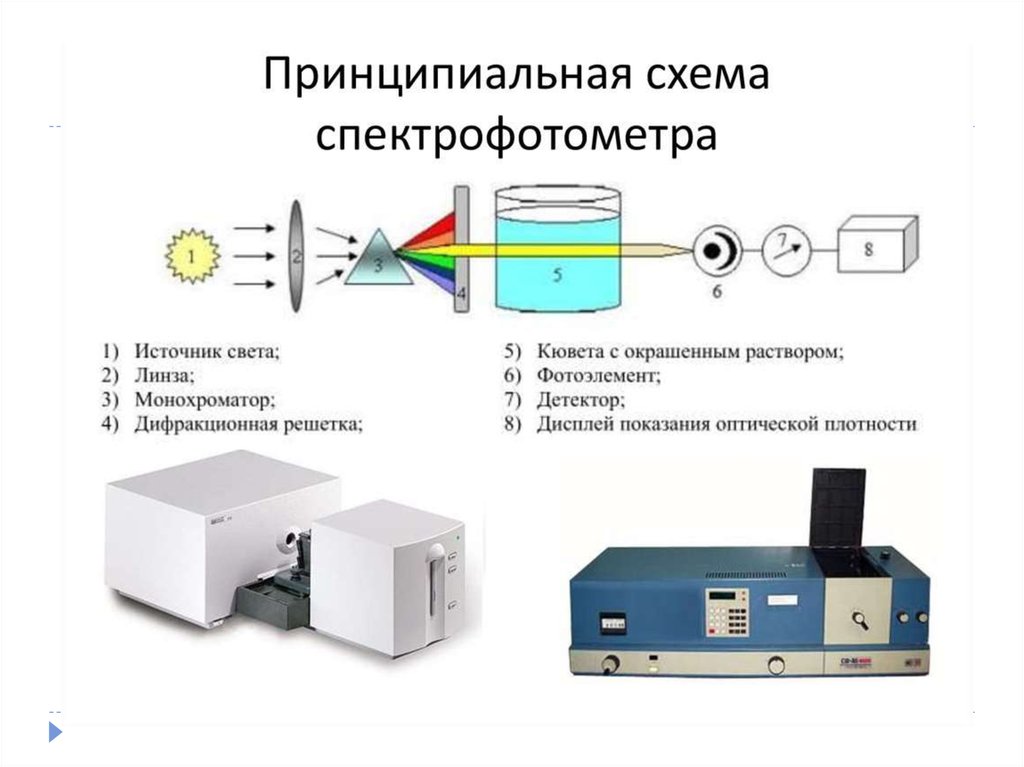
19. Спектрофотометрический метод
20. Сущность метода
Спектрофотометрия — физико-химический метод исследованиярастворов и твёрдых веществ, основанный на
изучении спектров поглощения в ультрафиолетовой (200—400
нм), видимой (400—760 нм) и инфракрасной (>760 нм) областях
спектра.
• Это метод фотометрического анализа, в котором определение
содержания вещества производят по поглощению им
монохроматического света в видимой, УФ- и ИК-областях
спектра.
• В спектрофотометрии, в отличие от фотометрии,
монохроматизация обеспечивается не светофильтрами, а
монохроматорами, позволяющими непрерывно изменять длину
волны. В качестве монохроматоров используют призмы или
дифракционные решетки, которые обеспечивают значительно
более высокую монохроматичность света, чем светофильтры,
поэтому точность спектрофотометрических определений выше.
21. Сущность метода
Монохроматор — спектральный оптико-механический прибор,предназначенный для выделения монохроматического
излучения. Принцип работы основан на дисперсии света.
22. Техническая часть
Техническая частьСпектрофотометрическое
исследование требовательно
относится к подготовке растворов,
как окрашенных, так и
чистых. Для того чтобы
производить измерения спектров,
используют спектрофотометр и
фотоколориметр, в которые
помещают исследуемые растворы.
23.
24. Применение
Спектрофотометрическое определение фигурирует во многихобластях для разных задач:
подтверждает подлинность заявленного элемента/продукта,
определяет доброкачественность изготовленного препарата,
с его помощью находят радиоактивные элементы в водоемах,
количественно оценивает, сколько разных веществ находится во
взвеси,
различать химические элементы во взвеси.
Применяется в биологических и геологических лабораториях, в
целях радиационной безопасности (на АЭС, институтах и т.д.),
промышленностях, где требуется знать химический состав
продуктов и материалов.
25. Преимущества
Хорошо подходит для определения состава инертныхгазов.
Работает с низкими концентрациями – различает
элементы, если их немного во взвеси.
Можно добиться расширенной неопределенности на
уровне 0,5-1,%.
Применим как для высокого, так и для низкого
содержания вещества в растворе.
Применим для примесей, ввиду закона сложения.
Быстрота определения (если не считать подготовку
растворов).
Простота.
26. Ограничения
Интенсивнее поглощаются те энергии (длина волны),которые соответствуют энергетическим уровням
возбуждения внутренних переходов атомов и
молекул: тогда молярный коэффициент поглощения
максимален.
Метод плохо работает для смеси газов.
27. Секвенирование
28. Секвенирование
Секвенирование биополимеров (белков и нуклеиновыхкислот — ДНК и РНК) — определение их
аминокислотной или нуклеотидной последовательности
(от лат. sequentum — последовательность). В результате
секвенирования получают формальное описание
первичной структуры линейной макромолекулы в виде
последовательности мономеров в текстовом виде
29. Методы секвенирования
Roche/454 Life SciencesIllumina/Solexa
Applied Biosystems/SOLiD
Одномолекулярное
секвенирование Helicos
Biosciences
Одномолекулярное
секвенирование в реальном
времени Pacific Biosciences
Ion Torrent Sequencing
Нанопоровое секвенирование
30. Roche/454 Life Sciences
Первая эффективно используемая на коммерческойоснове платформа СНП. Компания 454 Life Sciences
основана в 2000 году Джонатаном Ротбергом (в
производство запущена в 2005 году). Данная технология
представляет собой последовательный синтез методов
эмульсионного ПЦР и пиросеквенирования.
Амплификация ДНК проходит в каплях воды в масляной
эмульсии. В каждой капле воды находится
одноцепочечная матрица ДНК, связанная
с праймером на бусинке. Далее, каждая бусина
помещается на чип, представляющий собой оптическое
волокно. Туда же помещаются необходимые для
секвенирования ферменты: ДНК-полимераза,
люцифераза, АТФ-сульфурилаза. В последней сборке
реакция секвенирования идет в ячейках объемом
3,4·106 пкл, на стенках которых есть специальное
металлическое покрытие, нивелирующее шум.
31. Illumina/Solexa
Авторы метода — британские химики Шанкар Баласубраманиан иДэвид Кленерман. Этот метод секвенирования использует
прикреплённые к микросферам единичные молекулы ДНК. В 2006 году
была запущена Solexa Genome Analyzer 1G, первая платформа,
генерирующая короткие участки генома. После её приобретения
компанией Illumina Genome Analyzer использует оптически прозрачные
ячейки с 8 индивидуальными поверхностями, где связываются
олигонуклеотиды. В отличие от пиросеквенирования удлинение
последовательности происходит постепенно, что позволяет за раз с
помощью камеры снимать большие ДНК-чипы.
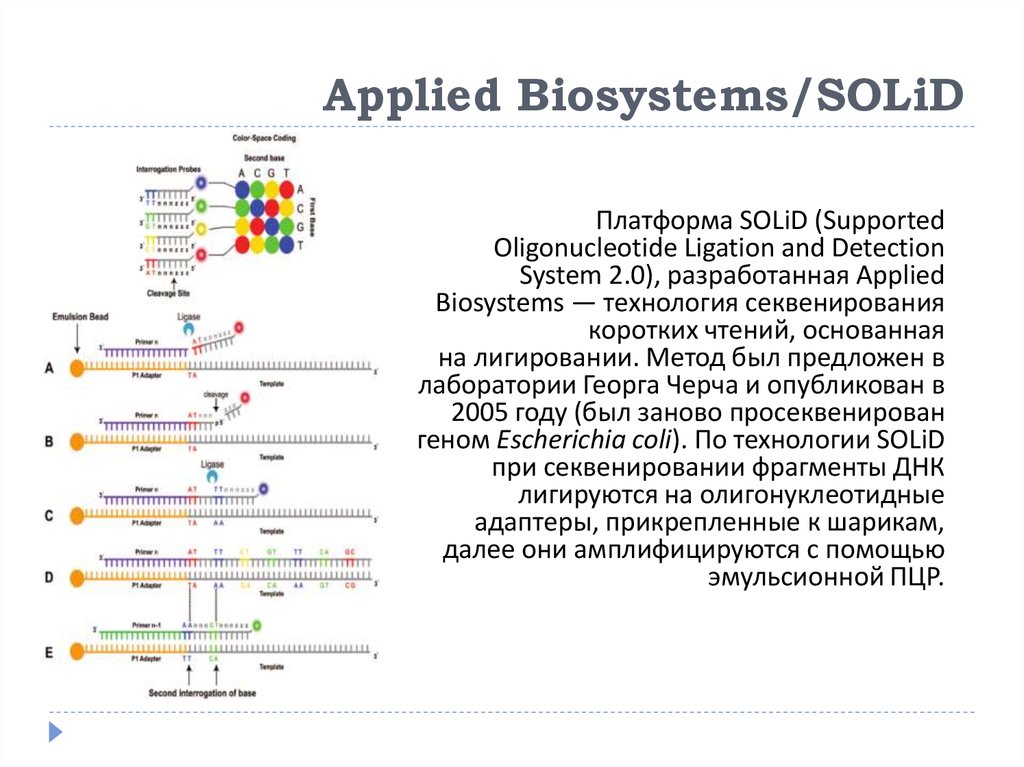
32. Applied Biosystems/SOLiD
Платформа SOLiD (SupportedOligonucleotide Ligation and Detection
System 2.0), разработанная Applied
Biosystems — технология секвенирования
коротких чтений, основанная
на лигировании. Метод был предложен в
лаборатории Георга Черча и опубликован в
2005 году (был заново просеквенирован
геном Escherichia coli). По технологии SOLiD
при секвенировании фрагменты ДНК
лигируются на олигонуклеотидные
адаптеры, прикрепленные к шарикам,
далее они амплифицируются с помощью
эмульсионной ПЦР.
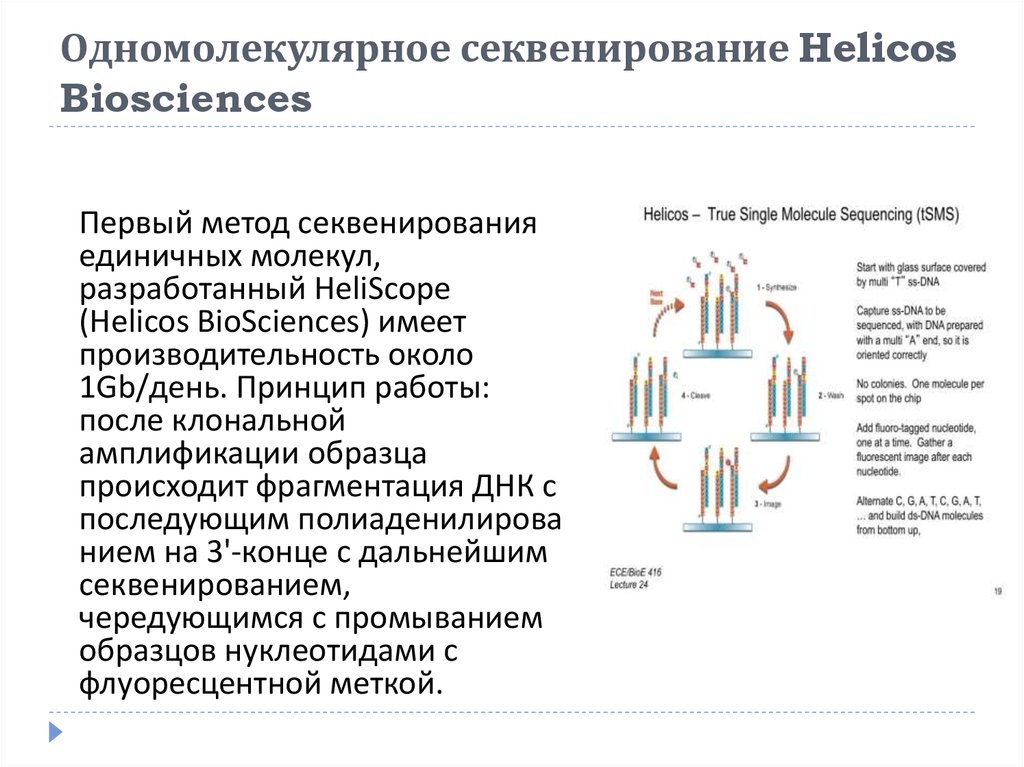
33. Одномолекулярное секвенирование Helicos Biosciences
Первый метод секвенированияединичных молекул,
разработанный HeliScope
(Helicos BioSciences) имеет
производительность около
1Gb/день. Принцип работы:
после клональной
амплификации образца
происходит фрагментация ДНК с
последующим полиаденилирова
нием на 3'-конце с дальнейшим
секвенированием,
чередующимся с промыванием
образцов нуклеотидами с
флуоресцентной меткой.
34. Одномолекулярное секвенирование в реальном времени Pacific Biosciences
Метод одномолекулярногосеквенирование в реальном
времени (англ. Single molecule
real time sequencing, SMRT)
основан на наблюдении за
работой единичной
молекулы ДНК-полимеразы.
Использование четырех
флуоресцентно-меченных
нуклеотидов позволяет
определить какой нуклеотид
присоединяет ДНКполимераза в данный момент.
35. Ion Torrent Sequencing
Метод основан на связи междухимической и цифровой информацией,
что позволяет быстрее и проще
секвенировать большое количество
образцов. Эта технология также
называется рН-индуцированным
секвенированием. Процесс основан на
детекции протонов, которые получаются
при синтезе цепи ДНК как побочный
продукт. Как следствие, рН раствора
меняется, что и можно детектировать.
Платформа Ion Torrent отличается от
остальных технологий секвенирования
тем, что в ней не используются
модифицированные нуклеотиды и
оптические методы. Метод Ion Torrent
позволяет исследовать транскриптомы,
малые РНК, проводить ChIP-seq. Более
того, с его помощью можно изучать
геномы микробных сообществ.
36. Нанопоровое секвенирование
Метод основан наизмерении тока ионов
через единичную нанопору
в непроводящей мембране.
При прохождении через эту
пору нуклеотидов ток
падает. Время, на которое
изменяется ток ионов, и
величина этого падения
зависят от того, какой
нуклеотид в данный
момент находится внутри
поры.
37. Иммуноферментный анализ (ИФА)
38.
Иммуноферментный анализ (ИФА) - лабораторноеисследование, основанное на высокой избирательности
и специфичности иммунологических реакций “антигенантитело”.
Суть метода - выявление специфических антител с
помощью специальных биохимических реакций,
которые помогают определить присутствие или
отсутствие антител и их количество.
39.
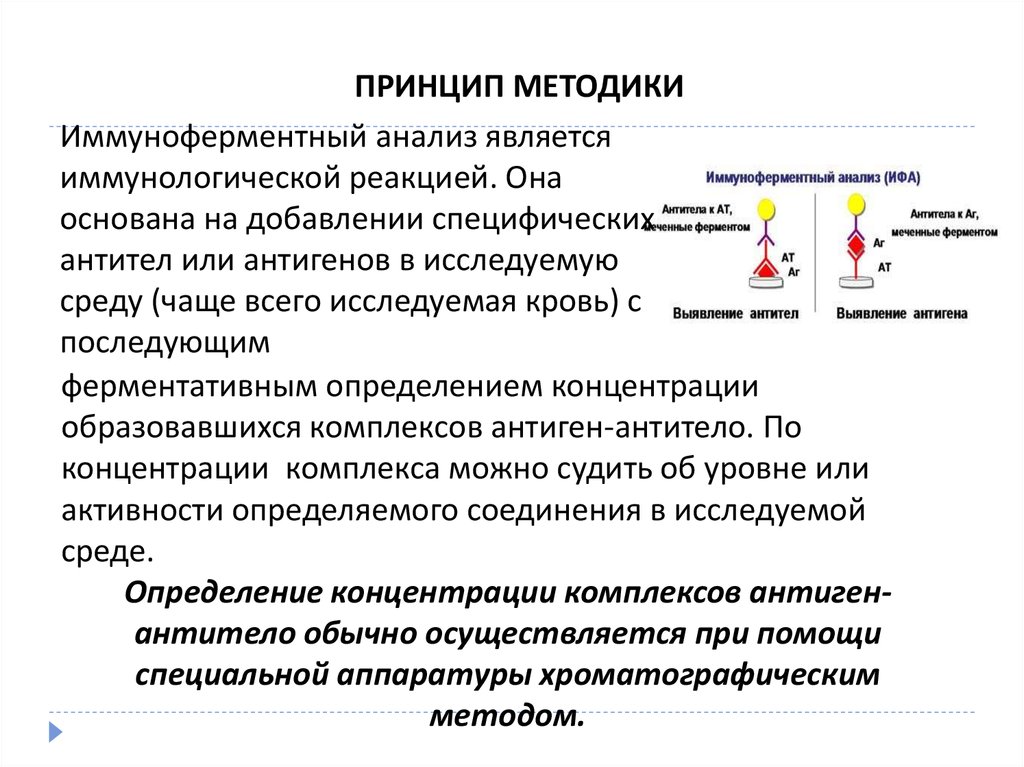
ПРИНЦИП МЕТОДИКИИммуноферментный анализ является
иммунологической реакцией. Она
основана на добавлении специфических
антител или антигенов в исследуемую
среду (чаще всего исследуемая кровь) с
последующим
ферментативным определением концентрации
образовавшихся комплексов антиген-антитело. По
концентрации комплекса можно судить об уровне или
активности определяемого соединения в исследуемой
среде.
Определение концентрации комплексов антигенантитело обычно осуществляется при помощи
специальной аппаратуры хроматографическим
методом.
40.
Преимущества ИФА относительно других методовобнаружения антигенов и антител:
- высокая чувствительность, которая, составляющая 90%;
- стабильность при хранении всех ингредиентов,
необходимых для проведения ИФА (год и более);
- быстрота и удобство проведения диагностической реакции;
- возможность использовать минимальные объемы
исследуемого материала;
- возможность автоматизации всех этапов проведения
реакции;
- небольшая стоимость диагностических наборов;
- возможность ранней диагностики инфекции;
- унифицированность и пригодность
для массовых обследований;
- легкость в отслеживании динамики
развития процесса инфекционного
заболевания.
41.
ПОКАЗАНИЯ К ПРОВЕДЕНИЮИФА анализ проводится по различным показаниям, основными из них в
клинической медицине являются:
Диагностика инфекционной патологии с преимущественно половым путем
передачи (ИППП), к которым относятся хламидиоз, микоплазмоз, уреаплазмоз,
трихомониаз, при этом выявляются специфические антитела к возбудителю
инфекции.
Диагностика инфекционных заболеваний различной локализации для
определения стадии патологического процесса, в первую очередь в процессе
диагностики парентеральных вирусных гепатитов и ВИЧ.
Определение концентрации гормонов для диагностики различной патологии
органов эндокринной системы (железы внутренней секреции).
Определение различных соединений для диагностики причины интоксикации
организма при отравлениях, укусах насекомых или змей.
При этих медицинских показаниях выполняется анализ крови ИФА. Также
данная методика активно применяется в экспериментальной медицине во время
проведения различных клинических исследований во время разработки новых
лекарственных средств, вакцин для иммунопрофилактики.
42.
Как подготовиться к ИФА?Для получения достоверных результатов исследования методом
иммуноферментного анализа следует придерживаться несколько несложных
подготовительных рекомендаций, к которым относятся:
За день до сдачи анализа следует отказаться от употребления в пищу
жирных продуктов питания (мясо, копчености) и алкоголя
Материал для исследования необходимо сдавать утром натощак.
В день исследования желательно избегать физических и
психоэмоциональных нагрузок
Перед исследованием необходимо постараться не курить
Выполнение этих рекомендаций необходимо для исключения получения
ложноположительного результата ИФА!
Большинство полученных ложноположительных результатов
иммуноферментного анализа крови бывает вследствие неправильного
выполнения подготовительных рекомендаций. Это в большинстве случаев
связано с употреблением в пищу жирных продуктов питания, которые
приводят к увеличению концентрации триглицеридов (жиры) в плазме крови,
которые снижают специфичность проводимого ИФА
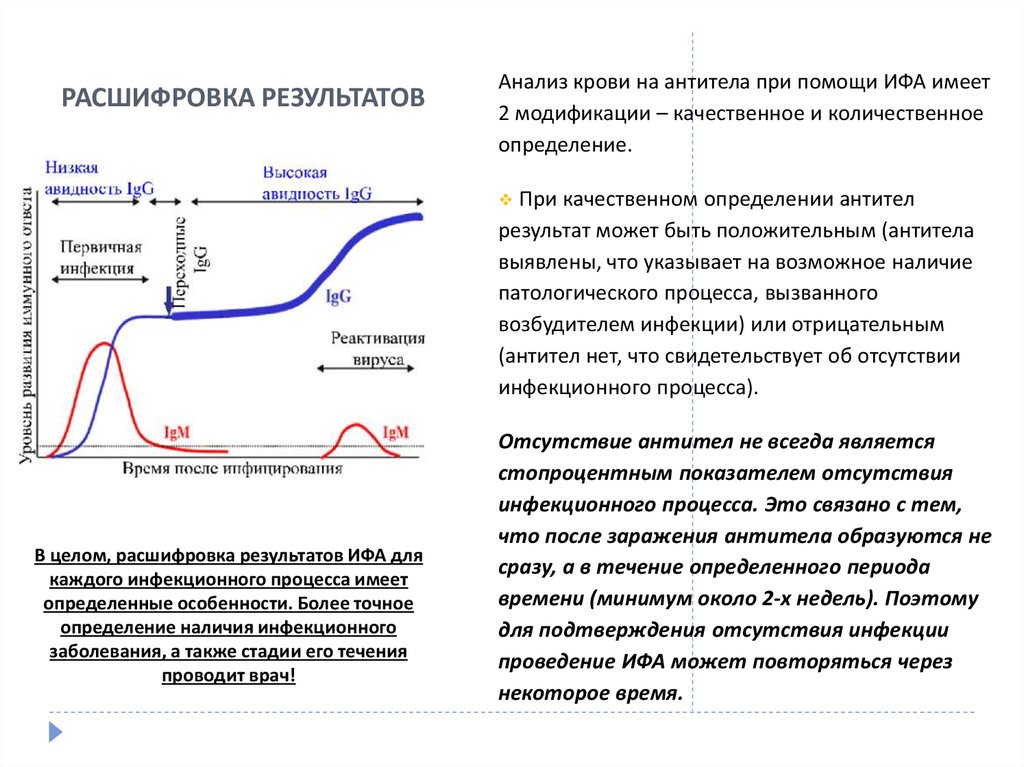
43. РАСШИФРОВКА РЕЗУЛЬТАТОВ
Анализ крови на антитела при помощи ИФА имеет2 модификации – качественное и количественное
определение.
При качественном определении антител
результат может быть положительным (антитела
выявлены, что указывает на возможное наличие
патологического процесса, вызванного
возбудителем инфекции) или отрицательным
(антител нет, что свидетельствует об отсутствии
инфекционного процесса).
В целом, расшифровка результатов ИФА для
каждого инфекционного процесса имеет
определенные особенности. Более точное
определение наличия инфекционного
заболевания, а также стадии его течения
проводит врач!
Отсутствие антител не всегда является
стопроцентным показателем отсутствия
инфекционного процесса. Это связано с тем,
что после заражения антитела образуются не
сразу, а в течение определенного периода
времени (минимум около 2-х недель). Поэтому
для подтверждения отсутствия инфекции
проведение ИФА может повторяться через
некоторое время.
44. РАСШИФРОВКА РЕЗУЛЬТАТОВ
При количественном ИФА выполняется определение титра(активности) антител, а также их классов. В большинстве случаев
для диагностики инфекционных заболеваний проводится
определение антител класса IgG (иммуноглобулины G) и IgM
(иммуноглобулины М), которые образуются в организме через
различные промежутки времени после инфицирования,
поэтому расшифровка результата анализа может иметь
несколько значений:
Повышение активности IgМ и отсутствие IgG – свидетельство
недавнего инфицирования и острого течения инфекционного
процесса.
Повышение активности IgМ и IgG – обострение инфекционного
процесса при его хроническом течении и давнем заражении.
Высокая активность IgG и отсутствие IgМ – хроническое течение
инфекционного процесса на фоне давнего заражения, после
которого прошло более полугода (время, необходимое для
образования антител класса IgG).
45.
ДИАГНОСТИКА АУТОИММУННЫХ ЗАБОЛЕВАНИЙАнтинуклеарные антитела - это аутоантитела к антигенам ядра клеток. Они образуют иммунные комплексы и
откладываются на базальных мембранах различных тканей и органов, тем самым вызывая воспаление и повреждение
тканей и сосудов. Образование таких антител характерно для системных аутоиммунных заболеваний. Исследование на
антинуклеарные антитела проводится если врача подозревает системное аутоиммунное заболевание.
Антитела к двухспиральной ДНК образуются при системных аутоиммунных поражениях соединительной ткани. Эти
иммунные комплексы откладываются на тканях, стенках сосудов и вызывают их повреждение. Антитела к
двухспиральной ДНК специфичны для системной красной волчанки.
Антитела к растворимым нуклеарным антигенам (ENA скрин) - скрининговый тест на антитела к растворимым ядерным
антигенам - (SSA(Ro), SSB(La), Sm, RNP, Jo1, Scl70). Образуются при многих системных аутоиммунных заболеваниях
(системная красная волчанка, синдром Шегрена, склеродермия, полимиозиты, смешанное заболевание соединительной
ткани, ревматоидный артрит). Положительные значения анализа являются аргументом наличия у больного
аутоиммунного процесса и является показанием для дифференцированного определения титров антител к различным
ENA для более точной постановки диагноза. Для дифференцированного определения антител к растворимым ядерным
антигенам применяется иммуноферментный анализ -комбинированный ENA.
Антикардиолипиновые антитела IgG, IgM - это аутоантитела к отрицательно заряженным или нейтральным
фосфолипидам, фосфолипидсвязывающими сывороточными белками. Антитела к фосфолипидам нарушают нормальное
функционирование эндотелия кровеносных сосудов, вызывая сужение сосудов и образование сосудистых тромбов.
Обследование назначают при подозрении на антифосфолипидный синдром (рецидивирующие венозные и/или
артериальные тромбозы).
Качественное и полуколичественное иммуноферментное определение специфических антител класса IgG к
цитрулиновому пептиду. Тест система предназначена для диагностики ревматоидного артрита различных стадий, в т.ч.
начало заболевания, когда клинические проявления слабо выражены. Эффективность теста для пациентов с клинически
подтвержденным ревматоидным артритом составляет от 78 до 88%.
Ревматоидный фактор обнаруживают при ревматоидном артрите, особенно при наиболее частой и распространенной
форме хронического воспаления суставов, именуемой синовиит. 75-80% больных ревматоидным артритом имеют
ревматоидный фактор, однако, он не специфичен для ревматоидного артрита так как обнаруживается у здоровых лиц и
при ряде других заболеваний.
С реактивный белок - маркер воспалительного процесса. Использование высоко чувствительных импортных тест-систем
позволяет выявлять С реактивный белок не только при высоко активном воспалительном процессе, но при хроническом
и вялотекущем.
ANCA скрин - определение аутоантител к цитоплазматическим антигенам нейтрофилов (протеиназа 3,
миелопероксидаза). Анализ назначают при подозрении на системные васкулиты, гломерулонефрит.
46. Рефрактометрия
Рефрактометрия47.
Рефрактометрия — это аналитический способ, в основекоторого лежит явление светового преломления при
переходе лучей из одной среды в другую, которое
объясняется изменением скорости светового
распределения в разной среде.
Сегодня этот метод анализа
широко применяется
во многих областях:
часто используется
рефрактометрия в
фармацевтическом и
пищевом анализе,
а также в изучении глаз.
48.
Рефрактометрия в офтальмологии это один изобъективных методов исследования преломляющей
способности глаза — рефракции, которое проводится
при помощи специализированного оборудования —
глазного рефрактометра. Метод рефрактометрии
используется для выявления таких глазных заболеваний,
как:
близорукость (миопия);
дальнозоркость(гиперметропия);
астигматизм.
Данный метод исследования позволяет врачам
максимально быстро получить точные данные о
здоровье глаз пациента. Проведение процедуры
возможно в любом возрасте: и у детей и у взрослых — в
этом определенное преимущество метода.
49.
Рефрактометр ХартингераСостоит из следующих деталей:
осветительной системы;
оптической системы;
измерительной шкалы.
Сама процедура происходит следующим образом:
в оптическую систему вводится тестовый символ,
которым являются три вертикальные и две
горизонтальные полосы. Световой луч от
устройства направляется в обследуемый глаз
пациента и проецирует на сетчатку картинку
тестовых символов, относимые оптической
системой глаз на фокальную плоскость
рефрактометра. Исходным положением оптики
устройства является измерительная шкала с
нулевыми показателями, которые сопрягаются с
дальними
точками
чистого
зрения
эмметропического глаза. Врач видит тестовый
символ через окуляр прибора.
50.
При нормальной рефракции глаза, две частиполукартинки вертикальных и горизонтальных полос
сливаются,
а
вот
в
случае
с гиперметропией и миопией наоборот —
расходятся. Горизонтальное смещение полос и по
вертикальной оси свидетельствует об астигматизме.
Поворачивая прибор по горизонтали, офтальмолог
минимизирует расхождение полос посредством
установки аппарата в один из главных меридианов.
Таким образом измеряется рефракция в конкретном
меридиане. Врач, вращая специальное кольцо,
расположенное около окуляра устройства, добивается
слияния полос, а шкала рефрактометрического
устройства обозначает разновидность и размеры
рефракционных способностей глазного аппарата.
Предел измерения у данного вида оборудования от 20,0 до +20,0 дптр., а вот точность — до 0,25 диоптрий.
51.
Компьютерный типНаиболее
часто
сегодня
используются
автоматические
компьютерные рефрактометры. Сущность их работы также
основана на испускании микроскопических пучков инфракрасных
лучей, которые пересекают зрачок и преломляющую среду,
отображаются от глазного дна и идут в обратном направлении.
Сенсор устройства зачитывает полученные сведения, а
специальное приложение анализирует исходные и заново
полученные данные, посредством которых рассчитывается
клиническая рефракция глаз. Все полученные результаты
мгновенно передаются на монитор и распечатываются.
52.
Процедура измерения рефракции происходит следующим образом:Пациент садится перед устройством.
Его подбородок фиксируется в специальном гнезде, а лоб прижимается к верхней панели.
Врач фиксирует голову обследуемого в необходимом положении так, чтобы во время
исследования она была неподвижна.
Пациенту при этом разрешено моргать.
Обследование каждого глаза происходит отдельно.
Обследуемому необходимо сосредоточить взгляд на фиксационном изображении, резкость
которого постепенно будет меняться.
Более современные устройства могут применять достаточно сложные картинки, которые могут
вызвать интерес даже у самого маленького пациента, что является немаловажным для успеха
процедуры, поскольку маленькие дети усидчивостью не отличаются.
Далее с помощью джойстика врач устанавливает рефрактометр на самой середине зрачка и
начинает комплексные замеры в ручном или автоматическом режиме.
Всего процедура может длиться от одной до двух минут.
53.
1.2.
3.
4.
Как расшифровать результаты
В готовой распечатке содержится вся информация о
состоянии рефракции наших глаз, об их здоровье.
Готовая распечатка состоит из трех колонок:
Первая называется SPH — «сфера». В ней содержатся
сведения о виде рефракции, обнаруженной у обследуемого.
Проще говоря, эта колонка говорит нам о том, имеется ли
заболевание близорукостью, или же, наоборот, пациент
страдает от дальнозоркости.
Следующая колонка CYL — «цилиндр». В ней содержится
информация о линзах, которые необходимы для коррекции
зрения. Если в таковых, конечно, есть потребность.
Последняя колонка AXIS — «ось». В ней содержатся данные о
необходимости угла постановки линзы.
Ну и, наконец, распечатка, в самом низу, содержит еще одно
значение – PD, которое используется для обозначения
междузрачкового расстояния.
54.
Показатели рефрактометрии меняются в течение всей жизни.Например, у новорожденного ребенка чаще всего обнаруживается
дальнозоркость, но к 20 годамэта аномалия остается всего лишь у
трети. Около 40% молодых людей имеют нормальную рефракцию, в то
время как остальные страдают от миопии. А с возрастом рефракция
ухудшается, что вызвано возрастными изменениями хрусталика, в это
время у пациентов начинает развиваться пресбиопия. Поэтому крайне
важно периодически проходить обследование, чтобы своевременно
предотвратить развитие заболеваний глазного аппарата.
55. Иммунотурбидиметрия
56.
В методе иммунотурбидиметриииспользует классическая реакция
антиген-антитело.
Комплексы антиген-антитело
представляют собой частицы,
которые могут быть оптически
замечены с помощью фотометра.
В результате происходит
изменение оптической плотности
среды, детектруемое
фотометрически, которая
пропорциональна скорости
агглютинации микрочастицами.
Если образец содержит свободное
лекарственное средство, реакция
агглютинации частично
ингибируется и происходит
замедление скорости изменения
оптической плотности.
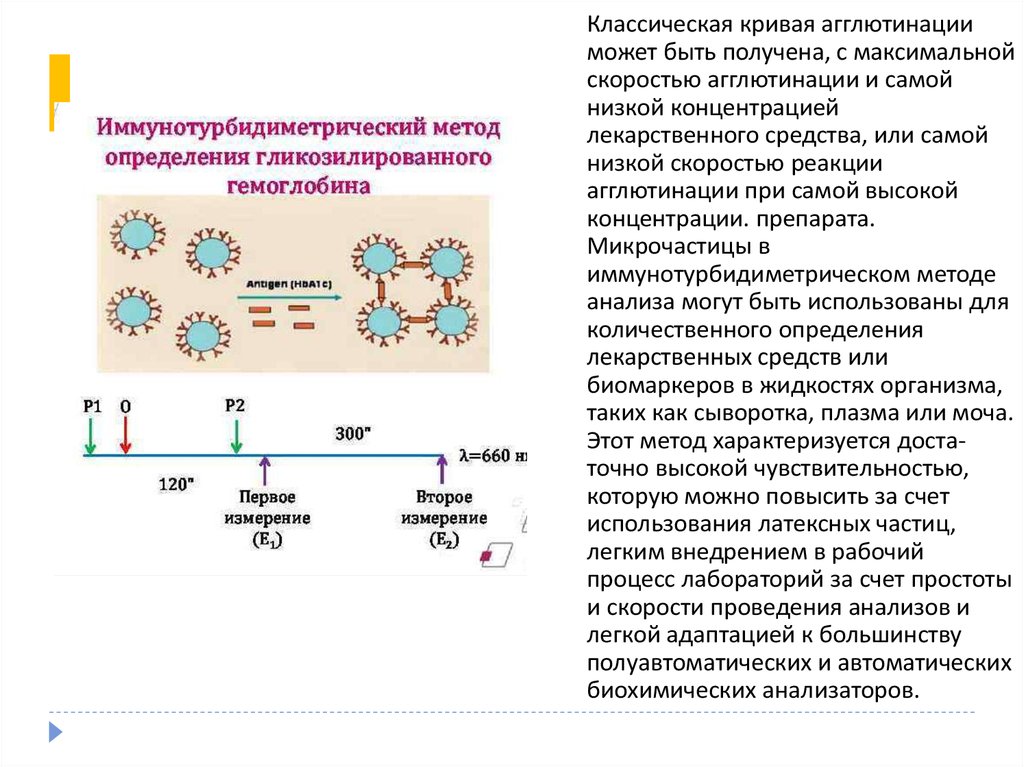
57.
Классическая кривая агглютинацииможет быть получена, с максимальной
скоростью агглютинации и самой
низкой концентрацией
лекарственного средства, или самой
низкой скоростью реакции
агглютинации при самой высокой
концентрации. препарата.
Микрочастицы в
иммунотурбидиметрическом методе
анализа могут быть использованы для
количественного определения
лекарственных средств или
биомаркеров в жидкостях организма,
таких как сыворотка, плазма или моча.
Этот метод характеризуется достаточно высокой чувствительностью,
которую можно повысить за счет
использования латексных частиц,
легким внедрением в рабочий
процесс лабораторий за счет простоты
и скорости проведения анализов и
легкой адаптацией к большинству
полуавтоматических и автоматических
биохимических анализаторов.
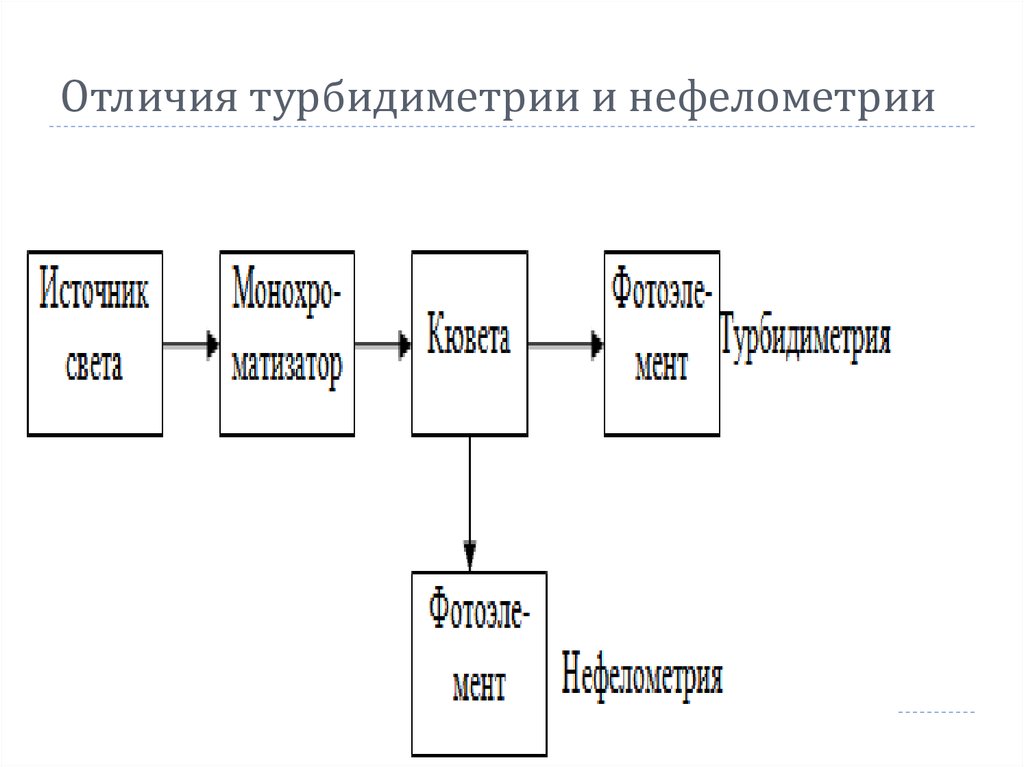
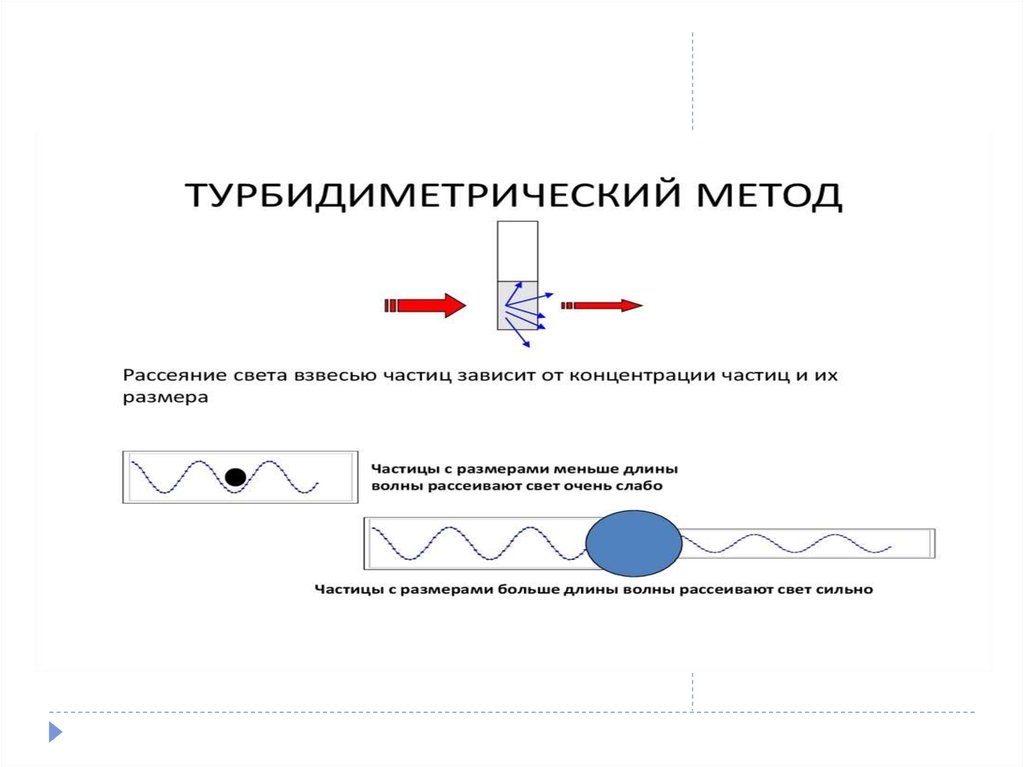
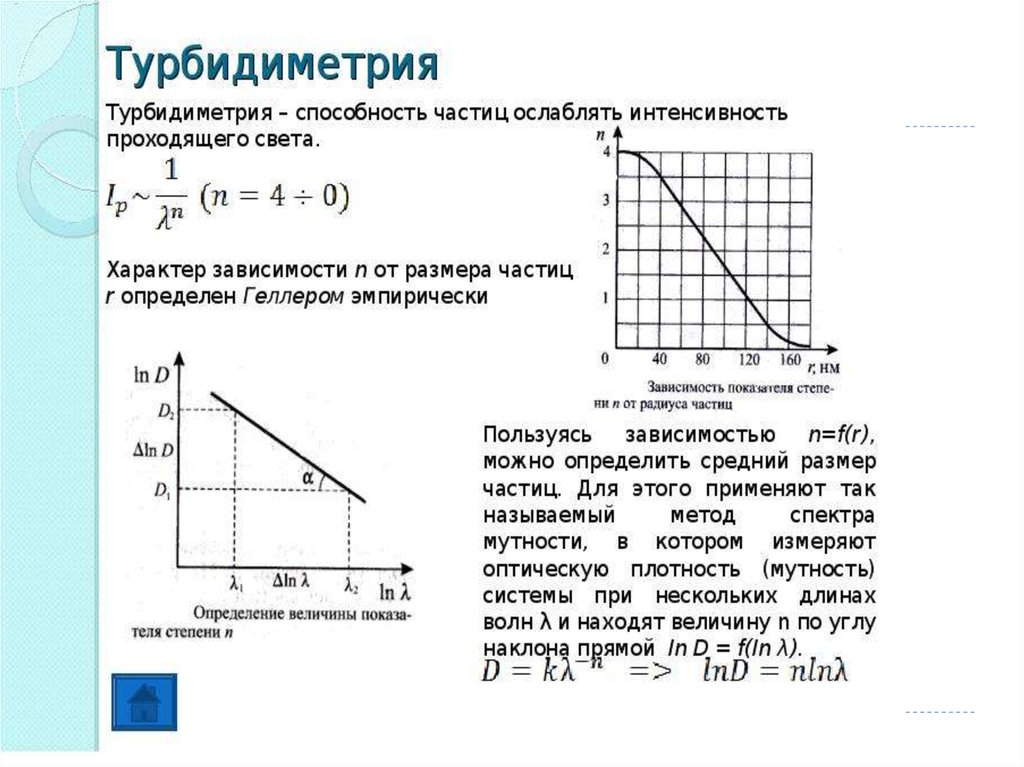
58. Отличия турбидиметрии и нефелометрии
59.
60.
61.
62.
63. Нефелометрия
64.
Нефелометрия-метод исследования и анализавещества по интенсивности светового потока,
рассеиваемого взвешенными частицами данного
вещества.
65. Суть метода
Интенсивность рассеянного светового потока зависитот множества факторов, в частности от концентрации
частиц в анализируемой пробе. Большое значение
при нефелометрии имеет объём частиц,
рассеивающих свет. Важное требование к реакциям,
применяемым при нефелометрии, заключается в том,
что продукт реакции должен быть практически
нерастворим и представлять собой суспензию
(взвесь). Для удержания твёрдых частиц во
взвешенном состоянии применяются различные
стабилизаторы (например, желатин),
предотвращающие коагуляцию частиц.
66. Реализация процесса
Для измерения интенсивности рассеянного светаиспользуются специальные приборы — нефелометры. Их
действие основано на уравнивании двух световых потоков:
одного от рассеивающей взвеси, другого от матового или
молочного стеклянного рассеивателя прибора. Один из
вариантов нефелометрии — нефелометрическое
титрование, в котором раствор анализируемого вещества
титруют раствором осадителя. В процессе титрования
интенсивность рассеянного света увеличивается
пропорционально количеству образующихся частиц. В
точке эквивалентности рост помутнения прекращается. По
излому кривой титрования находят объём затраченного на
реакцию осадителя. Погрешность при этом составляет от 5
до 10 %.
67. Применение
Нефелометрия используется преимущественно дляопределения хлоридов (в виде взвеси AgCl), сульфатов
(в виде взвеси BaSO4) при анализе различных
материалов, например руд, минералов.
Нефелометрию также применяют для определения
размеров и формы диспергированных частиц,
молекулярной массы полимеров, изучения
коагуляции
68. Серологические методы исследования
69. Что такое серологические исследования ?
Методы изучения биологических материалов людей иживотных, способные выявлять в них антитела или антигены,
которые вырабатывает организм в виде защитной реакции в
борьбе с инфекциями, называют серологические
исследования.
Серологический анализ назначается пациентам с подозрением на
какое-либо инфекционное заболевание. Этот анализ в
противоречивых ситуациях с постановкой диагноза поможет
установить возбудителя заболевания. Также от результатов
серологических исследований во многом зависит дальнейшее
лечение, так как определение конкретного микроорганизма
способствует назначению специфического лечения.
70. Какой материал исследуется ?
Серологические исследования подразумеваютзабор биологического материала от пациента в
виде:
- сыворотки крови;
- слюны;
- фекальных масс.
Материал в кратчайшие сроки должен оказаться в
лаборатории. В противном случае его можно
сохранить в холодильнике при температуре +4 или
добавив консервант.
71. Серологическое исследование крови
Человеческая кровь выполняет в организме множествофункций и имеет очень широкое поле деятельности,
поэтому и вариантов исследования крови также
существует много. Одним из них являются и
серологические исследования крови. Это базовый
анализ, проводимый с целью распознания тех или иных
микробов, вирусов и инфекций, а также стадии развития
инфекционного процесса. Используются серологические
исследования крови для:
- определения количества антител против вирусов и
микробов, находящихся в организме.
- определения антигена путем введения в кровь антител;
- определения группы крови.
72. Этапы серологического метода:
1) взятие материалов для исследования. В большинствеслучаев материалом является сыворотка крови. Ее получают
после образования сгустка крови, кровь следует забирать в
строго асептических условиях по стандартной методике,
2) выбор серологической реакции для данного случая зависит
от цели исследования, предполагаемого заболевания, фазы
болезни, материала для исследования, чувствительности
реакции, возможностей конкретной лаборатории. Для
выявления Ат, а также Аг используют реакции агглютинации
(РА), пассивной гемагглютинации (РПГА)),
иммунофлюоресценции (РИФ), торможения гемагглютинации
(РТГА), преципитации, флоккуляции, реакцию связывания
комплемента (РСК) и др.
3) постановка серологической реакции,
4) регистрация серологической реакции с целью определения
присутствия серологических маркеров инфекции.
73. Разнообразным серологическим реакциям свойственно несколько общих характеристик:
Разнообразным серологическим реакциямсвойственно несколько общих
характеристик:
1) так как любые серологические реакции являются
реакциями взаимодействия Ат и Аг, то во всех случаях
для установления присутствия Ат в исследуемом
субстрате необходим набор известных стандартных
корпускулярных или растворимых Аг,
называемых диагностикумами. В свою очередь, для
установления присутствия Аг нужен набор иммунных
диагностических сывороток;
2) взаимодействие Аг и Ат осуществляется только в
присутствии электролита, в качестве которого обычно
используют изотонический раствор хлорида натрия или
буферные смеси, рН системы должен быть около 7;
74. Разнообразным серологическим реакциям свойственно несколько общих характеристик:
Разнообразным серологическимреакциям свойственно
несколько общих характеристик:
3) для образования комплекса Аг-Ат требуется период
инкубации при особых температурных условиях (от +4 °С
до 37 °С). Образование специфического иммунного
комплекса происходит быстро; видимого простым
глазом феномена (агглютинации, лизиса и др.) медленно, через несколько часов или даже суток;
4) оба компонента серологической реакции (антиген и
антитела) должны присутствовать в эквивалентном
соотношении. Избыток какого-либо из компонентов
блокирует образование комплекса Аг-Ат и способствует
ложно отрицательным результатам.
75.
Учет серологических реакций осуществляют визуально, иногда спомощью лупы. Суть учета серологической реакции сводится к
определению феномена связывания Аг и Ат по образованию комплекса
Аг-Ат. Визуально образование комплекса Аг-Ат сопровождается двумя
основным феноменами - агглютинацией и преципитацией. Различия
между ними определяются особенностями антигенов и антител,
специфичных к ним. В то же время, среди микробных антигенов
присутствуют и такие, которые индуцируют синтез непреципитирующих,
образование комплекса Аг-Ат в данном случае не сопровождается ни
феноменом агглютинации, ни феноменом преципитации, а выявление
факта образования комплекса Аг-Ат требует маркирования
диагностического компонента реакции специальными метками, либо
перевода диагностического антигена в другое агрегатное состояние.
При оценке реакции применяют 3 главных критерия:
1) наличие и интенсивность реакции (в плюсах и др.);
2) диагностический титр,
3) нарастание титра Ат в течение болезни в 4 раза и более.
Наличие реакции устанавливают по визуальным феноменам или по
связыванию иммунохимического маркера. Для оценки интенсивности
серологической реакции используют принцип 4 "+" (табл.7).
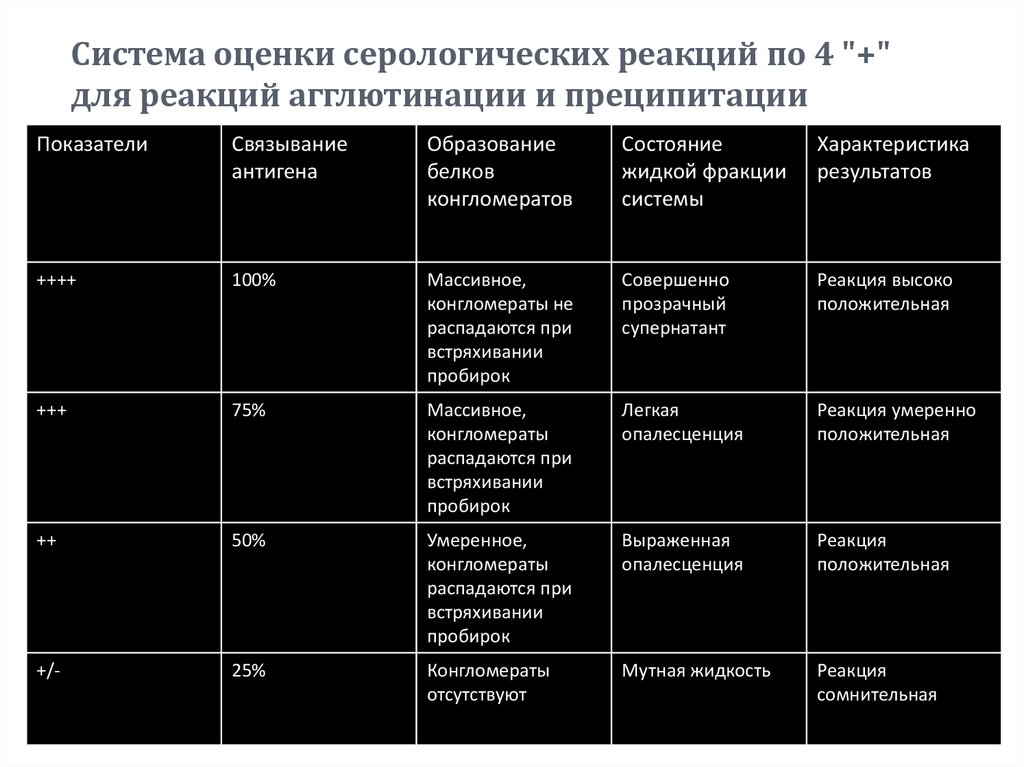
76. Система оценки серологических реакций по 4 "+" для реакций агглютинации и преципитации
Система оценки серологических реакций по 4 "+"для реакций агглютинации и преципитации
Показатели
Связывание
антигена
Образование
белков
конгломератов
Состояние
жидкой фракции
системы
Характеристика
результатов
++++
100%
Массивное,
конгломераты не
распадаются при
встряхивании
пробирок
Совершенно
прозрачный
супернатант
Реакция высоко
положительная
+++
75%
Массивное,
конгломераты
распадаются при
встряхивании
пробирок
Легкая
опалесценция
Реакция умеренно
положительная
++
50%
Умеренное,
конгломераты
распадаются при
встряхивании
пробирок
Выраженная
опалесценция
Реакция
положительная
+/-
25%
Конгломераты
отсутствуют
Мутная жидкость
Реакция
сомнительная
77. Реакция агглютинации (РА)
Представляет собой один из способов выявленияантигена/антител по принципу нахождения известного
по неизвестному. В случае нерастворимости антигена
(его корпускулярности) при добавлении к нему
специфичных антител происходит формирование
комплекса "антиген-антитело" в виде белкового
агломерата. Этот феномен получил название
агглютинации. Основное преимущество реакции
агглютинации - возможность визуального учета и
простота постановки. С другой стороны в сравнении с
более современными способами выявления
антиген/антитела чувствительность реакции
агглютинации невысока.
78. Компоненты РА:
1) диагностический компонент - антиген в виде суспензии вслучае поиска антител, т.е. диагностикум, или раствор антител
при необходимости идентификации антигена,
т.е. диагностическая сыворотка.В случае РА чаще диагностикум
называют агглютиногеном, а диагностическую сыворотку агглютинином;
2) исследуемый материал - микробная культура в виде суспензии
или выросшей на скошенном агаре, клетки крови (эритроциты
при определении антигенов по системе А,В,0), сыворотка крови
пациента при диагностике инфекционного заболевания или
сыворотка крови лабораторного животного при постановке
биологического/иммунологического эксперимента;
3) раствор электролита в качестве среды для
разведения ингредиентов реакции и в качестве среды для
постановки реакции. Обычно используют 0,15 М (0,85%) раствор
хлорида натрия, реже - другие прописи.
79.
Лабораторная посуда и необходимое оборудование. Как правило дляпостановки РА необходим ограниченный перечень оборудования:
1)пробирки или предметные стекла для самой реакции (иногда
нужны особые блюдца или другие предметы, например, для
определения группы крови),
2) пипетки стеклянные или автоматические дозаторы с
наконечниками,
3) термостат или холодильник, т.к. разные варианты РА проводятся
при разных температурных режимах,
4) источник света и черная поверхность для лучшей визуализации
результата РА.
Схема постановки РА:
1)приготовление разведений исследуемого образца,
2) внесение разведений в пробирки или нанесение их на стекло,
3) добавление диагностического компонента,
4) инкубация при необходимых температурных условиях,
5) регистрация результатов.
Регистрация результатов РА проводится по системе 4+ в процессе
визуального осмотра
80. Реакция пассивной (непрямой) гемагглютинации (РПГА).
Название реакции означает, что феномен агглютинацииформируется при участии вспомогательных частиц, т.е.
пассивно или непрямым способом. Реакция пассивной
(непрямой) агглютинации проводится для регистрации
взаимодействия антиген-антитело в том случае, когда антиген
водорастворим и при его связывании со специфическими
антителами не происходит образования крупных видимых
глазом агломератов. Но если такой водорастворимый антиген
неспецифически сорбировать на каких-либо частицах, то
проводимая реакция приобретает все характерные для
реакции агглютинации черты. Чаще всего для постановки РПА
(РНА) применяют эритроциты барана или частицы латекса
диаметром 3-5 мкм. При использовании эритроцитов барана в
качестве носителя диагностического компонента реакцию
называют реакцией пассивной гемааглютинации или
реакцией непрямой гемагглютинации - РПГА или,
соответственно, РНГА. При использовании частиц латекса
реакцию пассивной агглютинации называют реакцией латекс
агглютинации - РЛА
81.
Основные области применения РПА : определение эффективностипоствакцинального иммунитета (определение уровня специфических антител
после вакцинации), диагностика инфекционных болезней (определение титра
антител или присутствия в биологических средах пациента антигенов
микроорганизма, являющегося причиной заболевания), диагностика
аутоиммунных заболеваний (например, определение ревматоидного фактора).
Компоненты РПА:
1) диагностический компонент. Диагностикум, представляющий собой антиген,
сорбированный на эритроцитах барана, в этом случае называется эритроцитарным
диагностикумом. А если для сорбции антигена используют частицы латекса, то
диагностикум называют латексным. В случае определения антигена по известным
антителам на частицах (эритроцитах или латексе) необходимо сорбировать
диагностические антитела, тогда диагностическая сыворотка называется
эритроцитарным (латексным) антительным диагностикумом;
2) исследуемый материал - сыворотка крови пациента при диагностике
инфекционных или аутоиммунных заболеваний или сыворотка крови
лабораторного животного при постановке биологического/иммунологического
эксперимента;
3) раствор электролита в качестве среды для разведения ингредиентов реакции и в
качестве среды для постановки реакции. Обычно используют 0,15 М (0,85%)
раствор хлорида натрия, реже - другие прописи.
Лабораторная посуда и необходимое оборудование. Как правило для постановки
РПА необходимы то же оборудование, что и для постановки РА.
Схема постановки и учета РПА аналогичны РА.
82. Колорометрия
Колорометрия83.
Колориме́трия (от лат. color — «цвет» и греч. μετρώ —«измеряю») — физический метод химического
анализа, основанный на
определении концентрации вещества по
интенсивности окраски растворов (более точно —
по поглощению света растворами).
84. Основные сведения
Это физико-химический метод исследования состава биосред поинтенсивности цвета. Он был разработан, чтобы определить
концентрацию того или иного вещества в крови. Колориметрию можно
использовать как для исследования уже тонированных растворов, так
и для тех, которые окрашиваются путем химических реакций.
Как известно, подобные методы дают возможность определить
концентрацию веществ до 10-8 моль/л. Если быть точнее, то это
исследование выполняется путем визуального сравнения или
сопоставления с использованием специальных приборов. Следует
отметить, что наблюдение может осуществляться несколькими
способами:
Прямым, которым исследуется степень окрашиваемости при
определенной температуре. Зачастую все процедуры выполняются
при помощи таких устройств, как фотоколориметр и спектрофотометр.
Компенсационным. Заключается в том, что необходимо в процессе
исследования довести окрас образца до эталонного. Для этого
добавляется прозрачный растворитель, а также высота слоя жидкости
повышается в несколько раз.
85.
В целом колориметрия – это очень важный иполезный метод, который в медицине позволяет
определить количество желчных пигментов в крови,
гемоглобина, глюкозы в моче и крови, а также
используется для подтверждения наличия фосфора,
кальция и других микроэлементов в жидкости.
Использование фотоэлементов ограничено красной
границей. Здесь важно соблюдать все правила и
нюансы, чтобы результаты исследований были
корректными. Для этого в первую очередь
необходимо иметь надежное оборудование.
Например, спектрометр В-1200.
86. Преимущества колориметрии
Что касается достоинств данного метода, можновыделить 4 главных преимущества:
простота в применении;
отсутствие необходимости закупки дорогого
оборудование для опытов;
оперативность получения результатов;
данный метод позволяет определить даже очень
маленькую концентрацию веществ.
Надо отметить, что колориметрия – это весьма
обширный метод, так как он находит применение в
разных областях, будь то медицина, аналитическая
химия или пищевая промышленность.
87. Колориметр
оптический прибор для определения концентрациивещества в растворах путем сравнения интенсивности
их окраски с эталонными растворами; различные
колориметры применяются при диагностических,
гигиенических и экспериментальных исследованиях.
Колориметр-нефелометр
прибор для определения концентрации вещества в
растворах путем сравнения интенсивности окраски
или светорассеяния исследуемого и эталонного
растворов; применяется, например, в биохимических
исследованиях.
88. Визуальные методы
К визуальным методам относятся:- метод стандартных серий;
- метод колориметрического титрования, или дублирования;
- метод уравнивания.
Метод стандартных серий.
При выполнении анализа методом стандартных серий интенсивность окраски
анализируемого окрашенного раствора сравнивают с окрасками серии
специально приготовленных стандартных растворов (при одинаковой толщине
слоя).
Метод колориметрического титрования (дублирования)
основан на сравнении окраски анализируемого раствора с окраской другого
раствора - контрольного. Контрольный раствор содержит все компоненты
исследуемого раствора, за исключением определяемого вещества, и все
использовавшиеся при подготовке пробы реактивы. К нему добавляют из
бюретки стандартный раствор определяемого вещества. Когда этого раствора
будет добавлено столько, что интенсивности окраски контрольного и
анализируемого растворов уравняются, считают, что в анализируемом
растворе содержится столько же определяемого вещества, сколько его было
введено в контрольный раствор.
89.
Метод уравниванияотличается от описанных выше визуальных
колориметрических методов, в которых подобие
окрасок стандартного и испытуемого растворов
достигается изменением их концентрации. В методе
уравнивания подобие окрасок достигается
изменением толщины слоев окрашенных растворов.
Для этой цели при определении концентрации
веществ используют колориметры сливания и
погружения.
90. Достоинства визуальных методов колориметрического анализа:
- техника определения проста, нет необходимости всложном дорогостоящем оборудовании;
- глаз наблюдателя может оценивать не только
интенсивность, но и оттенки окраски растворов.
91. Недостатки:
- необходимо готовить стандартный раствор илисерии стандартных растворов;
- невозможно сравнивать интенсивность окраски
раствора в присутствии других окрашенных веществ;
- при длительном сравнивании интенсивности окраски
глаз человека утомляется, и ошибка определения
увеличивается;
- глаз человека не столь чувствителен к небольшим
изменениям оптической плотности, как
фотоэлектрические устройства, вследствие этого
невозможно обнаружить разницу в концентрации
примерно до пяти относительных процентов.
92.
Разработаны количественные методы, основанные набиуретовой реакции, при которой состав белка, очевидно
не должен сказываться на результатах определения, т.к.
эта реакция на пептидные связи, а не на боковые группы в
белке. Метод Горнелла и соавторов, основанный на
измерении полосы поглощения в области 550-650 нм,
используется для определения значительных количеств (110 мг) белка в пробе. Предлагаются биуретовые
микрометоды, основанные на поглощении
ультрафиолетовых лучей медно-белковыми комплексами:
они позволяют определять 0.1 - 2.0 мг белка в пробе.
Число небелковых веществ, которые могут влиять на
определения с помощью биуретовой реакции, невелико,
но следует вносить поправки на те вещества, которые
присутствуют в высоким концентрациях (соли аммония,
сахароза)
93.
Наиболее ценными являются те фотометрическиеметоды, которые позволяют следить во времени за
ходом ферментативной реакции без ее прекращения
по изменению окраски хромогенного субстрата или
добавленного индикатора. Метод Фолина и
Чиокальто, предложенный для определения
количества белка, основан на хромогенной природе
некоторых боковых групп аминокислот, а также на
присутствии в белках пептидных связей. Этот метод
обладает высокой чувствительностью (на пробу
достаточно 0.01 - 0.1 мг белка), но многие небелковые
вещества мешают определению.
94.
В настоящее время для определения количества белка широкопользуются измерениями интенсивности поглощения света при
280 нм, которое обусловлено присутствием в белке
ароматических аминокислот. Количество этих аминокислот в
разных белках различно и ,следовательно, интенсивность
неодинакова. В кювете толщиной 1 см у раствора, содержащего
1 мг “усредненного” белка в 1 мл, оптическая плотность равна 1
при длине волны 280 нм. Нуклеиновые кислоты поглощают при
280 нм, но можно сделать поправку на их присутствие, проводя
измерения и при 260 нм и при 280 нм. Очень важна быстрота
измерения активности ферментов. То же относится и к
измерению количества сухого остатка или количества белка. Тем
самым предпочитают быстрый метод определения белка путем
измерения величины поглощения при 280 нм. Выигранное
время важнее, за счет того, что удельное поглощение
выделяемого белка иногда значительно отличается от средней
величины поглощения смеси белков, присутствовавших в
исходном материале.
95. Концентрационная колориметрия
Метод концентрационной колориметрии широкоприменяется в медицине. Фотоэлектроколориметр
используется в клинико-биохимических
исследованиях. Колориметр позволяет производить
измерения коэффициентов пропускания
рассеивающих взвесей, эмульсий и коллоидных
растворов в проходящем свете. В зависимости от
реактива, применяемого для исследования,
определяют количество гемоглобина в крови,
количество белка и желчных пигментов, мочевины в
сыворотке, определение креатина в сыворотке и
моче, мочевой кислоты в сыворотке крови, глюкозы в
крови и моче, железа, кальция, фосфора и др.

















































































 Биология
Биология