Похожие презентации:
Биогенные элементы. Строение комплексных (координационных) соединений
1. Биогенные элементы. Строение комплексных (координационных) соединений.
12.
Биогенные элементы –это элементы необходимые для построения и
жизнедеятельности клеток органов и организма в целом.
Заболевания могут быть связаны с
недостатком или избытком накопления
элементов в организме, например
недостаток
F(фтор)- кариес
зубов
избыток
F- эмаль зубов
становится хрупкой
2
3.
По массовой доле различаютультрамакро
микромикро-эл
элементы
элементы
1. Na,K,Mg,Ca
1. Mn, Co, Cu, Zn
2. органогены
входят в состав
H,C,N,O,P, S 97,4% ферментов, гормонов,
3. Fe, Cl
витаминов.
участвуют в
2. Участвуют в
построении тканей
обмене веществ,
и в поддержке
кроветворении,
гомеостаза
тканевом дыхании…
Мо
3
4.
По своему значению в организмеразличают
незаменимые элементы примесные элементы
1. 6 органогенов:
H, C, N, O, P, S
2.10 металлов жизни:
Na, K, Ca, Mg,
Mn, Fe, Co, Cu, Zn, Mo
3. Cl, I
постоянно
присутствующие в
организме, но их роль
не изучена или
незначительна
Li, Ba, Al
4
5.
d-элементы - это 32 элемента Периодическойсистемы Менделеева, у которых валентные ē
находятся как на S подуровне внешнего
уровня, так и на d-подуровне предпоследнего
уровня.
5
6.
n-1d1ˉ10предпоследний
уровень
ns1-2
внешний уровень
Все они металлы а значит в реакциях
отдают электроны.
Имеют переменную валентность и
различные степени окисления.
Из 10 металлов жизни- 6 это d-элементы.
6
7.
Fe+2,+3
макро-
Co
Mn
Cu
+2,+3
+2,+3,+4,+6,+7 +1,+2
+2
м и к р о э л е м е н т ы
Zn
Mo
+2,+3,+4,+6
ультрамикроэлемент
7
8.
Так как многие d-элементы имеют много степенейокисления, то их соединения могут проявлять различные
свойства, в том числе О-В и К-О. Например:
MnО
Mn2O3
основные
оксид
Mn(OH)2
Mn(OH
MnO2
MnO3,
Mn2O7
амфотерный
кислотные оксиды
Mn(OH)4
H2MnO4
HMnO4
H4MnO4
Увеличение степени окисления
Нарастание кислотных свойств
8
9.
В организме d-элементы присутствуюткак в виде простых ионов ( Fe2+, Fe3+) так и в
виде сложных, так называемых комплексных
ионов. Простые ионы либо гидратированы
(окружены молекулами H2O), либо
гидролизованы, то есть свободных
d-элементов в организме нет.
9
10.
Помимо главных валентностей у атомов(особенно d-элементов) существуют побочные
валентности, которые проявляют себя в
некоторых реакциях. Насыщение главных
валентностей лежит в основе образования
соединений 1-го порядка:
HCl
H2O
NH3,
CuSO4
H- Cl
H-O
H-N-H
׀
׀
Н
Н
О
Си
О
S
О
О
10
11.
Насыщение побочных валентностейлежит в основе образования соединений
высшего порядка являющихся продуктами
сочетания соединений 1-го порядка.
Например:
HCl + NH3 → NH4CI
H2O + NH3 → NH4OH
или более сложные взаимодействия:
11
12.
а) CuSO4 + 4H2O → [Cu (H2O)4]SO4бледно-голубые
яркий синий
кристаллы
раствор
здесь CuSO4 и H2O с уже
реализованными валентностями вступают
во взаимодействие с образованием более
сложных , так называемых комплексных
соединений.
12
13.
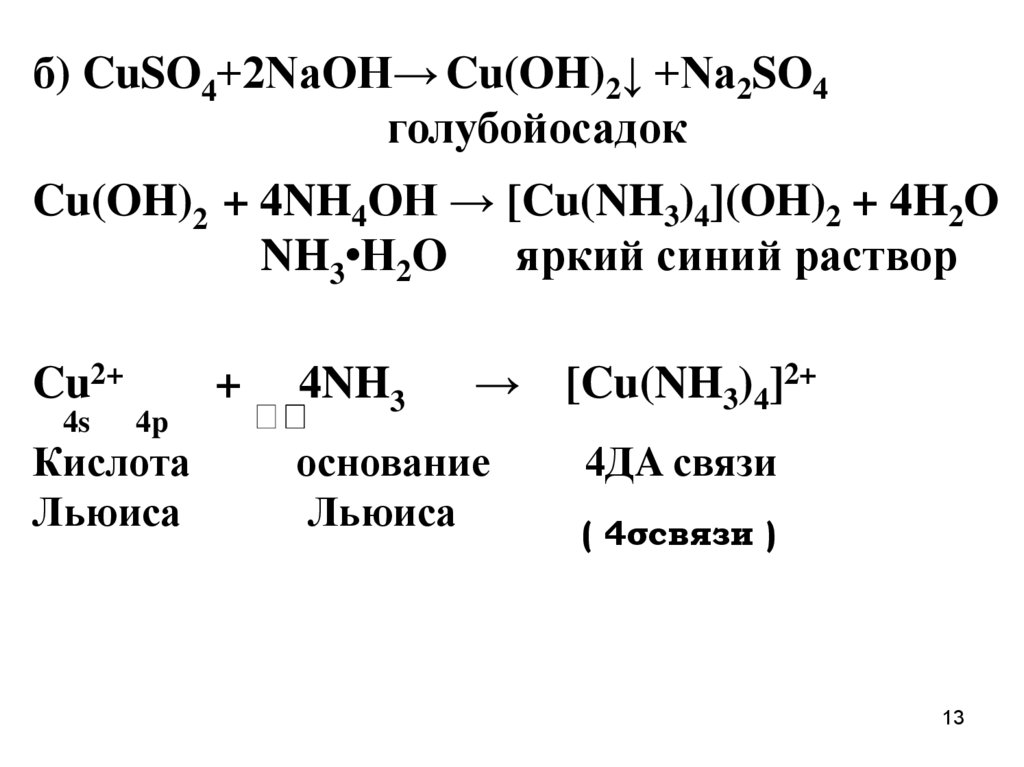
б) CuSO4+2NaOH→ Cu(OH)2↓ +Na2SO4голубойосадок
Cu(OH)2 + 4NH4ОН → [Cu(NH3)4](OH)2 + 4H2O
NH3•H2O яркий синий раствор
Cu2+
4s
+
4p
Кислота
Льюиса
4NH3
→ [Cu(NH3)4]2+
основание
Льюиса
4ДA связи
( 4σсвязи )
13
14.
Связываясь друг с другом атомы элементовобразуют различные вещества:
вещества 2-го порядка
вещества 1-го
молекулы которых не
порядка
подчиняются КТВ
молекулы которых
1. [Cu(NH3)4]SO4 или
построены в соответствии
CuSO4 •4NH3
с классической теорией
валентности (КТВ)
2.[Ag (NH )2]Cl илиAgCl
3
CuSO4, NH3, H2O,
AgCl, NH3
14
15.
Координационную теорию строениякомплексных соединений создал Вернер.
в
Комплексные соединения (КС)
- устойчивые химические
соединения сложного состава,
в которых имеется хотя бы
одна связь, образованная
по ДА механизму.
Альфред Вернер
(12.12.1866-15.11.1919)
15
16.
Теория строение комплексных соединений Вернера:1) Комплексное соединение состоит из центрального
атома или иона-комплексообразователя. Это могут
быть катионы Ме
S-элементов
nS1 или nS2
Na+ Mg2+
K+ Ca2+
жесткие (слабые)
кислоты Льюиса
p- элементов
nS2nР1-6
Al3+
d-элементов
n-1d1-10 nS1-2
Mn2+ Fe2+ Fe3+
Co2+ Co3+ Cu2+
Zn2+ Mo4+
мягкие (сильные)
кислоты Льюиса
комплексообразующая способность растет
16
17.
Кислота Льюиса- акцептор электронов(комплексообразователь)
17
18.
2) вокруг комплексообразователя (КО) координируютсялиганды- основания Льюисадоноры электронных пар.
РАЗЛИЧАЮТ:
а) нейтральные
и
отрицательные -нуклеофильные
H2O, NH3
Cl¯, F¯, CN¯
б) по числу донорных электоронных пар, дент - лиганды
могут быть: монодентатные - однозубые (H2O, NH3, CN¯)
полидентатные многозубные:
CH2
CH2,
SO42 -
NH2 NH2
этилендиамин
Это бидентатные лиганды. Они могут связывать
мягкие кислоты Льюиса, т.е слабые КО .
18
19.
3) комплексообразователь с лигандами вместе образуетвнутреннюю координационную сферу - комплексный
ион. Например:
[Co(NH3)4]
2+
,
[CoCl4]
2-
,
[Fe (CN)6]
3-
4) Все, что за квадратными скобками- это
внешняя координационная сфера.
19
20.
Разобрать комплексное соединение по плану:K4[Fe(CN)6] - гексацианоферрат (II) калия
а) K4[Fe(CN)6]
→ 4K+ + [Fe(CN)6]4сильный
электролит
б) [Fe(CN)6]4компл.ион
слабый эл-т
внешняя и внутренняя
координационные сферы
Fe2+
к-обртель n = 6
+
6CN¯
лиганды
в) данный К-образователь имеет гексагональную
октаэдрическую конфигурацию обусловленную d2sp3
гибридизацией атомных орбиталей
г) тип связи между комплексообразователем и
лигандами ковалентный, характер ДА
20
21.
д) процесс диссоциации комплексного ионаобратимый, его описывает константа равновесия,
называемая константой нестойкости:
[Fe2+] [CN¯]6
Кн =
[ [ Fe(CN)6]4-]]
ж) качественная р-ция на катион Fe2+
3FeSO4+ 2K3[Fe3(CN)6] = Fe3[Fe3(CN)6]2↓+ 3K2SO4
синий осадок
турнбуленовой сини
21
22.
Разобрать КС по плану:[Cu(NH3)4]SO4 тетраамино меди (II) сульфат
[Cu(NH3)4]SO4 → [Cu(NH3)4]2+ + SO42сильный эл-т
внутр.
и
внешняя
координационные сферы
[Cu(NH3)4]2+↔ Cu2+ + 4NH3 ̊
компл.ион к.обр-ль лиганды
слаб эл-т
n =4
монодентатные нейтральные
в) Cu2+ имеет тетрагональную конфигурацию - плоский
квадрат, обусловл. sp3 гибридизацией атомных орбиталей
г)тип связи между к.обр-лем и лигандами ковалентный,
характер ДА
[Cu2+][ NH3]4
д)
Кн =
[[Cu(NH3)4] 2+]
ж) кач. реакция на катион Cu2+ -см.методичку
22
23.
Разобрать КС по составу: тетрацианокобальтат (II) калияа) K2[Co(CN)4] → 2K+ + [Co(CN)4]2сильн. эл-т
внеш и
внутр
коорд-е сферы
б) [Co(CN)4] 2- ↔ Co2+ +
4CN¯
компл.ион
к.обр-ль и лиганды
слаб эл-т
n=4
монодентатные нейтр-е
в) Co2+ имеет тетрагональную, тетраэдрическую конфигурацию
обусловленную sp3 гибридизацией атомных орбиталей
г) тип связи между к.обр-телем и лигандами ковалентный,
характер ДА
2+
¯ 4
д) Кн = [Co ][ CN ]
[[Co2+ (CN)4] 2-]
ж) качественная реакция на катион Co2+ – смотри методичку
23
24.
Внутрикомплексные соединения.Это большая группа органических соединений , в
которых лиганды полидентатны, например гемоглобин,
2+
в котором Fe
связан двумя ионными и четырьмя
ковалентными ДA связями с белковой частью.
При отравлении применяют лекарственные препараты
2+
2+
называемые антидотами. Так при отравлении Zn , Cd ,
2+
Hg
в качестве антидота применяют
этилендиаминтетрауксусную кислоту (ЭДТА)
24
25.
Образующиеся при этом комплексные соединенияназываются хелатными. Хелатирующий эффект увеличивает
прочность комплексного соединения.
Белки, нуклеиновые кислоты это тетрадентатные лиганды
прочно связывающие даже жесткие кислоты Льюиса – слабые КО.
В живых системах широко распространены порфирины - очень
сложные соединения. Если в центре находится катион
2+
Fe
связанный с порфином - это гемоглобин
2+
Mg
- порфин - хлорофил
2+
Cu
- порфин - гемоцианин
2+
Co
- порфин - витамин В-12
25
26.
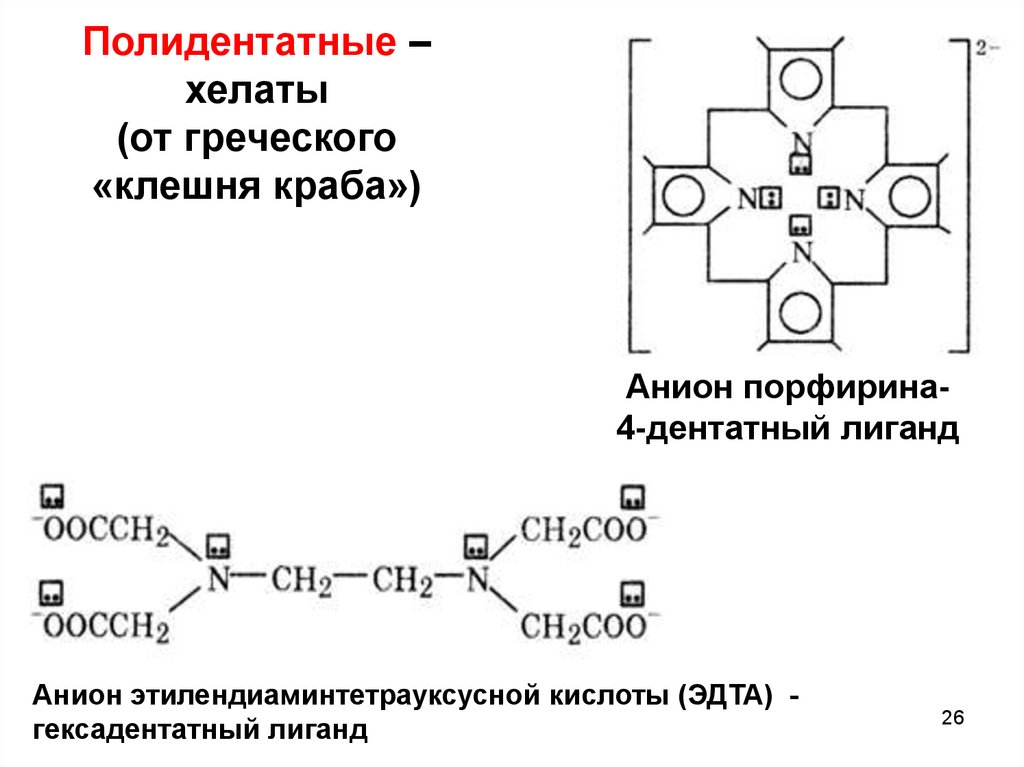
Полидентатные –хелаты
(от греческого
«клешня краба»)
Анион порфирина4-дентатный лиганд
Анион этилендиаминтетрауксусной кислоты (ЭДTA) гексадентатный лиганд
26
27.
Большинство комплексных соединений,как и сами ионы металлов, имеют окраску
27
28.
КЛАССИФИКАЦИЯ1. По заряду внутренней сферы:
- катионного типа:
[Cu(NH3)4]SO4
- анионного типа:
K4[Fe(CN)6],
- нейтрального типа: [Pt(NH3)2Cl2]
2. По принадлежности к определенному
классу соединений:
- комплексные кислоты:
Н2[SiF6],
- комплексные основания: [Ag(NH3)2]OH
- комплексные соли:
K3[Co(NO2)6]
28
29.
3. По природе лигандов внутреннейсферы:
-ацидокомплексы (анионы кислотных
остатков):
K3[Fe(CN)6]
-аквакомплексы: [Al(H2O)6]Cl3
-аммиакаты:
[Ag(NH3)2]OH
-гидроксокомплексы: K [Al(OH)6]
29
30.
[Ag(NH3)2]Cl(к.ч = 2)
sp–гибридизация
(прямая линия)
Ag+
4s2 4p6 4d10 5s0 5p0
[Ag(NH3)2]+
5s
5p
sp-гибридизация
30
31.
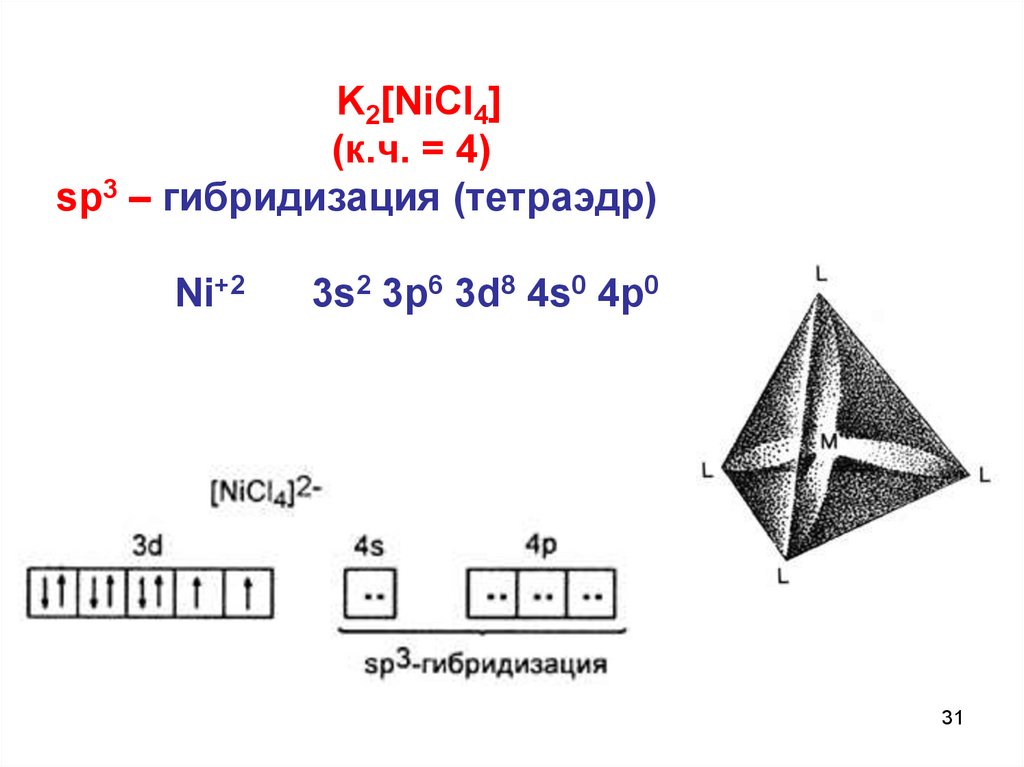
K2[NiCl4](к.ч. = 4)
sp3 – гибридизация (тетраэдр)
Ni+2
3s2 3p6 3d8 4s0 4p0
31
32.
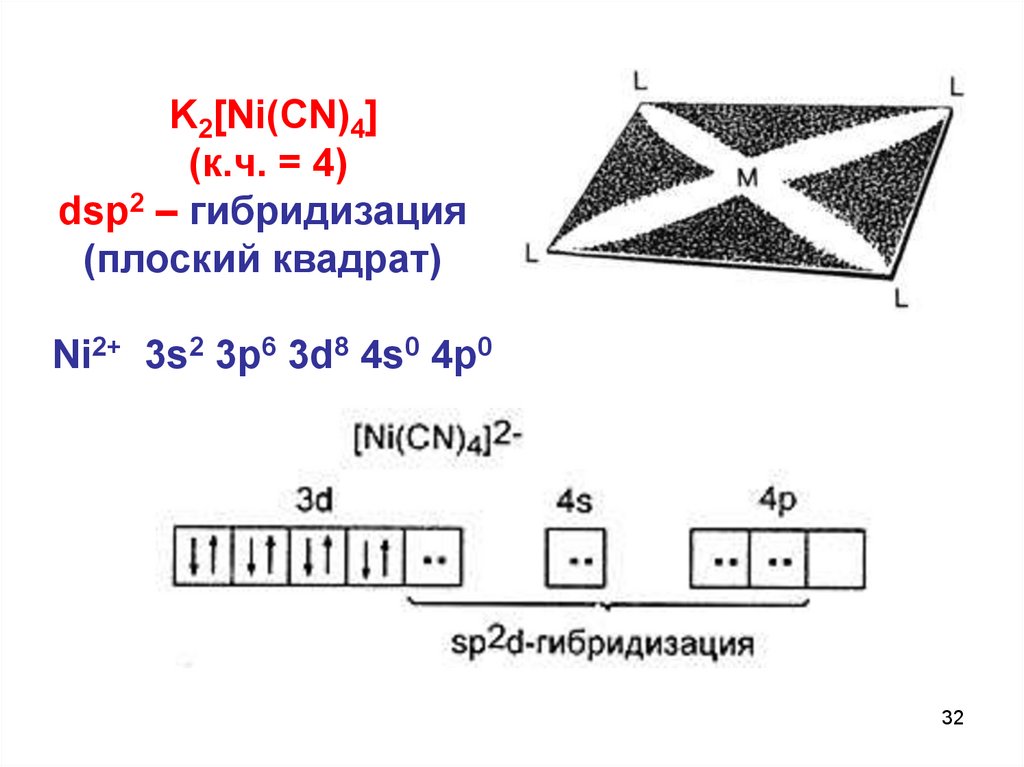
K2[Ni(CN)4](к.ч. = 4)
dsp2 – гибридизация
(плоский квадрат)
Ni2+ 3s2 3p6 3d8 4s0 4p0
32
33.
K3[Fe(CN)6](к.ч. = 6)
d2sp3 – гибридизация
(октаэдр)
Fe3+ 3s2 3p6 3d5 4s0 4p0
3d
4s
4p
↑
↓
3d
4s
4p
d2sp3-гибридизация
33
34.
Наиболее прочные КС образуютсямежду мягкими комплексообразователями
(d-элементами) и мягкими лигандами
(например —СОО־, —NH2 , —SH).
Белки содержат эти мягкие группы
и связывают металлы жизни в организме в
прочные биокомплексы.
34
35.
Катионы токсичных тяжелыхметаллов Cd²+, Pb²+, Hg²+ также
очень «мягкие» кислоты Льюиса и
поэтому активно образуют прочные
комплексы с жизненно важными
белок-содержащими субстратами,
нарушая их метаболизм.
35
36.
Склонностью к КОбразованиюобъясняется токсичность цианидов,
так как анион СN¯ ( очень мягкий
лиганд) активно взаимодействует с
катионами d-металлов в комплексах,
замещая в них биосубстраты и тем
самым инактивируя эти
биокомплексы.
36
37.
Катионы Na+ и К+вследствие своей жесткости
практически не образуют
устойчивых комплексов с
биосубстратами и в
физиологических средах
находятся, в основном, в виде
гидратированных ионов.
37
38.
Катионы Mg2+ и Ca2+ способныобразовывать устойчивые
комплексы с белками, и поэтому в
физиологических средах они
встречаются как в ионизированном,
так и в связанном состоянии:
1. в виде комплексов с белками;
2. в виде нерастворимых солей –
фосфатов, оксалатов и уратов.
38
39.
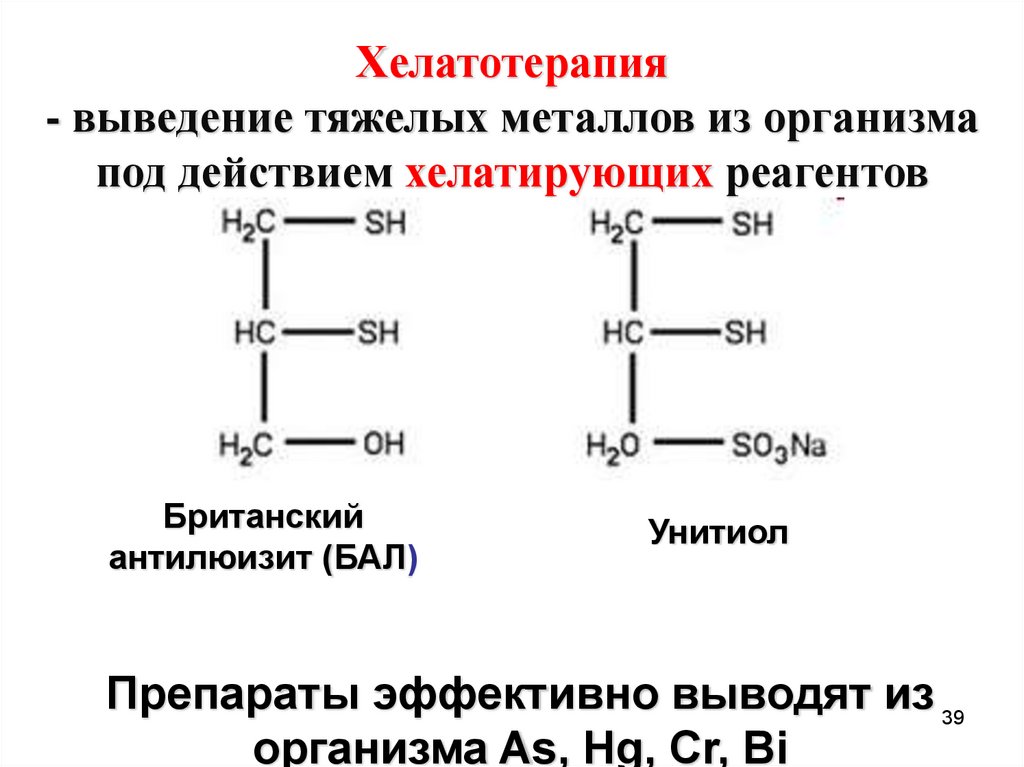
Хелатотерапия- выведение тяжелых металлов из организма
под действием хелатирующих реагентов
Британский
антилюизит (БАЛ)
Унитиол
Препараты эффективно выводят из 39
организма As, Hg, Cr, Bi
40.
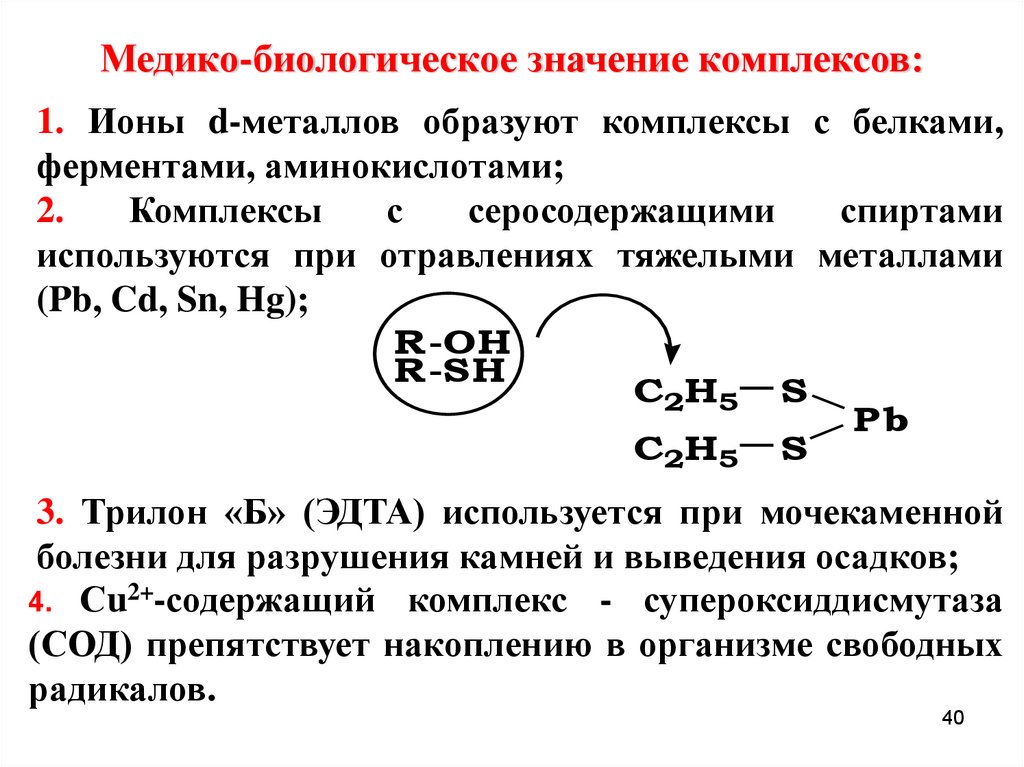
Медико-биологическое значение комплексов:1. Ионы d-металлов образуют комплексы с белками,
ферментами, аминокислотами;
2.
Комплексы
с
серосодержащими
спиртами
используются при отравлениях тяжелыми металлами
(Pb, Cd, Sn, Hg);
R-OH
R-SH
C2H5
S
C2H5
S
Pb
3. Трилон «Б» (ЭДТА) используется при мочекаменной
болезни для разрушения камней и выведения осадков;
4. Сu2+-содержащий комплекс - супероксиддисмутаза
(СОД) препятствует накоплению в организме свободных
радикалов.
40
41.
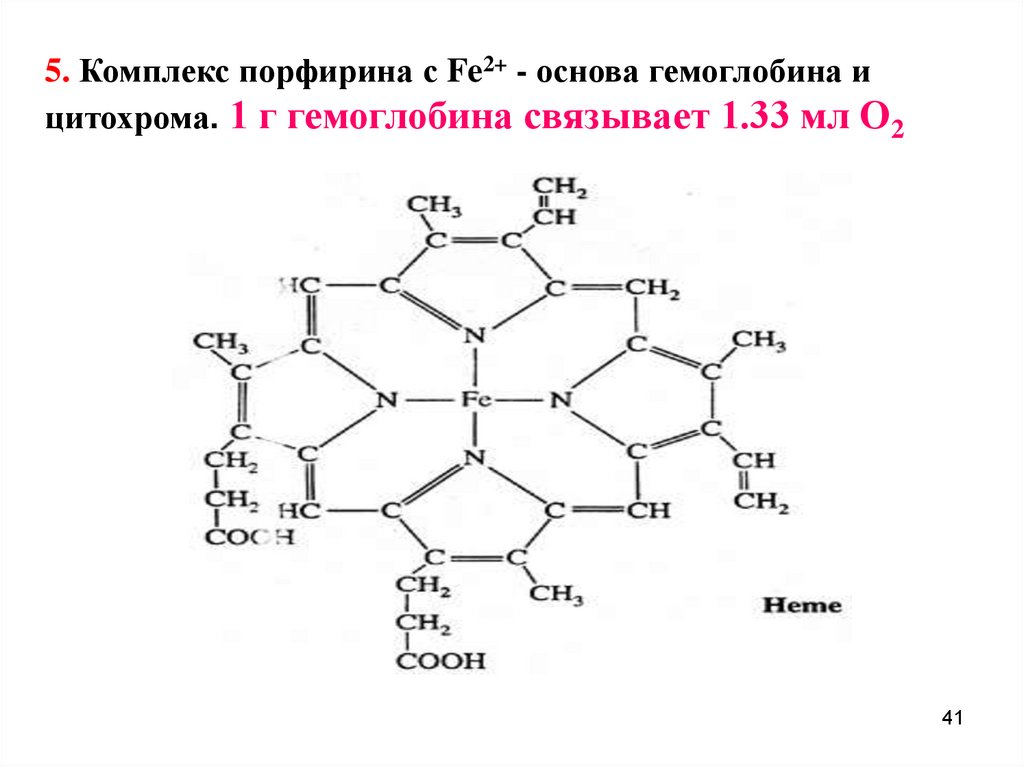
5. Комплекс порфирина с Fe2+ - основа гемоглобина ицитохрома. 1 г гемоглобина связывает 1.33 мл О2
41
42.
6. Роль NO в организме:а) Негативное влияние:
NO является лигандом, который,
подобно кислороду, образует
комплекс с гемоглобином,
устойчивость которого в 60 раз
больше, чем оксигемоглобина.
Возникает острое кислородное
голодание тканей из-за перехода
гемоглобина в нитрозогемоглобин
42
43.
HHb O 2 HHbO 2HHb NO HHbNO
Диагностический признак
токсического действия нитратнитритов – изменение уровня
метгемоглобина в крови, норма
которого определена для человека
на уровне до 2 %.
43
44.
б) Физиологическое значение:Вместе с тем, NO обязательно синтезируется в организме человека из аргинина.
Время жизни NO в клетках организма
составляет порядка 1 секунды, но,
благодаря высокой химической
активности, это соединение обеспечивает
расслабление гладких мышц сосудов,
регуляцию работы сердца, эффективную
работу иммунной системы, передачу
нервных импульсов и играет важную
роль в обучении и запоминании.
44
45.
Механизм отравления угарным газом СОДлина связи (Å)
1 Å=10-8см=10-10 м
CO NO O 2
1.13
1.15
1.21
Равновесие смещено в сторону образования карбоксигемоглобина, устойчивость которого в 210 раз больше, чем оксигемоглобина, что приводит к накоплению карбоксигемоглобина
45
в крови..
46.
Причины отравления1. Курение
2. Вдыхание выхлопных газов
автомобиля.
3. Преждевременное закрытие
вытяжной заслонки протопленной
печи.
46
47.
Помощь при отравлениях:Пострадавшим необходимо тепло,
сердечные средства и вдыхание
чистого кислорода, так как
содержание кислорода в воздухе
недостаточно для быстрого
вытеснения СО из
карбоксигемоглобина.
47








































 Химия
Химия








